Аляев Ю.Г., Сорокин Н.И., Кондрашин С.А., Шпоть Е.В., Сирота Е.С.
НИИ уронефрологии и репродуктивного здоровья человека Первого Московского государственного медицинского университета им. И.М. Сеченова, г. Москва
Введение. Заболеваемость раком почки в последние годы устойчиво воз- растает. Наиболее быстро она увеличивается за счет локализованных опухолей, которые в настоящее время встречаются у 60-70% пациентов с первично диаг- ностированным раком почки [1-5, 11]. В свою очередь более частое выявление локализованных образований небольших размеров в стадии Т1 и Т2 привело к тому, что в настоящее время резекция почки, а не нефрэктомия стала более распространенным и даже рекомендуемым методом лечения новообразований почки [6-11].
Данное обстоятельство, по мнению многих авторов, обусловлено совершен- ствованием современных методов лучевой диагностики: ультразвукового ис- следования (УЗИ), магнитно-резонансной томографии (МРТ) и мультиспираль- ной компьютерной томографии (МСКТ) с возможностью трехмерного модели- рования патологического процесса [12-15].
Согласно приведенным выше данным открытая резекция почки на сего- дняшний день является стандартом органосохраняющего лечения при опухолях почки размером менее 4 см. Тем не менее, лапароскопическая резекция все ча- ще рассматривается как потенциальная альтернатива [11]. Так, после работ McDougall et al. и Winfield et al. в 1993г.лапароскопическая резекция оказалась правомерным вмешательством при хирургическом лечении маленьких образо- ваний почки [16, 17].
Многоцентровое исследование среднего уровня кровопотери при открытой (ОР) и лапароскопической резекции (ЛПР) почки проведенное Kavoussi L.R. et. al. [18], 2007 (N=1799) показало сопоставимые результаты (средняя кровопоте- ря при ОР составила 376 (10-3300) мл, а при ЛПР 300 (25-6000) мл). Несмотря на это, как при открытой, так и при лапароскопической резекции почки главной проблемой остается достижение адекватного гемостаза. Так, например, при ла- пароскопии кровотечение не может быть остановлено прямой компрессией па- ренхимы, что препятствует достижению гемостаза в зоне резекции. В связи с этим поиск наиболее эффективного и безопасного способа интраоперационного (временного или окончательного) гемостаза в ходе резекции почки остается в настоящее время актуальным [19-21].
Материалы и методы. В клинике урологии Первого МГМУ им. И.М. Се- ченова при резекции почки (как открытой, так и лапароскопической) времен- ный интраоперационный гемостаз осуществляется: одновременным пережати- ем артерии и вены (так называемое «en bloc» пережатие), наложением зажима только на артерию («селективное slective» пережатие сегментарного сосуда, питающего опухоль или сегмент почки с опухолью), наложением сосудистого зажима «по мере необходимости» (on demand), а также без пережатия кровото- ка («без зажима» (no-clamping)). Окончательный интраоперационный гемостаз осуществляется: клипированием или лигированием сегментарной почечной ар- терии, суперселективной эмболизацией сегментарного сосуда, питающего опу- холь. Помимо механических способов предупреждения и остановки кровотече- ния при лапароскопической и открытой резекции почки применяется ряд физи- ческих методов в комбинации с герметизирующими системами на основе фиб- риногена, тромбина и др., наложение швов на рану, применение гемостатиче- ских материалов. Выбор метода гемостаза зависит от характера кровоснабже- ния опухоли (особенностей ангиоархитектоники почки), ее локализации и опыта хирурга.
Важную информацию в выборе способа временного гемостаза при резекции почки мы получаем в ходе анализа дооперационного трехмерного моделирова- ния патологического процесса, выполненного на основании данных мультиспи- ральной компьютерной томографии [13, 14, 22].
По нашему мнению одним из альтернативных способов окончательного ге- мостаза при выполнении резекции почки (в особенности лапароскопической) является предварительная суперселективная эмболизация сосудов, питающих опухоль, способствующая уменьшению интраоперационной кровопотери и со- кращению времени выполнения операции.
В зависимости от объема редуцируемого кровотока и диаметра питающей опухоль артерии применялись полимеризующиеся и склерозирующие раство- ры, спирали и синтетические вещества (рис.1).
Рис. 1. Материалы, используемые для суперселективной эмболизации
Результаты. В клинике урологии Первого МГМУ им. И.М. Сеченова за пе- риод с 2011 по 2013гг.резекция почки по поводу опухоли выполнена 214 паци- ентам. Из них в 56,5% наблюдений осуществлена открытая и в 43,5% наблюде- ний лапароскопическая резекция. Интраоперационный гемостаз осуществлялся: путем пережатия основного ствола почечной артерии в 67,2% наблюдений, пу- тем селективного пережатия сегментарной артерии, питающей опухоль в 10,7% наблюдений, путем клипирования или лигирования сегментарной артерии, пи- тающей опухоль в 2,3% наблюдений, без пережатия кровотока (zero ischemia) в 3,7% наблюдений и в 4 (1,8%) наблюдениях осуществлена резекция почки с предварительной суперселективной эмболизацией. Из них в 3 наблюдениях пе- ред открытой резекцией почки и в 1 перед лапароскопической. Все пособия вы- полнены по поводу опухолей почки клинической стадии T1.
Основным показанием к суперселективной эмболизации перед резекцией почки было наличие полюсных образований и сосуда, отдельно питающего опухоль.
Средний возраст больных составил 51 год (диапазон 30-61), средний размер опухоли 3,4 см (диапазон 3,0-5,5 см). Время ишемии (мин) при ОР составило 20,1 (4,0-52), средний уровень кровопотери (мл) 348 (260-2100); время ише- мии (мин) при ЛПР составило 15,7 (4,0-34,0), средний уровень кровопотери (мл) 260 (50 1000).
С целью объективизации показаний к резекции почки у всех пациентов на- ми проводилось определение нефрометрии по общепринятой методике R.E.N.A.L. score. Показатель по нефрометрической шкале R.E.N.A.L. оказался в диапазоне от 6 до 8 баллов, что соответствует среднему уровню сложности предстоящей резекции почки. Также перед операцией с целью оценки функции почек выполнялись динамическая нефросцинтиграфия и измерение уровня азо- тистых шлаков (креатинина и азота мочевины) в сыворотке крови. Средняя ме- диана наблюдения составила 18 месяцев (от 6 до 34 мес).
Приводим собственное клиническое наблюдение открытой резекции почки с предварительной суперселективной эмболизацией.
Пациент Н., 57 лет поступил в клинику в плановом порядке с жалобой на тупую боль в поясничной области справа и тотальную безболевую макрогема- турию после физических нагрузок. В 2008 году впервые отметил тотальную безболевую макрогематурию с червеобразными сгустками, в дальнейшем при обследовании по месту жительства диагностирован камень левой почки. В этом же году по месту жительства выполнена пиелолитотомия слева, после- операционный период без особенностей. Спустя некоторое время стал отме- чать тупую боль в поясничной области справа, макрогематурия сохранялась. При обследовании в июле 2010 года в нашей клинике диагностирована опухоль левой почки и коралловидный камень правой почки. При МСКТ: в лоханке пра- вой почки – конкремент до 2,3 см, в верхнем полюсе левой почки – образование, накапливающее контрастный препарат, размером до 5,5 см. (рис. 2) с инвазией в почечный синус на 0,7 см. К нижнему полюсу левой почки отходит добавоч- ная артерия (на 6,5 см ниже основной), диаметром 0,2 см.
Учитывая абсолютные показания к резекции почки, размеры и локализацию опухоли, а также высокие цифры нефрометрического показателя (>7), что не исключало возможность нефрэктомии, первым этапом выполнена перкутан- ная нефролитотрипсия, литоэкстракция справа. Послеоперационный период протекал без особенностей, нефростомический дренаж удален на 5-е сутки.
Вторым этапом с целью уменьшения риска интраоперационного кровоте- чения в ходе резекции почки и принимая во внимание наличие добавочной сег- ментарной артерии, питающей опухоль выполнена селективная артериогра- фия слева, суперселективная эмболизация добавочного ствола левой почечной артерии (рис. 3). Учитывая диаметр эмболизируемого сосуда в качестве эмбо- ла использована спираль Gianturko. При контрольной артериографии выявлена полная окклюзия питающей артерии, коллатеральный кровоток к опухоли от- сутствует. Постэмболизационный период протекал без особенностей.
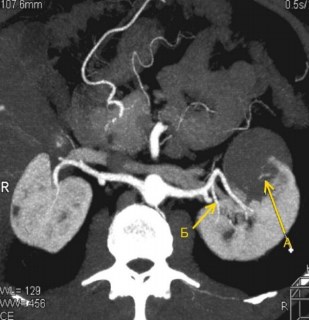
Рис. 2. Мультиспиральная компьютерная томография.
А в верхнем сегменте левой почки определяется образование, размером 5,5 см, неоднородной структуры, накапливающее контрастный препарат. Б на 6,5 см ниже основной почечной артерии отходит добавочная артерия к нижнему полюсу левой почки
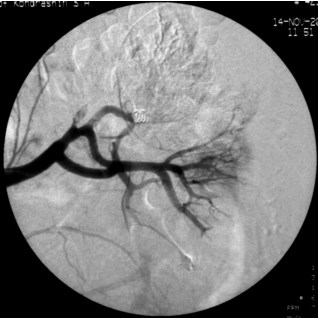
Рис. 3. Селективная почечная артериография слева. Суперселективная эмболизация сегментарных артерий, питающих опухоль, микроспиралью Gianturko
Через 6 суток после эмболизации выполнена открытая резекция левой поч- ки, парааортальная лимфаденэктомия (рис. 4). Операция протекала без суще- ственных технических трудностей, магистральный кровоток не перекрывался. Резекция выполнена по деморкационной линиии без повреждения крупных сосу- дов, интраоперационная кровопотеря составила 200 мл.
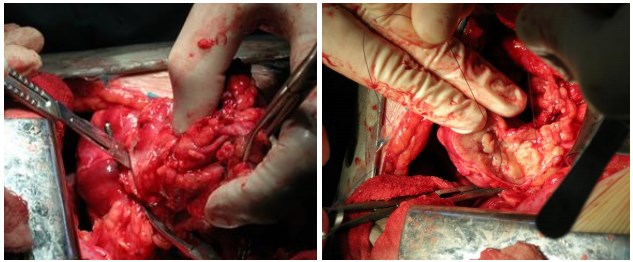
Рис. 4. Этапы резекции левой почки и ушивания зоны резекции
Послеоперационный период протекал без особенностей. По результатам морфологического исследования выявлен умеренно-дифференцированный по- чечно-клеточный рак. Опухолевая капсула хорошо выражена, определяются множественные участки некроза опухоли, вследствие проведенной эмболизаци (рис.5).
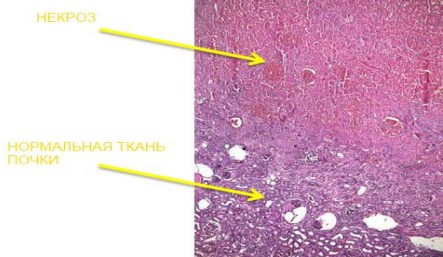
Рис. 5. Микропрепарат. По периферии очага некроза видна демаркационная линия. Окраска гематоксилином и эозином ×100.
В контрольных анализах крови уровень азотистых шлаков в пределах нор- мы (креатинин – 0,93 мг/дл, азот мочевины – 4,8 ммоль/л). При контрольной динамичекой нефросцинтиграфии через 3 месяца накопительно-выделительная функция левой почки сохранена, выраженных нарушений уродинамики не выяв- лено; сцинтиографическая картина правой почки характеризуется умеренным замедлением секреторно-экскреторного транспорта РФП.
В предыдущем примере методом лечения было решено избрать открытую резекцию почки, учитывая размеры и локализацию опухоли, ее близость к по- чечной ножке, а также «неполноценность» контрлатеральной почки и высокую вероятность нефрэктомии по результатам нефрометрии.
Рассмотрим второе клиническое наблюдение: лапароскопическая резекция левой почки с предварительной суперселективной эмболизацией.
Пацентка П., 40 лет. Диагноз: опухоль левой почки Т1аN0M0.
По данным МСКТ выполнено 3Д-моделирование патологического процесса. Опухоль размером 5,2×4,7 см, локализованная в нижнем сегменте почки, рас- положена на 2/3 экстраренально. От аорты к нижнему сегменту почки отхо- дит добавочная почечная артерия, проходящая под мочеточником. Выявлена отдельная сегментарная артерия, питающая опухоль (рис. 6, 7). Запланирова- на лапароскопическая резекция левой почки.
Учитывая наличие сосуда отдельно питающего опухоль и преимуществен- но экзофитное расположение опухоли первым этапом выполнена суперселек- тивная эмболизация сегментарной артерии с целью снижения интраопераци- онной кровопотери и исключения тепловой ишемии паренхимы почки. В услови- ях рентген-операционной интродьюсер проведѐн в сегментарную артерию, вы- полнено контрастирование. При этом визуализированы сосуды, кровоснаб- жающие опухоль. Для эмболизации использовался 96% этиловый спирт в объе- ме 5мл. При контрольной аортографии контрастируется описанная добавоч- ная артерия, поступления контрастного препарата в область опухоли не оп- ределяется (рис.8).
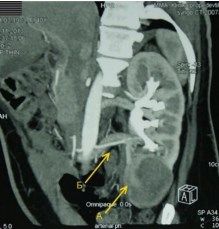
Рис. 6. Мультиспиральная компьютерная томография.
А в нижнем сегменте левой почки определяется образо- вание, размером 5,2×4,7 см, неоднородной структуры, накапливающее контрастный препарат. Б от основного ствола почечной артерии отходит добавочная артерия к ниж- нему полюсу левой почки
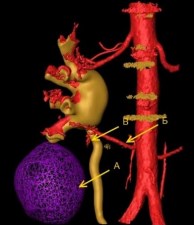
Рис. 7. Компьютерное моделирование: режим прозрачности. Вид сзади.
А опухоль нижнего сегмента левой почки размерами 5,2× 4,7 см. Образование располо- жено преимущественно экстраренально. Б добавочная почечная артерия слева, проходит под мочеточником. В сегментарная артерия, питающая опухоль.
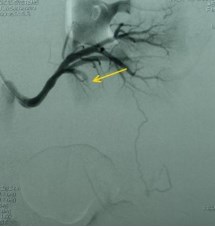
Рис. 8. Селективная почеч- ная артериография слева. Суперселективная эмболизация сегментарных артерий, питающих опухоль 96% этиловым спиртом
Спустя 4 часа после суперселективной эмболизации выполнена лапароско- пическая резекция левой почки. При диагностической лапароскопии брюшной полости обращал на себя внимание стекловидный отек забрюшинного про- странства слева, как следствие эмболизации. Стандартно была выделена поч- ка и основные элементы почечной ножки, и опухоль.
Резекция выполнена без перекрытия магистрального кровотока, при этом активного кровотечения не наблюдалось. Четко определялась линия демарка- ции, по которой и выполнена резекция (рис. 9). После отсечения опухоли, зона резекции была тщательно осмотрена на предмет положительного хирургиче- ского края. Для уверенности в абластичности, область резекции была обрабо- тана монополярным коагулятором (рис. 10).
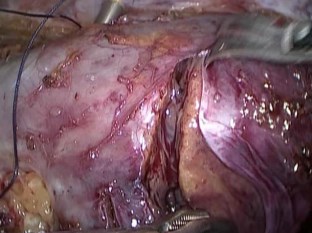
Рис. 9. Этап резекции левой почки
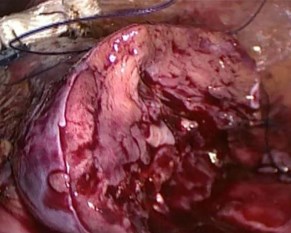
Рис. 10. Поверхность зоны резекции левой почки
С целью окончательного гемостаза рана почки ушита непрерывным двух- рядным швом нитью «Викрил», нити фиксированы клипсами Absolock с про- кладкой валика Surgicel, и дополнительно зона резекции укрыта пленкой «Тахокомб». Опухоль удалена из брюшной полости в контейнере и отправлена на гистологическое исследование. Брюшная полость дренирована. Объем крово- потери составил 50 мл.
Гистологическое заключение: в крае резекции опухолевого роста не обна- ружено. Опухоль состоит из округлых и полигональных крупных клеток с плотной зернистой эозинофильной цитоплазмой и представляет собой онко- цитому (рис. 11).
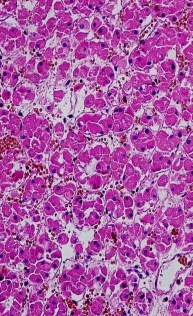
Рис. 11. Микропрепарат: опухоль, отек стромы ×200
Через 3 месяца после оперативного вмешательства была выполнена кон- трольная МСКТ и 3Д-моделирование. Левая почка размерами 5,2х4,7х12,5 см. Накопление и выделение паренхимой контрастного препарата нормальное. В результате резекции объем почечной паренхимы уменьшился на 9%. В кон- трольных анализах крови уровень азотистых шлаков в пределах нормы (креа- тинин – 1,02 мг/дл, азот мочевины – 6,5ммоль/л).
На основе проведения компьютерного моделирования был подсчитан объем почки, который составил 86,1 ml. При проведении виртуального удаления опу- холи с учетом отступления от края резекции до 5 мм объем функционирующей паренхимы почки мог уменьшиться на 4,2 ml. (рис. 12). При проведении ком- пьютерного моделирования через 3 месяца после резекции с предварительной эмболизацией объем функционирующей паренхимы почки уменьшился на 7,8 ml (9%) от исходного (рис. 13).
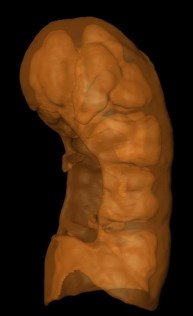
Рис. 12. Виртуальная модель объема функционирующей паренхимы почки перед опера- цией в результате виртуаль- ной резекции с соблюдением правил абластики (отступ от края опухоли 5 мм.)
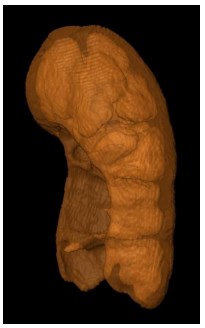
Рис. 13. Виртуальная модель через 3 месяца после прове- денной резекции
Осложнения характерные для постэмболизационного периода (боль, лихо- радка, артериальная гипертензия), а также потеря функции органа по данным лабораторных и радиоизтопных исследований (через 3, 6 и 12 мес) в наших на- блюдениях не отмечены.
Обсуждение. Суперселективная эмболизация почечных артерий, являю- щаяся малоинвазивной методикой при лечении ангиомиолипом почек [23], ис- пользуемая также для купирования послеоперационного кровотечения, вызван- ного повреждением сосудов в ходе перкутанных операций и резекции почки [24], была предложена Ching-Chia Li и соавт. [25] в 2003 г., а затем при боль- шем количестве пособий Michele Gallucci и соавт. [26] в 2004 г., как новый ме- тод, способный повысить безопасность лапароскопического вмешательства. По мнению авторов, предложенная ими методика, не требует создания локальной ишемии или клипирования, потому что кровотечение в момент резекции мини- мально вследствие суперселективной эмболизации сосудов, питающих опу- холь. Более того, эмболизация по мнению авторов позволяет визуализировать четкую границу между здоровой и некротизированной паренхимой почки, представляющей собой идеальную линию резекции. По существу интраопера- ционное ультразвуковое исследование и другие методики, помогающие опре- делить границы опухоли не требуются [25-28].
Кроме того за последние годы во многих исследованиях было доказано, что суперселективная эмболизация позволяет выполнять лапароскопическую ре- зекцию без пережатия основного ствола почечной артерии(так называемая «Zero ischemia laparoscopic partial nephrectomy») и избежать превышения поро- гового время тепловой ишемии. Онкологические результаты пособия сравнимы с таковыми при открытой операции, а функциональные результаты являются обнадеживающими благодаря оптимальному сохранению почечной функции [29,30].
Заключение. Несмотря на то, что результаты послеоперационного наблю- дения остаются предварительными (из-за небольших сроков), и для подтвер- ждения полученных нами данных необходимо сравнительное исследование, имеем основание полагать, что суперселективная эмболизация артерий, пи- тающих опухоль, перед выполнением резекции почки со средним нефрометри- ческим баллом, позволяет отказаться от интраоперационного пережатия крово- тока. Во-первых, это предотвращает тепловую ишемию нормальной паренхимы почки, которая в последующем могла бы негативно сказаться на ее функции; во-вторых делает возможным выполнение резекции в случаях сложной сосуди- стой анатомии, когда мобилизация почечной артерии, а тем более сегментар- ных сосудов, технически сложна или невозможна и в третьих Zero ischemia ведет к снижению интраоперационной кровопотери, что не только положитель- но сказывается на общем течении послеоперационного периода, но и способст- вует расширению показаний к использованию суперселективной эмболизации при лапароскопических операциях. Из недостатков метода стоит отметить ухудшение визуальной дифференцировки между опухолевой и здоровой тка- нью в ходе резекции по линии демаркации.
Литература
1. Chow W.H., Devesa S.S., Warren J.L., Freumeni J.F.Jr. Rising incidence of renal cell carcer in the United States. JAMA 1999;281:1628-31.
2. Nguyen M.M., ill I.S., Ellison L.M. The evolving presentation of renal carcinoma in the United States: trends from the Surveillance, Epidemiology, and End Results program. JUrol 2006;176:2397-400; discussion 2400.
3. A.H. Wille, M. Tullmann and J. Roigaset al., Laparoscopic partial nephrectomy in renal cell cancer—results and reproducibility by different surgeons in a high volume laparoscopic center, EurUrol46 (2006), pp. 337–343.
4. G.P. Haber and I.S. Gill, Laparoscopic partial nephrectomy: contemporary technique and outcomes, EurUrol49 (2006), pp. 660–665.
5. Ю. Г. Аляев, Е. В. Шпоть. Рак почки. Прошлое, настоящее и будущее. Фарматека. 2010. № 18-19. С. 14-19.
6. Raz O, Mendlovic S, Shilo Y et al. Positive surgical margins with renal cell carcinoma have a limited influence on long-term oncological outcomes of nephron sparing surgery. Urology 2009 Nov 4. [Epub ahead of print]. http://www.ncbi.nlm.nih.gov/pubmed/1989617
7. Marszalek M, Meixl H, Polajnar M et al. Laparoscopic and open partial nephrectomy: a matched-pair comparison of 200 patients. EurUrol 2009 May;55(5):1171–8. http://www.ncbi.nlm.nih.gov/pubmed/19232819
8. Peycelon M, Hupertan V, Comperat E et al. Long-term outcomes after nephron sparing surgery for renal cell carcinoma larger than 4 cm. J Urol 2009 Jan;181(1):35–41. http://www.ncbi.nlm.nih.gov/pubmed/19012929
9. Gill IS, Kavoussi LR, Lane BR et al. Comparison of 1,800 laparoscopic and open partial nephrectomies for single renal tumors. J Urol 2007 Jul;178(1):41–6. http://www.ncbi.nlm.nih.gov/pubmed/17574056
10. Delakas D, Karyotis I, Daskalopoulos G et al. Nephron-sparing surgery for localized renal cell carcinoma with a normal contralateral kidney: a European threecenter experience. Urology 2002 Dec;60(6):998–1002. http://www.ncbi.nlm.nih.gov/pubmed/12475657 ВЕСТНИК УРОЛОГИИ UROLOGY HERALD 2016, №2 UROVEST.RU 26
11. EUA Guidelines, 2013,http://www.uroweb.org/guidelines/online-guidelines.
12. Chow W.H., Devesa S.S., Warren J.L., Freumeni J.F.Jr. Rising incidence of renal cell carcer in the United States. JAMA 1999;281:1628-31.
13. Глыбочко П.В., Аляев Ю.Г., Терновой С.К., Дзеранов Н.К., Хохлачев С.Б., Ахвледиани Н.Д., Петровский Н.В., Фиев Д.Н. Трехмерное моделирование опухолевого процесса в почке с последующим планированием оперативного вмешательства на ней. Бюллетень Сибирской Медицины. Научно-практический журнал. Приложение.5.2012. С.38-40.
14. Глыбочко П.В., Аляев Ю.Г., Дзеранов Н.К., Хозлачев С.Б., Фиев Д.Н., Петровский Н.В. Виртуальное планирование органосохраняющих операций при опухоли почки. Медицинский Вестник Башкортостана. Том 8, №2, 2013. С. 256- 260.
15. Lasser MS, Doscher M, Keehn A, Chernyak V, Garfein E, Ghavamian R. Virtual surgical planning: a novel aid to robot-assisted laparoscopic partial nephrectomy.J Endourol. 2012 Oct;26(10):1372-9.
16. E.M. McDougall, R.V. Clayman and P.S. Chandhoke, Laparoscopic partial nephrectomy in the pig model, J Urol149 (1993), pp. 1633–1636.
17. H.N. Winfield, J.F. Donovan and A.S. Godet, Laparoscopic partial nephrectomy: initial case report for benign disease, J Endourol7 (1993), pp. 521–526.
18. Kavoussi LR, Lane BR, Blute ML, Babineau D, Colombo JR Jr, Frank I, Permpongkosol S, Weight CJ, Kaouk JH, Kattan MW, Novick AC, Comparison of 1,800 laparoscopic and open partial nephrectomies for single renal tumors, Gill IS,. (Glickman Urological Institute, Department of Quantitative Health Sciences, Cleveland Clinic, Cleveland, Ohio 44195, USA). J Urol. 2007 Jul;178(1):41-6. Epub 2007 May 11
19. vanDijk JH, Pes PL. Haemostasis in laparoscopic partial nephrectomy: currentstatus. Minim Invasive Ther Allied Technol. 2007;16(1):31-44.
20. Hassouna HA, Manikandan R. Hemostasis in laparoscopic renal surgery. Indian J Urol. 2012 Jan;28(1):3-8. doi: 10.4103/0970-1591.94939.
21. Viprakasit DP, Derweesh I, Wong C, Su LM, Stroup SP, Bazzi W, Strom KH, Herrell SD. Selective renal parenchymal clamping in robot-assisted laparoscopic partial nephrectomy: a multi-institutional experience. J Endourol. 2011 Sep;25(9):1487- 91. doi: 10.1089/end.2010.0667.
22. Глыбочко П.В., Аляев Ю.Г., Терновой Н.К., Дзеранов Н.К., Ахвледиани Н.Д., Фиев Д.Н., Хохлачев С.Б., Петровский Н.В., Матюхов И.П., Песегов С.В. Компьютерное моделирование – инновационная методика в диагностике и пла- нировании лечения пациентов с хирургическими заболеваниями почек. Ураль- ский медицинский журнал №9 (101) сентябрь 2012. С. 84.
23. N. Kothary, M.C. Soulen and T.W. Clark et al., Renal angiomyolipoma: longterm results after arterial embolization, J VascInterventRadiol16 (2005), pp. 45–50.
24. A. Chatziioannou, E. Brountzos and E. Primetiset al., Effects of superselective embolization for renal vascular injuries on renal parenchyma and function, Eur J VascEndovascSurg28 (2004), pp. 201–206.
25. Li CC, Chou YH, Wu WJ, Shih MC, Juan YS, Shen JT, Liu CC, Huang SP, Huang CH. Laparoscopic partial nephrectomy: the effect of preoperative tumor embolization. Kaohsiung J Med Sci. 2007 Dec; 23(12):624-30. doi: 10.1016/S1607- 551X(08)70061-5.
26. Gallucci M, Guaglianone S, Carpanese L, Papalia R, Simone G, Forestiere E, Leonardo C. Superselective embolization as first step of laparoscopic partial nephrectomy. Urology. 2007 Apr;69(4):642-5; discussion 645-6.
27. Munro NP, Woodhams S, Nawrocki JD, Fletcher MS, Thomas PJ. The role of transarterial embolization in the treatment of renal cell carcinoma. BJU Int. 2003 Aug;92(3):240-4.
28. Allaf ME, Bhayani SB, Rogers C, Varkarakis I, Link RE, Inagaki T, Jarrett TW, Kavoussi LR. Laparoscopic partial nephrectomy: evaluation of long-term oncological outcome. J Urol. 2004 Sep;172(3):871-3.
29. Ukimura O, Nakamoto M, Gill IS. Three-dimensional reconstruction of renovascular-tumor anatomy to facilitate zero-ischemia partial nephrectomy. Eur Urol. 2012 Jan;61(1):211-7. doi: 10.1016/j.eururo.2011.07.068. Epub 2011 Sep 15.
30. Cadeddu JA. Zero ischemia laparoscopic partial nephrectomy after superselective transarterial tumor embolization for tumors with moderate nephrometry score: long-term results of a single-center experience. J Urol. 2012 Apr;187(4):1226. doi: 10.1016/j.juro.2011.12.031. Epub 2012 Feb 14.
Статья опубликована в журнале "Вестник урологии" №2 2016, стр. 13-28









Комментарии