Ю.Л. Набока, М.И. Коган, И.А. Гудима, Е.В. Митусова, К.Т. Джалагония, С.Н. Иванов
ФГБОУ ВО «Ростовский государственный медицинский университет» МЗ РФ; Ростов-на-Дону, Россия
Введение
Инфекции мочевых путей (ИМП) любой локализации крайне редко рассматриваются в контексте эндогенного генеза взаимосвязи микробиоты мочи больных ИМП с микробиотой макроорганизма в целом и близлежащих биотопов, в частности. Пути инфицирования органов мочевой системы (ОМС) логично и подробно представлены в монографии «Экология микроорганизмов» (2006) под ред. академика О.В. Бухарина [1]. Возможность транслокации микроорганизмов из желудочно-кишечного тракта лимфогенно и/или гематогенно в ОМС описана в ряде работ [2, 3]. Причём «степень транслоцируемости бактерий градиентно убывает в ряду: «энтеробактерии – грампозитивная кокковая флора – прочие микроорганизмы» (цит. по В.А. Гриценко, 2006) [1].
В настоящее время отдельными исследовательскими группами предпринимаются попытки изучения микробных взаимосвязей ОМС с иными биотопами. В частности, в исследовании Thomas-White K. et al. (2018) проведён сравнительный анализ генома бактерий, выделенных из мочевого пузыря женщин с геномом 67 вагинальных и 120 кишечных штаммов [4]. Авторами верифицированы общие геномы 23 видов бактерий, обнаруженных как в мочевом пузыре, так и во влагалище. В работе Owrangi B. et al. (2018) доказана возможность транслокации уропатогенных E. coli (UPEC) через эпителий кишечника в кровоток, а затем в ОМС [5].
Таким образом, на сегодняшний день данный вопрос недостаточно изучен, но его актуальность подчеркивается отсутствием снижения заболеваемости ИМП [6, 7] и поиска принципиально новых решений при изучении этиологии и патогенеза заболеваний.
Цель исследования изучить корреляционные связи между различными таксонами микробиоты, выделенной из мочи, влагалища и кишечника у пациенток с инфекцией верхних мочевых путей.
Материалы и методы
Обследовано 60 женщин с инфекцией верхних мочевых путей (острый обструктивный калькулезный пиелонефрит (ООП)) в возрасте от 18 до 65 лет (средний возраст 41,5±23,5 лет). Критерии включения: отсутствие конкрементов в мочевых путях в анамнезе, первое обращение в стационар по поводу камня мочеточника, отсутствие инфекций нижних мочевых путей и заболеваний, передающихся половым путём, согласие обследуемых на участие в исследовании.
В течение первых 3 часов от момента госпитализации для бактериологического исследования забирали пузырную мочу уретральным катетером в стерильный одноразовый контейнер Sterile Uricol «HiMedia». Забор фекалий, их бактериологическое исследование, а также интерпретацию полученных результатов проводили в соответствии с протоколом отраслевого стандарта [8]. Отделяемое заднего свода влагалища забирали стерильным тампоном с транспортной средой (Hiculture Transport Swabs w/Alternativ Thioglycollate Medium). Материал, полученный от больных ООП, транспортировали в лабораторию в течение 30-60 минут
За основу бактериологического исследования мочи и отделяемого заднего свода влагалища были взяты методики В.В. Меньшикова (2009) [9], но с модификациями в плане использования питательных сред. Спектр применяемых питательных сред был шире регламентированных, включая как культивирование факультативно-анаэробных бактерий (ФАБ) (MacConkey Agar, HiCrome Klebsiella Selective Agar Base, HiCrome Candida Diff erential Agar, HiCrome Enterococci Agar, HiCrome Aureus Agar Base, Blood Agar Base, Streptococcus Selection Agar), так и анаэробных таксонов микробиоты (Rogosa Agar Modifi ed, Anaerobic Agar, Shaedler Agar, Bacteroides Bile Esculinum Agar, Shaedler Broth, Блаурокка). Соответственно применяли аэробные и анаэробные методики культивирования. Идентификацию бактерий, выделенных из мочи, фекалий и отделяемого заднего свода влагалища проводили по общепринятым методикам.
Для статистической обработки полученных результатов использовали версию «R ver 3.2» («R Foundation for Statistical Computing», Вена, Австрия) с общепринятыми коэффициентами значимости.
Результаты
На первом этапе исследования был проведён анализ результатов по признакам частот встречаемости и количественных характеристик различных таксонов микробиоты, верифицированной в трёх биотопах. На втором этапе проведён сравнительный корреляционный анализ между таксонами микроорганизмов, верифицированных в мочевых путях и влагалище, мочевых путях и кишечнике, а также во влагалище и кишечнике.
В биотопах мочевые пути и влагалище обнаружено 26 значимых коэффициентов корреляции: 4 – обратных и 22 – прямых от слабой до сильной тесноты связи. Необходимо отметить, что 15 (57,7%) из 26 коэффициентов корреляции регистрировали для таксономически общих родов или видов (рис. 1). 11 (42,3%) значимых коэффициентов корреляции были зафиксированы для различных таксонов (табл. 1).
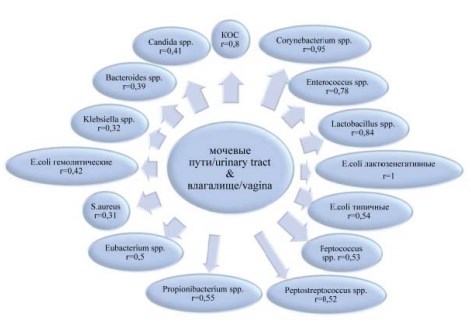
Рисунок 1. Значимые корреляции (p<0,05) между идентичными представителями микробиоты мочевых путей и влагалища
Таблица 1. Значимые корреляции (p<0,05) между различными представителями микробиоты мочевых путей и влагалища
| Моча/ Urine | r | Влагалище/ Vagina |
| KOC/Coagulase-negative Staphylococci | 0,33 | Lactobacillus spp. |
| E. coli типичные/f. coli typical | 0,48 | Bifidobacterium spp. |
| E. coli лактозонегативные/ E.coli lactose-negative | 0,34 | Propionibacterium spp. |
| 0,39 | Corynebacterium spp. | |
| Proteus spp. | 0,32 | Bacteroides spp. |
| 0,42 | Fusobacterium spp. | |
| Bacteroides spp. | -0,26 | Lactobacillus spp. |
| 0,31 | Candida spp. | |
| -0,27 | КОС/ Coagulase-negative Staphylococci | |
| E. coli гемолитические/Е. coli hemolytic | -0,26 | Corynebacterium spp. |
| -0,28 | Bifidobacterium spp. |
Интересным является следующее обстоятельство: значимые корреляционные связи между общими таксонами микроорганизмов, верифицированных в мочевых путях и влагалище, были прямыми. Причём из 15 коэффициентов корреляции большая доля (11) была зафиксирована для представителей факультативно-анаэробной микробиоты.
При анализе значимых коэффициентов корреляции между различными таксонами микробиоты более разноплановые связи получены для Proteus spp. и гемолитических E. coli., выделенных из мочи больных с различными таксонами микробиоты влагалища (табл. 1). Несмотря на разноплановость полученных связей в большинстве случаев микроорганизмы, выделенные из мочи больных ООП имели прямые или обратные значимые коэффициенты корреляции с Lactobacillus spp., Bifi dobacterium spp. и Corynebacterium spp., верифицированных во влагалище этих же пациенток.
У пациенток с ООП в мочевых путях и кишечнике обнаружен 21 значимый коэффициент корреляции с преобладанием прямых (15 (71,4%)), реже обратных (6 (28,6%)) связей. Между общими таксонами микробиоты зафиксированы 9 (42,8%) коэффициентов корреляции, между различными таксонами – 12 (57,2%) (рис. 2, табл. 2).
Таблица 2. Значимые корреляции (p<0,05) между различными представителями микробиоты мочевых путей и кишечника
| Моча/Urine | r | Кишечник/Guf |
| Corynebacterium spp. | 0,32 | Lactobacillus spp. |
| Enterococcus spp. | 0,26 | E.coli лактозонегативн ые/E.coli lactose-negative |
| Lactobacillus spp. | 0,26 | Bacteroides spp. |
| 0,28 | E.coli типичные | |
| КОС/ Coagulase-negative Staphylococci | E.coli лактозонегативные/Е.со// lactose-negative | |
| -0,29 | ||
| -0,28 | Bacteroides spp. | |
| Klebsiella spp. | ||
| -0,32 | Bifidobacterium spp. | |
| Propionibacterium spp. | -0,28 | Bifidobacterium spp. |
| Eubacterium spp. | -0,26 | Proteus spp. |
| -0,29 | Klebsiella spp. | |
| Peptostreptococcus spp. | ||
| 0,28 | Bifidobacterium spp. | |
| Candida spp. | 0,31 | Proteus spp. |
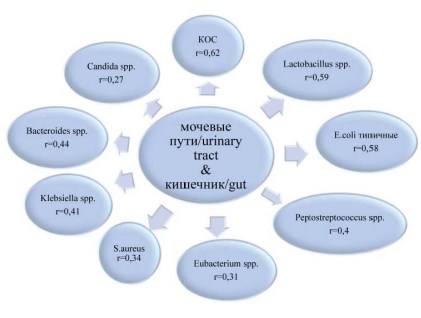
Рисунок 2. Значимые корреляции (p<0,05) между идентичными представителями микробиоты мочевых путей и кишечника
Аналогично выявленным корреляционным связям в биотопах мочевые пути – влагалище, в исследуемых локусах между общими таксонами микробиоты также регистрировали только прямые корреляционные связи и, в основном (5), для ФАБ.
Из 12 значимых коэффициентов корреляции между различными родами и/или видами микробиоты 6 были обратными, 6 – прямыми, причем, в большинстве случаев между аэробными и анаэробными представителями микробиоты (табл. 2).
У пациенток с ООП во влагалище и кишечнике выявлены 28 значимых коэффициентов корреляции, из них 13 – для общих таксонов микробиоты (рис. 3), 15 – для различных таксонов (табл. 3).
Таблица 3. Значимые корреляции (p<0,05) между различными представителями микробиоты влагалища и кишечника
| Влагалище/ Vagina | r | Кишечник/Gut |
| КОС | -0,27 | E.coli лактозонегативные |
| Corynebacterium spp. | 0,34 | Lactobacillus spp. |
| E.coli типичные | -0,28 | E.coli лактозонегативные |
| -0,28 | E.coli лактозонегативные | |
| E.coli гемолитические | -0,33 | Peptococcus spp. |
| -0,29 | Eubacterium spp. | |
| Lactobacillus spp. | 0,3 | КОС spp. |
| Peptococcus spp. | 0,29 | Bifidobacterium spp. |
| Eubacterium spp. | -0,42 | Proteus spp. |
| -0,35 | Klebsiella spp. | |
| Peptostreptococcus spp. | ||
| 0,31 | Proteus spp. | |
| Bacteroides spp. | -0,33 | Peptostreptococcus spp. |
| -0,5 | Enterococcus spp. | |
| Bifidobacterium spp. | ||
| 0,3 | E.coli типичные | |
| Candida spp. | -0,27 | Lactobacillus spp. |
Среди общих таксонов обращает внимание, что 6 коэффициентов корреляции обнаружены для аэробных представителей микробиоты, а 9 – для анаэробных. Все значимые корреляции были прямые.
Из 15 значимых коэффициентов корреляции между различными таксонами микроорганизмов, выделенными из влагалища и кишечника больных ООП 10 были обратными, 5 – прямыми (табл. 3). Причём в большинстве случаев значимые связи зафиксированы между аэробными и анаэробными таксонами микроорганизмов.
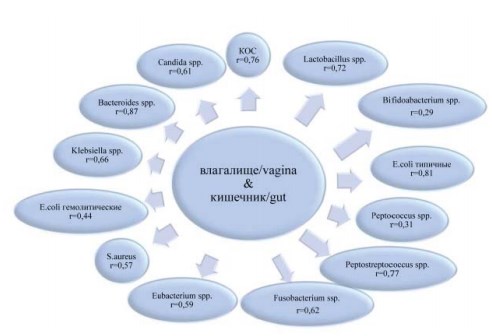
Рисунок 3. Значимые корреляции (p<0,05) между идентичными представителями микробиоты влагалища и кишечника
Таким образом, при изучении микробиоты мочевых путей, влагалища и кишечника у больных ООП в мочевых путях и влагалище между таксонами микробиоты обнаружены 26 значимых коэффициентов корреляции, в мочевых путях и кишечнике – 21, во влагалище и кишечнике – 28. Полученные результаты свидетельствуют о том, что необходимо рассматривать этиологическую структуру ООП и микробиоту, участвующую в манифестации заболевания, вне зависимости от её каузативности или дискутабельности во взаимосвязи с другими биотопами.
Заключение
Бесспорно, существование различных родов микроорганизмов в каждом конкретном биотопе определяются особенностями среды обитания, питательными субстратами, межвидовой конкуренцией за ресурсы (углеродные, энергетические), необходимостью выработки устойчивости к защитным механизмам макроорганизма. Представители семейства Enterobacteriaceae, вызывающие ИМП и бактериемию являются комменсалами кишечника, который насыщен питательными веществами и углеродами, однако они же могут трансформироваться в патогенные формы и размножаться в обедненных с точки зрения питательных веществ и богатых азотом мочевыводящих путях. В исследовании [10] обсуждаются механизмы адаптации микроорганизмов, которые позволяют патогенным энтеробактериям вне кишечника устанавливать как комменсальные, так и вирулентные взаимосвязи при транслокации микроорганизмов между биотопами одного и того же человека.
Анализируя связи энтеробактерий в биотопах мочевые пути, влагалище мы получили прямые достоверные значимые коэффициенты корреляции для типичных E. coli и Klebsiella spp. в обоих биотопах
Для типичных E. coli, выделенных из мочи имеется прямая значимая связь с Bifi dobacterium spp., обнаруженными во влагалище. Для лактозонегативных E. coli, регистрируемых в моче, также зафиксированы прямые коэффициенты корреляции с Propionibacterium spp. во влагалище. Однако для гемолитических E. coli зафиксированы обратные значимые коэффициенты корреляции с КОС, Corynebacterium spp., Bifidobacterium spp., обнаруженными во влагалище. Это свидетельствует о том, что при повышении в моче частоты обнаружения гемолитических E. coli во влагалище снижается присутствие вышеперечисленных таксонов бактерий.
Энтеробактерии, обнаруженные в мочевых путях, также значимо связаны с энтеробактериями, обнаруженными в кишечнике. Аналогично влагалищному биотопу зафиксированы прямые коэффициенты корреляции между типичными E. coli и Klebsiella spp., обнаруженными в моче и кишечнике. При повышении в моче Klebsiella spp. снижаются частота обнаружения и количество Bacteroides spp. и Bifidobacterium spp. в кишечнике, а при повышении в моче Eubacterium spp., снижаются Proteus spp. и Klebsiella spp.
Полученные значимые коэффициенты корреляции между различными таксонами микробиоты в трёх изучаемых биотопах являются бесспорным доказательством связи этих локусов, что подтверждается пока ещё единичными работами с филотипированием и генотипированием, в частности энтеробактерий, выделенных из мочи и кишечника пациенток с ИМП [11, 12].
Литература
- Бухарин О.В., Валышев А.В., Гильмутдинова Ф.Г., Гриценко В.А., Карташова О.Л., Кузьмин М.Д., Усвяцов Б.Я., Черкасов С.В. Экология микроорганизмов человека. Екатеринбург: УрО РАН; 2006:389-470. ISBN 5-7691-1738-9
- Алмагамбетов К.Х., Горская Е.М., Бондаренко В.М. Транслокация кишечной микрофлоры и её механизмы. Журн. микробиологии. 1991;7:74-79.
- Berg RD. Bacterial translocation from the intestines. Jikken Dobutsu. 1985;34(1):1-16. PMID: 3987819
- Thomas-White K, Forster SC, Kumar N, Van Kuiken M, Putonti C, Stares MD, Hilt EE, Price TK, Wolfe AJ, Lawley TD.Culturing of female bladder bacteria reveals an interconnected urogenital microbiota. Nat Commun. 2018;9(1):1557. DOI:10.1038/s41467-018-03968-5
- Owrangi B, Masters N, Kuballa A, O’Dea C, Vollmerhausen TL, Katouli M. Invasion and translocation of uropathogenic Escherichia coli isolated from urosepsis and patients with community-acquired urinary tract infection. Eur J Clin Microbiol Infect Dis. 2018;37(5):833-839. DOI: 10.1007/ s10096-017-3176-4
- Клинические рекомендации «Инфекции мочевыводящих путей у детей, взрослых, беременных: цистит, пиелонефрит, бессимптомная бактериурия». М.-КазаньРостов-на-Дону. 2014:25.
- Schaeffer A.J., Matulewicz M.S., Klumpp D.J. Infection of the urinary tract. Campbell-Walsh Urology. 2016;12:237-303.
- Отраслевой стандарт «Протокол ведения больных. Дисбактериоз кишечника» (ОСТ 91500.11.0004-2003).
- Меньшиков В.В. Методики клинических лабораторных исследований. М.: Лабора; 2009:880.
- Alteri CJ, Mobley HL. Escherichia coli physiology and metabolism dictates adaptation to diverse host microenvironments. Curr Opin Microbiol. 2011;15(1):3-9. DOI: 10.1016/j. mib.2011.12.004
- Moreno E, Andreu A, Pigrau C, Kuskowski MA, Johnson JR, Prats G. Relationship between Escherichia coli strains causing acute cystitis in women and the fecal E. coli population of the host. J Clin Microbiol. 2008;46(8):2529-34. DOI: 10.1128/JCM.00813-08
- Ramos NL, Saayman ML, Chapman TA, Tucker JR, Smith HV, Faoagali J, Chin JC, Brauner A, Katouli M. Genetic relatedness and virulence gene profi les of Escherichia coli strains isolated from septicaemic and uroseptic patients. Eur J Clin Microbiol Infect Dis. 2010 Jan;29(1):15-23. DOI: 10.1007/ s10096-009-0809-2
Статья опубликована в журнале "Вестник урологии" № 1 2019, стр. 38-44











Комментарии