Кульчавеня Е.В.
ФГБУ Новосибирский НИИ туберкулеза Минздрава России, г.Новосибирск ГБОУ ВПО Новосибирский государственный медицинский университет Минздрава России, г.Новосибирск Адрес: 630040, г.Новосибирск, ул.Охотская, 81а тел. (383)2037989 Эл.почта: urotub@yandex.ru
Туберкулез остается серьезной и актуальной медицинской, социальной и экономической проблемой. Изучение эпидемической ситуации за последние десятилетия показало, что прогноз относительно ликвидации туберкулеза в мире и отдельно взятой стране не оправдался [Краснов В.А., 2004; Шилова М.В., 2005; van Kerkhoff L., 2006].
В настоящее время около 30% населения земного шара инфицировано микобактерией туберкулеза. Как причина смертности взрослого населения от единичного инфекционного агента туберкулез занимает первое место [Ерохин В.В. с соавт., 2005; Левашев Ю.Н. с соавт., 2005]. В период с 1988 по 2001 г.г. увеличилась смертность от туберкулеза в молодых возрастных группах. Основными причинами бурного роста этого социального заболевания являются распространение СПИДа, увеличение количества полирезистентных штаммов микобактерий туберкулеза (МБТ), военные действия во многих странах мира [Tomioka H. et al., 2006; Nelson M., 2006].
Увеличилась частота внелегочных поражений: туберкулеза органов мочевыводящей системы, костно-суставной системы, мягких мозговых оболочек и центральной нервной системы, гортани, периферических лимфатических узлов, кишечника, кожи и т.д. Многие авторы отмечают, что истинная заболеваемость внелегочными формами туберкулеза значительно превышает регистрируемую. Внелегочные формы туберкулеза, несмотря на скромную роль в эпидемической ситуации, таят потенциальную угрозу жизни больного [Васильева А.В. с соавт., 2000; Fain O., 2002].
Туберкулез – хроническое инфекционное заболевание, протекающее с внутриклеточным (в макрофагах) паразитированием микобактерий. Туберкулез любой локализации вызывается микобактерией туберкулеза. Для человека вирулентными являются микобактерии (МБТ) человеческого и бычьего вида. Таким образом, туберкулез – антропозоонозная инфекция; при сборе анамнеза всегда следует иметь в виду возможность инфицирования от животных.
Заражение туберкулезом происходит преимущественно воздушно-капельным путем. Вместе с тем возможно внутриутробное заражение, передача инфекции алиментарным, половым, контактным и трансмиссивным путем.
В зависимости от места внедрения микобактерии первоначально могут проникать в легкое, миндалины, кишечник и так далее. Возбудитель туберкулеза не выделяет экзотоксин, а потому присутствие в тканях небольшого числа микобактерий проявляется не сразу. МБТ, находясь внеклеточно, медленно размножаются, а окружающая их ткань остается интактной, сохраняет нормальную структуру. Такое состояние определяется как латентный микробизм, при котором макроорганизм проявляет толерантность к микобактерии.
Независимо от входных ворот, микобактерии с током лимфы довольно быстро попадают в регионарные лимфоузлы, откуда лимфогематогенным путем распространяются по всему организму. Возникает первичная (облигатная) микобактериемия. МБТ оседают в органах с наиболее развитым микроциркуляторным руслом – в легких, лимфатических узлах, корковом слое почек, эпифизах и метафизах трубчатых костей, ампулярно-фимбриональных отделах маточных труб, увеальном тракте глаза. Однако первичная бактериемия не влечет за собой непременное развитие диссеминированного туберкулеза [Лебедева З.А., 1952; Чистович А.И., 1960,].
Оседая в различных тканях, микобактерии продолжают размножаться, и их популяция может значительно увеличиться, прежде чем сформируется иммунитет и появится возможность для их разрушения и элиминации.
Первыми микобактерии поглощают полинуклеарные лейкоциты, которые вскоре погибают, так как их бактерицидный потенциал недостаточен для МБТ. После этого микобактерия фиксируется на клеточной мембране макрофага и поглощается им.
Недостаточная активация макрофагов и неэффективный фагоцитоз приводят к неконтролируемому размножению МБТ; в течение 20 дней возможно появление более 500 миллионов новых МБТ. Их взаимодействие с полинуклеарными лейкоцитами и макрофагами способствует массовой гибели фагоцитирующих клеток. При этом в межклеточное пространство поступает большое количество медиаторов и протеолитических ферментов, повреждающих окружающие ткани [Frattazzi C. et al., 1999].
По мере развития иммунного ответа размножение микобактерий замедляется, их общее число уменьшается, специфическая воспалительная реакция затихает. Однако окончательной ликвидации возбудителя туберкулеза не происходит даже при полноценном взаимодействии макрофагов и Т-лимфоцитов. Определенная популяция МБТ сохраняется в единичных туберкулезных гранулемах, окруженных плотной фиброзной капсулой. В связи с сохранением микобактерий в организме, противотуберкулезный иммунитет называют нестерильным.
В целом риск развития туберкулеза у впервые инфицированного человека составляет около 8% в первые 2 года после заражения, в последующем постепенно снижается. Контакт организма с МБТ во многих случаях не ведет к развитию болезни, 90% инфицированных людей остаются клинически здоровыми [WHO reports 1997-2006].
Туберкулез является клинически неоднородным заболеванием. Различают первичную форму заболевания, которая развивается у ранее неинфицированного микобактериями организма, а также вторичный генез туберкулеза, когда заболевание возникает при повторном инфицировании. Экзогенная суперинфекция как причина развития вторичного туберкулеза по частоте многократно превосходит реактивацию старых очагов.
В большинстве случаев туберкулез начинается с формирования очага воспаления на месте ворот инфекции, за чем следует поражение региональных лимфоузлов, образуя так называемый первичный комплекс. Первичное инфицирование через органы дыхания является наиболее частым. Оно ведет к образованию одного или многих очагов туберкулезного воспаления в легком, в зависимости от массивности инфицирования. Процесс развития этих очагов протекает одновременно с общей диссеминацией микобактерий по лимфатическим и кровеносным путям [Чистович А.И., 1960].
Однако первичное инфицирование может не сопровождаться образованием очага воспаления в области ворот инфекции, например, при инфицировании через слизистые оболочки. Тогда началом болезни является общая туберкулезная диссеминация по лимфатическим и кровеносным путям, результатом чего является образование множественных очагов туберкулезного воспаления в тканях внутренних органов, лимфатических узлов и костного мозга.
На фоне волн гематогенной диссеминации, скрытых или выявляемых клинически, могут развиваться разные формы «изолированных» или «органных» поражений, входящих в группу внелегочных форм вторичного туберкулеза. Развитие этих форм имеет патогенез, аналогичный тому, который имеют внелегочные поражения, развивающиеся на фоне гематогенной диссеминации при первичном туберкулезе. Эти органные формы развиваются на фоне общей туберкулезной диссеминации, одни элементы которых излечиваются, другие получают прогрессивное развитие.
Таким образом, туберкулез почек или простаты, как и все другие органные формы туберкулеза, развивается всегда на фоне общей гематогенной диссеминации, другие элементы которой могут сохранить активность или излечиться (зарубцеваться), причем процесс диссеминации может протекать скрыто и клинически не распознаваться.
При констатации факта преимущественного поражения органа или системы органов, естественно, возникает вопрос о причинах возникновения «очага наименьшего сопротивления» туберкулезной инфекции при наличии общей сопротивляемости, обеспечивающей ликвидацию явлений общей диссеминации. Провоцирующими факторами в случае уротуберкулеза являются, главным образом, нарушения уродинамики и микроциркуляции [Schlesinger L.S., 1996; Frattazzi C. et al., 1999].
Клиническое течение туберкулеза предстательной железы
Клиническая классификация туберкулеза мужских половых органов включает:
- Туберкулезный эпидидимит (одноили двусторонний).
- Туберкулезный орхоэпидидимит (одноили двусторонний).
- Туберкулез предстательной железы (инфильтративная или кавернозная форма).
- Туберкулез семенных пузырьков.
- Туберкулез полового члена.
Осложнения: свищи мошонки и промежности, бесплодие, сексуальная дисфункция.
Возможно выделение микобактерии во внешнюю среду с дериватами половых желез или с отделяемым свища; в этом случае в диагнозе помимо формы туберкулеза указывают «МБТ+».
Туберкулез предстательной железы всегда считался заболеванием, необычайно трудным для ранней диагностики в силу отсутствия характерных клинических и лабораторных проявлений, а также невысокой частоты обнаружения микобактерии туберкулеза в секрете простаты и/или эякуляте. Однако, по данным аутопсий, туберкулезное поражение предстательной железы встречается у 70% больных с распространенными формами туберкулеза легких, как правило, прижизненно не диагностируемое.
При первичном обращении к урологу у половины больных выявляются симптомы нарушенного мочеиспускания; 40% мужчин предъявляют жалобы на боль в промежности; 59% – и в поясничной области. У 85% пациентов имеет место повышенное содержание лейкоцитов в осадке мочи, а у 78% – в секрете простаты. Эритроциты присутствуют у 53% больных в моче и у 29% – в секрете простаты. МБТ в дериватах половых желез обнаруживаются лишь в 36% случаев.
У 79% больных туберкулезный простатит сочетается с нефротуберкулезом, у 31% – с туберкулезом яичка и его придатка; в 5% случаев выявляется изолированный туберкулез простаты.
Пальпация предстательной железы и исследование ее секрета сохраняют первостепенное значение в диагностике хронического простатита любой этиологии, в том числе туберкулезного, но принципиальна важна последовательность выполнения диагностических приемов. Пальцевое ректальное исследование с массажем простаты на первичном приеме приводит к контаминации мочи секретом железы и врач не сможет объективно оценить пузырную мочу. Поэтому следует начинать обследование больного с 3-стаканной пробы мочи, причем струя мочи не должна прерываться во время исследования, а затем уже выполнять ректальное исследование с забором секрета. В том случае если он не получен, целесообразно сделать общий анализ мочи после массажа простаты. Микроскопия эякулята и секрета простаты, бактериологическое исследование их на неспецифическую микрофлору и на микобактерию туберкулеза, ультразвуковое исследование (УЗИ) почек и трансректальное ультразвуковое исследование (ТРУЗИ) простаты завершают первичный комплекс обследования пациента.
Туберкулез простаты приводит к нарушениям ее структуры в виде участков повышенной и пониженной эхогенности, наличия гипери гипоэхогенных включений, диагностируемых во время трансректального ультразвукового исследования. Причем при неспецифическом хроническом бактериальном простатите поражается преимущественно периферическая зона простаты, а туберкулез захватывает и периферическую, и центральную зоны предстательной железы. Туберкулез простаты к тому же в полтора раза чаще сопровождается развитием простатолитиаза, чем неспецифический простатит. В данной ситуации картину кальциноза железы можно интерпретировать как обызвествление туберкулезных очагов.
При оценке васкуляризации и гемодинамики предстательной железы методом ультразвуковой допплерографии обнаружено, что туберкулез простаты характеризуется более резким снижением пиковых, диастолических, средних линейных объемных скоростей кровотока, уменьшением плотности сосудистого русла как в центральной, так и в периферической зонах железы. У больных хроническим неспецифическим простатитом нарушения кровообращения регистрируются преимущественно в периферической зоне простаты. При доброкачественной гиперплазии предстательной железы, напротив, скорость объемного кровотока в сосудах, проходящих в зоне гиперплазии простаты, увеличена.
Показатели линейной пиковой скорости кровотока 1,60 у.е., индекса резистентности >0,8 у.е., плотности сосудистого сплетения <0,5 сосуд/см характерны для туберкулезного поражения простаты, что позволяет рассматривать трансректальное ультразвуковое исследование (ТРУЗИ) простаты, дополненное допплерографией, как метод, способствующий повышению эффективности диагностики туберкулеза предстательной железы [Куксин В.М. с соавт., 2004].
Восходящая уретрография – крайне важный метод в диагностике туберкулеза предстательной железы, однако информативен только при наличии каверн простаты; инфильтративная форма процесса рентгенологических признаков не имеет. В качестве иллюстрации приводим уретрограмму больного кавернозным туберкулезом предстательной железы (рис. 1).
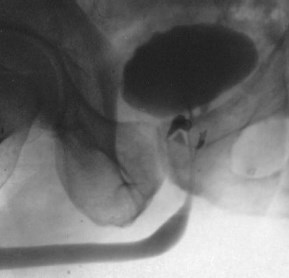
Рис. 1. Туберкулезные каверны предстательной железы
В настоящее время широкое распространение получила биопсия простаты. Этот метод исследования показан при инфильтративном поражении предстательной железы и подтверждает диагноз в случае обнаружения специфических патоморфологических признаков или активного параспецифического воспаления при наличии других данных, свидетельствующих за туберкулез.
Вариант туберкулеза предстательной железы представлен на рисунке 2.
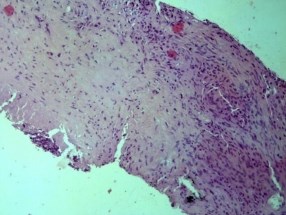
Рис. 2. Множественные гигантские клетки Пирогова-Лангганса, сливные очаги казеоза в паренхиме простаты. Гематоксилин-эозин, × 100
Биопсия противопоказана при кавернозном туберкулезе предстательной железы, так как возможно развитие «путевой инфекции». Отсюда следует логичный вывод, что первоначально должна быть выполнена уретрография. Подчеркиваем, что обнаружение фиброза не является признаком перенесенного нелеченного туберкулеза, так как самопроизвольное излечение туберкулеза всегда происходит через полное рассасывание или обызвествление очагов.
Туберкулез простаты – заболевание, передающееся половым путем. У больных туберкулезом легких МБТ в эякуляте обнаруживаются редко (0,08% случаев), при сочетании туберкулеза с гепатитами МБТ в эякуляте обнаруживали у 19%, в секрете – у 13% больных. При сочетанном течении туберкулеза, гепатита и сифилиса частота выявления МБТ в эякуляте возрастает до 49%, в секрете – до 44% [Афонин А.В. и соавт., 2006]. При туберкулезе предстательной железы МБТ в эякуляте или секрете простаты обнаруживают в 36% случаев, однако сокращение сроков между забором материала и посевом, проведение повторных посевов, а также выполнение посевов после провокации подкожным введением 50 ТЕ туберкулина многократно повышают частоту идентификации МБТ.
Таким образом, верификация диагноза туберкулеза простаты может быть, как и при туберкулезе мочевого пузыря, получена патоморфологически, бактериологически, по совокупности эпидемических и клинико-лабораторных данных, а также в случае формирования каверн – рентгенологически.
Для снижения рисков недодиагностики туберкулеза предстательной железы, уролог должен руководствоваться следующим алгоритмом обследования больного хроническим простатитом:
- Сбор анамнеза. Указание на перенесенный ранее или имеющийся в настоящее время туберкулез любых локализаций, особенно диссеминированные формы. Наличие в семье детей с гиперэргическими туберкулиновыми пробами должно насторожить в отношении туберкулеза.
- Осмотр и физикальное обследование наружных половых органов. Обнаружение свищей в области промежности – прямое указание на наличие туберкулеза (рис. 3).
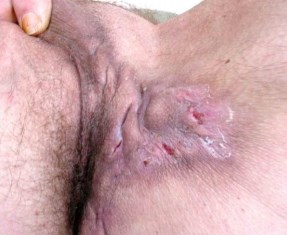
Рис. 3. Кавернозный туберкулез предстательной железы, осложненный свищами
- Трехстаканная проба мочи. В 1968 году Meares и Stamey предложили так называемый 4-стаканный тест. Это трудоемкое и дорогостоящее исследование совершенно необоснованно считается в США «золотым стандартом», хотя по данным мировой литературы в повседневной практике применяется не более чем 30% урологов. На наш взгляд оптимальной является трехстаканная проба, которая выполняется следующим образом. После туалета наружных половых органов больному предлагают помочиться примерно равными порциями в три емкости последовательно, не прерывая струю. Первая порция отражает состояние мочеиспускательного канала, вторая — почек и мочевого пузыря. Наличие патологических элементов в третьей порции свидетельствует о неблагополучии предстательной железы, так как именно эта порция контаминируется содержимым простаты и семенных пузырьков. Некоторые руководства рекомендуют ограничиться двухстаканным тестом, но при этом невозможно оценить состояние почечной и пузырной мочи, поскольку первая порция будет содержать смыв с мочеиспускательного канала, а вторая будет контаминирована секретом простаты.
- Ректальное исследование с забором секрета простаты и последующим окрашиванием его по Граму и исследованием нативного мазка методом световой микроскопии. Практика последних лет свидетельствует об отказе врачей от пальцевого ректального исследования и подмене его трансректальным ультразвуковым исследованием. При этом вместо секрета простаты ограничиваются анализом эякулята. Это глубоко порочный подход. Во-первых, информация, полученная при пальпации предстательной железы, незаменима, ТРУЗИ ее только дополняет. Вовторых, в эякуляте содержится секрет только тех долек простаты, чьи выводные протоки свободны, а из пораженных долек секрет нужно выдавливать механически – как из-за атонии их гладкой мускулатуры, так и по причине гнойно-некротических пробок. Не всегда при массаже удается получить секрет – по разным причинам. Так может произойти при фиброзе или склерозе простаты, после прошедшей накануне эякуляции (поэтому эякулят для исследования собирают после того, как получен секрет), при выраженной болезненности железы. В таком случае больному предлагают помочиться небольшой порцией непосредственно после пальцевого ректального исследования и рассматривают полученный смыв как аналог секрета предстательной железы.
- Секрет простаты помещают на предметное стекло и накрывают каплю покровным стеклом, после чего препарат направляют в лабораторию для световой микроскопии. Другую каплю собирают в стерильную пробирку и немедленно отправляют в бактериологическую лабораторию; для получения достоверных результатов между забором материала и посевом должно пройти не более часа. Следующую, третью каплю аккуратно размазывают по стеклу и оставляют для подсыхания – этот препарат будет впоследствии окрашен по Граму. После чего из мочеиспускательного канала берут соскоб для ДНКдиагностики методом ПЦР внутриклеточных инфекций и вирусов, передаваемых половым путем. Этот материал можно заморозить, однако следует помнить, что после размораживания он должен быть срочно запущен в диагностический процесс, повторное замораживание недопустимо. Повторим: если секрет не был получен, для всех тестов используют мочу после массажа простаты.
- Спермограмма.
- Бактериологические исследования на неспецифическую микрофлору и на микобактерию туберкулеза с определением чувствительности возбудителя к антибактериальным препаратам. Информативность, чувствительность и специфичность методов по нарастанию: простая микроскопия с окраской мазка по Цилю-Нильсену, люминесцентная микроскопия, ДНК-диагностика методом полимеразной цепной реакции (ПЦР), посев на твердые среды, использование автоматических систем Bactec и GeneXpert.
- Ультразвуковое исследование почек. Этот метод имеет вспомогательное, на важное значение, поскольку для неспецифического простатита нехарактерно поражение почек, а при туберкулезе простаты у большинства больных находят те или иные изменения мочевой системы.
- Трансректальное ультразвуковое исследование простаты с допплерографией.
- ДНК-диагностика инфекций, передаваемых половым путем, и микобактерий туберкулеза методом ПЦР соскоба мочеиспускательного канала и секрета простаты и эякулята.
- Биопсия простаты (при отсутствии каверн на уретрограмме) с патоморфологическим и бактериологическим исследованием биоптатов, а также с проведением ДНК-диагностики.
- При склонности к непрерывнорецидивирующему типу течения показана восходящая уретрография.
Туберкулез как причина репродуктивных нарушений
Проблема влияния туберкулеза на состояние репродуктивной функции у мужчин в медицинской литературе освещена недостаточно. Так, имеются сообщения, что причинами инфертильности у мужчин являются последствия туберкулезного эпидидимита. При туберкулезе мужских половых органов, как правило, развивается экскреторнообтурационная форма бесплодия [Gorse G.J., 1985]. Moon S.Y. et al. (1999) подтвердили роль туберкулезного эпидидимита в развитии аспермии и азооспермии и сравнили результаты экстракорпорального оплодотворения (ЭКО) при обтурации семявыносящего протока туберкулезной и нетуберкулезной этиологии. Достоверных различий ни в частоте наступления беременности, ни в частоте развития аномалий развития плода среди пациентов этих двух групп не было выявлено. Авторы считают ЭКО методом выбора при лечении бесплодия у пациентов, перенесших туберкулез.
Приводятся данные о неэффективной двукратной реконструктивно-восстановительной операции на семявыносящем протоке при его стриктуре, развившейся после перенесенного мочеполового туберкулеза, и последующем эффективном лечении обтурационного бесплодия методом ЭКО у этого же пациента. Эффективность ЭКО при туберкулезе семявыносящего протока, осложненного обтурационным бесплодием, подтверждают и другие наблюдения [Briceno Mayz O., 2000].
Среди этиологических факторов обтурационной аспермии наиболее распространенными являются туберкулез придатка яичка (34%) и сперматоцеле (32%). 30% пациентов имеют указание на перенесенный туберкулез легких в анамнезе. У мужчин, перенесших туберкулез, в 5 раз чаще диагностируется двусторонняя обструкция семявыносящих протоков, чем в группе не инфицированных туберкулезом [Paick J., 2000].
Таким образом, роль мочеполового туберкулеза в развитии бесплодия у мужчин несомненна, более того, проблемы с фертильностью иногда могут быть первым признаком туберкулезного поражения мужских половых органов.
Некоторые исследователи отмечают улучшение параметров спермограммы на фоне противотуберкулезного лечения. Степанов П.И. [1990] полагал, что лимфотропный способ введения противотуберкулезных химиопрепаратов не только более эффективен по сравнению с пероральным и парентеральным введением, но и способствует сохранению фертильности пациентов. Напротив, по мнению других не наблюдается положительных изменений в эякуляте после проведения курса противотуберкулезной полихимиотерапии. Так, было отмечено улучшение параметров сперматогенеза лишь у 25% пациентов без клинических проявлений туберкулеза, у всех остальных выявлена олигои астенозооспермия [Jimenez-Cruz J.F., 1979].
Еще одной проблемой во фтизиатрической практике является токсическое влияние противотуберкулезных препаратов на организм больного, в том числе и на его репродуктивную систему.
Учитывая многократные рентгенологические исследования у больных туберкулезом, определенный интерес вызывает исследование Курило Л.Ф. с соавт. (2006), в котором было доказано, что относительно малые и средние дозы ионизирующей радиации (0,5-2 Гр) способны вызывать нарушение сперматогенеза не только в ранние (через 1 месяц), но и в поздние сроки (через 1 год и более).
Таким образом, изучение состояния репродуктивного статуса у мужчин является важной и актуальной проблемой современной науки во всем мире. Роль туберкулеза в развитии бесплодия у мужчин несомненна, более того, проблемы с фертильностью иногда могут быть первым признаком туберкулезного поражения мужских половых органов. Клиники, занимающиеся лечением бесплодных пар, должны включить в алгоритм первичного обследования своих пациентов тесты, направленные на исключение туберкулеза. Раннее выявление и адекватная этиопатогенетическая терапия позволяют в половине случаев восстановить фертильность; при позднем выявлении прогноз в этом отношении неутешителен.
Нарушение сексуальной функции у мужчин, больных туберкулезом
Исследование эректильной функции больного туберкулезом обойдено вниманием, хотя эта составляющая половой жизни человека не менее важна, а в ряде случаев является определяющей в оценке качества жизни. Не следует считать эту проблему малозначимой: в Российской Федерации более полумиллиона человек больны туберкулезом, и около 80% из них – молодые мужчины. Совершенно очевидно, что их сексуальная функция неполноценна
Собственно токсическое влияние туберкулезной инфекции, как мы можем судить по художественной литературе, отнюдь не препятствуют сексуальной жизни пациентов. Напротив, интересная худоба, «демонический» блеск в глазах, пылающий румянец придавали определенный шарм чахоточному больному. Кроме того, в дореволюционной России чахотка считалась вполне «аристократическим» заболеванием, и болеть ею было не позорно, чахотку не скрывали, а иногда даже гордились ею. Совсем иная ситуация сейчас. Диагноз «туберкулез» ввергает пациента в стресс, поскольку очень часто означает крах карьеры, семейной жизни, потерю статуса и т.д. Любое заболевание человека следует рассматривать в системе личность – организм – среда, которая отражает теснейшую связь между субъективным переживанием индивидуумом стресса и сопротивляемостью организма. Аффективное перенапряжение, возникающее в результате дезадаптивного стиля отношений между индивидуумом и окружающими людьми и событиями, может выступать патогенным фактором развития психосоматического заболевания.
Клинической манифестации какоголибо туберкулезного поражения, как правило, предшествуют переживания различных жизненных ситуаций, которые патологически заостряют внутренние противоречия личности. Особенно патогенными являются затяжные тяжелые душевные страдания, связанные с переживанием чувства страха, негодования и злобы, недоверия и подозрительности, которые становятся привычными для человека, терпеливо переносятся им, но сопровождаются длительным изнуряющим психоэмоциональным напряжением в субъективно невыносимой для личности ситуации.
Было установлено, что значимым элементом системы отношений больных туберкулезом является враждебность к окружающим в виде повышенной подозрительности и обидчивости, а также чувства вины, раздражительности и негативизма.
Враждебность к другим людям у больных туберкулезом обусловлена высокой значимостью для них моральноэтических категорий и нетерпимостью к их нарушениям, что является особенностью интрапсихической перестройки больных в оценке происходящих событий и поведения людей.
Сформированная у больных туберкулезом враждебность способствует возникновению и длительному сохранению у них аффективного перенапряжения, способного нарушить вегетативный баланс в организме.
Разумеется, описанные выше психические нарушения, равно как и длительная изоляция от семьи, также не способствуют улучшению сексуальной жизни.
С целью определения нарушения сексуальной функции у мужчин, больных туберкулезом, нами проведено комплексное обследование 105 впервые выявленных больных туберкулезом легких и 37 добровольцев в возрасте от 18 до 39 лет. У 62 человек был диагностирован инфильтративный туберкулез легких (I группа), а у 43 – фиброзно-кавернозный туберкулез легких (II группа). Контрольную группу составили 37 условно здоровых добровольцев. Мы не случайно выбрали наиболее сексуально активный возраст обследованных, дабы исключить возможное влияние возрастных изменений на результаты. Средний возраст пациентов I и II групп составил 26,3±0,8 и 27,1±0,8 лет, соответственно. В контрольной группе – 24,9±0,9 лет. Разница между группами недостоверна. Всем пациентам проводили общеклиническое, пальцевое ректальное и трансректальное ультразвуковое исследование предстательной железы, микроскопическое исследование нативного мазка секрета простаты, спермограмму. Все пациенты и здоровые добровольцы отвечали на вопросы анкет «Шкала оценки мужской сексуальной функции» (шкала МСФ), и «Индекс симптомов хронического простатита» (NIH-CPSI). Обследование пациентов осуществляли при поступлении, через 3 и 6 месяцев наблюдения.
Исходно обнаружены более выраженные клинические и лабораторные симптомы интоксикации у больных фиброзно-кавернозным туберкулезом легких в сравнении с пациентами I группы. Чаще в этой группе выявляли и повышение числа лейкоцитов в секрете простаты и эякуляте, снижение числа сперматозоидов и их подвижности. По результатам анкетирования у больных обеих групп констатировано значительное нарушение всех составляющих полового акта и индекса качества жизни. Суммарные баллы по Шкале МСФ в I, II и контрольной группах составили 24,7, 37,2 и 48,3 соответственно (p<0,0001, рис. 4).
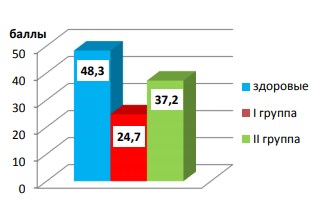
Рис. 4. Исходная оценка половой функции
Наиболее глубокое угнетение половой функции отмечено у пациентов I группы, недавно заболевших туберкулезом. У них более выражена интоксикация, сильнее стресс. У больных II группы уже включились адаптивные возможности, заболевание приобрело хроническое течение, и организм ответил относительным восстановлением сексуальных функций.
Наиболее сильные корреляции отмечены между снижением суммарного балла по Шкале МСФ и выраженностью интоксикационного синдрома (лейкоцитоз, гипертермия, астенические проявления: критерий Пирсона / p = -0,391/0,002; -0,332/0,008; -0,317/0,01 соответственно). Достоверных зависимостей между нарушением сексуальной функции и наличием воспалительных изменений в секрете простаты и эякуляте, снижением количества лецитиновых зерен и подвижных форм сперматозоидов у больных туберкулезом не зафиксировано. Вероятно, эти изменения носят вторичный характер на фоне общего интоксикационного синдрома и значительного снижения половой активности в период болезни. Напротив, в группе здоровых добровольцев, именно эти изменения имеют четкие корреляции с нарушением сексуальной функции по данным анкетирования.
А.П. Чехов, близко знакомый с туберкулезом не только как врач, но и как пациент, писал: «Чахоточный больной красив, потлив и похотлив». Вопреки этому утверждению классика русской литературы, современные больные туберкулезом легких отмечают снижение полового влечения, причем более выражено – хронически, длительно болеющие фиброзно-кавернозным туберкулезом легких (рис. 5).
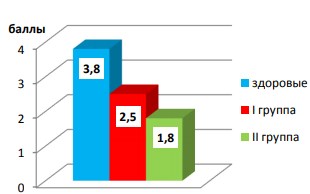

Рис. 5. Оценка полового влечения
Обращает на себя внимание выраженное снижение частоты спонтанных эрекций в группах больных туберкулезом в сравнение со здоровыми лицами (рис. 6).
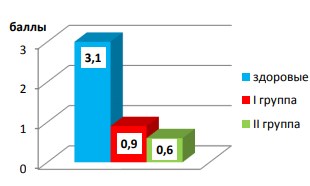
Рис. 6. Частота спонтанных эрекций (в баллах) до начала лечения
Снижение этого показателя было менее выражено в I группе больных. Возможно, это является следствием изменения нейрогуморального статуса пациентов, обусловленного специфической интоксикацией и стрессом. Доказано, что гормональный статус больных туберкулезом характеризуется подавлением продукции дигидроэпиандростерона-сульфата и повышением сывороточных концентраций аденокортикотропного гормона и кортизола.
Сказанное выше логично объясняет то, что в группах больных наиболее выраженными были различия в характеристике нейрогуморальной, психической, и эректильной функций. В то же время оценка эякуляторной составляющей у больных инфильтративным туберкулезом легких не имела достоверных различий в сравнении с контрольной группой (p=0,07).
Субъективная оценка наличия и давности сексуальных расстройств в обеих группах больных туберкулезом не имела достоверных различий, но значимо отличалась от результатов здоровых испытуемых (3,6; 3,8; 4,5 соответственно). В целом группу больных фибрознокавернозным туберкулезом характеризовало значительно более глубокое нарушение всех компонентов сексуальных функции по сравнению с группой больных инфильтративным туберкулезом.
В процессе лечения происходило улучшение общего состояния пациентов I и II групп, купирование или снижение симптомов интоксикации, улучшение показателей крови, секрета предстательной железы и эякулята. Однако в группе больных фиброзно-кавернозным туберкулезом легких положительные тенденции замедленны – как в отношении основного заболевания, так и по сексуальной функции. На фоне противотуберкулезной терапии отмечалось восстановление либидо, более выраженное у больных I группы, чем у хронически больных II группы (рис. 7).
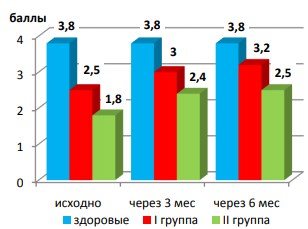
Рис. 7. Динамика полового влечения
Мы также отметили улучшение эректильной функции по совокупной оценке ответов на II, III и IV вопросы Шкалы у всех больных туберкулезом легких, однако ни в одной группе оно не достигло параметров здоровых мужчин (рис. 8).
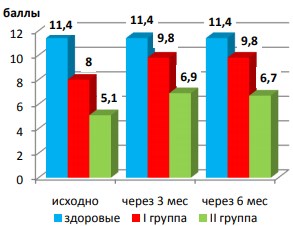
Рис. 8. Динамика эректильной функции (II+III+IV по шкале МСФ)
В группе больных инфильтративным туберкулезом наиболее значимые изменения происходили в первые 3 месяца терапии: отмечено достоверное нарастание частоты спонтанных эрекций (средний балл оценки – 2,1), повышение либидо и половой активности, субъективной оценки качества половой жизни. В последующие 3 месяца терапии по результатам анкетирования не происходило значимых изменений. Через 6 месяцев лечения у пациентов I группы, несмотря на положительные тенденции, сохранялись значимые различия в субъективной оценке нейроэндокринной, психической, эректильной составляющих полового акта, а также в оценке качества половой активности в сравнении с контролем. В группе больных фиброзно-кавернозным туберкулезом наибольшие положительные изменения также происходили в первые три месяца терапии.
Однако, несмотря на то, что через три месяца зафиксировано достоверное нарастание либидо, частоты спонтанных эрекций, эмоционального настроя и половой активности, субъективные оценки по всем оцениваемым параметрам были ниже контрольных с высокой степенью вероятности (p<0,0001). Через 6 месяцев лечения нарастания положительных тенденций не отмечено. Напротив, по некоторым критериям (частота спонтанных эрекций, доля удачных попыток полового акта, интенсивность оргазма) отмечено снижение суммы баллов.
К моменту обнаружения туберкулеза лишь 7,6% опрошенных мужчин считали свою половую потенцию отличной и 16,2% колебались между «хорошо» и «отлично». 25,7% расценивали свой сексуальный потенциал как хороший, 40% – удовлетворительный, 8,6% – неудовлетворительный, а 1,9% отрицали у себя его наличие вообще. 23,8% мужчин были полностью сексуально удовлетворены, 25,7% отмечали незначительное расстройство половой функции, а у 50,5% нарушения были значительными, причем только у 10,5% эти изменения наблюдались в течение длительного времени, а у 40% пациентов – развились в последние годы, непосредственно перед тем, как у них был выявлен туберкулез.
Ежесуточное и почти ежесуточное желание иметь половое сношение отмечали 10,4% мужчин, 2-3 раза в неделю считали достаточным 41%, 3-4 раза – 10,5% пациентов. Треть опрошенных (33,3%) ограничивались одним соитием в неделю, а у 4,8% такого стремления не было вовсе.
Несмотря на молодой возраст, частота спонтанных эрекций была удручающе низка: у 29,5% они возникали не более нескольких раз в месяц, а 57,1% не отмечали их вообще. Вместе с тем 63,8% были убеждены в своей способности совершить повторное половое сношение в течение суток, а 80,9% перед началом полового акта чувствовали себя вполне уверенно. Однако менее чем у половины мужчин (47,7%) все или почти все попытки были удачными, что косвенно свидетельствует о завышенной самооценке у многих пациентов.
Эрекцию, достаточную для сношения, отметили 80% пациентов, причем 39,1% могли регулировать продолжительность полового акта, у 20,9% – он составлял от 3 до 6 минут, а 30,5% испытывали затруднение с эякуляцией. В то же время 9,5% мужчин семяизвержения добиться не смогли. Из тех, кто успешно завершил половой акт, интенсивность семяизвержения была высокой у 33,3% и у 39,1% – умеренной. Интенсивный оргазм в итоге имели 38,1%, умеренно-интенсивный – 30,5%, а у 1,9% мужчин он отсутствовал или наступал не при каждом семяизвержении (13,3%).
К окончанию шестимесячного курса лечения у больных туберкулезом наблюдалась положительная динамика со стороны половой функции. Количество желающих иметь ежесуточный или почти ежесуточный секс увеличилось до 24,1%, частота спонтанных эрекций от ежесуточных до 4-5 раз в неделю возросла до 29,9%. Считали себя способными на повторный половой акт 80,4% мужчин, и 64,4% добивались в этом успеха.
Эректильная функция практически восстановилась: 93,2% мужчин не нуждались в дополнительной стимуляции, и лишь 3,4% больных эрекции не достигли ни разу. Более половины пациентов (57,4%) эякулировали в желаемое время, число не имевших семяизвержения сократилось втрое, но остальные по-прежнему отмечали затрудненную эякуляцию.
Качество эякуляции также улучшилось: у 51,8% она была интенсивной, а еще у 3,4% крайне интенсивной. Ни один пациент не жаловался на отсутствие семяизвержения.
Значительно возросла самооценка половой функции в целом. На «отлично» и «хорошо-отлично» ее оценивали соответственно 19,5% и 24,2%, «хорошо» поставили себе 28,7% мужчин и «удовлетворительно» – 23,0%.
Не стало больных, которые не имели бы половой жизни вовсе, и к числу тех, кто оценивал ее как неудовлетворительную, сократилось вдвое.
Мы сочли необходимым ввести группу контрольных мужчин, проживающих в тех же неблагоприятных условиях: низкая температура, плохие материально-бытовые условия, отсутствие сбалансированного питания и витаминов, эпидемическая напряженность. Тем не менее, в группе условно здоровых мужчин, сопоставимой по возрасту и среде обитания, были существенно более высокие показатели. Так, на «отлично», «хорошо-отлично» и «хорошо» свою половую потенцию оценивали соответственно 46,0%, 37,8% и 10,8%; 5,4% ограничились оценкой «удовлетворительно». Достаточную эрекцию отмечали 100% мужчин; лишь 8,1% встретились с затруднением в достижении эякуляции.
Таким образом, больные туберкулезом легких, несмотря на отсутствие каких бы то ни было сопутствующих заболеваний органов мочеполовой системы, демонстрируют ухудшение всех параметров полового акта – от влечения до оргазма. Степень нарушений существенно выше в группе больных фиброзно-кавернозным туберкулезом легких и коррелирует с высокой степенью вероятности с выраженностью интоксикационного синдрома. Снижение частоты спонтанных эрекций является наиболее характерным симптомом и одинаково выражено в обеих группах.
Хотя адекватная полихимиотерапия, купируя системный воспалительный процесс и снижая интоксикацию, позволяет улучшить сексуальную функцию, больных туберкулезом легких, и через 6 месяцев лечения сохраняются выраженные различия в субъективной оценке половых функций в обеих группах в сравнении с контролем.
Полученные данные подтверждают гипотезу, что эректильная дисфункция – не самостоятельное заболевание, а отражение общего нездоровья организма.
Проблема поддержания качества жизни человека на достойном уровне является одной из задач современной медицины. A priori очевидно, что качество жизни больного туберкулезом невысоко. Помимо переживаний по поводу причиняющего значительные страдания и потенциального смертельно опасного заболевания, пациент испытывает моральный дискомфорт, поскольку отчасти ощущает себя изгоем, надолго вынужден отрываться от семьи, возможны проблемы с работой. Разумеется, сексуальные дисфункции вносят свою лепту в копилку душевных страданий больного туберкулезом. Сохранение/восстановление фертильности актуально не для всех пациентов, понятие «сексуальная дисфункция» значительно шире, и включает в себя также эректильную дисфункцию, нарушение эякуляции и т.д. Было показано, что в разных регионах Российской Федерации около 30% молодых мужчин имеют нарушение семяизвержения – как ускоренный, так и замедленный вариант [Кульчавеня Е.В. с соавт., 2011]. Мы поставили цель изучить частоту нарушений эякуляции у больных туберкулезом мужчин и определить влияние противотуберкулезной терапии на процесс семяизвержения.
В исследование были включены 98 мужчин, больных туберкулезом органов дыхания. У всех оценивалось субъективное восприятие наступления семяизвержения ретроспективно, до заболевания туберкулезом, и через три месяца после начала полихимиотерапии. Критерии включения в исследование были следующие: мужчины, больные туберкулезом органов дыхания, возраст от 18 до 60 лет, регулярная половая жизнь, гетеросексуальность, интеллектуальный уровень и образование, достаточные для понимания проблемы сексуальной функции и дисфункции.
Критериями исключения являлись все состояния, которые могли так или иначе повлиять на субъект изучения: наличие осложнений основного заболевания, препятствующих полноценной половой жизни, интеркуррентные заболевания эндокринной и сердечно-сосудистой системы в стадии субили декомпенсации, артериальная гипертензия, требующая постоянного приема гипотензивных препаратов, психические заболевания, заболевания, передаваемые половым путем, аномалии развития половых органов, сопутствующие урологические заболевания, заболевания центральной и периферической нервной системы, низкий уровень общего развития, социальная дезадаптация, нахождение ранее в местах лишения свободы.
Средний возраст изучаемой когорты мужчин, больных туберкулезом, составил на момент включения в исследование 34,7±4,9 лет (колебания от 22 до 60 лет). Все пациенты были впервые выявлены, социально благополучны, женаты или имели постоянную половую партнершу. У 36 было высшее образование, у 39 – среднее специальное, у остальных 23-х – среднее. Все были трудоустроены. На момент госпитализации у 18 был диагностирован очаговый туберкулез легких, у 47 – инфильтративный туберкулез легких, у 8 – кавернозный и у 25 – фиброзно-кавернозный туберкулез легких. Бактериовыделение обнаружено методом посева у 41-го пациента (41,8%), причем в 5-и случаях имела место поливалентная резистентность возбудителя, а в двух – множественная лекарственная устойчивость. Лечение проводилось согласно приказу Министерства здравоохранения Российской Федерации № 109 от 21.03.2003 г. «О совершенствовании противотуберкулезных мероприятий в Российской Федерации», режим выбирался в зависимости от диагноза. У всех пациентов переносимость препаратов была удовлетворительная, сколько-нибудь значимых побочных реакций не отмечено.
Выявленные сопутствующие заболевания (миопия средней степени – 6 больных, хронический бескаменный холецистит – 12 больных, атопический дерматит – 9, хронический геморрой – 5, полиартрит – 4 пациента) не могли оказать влияния на качество полового акта.
Исходно только у четырнадцати пациентов (14,3%) из 98-и имелись нарушения скорости семяизвержения: у десятерых (10,2%) была преждевременная эякуляция (ПЭ), а у четверых (4,1%) пациентов старшего возраста – затрудненная эякуляция (ЗЭ). Остальные 84 пациента (85,7%) каких-либо отклонений по этому параметру не отмечали. В проведенном нами ранее исследовании по изучению структуры нарушений эякуляции в России ПЭ встречалась у 33,5% жителей Сибири и у 43,6% жителей южных регионов; затрудненное семяизвержение – соответственно в 16,9% и 6,1% [Кульчавеня Е.В. с соавт., 2011]. В когорте изучаемых пациентов частота нарушения эякуляции была меньше, чем в популяции сибиряков, сопоставление представлено на рисунке 9.
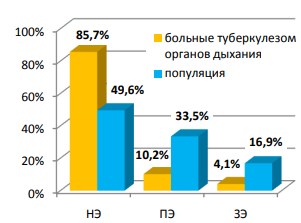
Рис. 9. Сопоставление структуры нарушений эякуляции в популяции сибиряков и больных туберкулезом изучаемой когорты НЭ – нормальная эякуляция, ПЭ – преждевременная эякуляция, ЗЭ – затрудненная эякуляция
В настоящую разработку взяты жители холодных областей России (Сибирский, Дальневосточный и СевероЗападный федеральные округа), поэтому данные по южным областям мы опустили, чтобы не затруднять восприятие. Полученная пропорция объясняется более строгим подходом к выборке – мы заранее исключили многие факторы, нарушающие процесс семяизвержения, чтобы беспристрастно оценить влияние полихимиотерапии на эякуляцию.
Через три месяца стандартной полихимиотерапии, определенной приказом Минздравсоцразвития № 109 от 2003 года, ситуация претерпела отрицательные изменения. Доля мужчин с нормальной эякуляцией снизилась до 61,2% (60 пациентов), напротив, частота преждевременной эякуляции возросла вдвое (20 больных), а затрудненной – в 4,5 раза (18 пациентов). Результаты показаны на рисунке 10.
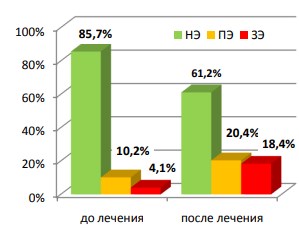
Рис. 10. Изменение структуры нарушений эякуляции на фоне полихимиотерапии (n=98) НЭ – нормальная эякуляция, ПЭ – преждевременная эякуляция, ЗЭ – затрудненная эякуляция
Как следует из диаграммы, прием противотуберкулезных препаратов вызывает преимущественно затрудненную эякуляцию, что является косвенным подтверждением их нейротоксичности.
Оргазм и эякуляция связаны с сокращением яичек, придатков, семявыносящих протоков, семенных пузырьков, простаты, уретры, пениса и анального сфинктера с одновременным пиком подъема давления, усиления сердечного выброса и дыхания. Конечный результат этой фазы – эмиссия и экспульсия семенной жидкости. Во время эмиссии происходят перистальтические сокращения придатков и vas deferens, сокращение семенных пузырьков, простаты и шейки мочевого пузыря, продвижение спермиев и семенной/простатической жидкости в заднюю уретру. Экспульсия означает ритмичные сокращения m. bulbospongiosus, закрытие шейки мочевого пузыря и расслабление наружного сфинктера, уретры, и – выброс семени. Таким образом, эякуляция представляет собой нейромышечный акт, и для полноценного осуществления этого физиологического процесса необходима здоровая нервная система – как центральная, так и периферическая.
К нарушениям эякуляции относят следующие патологические виды семяизвержения: преждевременная эякуляция (ПЭ), затрудненная эякуляция (ЗЭ), ретроградная эякуляция (РЭ), отсутствие эякуляции, или анэякуляция, снижение интенсивности и объема, уменьшение чувствительности.
Наиболее частым, но до сих пор до конца непознанным нарушением семяизвержения, является ПЭ. На согласительной комиссии Международного научного общества сексуальной медицины в 2007 году в Брюсселе было принято следующее определение ПЭ. Преждевременная эякуляция – это мужская сексуальная дисфункция, характеризующаяся эякуляцией, которая всегда или почти всегда наступает в течение одной минуты после пенетрации, при невозможности задержать ее всегда или почти всегда, если это негативно влияет на взаимоотношения партнеров, вызывает стресс, фрустрацию и нарушает интимность. Причинами вторичной ПЭ являются некоторые урологические и эндокринные заболевания, а также неврологические нарушения.
В России ежегодно заболевает туберкулезом около 120000 людей, и не менее двух третей из них – мужчины, как правило, молодые, для которых полноценный половой акт является важной составляющей качества жизни. Туберкулез сам по себе является негативным фактором; необходимость длительного приема нейротоксичных препаратов увеличивает вероятность развития сексуальных дисфункций. Безусловно, у больного туберкулезом присутствуют и другие причины для половых расстройств – интоксикация, хронический стресс, изоляция. Однако все эти факторы потенциально могут спровоцировать временную ПЭ, а у пациентов в нашем исследовании многократно возросла частота ЗЭ. Мы полагаем, что пропорция нарушений эякуляции у больных туберкулезом обусловлена именно длительным медикаментозным лечением, поскольку нейротоксичные противотуберкулезные препараты (к которым относятся изониазид, циклосерин, фторхинолоны, этионамид и протионамид) нарушают эякуляторный рефлекс, и время наступления семяизвержения затягивается.
Таким образом, согласно полученным результатам, у подавляющего большинства мужчин, больных туберкулезом, до начала противотуберкулезного лечения не отмечалось нарушений эякуляции. Через три месяца стандартной полихимиотерапии частота нормального семяизвержения снизилась с 85,7% до 61,2%. Напротив, частота преждевременной эякуляции увеличилась с 10,2% до 20,4%, а затрудненного семяизвержения – с 4,1% до 18,4%. Структура нарушений эякуляции на фоне полихимиотерапии несомненно свидетельствует о специфическом неблагоприятном эффекте противотуберкулезных препаратов.
Оптимизация этиопатогенетичекой терапии больных туберкулезом предстательной железы
Всемирная организация здравоохранения настойчиво предлагает применять для лечения больных туберкулезом стратегию DOTS – Directly Observed Treatment, Short-course, полагая, что это позволит излечить 90% больных (TB Advocacy, a practical guide 1999, WHO Global Tuberculosis Programme). В Российской Федерации этиотропная терапия больных туберкулезом мочевой системы проводится по основным принципам лечения туберкулеза, отраженным в приказе МЗ РФ №109 от 21.03.2003 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации». Однако в отношении больных внелегочным туберкулезом предлагаются усредненные схемы, включающие этамбутол и стрептомицин, однотипные для больного туберкулезом глаз и туберкулезом кишечника, туберкулезом позвоночника и туберкулезом кожи, туберкулезом мочеполовой системы и туберкулезом лимфоузлов и т.д. Совершенно очевидно, что многообразие форм внелегочного туберкулеза требует не менее многообразного подхода к выбору терапии, ибо «лечим мы не болезнь, но больного».
Поэтому при осложненном уротуберкулезе с поражением мочевого пузыря и предстательной железы следует руководствоваться «Инструкцией по химиотерапии больных туберкулезом», которая указывает, что содержание лечения определяется стандартами, в пределах которых проводят индивидуализацию лечебной тактики с учетом особенностей динамики заболевания, лекарственной чувствительности возбудителя, фармакокинетики применяемых препаратов и их взаимодействия, переносимости препаратов и наличия фоновых и сопутствующих заболеваний. Эта Инструкция приведена в пункте 4 приложения № 6 приказа № 109.
Выделяют основные противотуберкулезные препараты: изониазид (H), рифампицин (R), пиразинамид (Z), этамбутол (E), стрептомицин (S); и резервные: протионамид (Pt) / этионамид (Et), канамицин (K), амикацин (A), капреомицин (Cap), циклосерин (Cs), рифабутин (Rb), ПАСК (PAS), фторхинолоны (Fq).
Курс химиотерапии подразделяется на интенсивную фазу, направленную на ликвидацию клинических проявлений заболевания, максимальное воздействие на популяцию МБТ, и фазу продолжения, цель которой – подавление сохраняющейся микобактериальной популяции, дальнейшее уменьшение воспалительных изменений и инволюция туберкулезного процесса, а также восстановление функциональных возможностей больного. Стандартные режимы химиотерапии представлены в таблице.
Таблица. Стандартные режимы химиотерапии
| Режим | Фаза курса химиотерапии | |
| интенсивная | продолжения | |
| I | 2 H R Z E / S* | 6 H R / 6 H3 R3 |
| II-a | 2 H R Z E S + 1 H R Z E | 5 H R E / 5 H3 R3 E3 |
| II-б | 3 H R Z E [Pt] [Cap] / [K] [Fq] | В соответствии с режимами I, II-a или IV в зависимости от лекарственной чувствительности МБТ |
| III | 2 H R Z E | 4 H R / 4 H3 R3 6 H E |
| IV | Минимум 5 препаратов, к которым сохранена чувствительность [Z E Pt Cap / K Fq] [Rb] [Cs] [PAS] Длительность фазы не менее 6 мес. | Минимум 3 препарата, к которым сохранена чувствительность [E Pt Fq] [Rb] [Cs] [PAS] Длительность фазы не менее 12 мес. |
цифра перед сокращенным названием препарата означает продолжительность терапии в месяцах; возможность интермиттирующего приема обозначена как «H3 R3» (например, H3 R3 означает, что изониазид и рифампицин вводят три раза в неделю).
I режим назначают впервые выявленным больным с бактериовыделением и/или распространенным либо осложненным поражением различных органов.
II-а режим назначают при повторном курсе химиотерапии после перерыва в лечении или по поводу рецидива при невысоком риске лекарственной устойчивости МБТ.
II-б режим назначают пациентам с высоким риском лекарственной устойчивости МБТ до получения результатов микробиологического исследования.
III режим предназначен впервые выявленным больным без бактериовыделения с малыми (ограниченными) и неосложненными формами туберкулеза.
IV режим назначают больным, выделяющим МБТ с множественной лекарственной устойчивостью (по крайней мере к изониазиду и рифампицину одновременно).
Особо трудную задачу представляет собой проблема лечения больных туберкулезом предстательной железы. Анатомо-функциональные свойства простаты препятствуют проникновению в нее большого ряда антибиотиков и химиопрепаратов, поэтому, во-первых, необходимо усиление этиотропной терапии, а во-вторых, одновременное применение патогенетического лечения. Стандартная полихимиотерапия (рифампицин + изониазид + пиразинамид + стрептомицин) приводит к клиническому выздоровлению лишь в 22,8% случаев, а у 77,2% пациентов заболевание приобретает хронический характер с непрерывно рецидивирующим течением.
С целью усиления эффективности противотуберкулезной терапии предложено включение в схему фторхинолонов. Однако здесь также следует подходить к выбору препарата осторожно. Так, ломефлоксацин имеет удовлетворительную проницаемость в предстательную железу, но является антагонистом рифампицина – основного противотуберкулезного препарата. Напротив, моксифлоксацин хорошо сочетается со всеми противотуберкулезными антибиотиками и химиопрепаратами, но имеет низкую степень проникновения в предстательную железу [Падейская Е.Н., Яковлев В.П., 1998].
Оптимальным в отношении туберкулеза простаты следует считать офлоксацин и левофлоксацин. Они имеют не только хорошую сочетаемость с противотуберкулезными препаратами, но также оказывают легкое синэргическое действие в отношении изониазида – препарата первой линии в лечении больных туберкулезом. ПАСК – ПараАмино Салициловая Кислота, будучи по своей природе салицилатом – помимо туберкулостатического обладает антипростагландиновым эффектом и снижает интенсивность воспаления в ткани предстательной железы, поэтому применение этого туберкулостатика в лечении больных туберкулезом простаты показано.
Таким образом, в интенсивной фазе полихимиотерапии рекомендуется схема: изониазид + рифампицин + пиразинамид + офлоксацин/левофлоксацин + ПАСК, с исключением через месяц фторхинолонов. Через 4 месяца в фазе продолжения следует оставить изониазид + рифампицин, длительность этой фазы должна составлять не менее 4-6 месяцев. Оптимальным является парентеральное (внутривенно капельно) введение основных препаратов, что обеспечивает полную контролируемость лечения, улучшает его переносимость, позволяет избежать негативного влияния на желудочно-кишечный тракт и обеспечивает более высокую концентрацию препаратов в очаге поражения.
Туберкулез предстательной железы является показанием к назначению патогенетических препаратов, наиболее хорошо изученными среди которых являются ректальные суппозитории витапрост, афала, простанорм, канефрон.
Действующее вещество витапроста – сампрост – комплекс водорастворимых биологически активных пептидов, выделенных из предстательной железы половозрелых бычков; относится к новому классу биологических регуляторов – цитомединам. Применение витапроста в ректальных суппозиториях позволяет доставить действующее вещество непосредственно к больному органу по лимфатическим путям. Витапрост уменьшает отечность предстательной железы и лейкоцитарную инфильтрацию интерстициальной ткани простаты, кроме того, способствует снижению тромбообразования и обладает антиагрегационной активностью (Борисенко К.К. с соавт., 1991; Ткачук В.Н. с соавт., 1991, 2005, 2007). Витапрост следует назначать больным туберкулезом предстательной железы по одному суппозиторию в прямую кишку в течение одного месяца, одновременно с началом полихимиотерапии. Через три месяца после завершения первого курса назначается поддерживающая терапия, также продолжительностью 1 месяц.
Хорошо зарекомендовала себя принципиально новая, не имеющая аналогов разработка отечественной компании «Материа Медика» – афинно очищенные антитела к простатоспецифическому антигену (ПСА) – афала. ПСА, широко известный маркер онкозаболеваний предстательной железы, вырабатывается секреторным эпителием простаты и обеспечивает «разжижение» эякулята. ПСА относится к классу протеаз с химотрипсиноподобной энзиматической активностью. Бóльшая часть ПСА поступает в эякулят, разжижая его, однако 0,1% простатоспецифического антигена абсорбируется через базальную мембрану и проникает в кровь, где часть молекул связывается с белками, образуя так называемый связанный ПСА.
Причинами повышения уровня ПСА в крови, помимо рака простаты, могут быть также острый или хронический простатит, доброкачественная гиперплазия предстательной железы, ишемия или инфаркт предстательной железы и эякуляция накануне исследования.
Повышение ПСА при простатите (в том числе туберкулезной этиологии) наступает вследствие нарушения барьерной функции простатических эпителиальных клеток, их базальной мембраны, базальной мембраны и эндотелия кровеносных сосудов. Формируется порочный круг: активное воспаление (острое или хроническое в стадии обострения) нарушает целостность и проницаемость простатического эпителия, способствует выходу ПСА – высокоактивного протеолитического фермента – в окружающие ткани, таким образом еще больше усиливая воспаление, что, в свою очередь, ведет к повышению проницаемости сосудистой стенки и выводных протоков предстательной железы. Афала оказывает нормализующее действие на эпителий простаты, что обеспечивает ее эффективность в комплексном лечении больных как туберкулезом предстательной железы, так и хроническим неспецифическим простатитом.
При туберкулезе простаты следует назначать афалу по 1 таблетке 4 раза в день сублингвально до полного рассасывания. Курс лечения – 2 месяца, через 2 месяца – поддерживающий курс по 1 таблетке дважды в день сублингвально в течение 30 дней.
Больным туберкулезом предстательной железы в стадии стабилизации процесса (через 3-4 месяца интенсивной фазы химиотерапии) показана адаптационная терапия. Оптимальным выбором является отечественный фитопрепарат простанорм – экстракт травы зверобоя, травы золотарника канадского, корня солодки, корневищ и корня эхинацеи. Простанорм оказывает иммуномодулирующий, противовоспалительный и антибактериальный эффект, нивелирует побочное действие химиопрепаратов на репродуктивную систему больного пациента.
Туберкулезный процесс закономерно вызывает интоксикацию организма в той или иной степени. Больной туберкулезом получает одновременно не менее четырех препаратов, что дает дополнительную нагрузку на организм. Поэтому необходимо патогенетическое воздействие, направленное на ускоренную элиминацию продуктов метаболизма, улучшение микроциркуляции, купирование воспаления в мочевой системе и восстановление локальной иммунорезистентности уротелия. Этими свойствами в полной мере располагает растительный препарат Канефрон H. Канефрон – комбинированный фитопрепарат. В его состав входят трава золототысячника (herba Centaurii), обладающая диуретическим и антибактериальным действиями; корень любистока (radix Levistici), оказывающий диуретический, спазмолитический, а также антибактериальный эффект, и листья розмарина (folia Rosmarini), которые содержат розмариновую кислоту, эфирные масла и флавоноиды. Вследствие действия розмариновой кислоты угнетается высвобождение медиаторов воспаления, что обусловливает стойкий противовоспалительный эффект. Входящие в состав препарата компоненты оказывают выраженное антисептическое, спазмолитическое, противовоспалительное действие на мочеполовой тракт, уменьшают проницаемость капилляров почек, обладают диуретическим эффектом, улучшают функцию почек.
При одновременном применении с антибиотиками (норфлоксацин, офлоксацин, пефлоксацин, ципрофлоксацин, амоксициллин/клавуланат) канефрон потенцирует их действие [Неймарк А.И., 2008; Перепанова Т.С., 2008].
При назначении лечения больному туберкулезом мочеполовой системы следует учитывать индивидуальные особенности пациента, наличие осложнений и сопутствующих заболеваний. Спектр возможностей современной этиопатогенетической терапии весьма широк, и адекватное лечение позволяет добиться успеха даже у наиболее сложной категории пациентов, страдающих туберкулезом предстательной железы.
Приведу также несколько примеров ошибочной трактовки симптомов туберкулеза предстательной железы.
История 1. Пациент Б., 38 лет, житель Новосибирска. В анамнезе – беспорядочные половые связи, неоднократно лечился по поводу трихомониаза, гонореи, хламидиоза и уреаплазмоза. 2 года назад вступил в брак, ведет моногамный образ жизни, в семье растет ребенок. Когда после переохлаждения появилась боль при мочеиспускании, сильная боль в промежности, выделения из уретры, пациент отнес их на счет перенесенных ранее венерических заболеваний и попытался лечиться самостоятельно известными ему препаратами. Самолечение пользы не принесло; присоединилась лихорадка до 39°С с ознобами. Пациент был доставлен в урологический стационар, где выставили диагноз «абсцесс простаты» и назначили цефалоспорины, нитрофураны, дезинтоксикационную терапию. Учитывая неэффективность лечения, через 2 недели больной был консультирован в НИИ туберкулеза.
Объективно: правильного телосложения, достаточного питания. Состояние средней степени тяжести, t=37,8°С. Язык влажный, обложен сероватым налетом. Живот мягкий, умеренно болезненный над лоном. Печень, почки не пальпируются. Status genitalis: половые органы развиты по мужскому типу, яички в мошонке. Пальпаторно яички и их придатки не изменены. Per rectum: ампула свободна. Простата не увеличена, уплощена, поверхность бугристая, консистенция плотная. Бороздка не определяется. При надавливании – сильная болезненность, из уретры выделилось около 1 мл гноя.
На обзорной рентгенограмме органов грудной клетки патологических изменений нет. Анализ крови: лейкоцитоз, палочкоядерный сдвиг формулы нейтрофилов. Анализ мочи: в 1-й порции лейкоциты сплошь покрывают поля зрения, во 2-й – 25-30, в 3-й – 10-15 лейкоцитов. Методом люминесцентной микроскопии в секрете обнаружены микобактерии туберкулеза в большом количестве. На экскреторных урограммах признаков ретенции и деструкции в почках и верхних мочевых путях нет. При ретроградной уретропростатографии выявлена каверна предстательной железы (рис. 11).
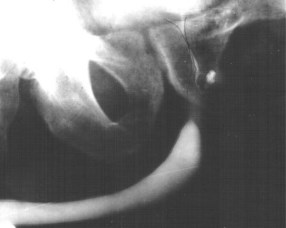
Рис. 11. Небольшая каверна предстательной железы
Больному был выставлен диагноз: туберкулез предстательной железы; назначена терапия с хорошим эффектом.
В этом случае относительно своевременное направление пациента к фтизиоурологу позволило установить диагноз мочеполового туберкулеза в стадии поражения только одного органа.
Следующую Историю 2 хотелось бы предварить цитатой: «Благими намерениями вымощена дорога в ад…». История эта произошла давно, сейчас иной подход к ведению больных с доброкачественной гиперплазией предстательной железы (ДГПЖ) – но она не потеряла своей поучительности.
54-летний мужчина М. переехал из Казахстана в Новосибирскую область и вскоре почувствовал недомогание, слабость, учащение мочеиспускания и ослабление струи мочи. Обратился в ЦРБ, где ему, в лучших традициях всеобщей диспансеризации, перед тем, как направить к урологу, выполняли флюорографию. И обнаружили диссеминированный туберкулез легких. А уролог пальпаторно определил увеличенную простату, что, вкупе с жалобами, было расценено как ДГПЖ. Больного хотели госпитализировать в противотуберкулезный стационар. Но в стационаре на тот момент мест не было; рекомендовали госпитализацию через 2 недели. Эти 2 недели он решил «подлечить свою аденому»
Обратился в урологический стационар, где все честно рассказал: мол, мигрант, без прописки, без денег, зато с активным туберкулезом легких. Понятное дело, с ним даже разговаривать не стали.
Обойдя несколько клиник, пациент поумнел и перестал делиться всей информацией, давил на жалость: бедный, несчастный, уже и задержки мочеиспускания были… И так набрел на доброго доктора, который его пожалел и велел прийти назавтра с тем, чтобы в этот же день сдать все анализы и тут же отправиться на операцию – эпицистомию, как первый этап.
Больной пришел рано утром, сдал все анализы, прошел флюорографию и был прооперирован. К обеду подоспели результаты. «Добрый доктор» схватился за голову: диссеминация в легких по типу «звездного неба»! Больной был с пристрастием допрошен, во всем сознался и, поскольку как раз подошел срок госпитализации в противотуберкулезный стационар, благополучно был переведен туда с цистостомой.
Позвольте напомнить Вам, уважаемый читатель, что туберкулез склонен к заживлению через рубец. При туберкулезе легких это благоприятный исход, а при туберкулезе мочеполовой системы – нет, поскольку мы получаем «желательное рубцевание в нежелательном месте». Избыточное склерозирование нарушает уродинамику со всеми вытекающими последствиями. Особенно быстро процесс рубцевания происходит в мочевом пузыре – возможно развитие микроцистиса после нескольких дней дренирования постоянным катетером мочевого пузыря в состоянии активного туберкулезного воспаления.
А тут – цистостома!
Пока фтизиатры разобрались, что к чему, пока начали полихимиотерапию, пока вызвали на консультацию фтизиоуролога – процесс был упущен. У больного наступила практически полная облитерация мочевого пузыря (рис. 12)
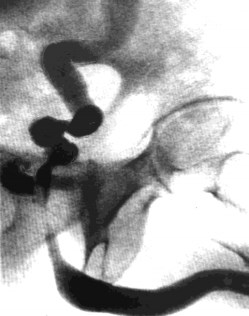
Рис. 12. Облитерация мочевого пузыря (туберкулезный микроцистис, рефлюкс, гигантская каверна предстательной железы, симулировавшая ДГПЖ)
И это не единичный случай. Доброкачественная гиперплазия предстательной железы – излюбленная маска туберкулеза простаты у пожилого мужчин; нередко наблюдается и сочетание этих заболеваний. Вот история 3 больного С. В течение 2-х лет – транзиторная дизурия, к врачам не обращался. В 2003 г. – учащенное мочеиспускание с резью, ослабление струи мочи стало постоянным. Урологом выставлен диагноз ДГПЖ, предложена трансуретральная резекция. Обследование свели к минимуму; несмотря на пиурию, экскреторную урографию не выполняли. Произвели ТУРП.
В послеоперационном периоде дизурия, пиурия и гематурия сохранялись. Несмотря на это, больного стандартно выписали на 7-й день, не дожидаясь патоморфологического заключения (счастье С., что это исследование вообще выполнили!). Амбулаторно проводилась терапия фторхинолонами в течение 2-х месяцев без какого-либо эффекта. И тут (второй удачный для пациента момент) доктор, наблюдавший С., поступает к нам на кафедру туберкулеза факультета повышения квалификации НГМА на цикл «Дифференциальная диагностика туберкулеза мочеполовой системы». После первой же лекции страшное подозрение закрадывается в его душу, он срочно поднимает из архива стекла с микропрепаратами операционного материала и с ужасом убеждается, что у С. – туберкулез!! Дополнительное обследование, проведенное в НИИТ, выявило также кавернозный туберкулез правой почки с обызвествлением. Вскоре был получен рост МБТ – мультирезистентной, как и следовало ожидать после такой нерациональной терапии.
В стандартный комплекс обследования больного с заболеванием предстательной железы входит ТРУЗИ, в показанных случаях дополненное допплерографией. К сожалению, не только допплерография, но и банальное трансректальное ультразвуковое исследование предстательной железы выполняется не всегда. Вот, к примеру, история Н. 5 лет он наблюдался у уролога по поводу учащенного болезненного мочеиспускания, периодически отмечал макрогематурию. Однажды, еще при первичном приеме, проведя Н. ректальное исследование, врач обнаружил увеличенную простату, выставил диагноз «Доброкачественная гиперплазия» и назначил альфа-блокаторы. Какое-то облегчение они больному, вероятно, приносили, но, тем не менее, полностью симптомы не снимали. Поэтому с завидным постоянством, не реже 1 раза в месяц, Н. появлялся у своего уролога и просил помощи.
Только через 5 лет врач огорчился отсутствием эффекта от лечения настолько, что направил Н. на стационарное обследование. УЗИ простаты – каверны в обеих долях, УЗИ почек – множественные каверны в левой почке, экскреторные урограммы – нефункционирующая левая почка, посев мочи – сплошной рост МБТ. К счастью, чувствительной ко всем препаратам, так как больной антибактериального лечения не получал, принимал только альфаблокаторы.
Туберкулез предстательной железы диагностируют часто при целенаправленном поиске. Напротив, отсутствие знаний об этом, неоптимальная эмпирическая антибактериальная терапия с применением фторхинолонов, амикацина и, тем более, рифампицина, затрудняет своевременное распознавание этого потенциально летального заболевания и способствует росту устойчивости микобактерии туберкулеза.
Рекомендуемая литература
Грунд, Е.Д. Туберкулез почек. / Е.Д. Грунд // Москва. – Медицина, 1969. – 207 с.
Кульчавеня, Е.В. Трудности диагностики туберкулеза мочеполовой системы. / Е.В. Кульчавеня // – Новосибирск, 2004. – 103 с.
Кульчавеня, Е.В. Простатит. Диагностика и лечение: руководство / Е.В. Кульчавеня, А.И. Неймарк. // М.: ГЭОТАР-Медиа, 2010. – 256 с.
Кульчавеня, Е.В. Избранные вопросы фтизиоурологии / Е.В. Кульчавеня, В.А. Краснов. // Новосибирск: Наука, 2010. – 142 с.
Марион, Г. Руководство по урологии. / Г. Марион // Государственное медицинское издание Москва, Ленинград. – 1931. – 539 с.
Мочалова, Т.П. Туберкулез мочеполовой системы: руководство для врачей / под ред. Т.П. Мочаловой. // – М., 1993. – 254 с.
Abbara, A. Etiology and management of geniourinary tuberculosis. / A. Abbra, R.N. Davidson // Nat Rev Urol. – Vol.9, №8(12). – P678-688.
Barry, C.E.. The spectrum of latent tuberculosis: rethinking the biology and intervention strategies. / C.E. Barry, H.I. Boshoff, V. Dartois. // Nature Reviews Microbiology. – Vol.7. – P.845-855.
Urogenital tuberculosis. Diagnostic aspects. / S. Bennani, M. Hafiani et al. // J Urol (Paris). – Vol.101(4). – P.187-190
Das, K.M. Sonographic features of genitourinary tuberculosis. / R. Indudhara, S. Vaidyanathan // AJR Am J Roentgenol. – Feb, Vol.158(2). – P.327-329.
Global tuberculosis control: WHO report 2011 Available from: http://www. who.int/tb/publications/global_report/2008 /pdf/report_without_annexes.pdf http://www.who.int/tb/publications/global _report/2011/gtbr11_full.pdf\
Guidelines on urological infections. European Association of Urology / M. Grabe, T.E. Bjerklund Johansen, H. Botto et al. // Arnhem, The Netherlands, ISBN/EAN: 978-90-79754-96-0.









Комментарии