Евсеев С.В., Гусев А.А.
Кафедра урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии ГБОУ ВПО РостГМУ Минздрава России, г.Ростов-на-Дону Адрес: 344022, г. Ростов-на-Дону, пер. Нахичеванский, 29, тел. (863)2014448 Эл.почта: gusev_rost@mail.ru
Первое описание опухоли почки по сообщению CarsonW.J. [1] было сделано Konig G. в 1826 году, в своем обзоре он описал два случая «медуллярной саркомы» почки. В дальнейшем подробное описание опухоли почки было сделано Grawitz P. в 1883 году [2], который ввел термин struma lipomatodes aberrata renis для почечноклеточного рака, но ошибочно считал, что эти опухоли происходят из надпочечников. Непочечное происхождение рака почки подтверждалось и другими учеными – Lubarch и Birch-Hirschfeld [3], которые в 1894 году ввели термин hypernephroma, встречающийся в литературе и по сегодняшний день.
В настоящее время почечно-клеточный рак (ПКР) остается значимой проблемой урологии, он составляет около 3% всех злокачественных опухолей у взрослых и примерно 85% первичных злокачественных опухолей почки [4]. В 2001 году в мире зарегистрировано 189,1 тыс. новых случаев ПКР (2,2% – среди злокачественных заболеваний у мужчин и 1,5% – у женщин) и 91,1 тыс. смертей [5].
По данным Greenlee R.T. [6] в 2000 году в США было зарегистрировано 31.200 новых случаев ПКР, что составляет более 2% всех злокачественных опухолей, и 11.900 больных ПКР умерло от прогрессии заболевания. Аналогичные показатели приводит Landis S.H. [7] в статистическом отчете 1999 года, отмечая, что заболеваемость раком почки составляет 8,7 новых случаев на 100.000 населения ежегодно в соотношении мужчины : женщины 3:2. По его же данным ежегодный прирост ПКР с 1970 года составляет 3-4%, а смертность от рака почки составляет более 40%, тогда как смертность от рака мочевого пузыря и рака простаты – 20%. Приблизительно 54.000 новых диагнозов ПКР ставятся ежегодно в Соединенных Штатах Америки, и 13.000 пациентов умирают от этой болезни [8]. В среднем, ежегодно выявляется около 12 новых случаев ПКР на 100.000 населения.
По данным Jacqmin D. (2001) [9] частота выявления рака почки в последние 10 лет возросла вследствие широкого внедрения методов визуализации. В Европе ежегодно регистрируется 20.000 новых случаев ПКР; у мужчин – в два раза чаще, чем у женщин. Однако в 1/3 наблюдений при первичном обращении уже диагностируются метастазы, а у 50% больных локализованным ПКР отмечается диссеминация опухолевого процесса после радикальной нефрэктомии.
По данным Аксель Е.М. [10] в 2003 году в России выявлено 15 тыс. больных со злокачественными образованиями почки, их доля среди всех злокачественных новообразований составила 3,9% у мужчин и 2,7% у женщин. Заболеваемость в среднем по России – 10,2% у мужчин и 5,2% у женщин. Прирост абсолютного числа заболевших с 1993 по 2003 гг. составил 55%. Ежегодно от рака почки в России умирает 7,9 тыс. больных. В структуре умерших от злокачественных новообразований на долю ПКР приходится 2,7%. Показатели смертности в среднем по России составляют 5,9% и 2,2% соответственно у мужчин и женщин.
Вместе с повышением заболеваемости ПКР отмечается тенденция увеличения локализованных форм ПКР, как результат более ранней диагностики. По данным Chow W. H. (1999) [11] и Pantuck A. J. (2001) [12] количество локализованных форм ПКР за последние 20 лет выросло на 4-6%. Аляев Ю.Г. (2005) [13] пишет, что за последние 10 лет число больных раком почки, ограниченным в пределах фасции Герота (рТ1а рТ3а) составило 93,8%. По мнению Jayson M. (1998) [14] это связано с увеличением количества, выявляемых с помощью ультрасонографии, КТ и МРТ, бессимптомных (инцидентальных) опухолей почек, которые в настоящее время составляют в общей когорте раков почки до 60%. Тогда как в 70-х и в начале 80-х годов прошлого века бессимптомные раки почки составляли не более 10% [15].
Однако количество местнораспространенных форм ПКР, включая метастатическое поражение регионарных лимфоузлов и отдаленные метастазы, также увеличивается во всех возрастных, половых и расовых категориях [16]. По данным литературы соотношение полов (мужчины : женщины – 3:2), возрастная категория (40-70 лет) больных ПКР с течением времени не меняются [8, 17].
В 2006 в странах ЕС было зарегистрировано 27.326 летальных исходов от почечно-клеточного рака, это приблизительно 2,2% всех летальных исходов от рака (16.798 мужчин и 10.528 женщин). Смертность от почечно-клеточного рака в Странах-членах Европейского Союза увеличивалась до конца 1980-ых / ранних 1990-ых. После этого уровни стабилизировались или уменьшились [18]. Смертность снизилась от 4.8 на 100.000 в 1990-1994 гг. к 4.1 в 2000-2004 гг. у мужчин, и от 2.1 до 1.8 на 100.000 у женщин [18]. Снижение смертности было более значимо у мужчин. Эта благоприятная тенденция снижения смертности в пределах ЕС, частично может быть объяснена улучшением диагностики, и возрастающим количеством почечных масс малого размера.
В США смертность пациентов с почечно-клеточным раком увеличилась от 1.5 на 100.000 в 1983 г. до 6.5 на 100. 000 в 2002 г. [19] Это увеличение могло бы быть, по крайней мере, частично объяснено тем фактом, что опухоли малого размера более успешно лечатся, и 5-летние уровни выживания улучшились для пациентов с почечноклеточным раком с 56.4% (1983-1987 гг.) к 68.9% (1998-2002 гг.) [20]. С начала 2000-ых годов уровни смертности выравнивались и немного снизились к 2006 году, подобная тенденция присутствует и в Европе, где уровни уменьшались в большинстве стран [18].
Проспективными исследованиями последнего десятилетия определено, что хронические заболевания почек (ХЗП) распространены в большей степени, чем это оценивалось раньше. В настоящее время ХЗП, приводящие к снижению скорости клубочковой фильтрации, признаны основным независимым фактором смертности. Сочетание почечно-клеточного рака с ХЗП подтверждается большинством морфологических исследований. У 26% больных с ПКР в начальных стадиях (Т1), нормальным уровнем креатинина и неизмененной контрлатеральной почкой, отмечается снижение СКФ меньше 60 мл/мин [21]. Снижение СКФ коррелирует с плохим прогнозом у пациентов с заболеваниями сердечно-сосудистой системы. Больные с уровнем СКФ <60 мл/мин имеют в 2,1 раза повышенный риск сердечно-сосудистых осложнений и 4,5 раза повышенный риск летального исхода [22]. Золотым стандартом лечения ПКР остаются хирургические способы удаления опухоли: радикальная нефрэктомия и резекция почки. Оба хирургических метода связаны с удалением не только очага патологии, но и с удалением функционирующей почечной ткани. Количество удаляемой почечной ткани особенно значимо при выполнении радикальной нефрэктомии. В связи с чем, у 58% пациентов с ПКР и исходным уровнем СКФ от 60 до 90 мл/мин после удаления почки определяется снижение СКФ ниже 60 мл/мин. Тогда как при выполнении резекции почки риск аналогичного снижения СКФ существует только у 15% пациентов [23]. Несмотря на это, радикальная нефрэктомия является самым распространенным типом операции во всем мире и составляет 80% среди всех хирургических способов лечения ПКР. Что связано, как с объективными, так и некоторыми субъективными факторами, такими как отсутствие достоверных дооперационных факторов прогноза развития почечной недостаточности на фоне снижения СКФ, отсутствии критериев оценки резервной функции остающейся единственной почки.
Наиболее распространенные факторы риска ХЗП – это диабет, гипертония, сердечно-сосудистые заболевания, генетическая предрасположенность, и возраст свыше 60 лет [24]. Главное патогенное действие ХЗП – прогрессия в почечную недостаточность, развитие нарушений почечных функций, которые увеличивают риск сердечно-сосудистых заболеваний.
В статье James M.T. et al, 2009 «ХЗП и риск госпитализации и смерти от пневмонии» [25], автор показывает прочную взаимосвязь между снижением почечной функцией (оценивалась скорость клубочковой фильтрации) и риском госпитализации с пневмонией и последующей смертностью. Пневмония – это значимое осложнение ХЗП, так как она распространена, показывает прочную взаимосвязь с ХЗП, профилактируется вакцинацией и поддается лечению.
James M.T. et al. цитируют предыдущие доклады, в которых говорится, что меньше чем 50% пациентов с ХЗП получают противогриппозную прививку, показывая, что уровень внимания, который уделяют профилактике пневмонии, не достаточно высок. Авторы выполнили внушительную работу по показу абсолютного и относительного риска. Количество обследованных 252.516 человек, в том числе 4.253 впервые госпитализированных с пневмонией, является достаточно многочисленным, чтобы позволить детализировано расслоить по возрасту и СКФ. Главная стратегия моделирования основывается на относительных рисках и соответственно указывает, что относительный риск снижается с возрастом. Однако авторы также указывают, что абсолютный риск госпитализации с пневмонией резко увеличивается с возрастом. Они делают вывод, что «повышенный относительный риск пневмонии при сниженном СКФ был более явным у молодых пациентов» и что, «тем не менее, абсолютные приросты риска со сниженным СКФ были самыми высокими у пожилых пациентов, и таким образом, вмешательства, с целью профилактики и лечения пневмонии, как ожидается, окажут свое самое большое влияние в этом возрастном слое населения».
Тенденции уравновешивания высокого абсолютного риска, и низкого относительного риска у пожилых людей замечены в большинстве условий, связанных с возрастом. Они усложняют интерпретацию, но достойны внимания каждый раз, так как высокие относительные риски имеют тенденцию быть более значимыми и более понятными, но изменение относительных рисков в подгруппах высокого риска часто приводят к самому высокому относительному риску и возможности для профилактики [26].
Это исследование риска пневмонии наглядно, и следовательно, должно интерпретироваться внимательно. Использование одной лаборатории с информацией о калибровке креатинина – редкий случай для исследований такого масштаба, где часто использование нескольких лабораторий и неточная калибровка в течение долгого времени ограничивают интерпретацию абсолютного уровня СКФ. Авторы также проводят много полезных анализов чувствительности, уверяя нас, что показатели не зависят ни от исходного уровня, ни от изменяющийся во времени используемой меры СКФ, ни от посещений отделения неотложной помощи с пневмонией, которые не приводят к госпитализации. Авторы не смешивают всех пациентов с СКФ, больше чем 60 mL/min/1.73 m2 в единственную группу. Вместо этого они определяют, что пневмония, как многие другие осложнения, имеет высокий риск среди пациентов с очень низким сывороточным креатинином и, следовательно, высокой СКФ. В этой статье используется группа с СКФ выше 105 mL/min/1.73 m2 , чтобы исследовать риск, связанный с высокой СКФ, и находят существенно повышенный риск во всех возрастных группах. Выделение этой группы от контрольной группы (60-104 mL/min/ 1.73 m2 ) важно, чтобы избежать неуместного повышения исходного риска этой контрольной группы, которая тогда затеняет повышение риска в умеренно сниженной CRA, ниже 60 mL/ min/1.73 m2 .
ХЗП обычно асимптоматичны до своих поздних стадий, таким образом большинство пациентов с ХЗП выявляются только незадолго до начала симптоматической почечной недостаточности, когда остается мало возможностей предотвратить неблагоприятные результаты [27].
Определение ХЗП установленное National Kidney Foundation:
1. Почечные нарушения в течение 3-х и более месяцев, вызванные структурными или функциональными отклонениями почки, с или без снижения СКФ, проявляющиеся также:
А.Патологическими отклонениями;
Б. Маркерами почечных нарушений, включающие отклонения в составе крови или мочи, или отклонения на визуальных тестах.
2. СКФ <60 mL/min/1.73 m 2 в течение 3-х и более месяцев, с или без почечных нарушений.
Стадии ХЗП, установленные National Kidney Foundation, представлены в таблице 1.
Таблица 1. Стадии хронических заболеваний почек
| Стадия | Описание | СКФ |
|---|---|---|
| 1 | Почечные нарушения с СКФ выше 90 | >90 |
| 2 | Почечные нарушения со средним снижением СКФ | 60-89 |
| 3 | Умеренно сниженная СКФ | 30-59 |
| 4 | Серьезно сниженная СКФ | 15-29 |
| 5 | Почечная недостаточность | <15 (или диализ) |
В большинстве случаев ХЗП можно выявить 2 простыми исследованиями: анализ мочи на протеинурию и анализ крови, чтобы оценить скорость клубочковой фильтрации (СКФ).
Для расчета СКФ предложено множество формул. Однако в основном сейчас используется 3 из них.
1. Cockcroft-Gault:
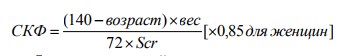
где Scr – сывороточный креатинин
2. Modification of Diet in Renal Disease (MDRD):
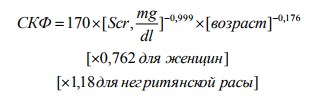
3. Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI): 1. Формула для женщин белых или других рас:
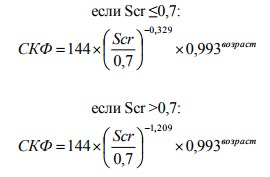
2. Формула для мужчин белых или других рас
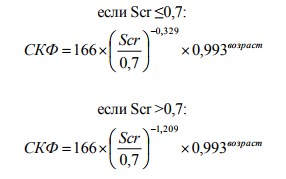
3. Формула для женщин негритянской расы:
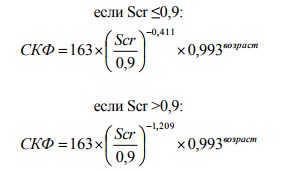
4. Формула для мужчин негритянской расы:
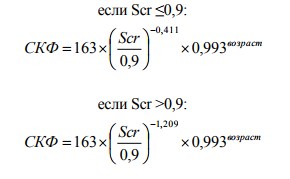
Сывороточный креатинин в Соединенных Штатах определяют, чаще чем 281 миллионов раз ежегодно (предположение основано на 191 354 358 тестах креатинина, зафиксированных в 1996 г., и принятие ежегодного темпа роста в 3%) [28], также недавние отчеты показывают, что больше чем 70% лабораторий теперь используют MDRD уравнение [29]. В 2009 г., Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) создало и утвердило новое уравнение, уравнение креатинина CKD-EPI, которое использует те же самые переменные как в уравнении MDRD, но более точно [24].
Другие критерии также важны в клинической практике и здравоохранении, включая обнаружение болезни, предсказание прогноза, и последующей терапии. В American Journal of Kidney Diseases есть 2 статьи в которых сравнивают уравнение CKD-EPI с уравнением MDRD и уравнением КокрофтаГольта для того, чтобы оценить распространенность ХЗП [30, 31]. Краткое изложение статей представлено в таблице 2.
Таблица 2. Сравнение уравнений CKD-EPI, MDRD, Кокрофта-Гольта
| Cockcroft-Gault | MDRD | CKD-EPI | |
|---|---|---|---|
| Год публикации | 1973 | 1999 | 2009 |
| Единицы измерения | mL/min | mL/min/1.73 m2 | mL/min/1.73 m2 |
| Входящие переменные: Креатинин Возраст Пол Раса Вес |
Да Да Нет (коэффициент добавлен позднее) Нет |
Да Да Да Негритянская, белые и остальные (Китайский и японский коэффициенты добавлены позднее) Нет |
Да Да Да Негритянская, белые и остальные (японский коэффициент добавлен позднее) Нет |
| Стандартизация пробы креатинина | Нет (не может быть стандартизирован) | Да (2006) | Да |
Определение почечной функции критически важно для пациентов, которые подвергнутся радикальной нефрэктомии, по причине, того что у многих из них, до оперативного вмешательства, уже есть некоторые нарушения почечной функции, и у них есть риск развития ХЗП после хирургии [32].
Радикальная нефрэктомия снижает почечную функцию в основном за счет сокращения числа функционирующих нефронов, но функция в контралатеральной почке может быть улучшена компенсационной гипертрофией, и/или снижена за счет гипоперфузии и гиперфильтрационного повреждения [33].
Почечная функция после нефронсохраняющей хирургии лучше, чем после нефрэктомии, но отрицательно на нее воздействуют несколько факторов, включая дооперационную почечную дисфункцию и повреждения вызываемые ишемией [34].
Недавние наблюдения предполагают, что радикальная нефрэктомия для почечных опухолей, размером 4 см или менее, значительно увеличивают риск почечной недостаточности по сравнению с резекцией почки [35, 36]. Поскольку почечная недостаточность связана с сердечно-сосудистой заболеваемостью и смертностью, было предположено, что радикальная нефрэктомия может сократить общую выживаемость у пациентов с маленькими опухолями почек [35].
Увеличение случаев выявления опухолей почки было отражено увеличением числа операций, выполняемых с целью удаления этих опухолей [37]. Однако, неожиданностью стало продолжающееся увеличение смертности этих пациентов после радикальных нефрэктомий [37]. Предполагая, что полное хирургическое удаление малых локализованных опухолей почки, является лечебным, смертность пациентов с малыми опухолями почки должна снижаться, а не расти. Эта на вид парадоксальная тенденция привлекла внимание к значению сочетаний условий и конкурирующим причинам смертности у пациентов подвергнутых хирургическому лечению опухолей почки, и это выдвинуло на первый план потребность переоценить эффекты лечения таких опухолей [37]. Механизм, которым хирургия может неблагоприятно повлиять на неонкоспецифическую выживаемость – это развитие ХЗП. ХЗП связаны не только с почечной недостаточностью, но также и с сердечно-сосудистыми заболеваниями и преждевременной смертью [38].
Хотя радикальная нефрэктомия – известный фактор риска ХЗП у пациентов с опухолями почки [35], она продолжает быть наиболее распространенной процедурой, выполняемой у пациентов с малыми опухолями почки в Соединенных Штатах, и за границей [39]. Широкое использование радикальной нефрэктомии может привести к сверхлечению многих из этих опухолей, способствуя росту общей смертности этих пациентов, особенно людей с малыми опухолями, которые вряд ли умрут от почечного рака [32]. В статье «Прогностические факторы для ХЗП после Хирургии у пациентов с малыми опухолями почек» Hwang Gyun Jeon et al. (2009) [40] сравнивают почечные функции после радикальной нефрэктомии и резекции.
Они говорят о том, что у нефронсохраняющей хирургии по сравнению с радикальной нефрэктомией эквивалентные онкологические результаты, и для малых опухолей почек подход к хирургическому лечению изменился от радикальной нефрэктомии к резекции почки.
Однако, большинство случайно обнаруженных опухолей почек в Соединенных Штатах Америки и Европе подвергаются лечению открытой или лапароскопической радикальной нефрэктомией. Анализ Nationwide Inpatient Sample [41] показал, что 7.5% из 66.621 случаев рака почек между 1988 и 2002 гг. в Соединенных Штатах подвергались лечению в объеме резекции почки.
Данные Hospital Episode Statistics database of the Department of Health в Англии показывают, что только 3.3% из 17.308 пациентов между 1995 и 2002 гг. выполнили резекцию почки. [39]. По данным LauW.K.et al. [36] после радикальной нефрэктомии постоперационная почечная функция была хуже чем после резекции почки и 10-летний совокупный уровень ХПН был выше (22,4% против 11,6%, p=0,01). McKiernan J., Simmons R., Katz J. (2002) [42] также показали, что пациенты, подвергающиеся радикальной нефрэктомии, имели больший риск развития ХПН, чем подобная когорта пациентов, подвергающихся резекции почки, когда дооперационные факторы риска ХПН контролировали одномерным анализом. Sorbellini M., Kattan M.W., Snyder M.E. (2006) [43] ввели номограмму для того, чтобы предсказать ХПН среди пациентов, подвергающихся резекции почки или радикальной нефрэктомии.
В исследовании Hwang Gyun Jeon (2009) [40], использовалась формула MDRD, чтобы оценить СКФ. Среди пациентов у 10,6% была СКФ ниже 60 mL/min1.73 m2 до хирургии, которая подобна 11% ожидаемым в когорте взрослых пациентов [24]. Эта распространенность была намного ниже, чем уровень ранее сообщаемый в Memorial Sloan-Kettering Cancer Center [35] (26%) и в исследовании Лукаса (27%) [44]. Несоответствия, возможно, произошли из-за различий в возрасте пациентов; возраст пациентов в когорте Hwang Gyun Jeon был приблизительно на 10 лет меньше, чем в двух вышеупомянутых исследованиях.
Уровень СКФ в исследовании Hwang Gyun Jeon был выше, чем в предыдущих исследованиях. В его исследовании, у 86 (66,7%) из 129 и 11 (11,5%) из 96 пациентов, кто подвергся радикальной нефрэктомии, или резекции почки развивались ХЗП. Однако, ими был обнаружен подобный уровень ХЗП в нескольких статьях, в которых использовали формулу MDRD для опухолей менее 4 см.
Известно, что дооперационная почечная функция, возраст, пол, гипертония, и протеинурия в дополнение к типу операции являются прогнозирующими факторами для развития постоперационной почечной недостаточности. Результат этого исследования показывает, что возраст, дооперационная СКФ, и тип операции были связаны с ХЗП (p=0,001). Это объяснили так: с повышением возраста, нефроны атрофируются и клубочковая фильтрация снижается [45].
В дополнение к ранее выявленным прогнозирующим факторам, диабет был независимым фактором риска для ХЗП в исследовании Hwang Gyun Jeon. Диабет не выделялся, как риск развития ХЗП в предыдущих докладах [35, 46].
В исследовании Hwang Gyun Jeon [40], больше чем у половины пациентов (60%, 12 из 20) с диабетом развивались ХЗП после хирургии, и большинство из них (83%, 10 из 12) подверглись радикальной нефрэктомии. Это первое сообщение, показывающее ассоциацию диабета с развитием ХЗП в этой группе пациентов.
Исследование Yoshito Tsushima et al. (1999) [47] описанное в статье «Определение СКФ на единицу почечного объема используя компьютерную томографию» показало, что функциональная КТ может обеспечить достоверную информацию о почечной функции, так же, как и важная морфологическая информация. Для измерения необходимо 1 динамическое исследование КТ с небольшим количеством (20 мл) неионного контрастного материала и без забора крови. Почечная функция была точно измерена в их исследовании, с существенно более высоким корреляционным коэффициентом, чем при использовании метода ядерной медицины. Используя низкую дозу неионного контрастного вещества Yoshito Tsushima et al. избежали небольшой недооценки клиренса креатинина, которая наблюдалась в предыдущем исследовании [47].
Неинвазивное определение почечной функции с помощью КТ, которая широко доступна, может быть полезным в нескольких ситуациях, включая онкологическое обследование КТ, при котором определение СКФ часто необходимо для того, чтобы определить дозы почечного выделения химиотерапевтических агентов. Большинство таких пациентов подвергнутся КТ для стадирования и других целей, и одновременное определение СКФ будет экономически выгодно и удобно для пациента. Это также обеспечило бы функциональной и анатомической информацией в случаях гидронефроза, мочекаменной болезни, почечных опухолях и мальформациях, которые часто подвергаются предоперационной ангиографии [48].
Yoshito Tsushima et al. (1999) [47] полагают, что их метод предоставляет больше преимуществ, по сравнению с другими методами КТ. Рассматривая относительную почечную функцию, Frennby et al. ранее получили измерение СКФ с помощью вычислений, основанных на накоплении неионного контрастного вещества в почках на КТ между 1 и 4 минутами после внутривенной инъекции, и сравнивая это с результатом ренографии использованием 99mTc-DTPA [49]. Коэффициент корреляции между этими 2 методами был высок, и они пришли к выводу, что СКФ может быть определена обычной КТ. Их метод прост, но имеет некоторые ограничения. Они предполагают, что все контрастные вещества в почках в это время фильтрованы, хотя существенное их количество будет находиться внутри сосудов. Эта ошибка может вызвать ложную недооценку различий СКФ между почками. Относительно большая доза контрастного вещества (50 мл. iohexol 300 mg. I/ml.) была использована в их исследовании. В исследовании Yoshito Tsushima используется малое (20 мл) количество неионого контрастного вещества.
Для измерения абсолютной почечной функции используется йодсодержащие контрастные вещества как заместители инулина, которые были использованы несколькими исследователями. Измерение клиренса контраста плазмы и почки показывает превосходное соответствие СКФ с инулином [50], который, был точной альтернативой клиренса креатинина для измерения СКФ.
ЗАКЛЮЧЕНИЕ
Таким образом, проанализировав литературу, можно сделать выводы, что несмотря на раннее диагностирование и своевременное оперативное лечение ПКР, снижение почечной функции в послеоперационном периоде и связанный с этим высокий риск развития сердечно-сосудистых осложнений влияют на общую выживаемость, которая остается достаточно низкой, несмотря на достигнутое в последние годы повышение канцерспецифической выживаемости больных с ПКР.
ЛИТЕРАТУРА
1. Carson, W.J.: Tumors of the kidney: Histologic study / W.J Carson // Trans Sec Urol AMA – 1928.– P.114.
2. Grawitz, P.: Die sogenannten Lipome der Niere / P. Grawitz // Virchows Arch. – 1883. – V.93. – P.39.
3. Birch-Hirschfeld, F.V. Zentralbl Krankh Horn Sex Org / F.V. Birch-Hirschfeld, A. Doederlein. – 1894 – Vol.3
4. Танаго, Э. «Урология по Дональду Смиту» / Э. Танаго, Д. Маканинич // М.,изд. Практика, 2005. – с.372-388.
5. Ferlay, J. Globocan 2000 / J. Ferlay, F. Bray, P. Pisani, M. Parkin // IARCPress. Lyon. – 2001. – P.124.
6. Greenlee, R. T. Cancer statistics, 2000. CA / R.T. Greenlee, T. Murray, S. Bolden et al // Cancer J Clin. – 2000. – Vol.50. – P.7.
7. Landis, S.H. Cancer statistics: 1999 / S.H. Landis, T. Murray, S. Bolden, P.A. Wingo // CA Cancer J Clin. – 1999. – Vol.49 – P.8–31.
8. Jemal, A. Cancer statistics, 2009 / A. Jemal, R.C. Tiwari, T. Murray et al. // CA Cancer J Clin. – 2009. – Vol.54. – P.8.
9. Jacqmin, D. Renal cancer / D. Jacqmin, H. van Poppel, Z. Kirkali, G. Mickisch // Eur Urol. – 2001. – Vol.39. – P.361-369.
10. Аксель, Е.А. Заболеваемость злокачественными новообразованиями мочевых и мужских половых органов в России в 2003 г. / Е.А. Аксекль // Онкоурология. – 2005. – №1. – С.6-9.
11. Chow, W.H. Rising incidence of renal cell cancer in the United States / W.H. Chow, S.S. Devesa, J.L. Warren, J.F. Fraumeni // JAMA. – 1999. – Vol.281. – P.1628-3111.
12. Pantuck, The changing natural history of renal cell carcinoma / A.J. Pantuck, A. Zisman, A.S. Belldegrun // J Urol. – 2001. – Vol.166. – P.1611.
13. Аляев, Ю.Г. Локализованный и местно-распространенный рак почки: нефрэктомия или резекция? / Ю.Г. Аляев, А.А. Крапивин // Онкоурология – 2005. – №1. – С.10-15.
14. Jayson, M. Increased incidence of serendipitously discovered renal cell carcinoma / M. Jayson, H. Sanders // Urology. – 1998. – Vol.51. P.203.
15. Konnak, J. W. Renal cell carcinoma as an incidental finding / J.W. Konnak, H.B. Grossman // J Urol. – 1985. – Vol.134. – P.1094.
16. Natural history of renal masses followed expectantly / W. Kassouf, A.G. Aprikian, M. Laplante, S. Tanguay // J Urol. – 2004. – Vol.171. – P.111-113.
17. Аль-Шукри, С.Х. Опухоли мочеполовых органов / С.Х. Аль-Шукри, В.Н. Ткачук // С-Пб.,2000. – С.17-45.
18. The changing pattern of kidney cancer incidence and mortality in Europe / F. Levi, J. Ferlay, C. Galeone et al. // BJU Int. – 2008. – Vol.101(8). – P.949–958.
19. Global increase in kidney cancer incidence / A. Mathew, S.S. Devesa et al. // Eur J Cancer Prev. – 2002. – Vol.11(2). – P.171-178.
20. Chow, W.H. Re: rising incidence of small renal masses: a need to reassess treatment effect / W.H. Chow, W.M. Linehan, S.S. Devesa // J Natl Cancer Inst. – 2007. – 99. – P.569–570; author reply P.570-571.
21. Novick, A.C. Guideline for Management of the Clinical Stage 1 Renal Mass / A.C. Novick, S.C. Campbell // 2009.
22. Mild chronic kidney dysfunction and treatment strategies for stable coronary artery disease / N.H. Lopes, F. da Silva Paulitsch et al. // J. Thorac. Cardiovasc. Surg. – 2009. – Vol.137(6). – P.1443-1449.
23. Kim, H.L. Estimation and prediction of renal function in patients with renal tumor / H.L. Kim, S. K. Shah, W. Tan // J Urol – 2009. – Vol.181. – P.2451-2461.
24. A new equation to estimate glomerular filtration rate / A.S. Levey, L.A. Stevens, C.H. Schmid et al. // Ann Intern Med. – 2009. – Vol.150(9). – P.604-612.
25. CKD and risk of hospitalization and death with pneumonia / M.T. James, H. Quan, M. Tonelli et al // Am J Kidney Dis – 2009. – Vol.54. – P.24-32.
26 Stamler, J.Blood pressure, systolic and diastolic, and cardiovascular risks. US population data / J. Stamler, R. Stamler, J.D. Neaton // Arch Intern Med – 1993. – Vol.153. – P.598-615.
27. The timing of specialist evaluation in chronic kidney disease and mortality / K.S. Kinchen, J. Sadler, N. Fink et al // Ann Intern Med – 2002. – Vol.137. – P.479-486.
28. National Inventory of Clinical Laboratory Testing Services (NICLTS). Development and test distribution for 1996 / S.J. Steindel, W.J. Rauch, M.K. Simon, J. Handsfield // Arch Pathol Lab Med. – 2000. – Vol.124(8). – P.1201-1208.
29. Miller, WG. Reporting estimated GFR: a laboratory perspective / W.G. Miller WG. // Am J Kidney Dis. – 2008. – Vol.52(4). – P.645-648.
30. Risk implications of the new CKD Epidemiology Collaboration (CKD-EPI) equation compared with the MDRD Study equation for estimated GFR: the Atherosclerosis Risk in Communities (ARIC) Study / K. Matsushita, E. Selvin, L.D. Bash et al. // Am J Kidney Dis. – 2010. – Vol.55. – P.648-659.
31 Comparison of the prevalence and mortality risk of CKD in Australia using the CKD Epidemiology Collaboration (CKD-EPI) and Modification of Diet in Renal Disease (MDRD) Study GFR estimating equations: the AusDiab (Australian Diabetes, Obesity and Lifestyle) Study / S.L. White, K.R. Polkinghorne, R.C. Atkins, S.J. Chadban // Am J Kidney Dis. – 2010. – Vol.55. – P.660-670.
32. Partial nephrectomy versus radical nephrectomy in patients with small renal tumors is there a difference in mortality and cardiovascular outcomes? / W.C. Huang, E.B. Elkin, A.S.Levey et al. // J Urol – 2009. – Vol.181. – P.55.
33. Renal function assessment in the era of CKD: renewed emphasis on renal function centered patient care / B.R. Lane, E.D. Poggio, B.R. Herts et al. // J Urol – 2009. – Vol.182. – P.435.
34. Factors predicting renal functional outcome after partial nephrectomy / B.R. Lane, D.C. Babineau, E.D. Poggio et al. // J Urol – 2008. – Vol.180. – P.2363.
35. Chronic kidney disease after nephrectomy in patients with renal cortical tumours: a etrospective cohort study / W.C. Huang, A.S. Levey, A.M. Serio et al. // Lancet Oncol – 2006. – Vol.7. P.735.
36. Matched comparison of radical nephrectomy vs nephronsparing surgery in patients with unilateral renal cell carcinoma and a normal contralateral kidney / W.K. Lau, M.L. Blute, A.L. Weaveret al. // Mayo Clin Proc – 2000. – Vol.75. – P.1236.
37. Rising incidence of small renal masses: a need to reassess treatment effect / J.M. Hollingsworth, D.C. Miller, S. Daignault et al. // J Natl Cancer Inst – 2006. – Vol.98. – P.1331.
38. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization / A.S. Go, G.M. Chertow, D. Fan et al. // N Engl J Med – 2004. – Vol.351/ – P.1296.
39. National utilization trends of partial nephrectomy for renal cell carcinoma: a case of underutilization?/ B.K. Hollenbeck, D.A. Taub, D.C. Miller et al. // Urology – 2006. – Vol.67. – P.254.
40. Prognostic Factors for Chronic Kidney Disease After Curative Surgery in Patients With Small Renal Tumors / G.J. Hwang, G.J. In, W.L. Jeong et al. // UROLOGY – 2009. – Vol.74(5). – P.1064–1069.
41. Hafez, K.S.Nephron sparing surgery for localized renal cell carcinoma: impact of tumor size on patient survival, tumor recurrence and TNM staging / K.S. Hafez, A.F. Fergany, A.C. Novick // J Urol. – 1999. – Vol.162. – P.1930-1933.
42. Natural history of chronic renal insufficiency after partial and radical nephrectomy / J. McKiernan, R. Simmons, J. Katz et al. // Urology – 2002. – Vol.59. – P.816-820.
43. Prognostic nomogram for renal insufficiency after radical or partial nephrectomy / M. Sorbellini, M.W. Kattan, M.E. Snyder et al. // J Urol. – 2006. – Vol.176. – P.472-476.
44. Renal function outcomes in patients treated for renal masses smaller than 4 centimetres by ablative and extirpative techniques / S.M. Lucas, J.M. Stern, M. Adibi et al // J Urol. – 2008. – Vol.179. – P.75-79.
45. Age-related incidence of sclerotic glomeruli in human kidneys / C. Kaplan, B. Pasternack, H. Shah et al // Am J Pathol. – 1975. – Vol.80. – P.227-234.
46. Preservation of renal function following partial or radical nephrectomy using 24-hour creatinine clearance / A.T. Clark, R.H. Breau, C. Morash et al. // Eur Urol. – 2008. – Vol.54. – P.143-149.
47. Use of contrast-enhanced computed tomography to measure clearance per unit renal volume: a novel measurement of renal function and fractional vascular volume / Y. Tsushima, M.J. Blomley, S. Kusano et al // Am J Kidney Dis – 1999. – Vol.33. – P.754
48. Renal computed tomography with 3dimensional angiography and simultaneous measurement of plasma contrast clearance reduce the invasiveness and cost of evaluating living renal donor candidates / B.W. Lindgren, T. Demos, R. Marsan et al. // Transplantation – 1996. – Vol.61. – P.219.
49. Determination of the relative glomerular filtration rate of each kidney in man. Comparison between iohexol CT and 99mTc-DTPA scintigraphy / B. Frennby, T. Alme´n, B. Lilja et al. // Acta Radiol – 1995. – Vol.36. – P.410.
50. Brown, S.C.W. Iohexol clearance for the determination of glomerular filtration rate in clinical practice: evidence for a new gold standard / S.C.W. Brown, P.H. O’Reilly // J Urol.– 1991. – Vol.146. – P. 675.
51. Dosing of contrast material to prevent contrast nephropathy in patients with renal disease / R.G. Cigarroa, R.A. Lange, R.H. Williams et al // Am J Med – 1989. – Vol.86. – P.649.









Комментарии