Микробный спектр мочи при немышечно-инвазивном раке мочевого пузыря
Автор обзора Шадеркина В.А., CEO Uroweb.ru
План обзора:
- Возможные механизмы канцерогенеза
- Состав мочевого микробиома при НМИРМП и отличие от здоровых людей
- Связь микробиома с развитием и прогрессированием рака
- Влияние микробиома на формирование ответа на лечение
- Метагеномные и 16S-рРНК исследования мочевого микробиома
- Диагностическое значение мочевого микробиома
- Прогностическое значение мочевого микробиома
- Выводы
- Литература
1. Возможные механизмы канцерогенеза
Немышечно-инвазивный рак мочевого пузыря (НМИРМП) – это форма рака, при которой опухоль ограничена слизистой или подслизистым слоем мочевого пузыря, не прорастая в мышечную стенку.
На долю НМИРМП приходится около 75% новых случаев рака мочевого пузыря [1]. Несмотря на относительно благоприятный прогноз (5-летняя выживаемость достигает почти 90% при своевременном лечении), данное заболевание характеризуется частыми рецидивами (до 50–70% в течение 5 лет) и риском прогрессирования в инвазивные формы (у 10–30% пациентов) [2, 3, 4].
Стандартом диагностики и мониторинга остается цистоскопия, однако это инвазивная и дорогостоящая процедура [5]. В этой связи актуален поиск новых неинвазивных биомаркеров, в том числе основанных на анализе мочи.
Долгое время считалось, что мочевыводящие пути стерильны, однако современные исследования опровергли эту догму, обнаружив в моче здоровых людей уникальное сообщество микроорганизмов [6].
Мочевой микробиом – совокупность микроорганизмов, обитающих в мочевых путях – теперь активно изучается в контексте различных заболеваний. Появляются данные, что изменение состава мочевой микрофлоры (дисбиоз) может влиять на развитие и течение рака мочевого пузыря [7, 8].
Хроническое воспаление, поддерживаемое микробами, рассматривается как один из возможных механизмов канцерогенеза [8]. С другой стороны, терапевтическое введение ослабленного живого микобактерии BCG (вакцины БЦЖ) в полость мочевого пузыря – эффективный метод лечения НМИРМП – прямо указывает на то, что иммунная активация микробным агентом способна подавлять рост опухоли [7, 8].
В данном обзоре представлены новейшие научные данные (2018–2025 гг.) о спектре мочевого микробиома при НМИРМП, его типичном составе, отличиях от здоровой нормы, а также о том, какую роль микробиом может играть в развитии, прогрессировании и ответе на лечение рака мочевого пузыря. Отдельно рассмотрены результаты метагеномных исследований (включая секвенирование гена 16S рРНК) и обсуждается диагностическое и прогностическое значение мочевого микробиома.
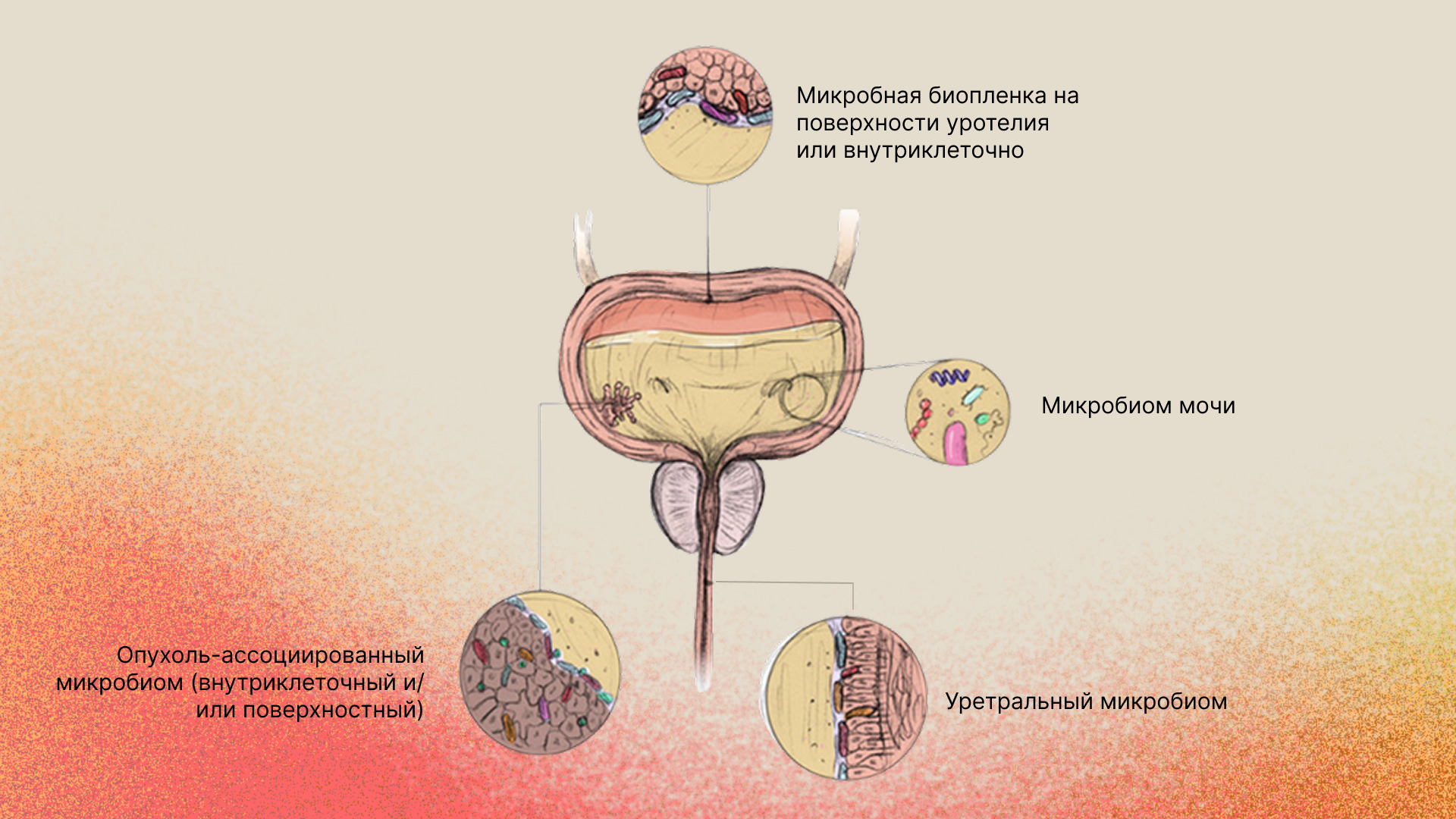
2. Состав мочевого микробиома при НМИРМП и отличие от здоровых людей
Диверсификация микробиоты
У пациентов с НМИРМП в моче обнаруживается гораздо более разнообразная микробная флора по сравнению со здоровыми людьми. В ряде исследований показано значительное повышение альфа-разнообразия (числа видов и их равномерности) мочевого микробиома у больных раком [5]. Например, в работе Wu и соавт. (2018) методом секвенирования 16S рРНК было продемонстрировано, что в моче пациентов с раком количество обнаруженных видов в среднем более чем в 2 раза превышает таковое у здоровых (наблюдаемое число OTU: около 120 против 56) [9]. Одновременно отмечено общее различие структуры микробных сообществ (бета-разнообразия) между онкобольными и контролями [9].
Интересно, что некоторые исследования, напротив, не выявили значимой разницы в разнообразии микробиоты между группами [10]. Такая непоследовательность результатов может объясняться различиями в методах отбора проб (самособранная средняя порция мочи против катетеризации и др.) [5].
Тем не менее, совокупные данные указывают, что при НМИРМП микробный пейзаж мочи заметно меняется.
Преобладающие таксоны
У больных раком мочевого пузыря отмечено смещение баланса микробиоты в сторону некоторых условно-патогенных бактерий. На уровне типов (фил) в моче пациентов с опухолью обычно повышена доля Proteobacteria и Actinobacteria, тогда как у здоровых превалируют Firmicutes [11, 12].
Так, в моче при раке значимо чаще обнаруживаются представители родов Actinomyces, Achromobacter, Brevibacterium и Brucella [11].
Кроме того, по сравнению со здоровыми контрольными группами у пациентов с раком мочевого пузыря достоверно выше относительное количество ряда известных уропатогенов: Klebsiella, Escherichia (включая шигелл), Pseudomonas, Acinetobacter и др. [10]. К примеру, Acinetobacter фигурирует как «общий знаменатель» сразу в нескольких исследованиях, демонстрируя повышенную численность при раке [10].
Напротив, нормальный мочевой микробиом у здоровых богат бактериями типа Firmicutes, выполняющими защитные функции. В частности, у лиц без рака значительно более выражено присутствие лактобацилл (Lactobacillus) и некоторых анаэробов рода Veillonella [12]. Лактобациллы считаются компонентом здорового урогенитального микробиоценоза, особенно у женщин, и их уменьшенная численность может создавать условия для колонизации патогенами. Действительно, в моче пациентов с НМИРМП лактобациллы зачастую подавлены по сравнению с контролем [10, 11, 12].
Различия с контрольной группой
Таким образом, спектр мочевой микрофлоры при НМИРМП сдвинут в сторону повышенного содержания потенциально про-воспалительных и условно-патогенных микроорганизмов. Помимо перечисленных, в разных работах отмечалось увеличение доли Staphylococcus, Corynebacterium, Streptococcus, Anaerococcus, Sphingomonas, Prevotella и других родов у больных раком, хотя согласованность по ним ниже [1].
Примечательно, что некоторые бактерии, обычно связанные с мочевыми инфекциями, могут уменьшаться при наличии опухоли. Например, в упомянутом исследовании Wu et al. наблюдалось снижение численности Proteus и Serratia в моче больных по сравнению со здоровыми [9]. Авторы связывают это с тем, что в контрольную группу входили пациенты с доброкачественными урологическими проблемами, у которых эти уропатогены встречались чаще.
В целом же, по сравнению со здоровыми людьми, для микробиома мочи больных НМИРМП характерны:
- большее видовое разнообразие;
- повышенная доля типов Proteobacteriaи Actinobacteria;
- обогащение рядом грамотрицательных родов (Klebsiella, Escherichia, Pseudomonas, Acinetobacter, Sphingomonas, Prevotellaи др.) и некоторых грамположительных актиномицетов (Actinomyces и др.);
- относительное снижение ключевых «здоровых» микробов, таких как Lactobacillus.
Эти различия статистически подтверждены во многих исследованиях [13, 14].
3. Связь микробиома с развитием и прогрессированием рака
Микробиом и канцерогенез
Накоплено множество свидетельств того, что микробы могут способствовать развитию злокачественных опухолей через хроническое воспаление и прямое воздействие на клетки. Применительно к мочевому пузырю считается, что дисбиоз мочевой микрофлоры создает фон воспаления, который поддерживает канцерогенез [5].
Проникновение оппортунистических бактерий в уротелий активирует Toll-подобные рецепторы и каскады воспалительной сигнализации (NF-κB, JAK-STAT), что ведет к выработке цитокинов и формированию хронического воспаления в стенке мочевого пузыря [5].
В опухолевых тканях мочевого пузыря действительно обнаруживаются повышенные уровни провоспалительных цитокинов, таких как IL-6, коррелирующие с худшим прогнозом. Отдельные штаммы бактерий способны вырабатывать генотоксины, напрямую повреждающие ДНК эпителия. Например, известно, что уропатогенные штаммы E. coli могут продуцировать колибактин – токсин, вызывающий повреждение ДНК и тем самым потенцирующий опухолевый рост в кишечнике и, вероятно, в мочевом пузыре [10, 15]. Обнаружение в тканях мочевого пузыря бактериальных биопленок при раке также поддерживает гипотезу об участии микробов в инициации опухоли.
В эпидемиологических исследованиях связь рака мочевого пузыря с перенесенными инфекциями мочевых путей остается противоречивой. Некоторые работы отмечают, что частые инфекции ассоциируются с повышенным риском рака, тогда как другие сообщают об обратном – многократные эпизоды ИМП коррелируют со снижением вероятности развития рака, особенно у женщин.
Метанализ новейших данных не выявил однозначной связи между анамнезом инфекций и заболеваемостью раком мочевого пузыря. Тем не менее, потенциальная роль микробного фактора в инициации опухолевого роста признана.
Прогрессирование и рецидивы
Особый интерес представляет вопрос: влияет ли состав мочевого микробиома на агрессивность опухоли и риск рецидива НМИРМП. Большинство исследований не обнаружили явных отличий микробиоты между поверхностными (НМИРМП) и инвазивными (MIBC) формами рака мочевого пузыря на уровне альфа- и бета-разнообразия [10].
Однако отмечены различия в удельном составе отдельных таксонов. Так, у пациентов с мышечно-инвазивным раком (MIBC) в моче обнаруживают больше Haemophilus и Veillonella, тогда как для НМИРМП характерны большие количества Cupriavidus, Staphylococcus, Campylobacter и Corynebacterium [10].
Интересно, что некоторые микробы ассоциированы с риском рецидива: например, Escherichia/Shigella чаще встречалась у пациентов с НМИРМП, не склонным к ранним рецидивам (т.е. при более благоприятном течении). В то же время высокая общая численность и разнообразие микробов, по отдельным данным, скорее сопряжены с большим риском рецидива. В частности, низкое видовое разнообразие мочевого микробиома коррелировало с более продолжительной безрецидивной выживаемостью у пациентов после лечения [5]. Иными словами, чем богаче и сложнее микробное сообщество, тем выше вероятность раннего рецидива опухоли.
«Биомаркеры» прогрессирования РМП
На уровне отдельных бактерий выделены потенциальные «биомаркеры» прогрессирования. Wu и соавт. показали, что у пациентов с группой высокого риска (множественные или крупные опухоли, предполагающие склонность к прогрессированию) мочевой микробиом обогащен особыми родами бактерий – Herbaspirillum, Porphyrobacter и Bacteroides [9].
Эти организмы практически отсутствовали у пациентов низкого риска и у здоровых, поэтому были предложены в качестве прогностических индикаторов худшего исхода.
В недавно опубликованной работе (2025 г.) также предпринята попытка классифицировать пациентов по типам мочевого микробиома – так называемым «уринотипам» [1]. Выделены, например, варианты микробиоты, где доминируют Prevotella или Corynebacterium; такие уринотипы значительно чаще наблюдались при раке и предположительно связаны с более агрессивным течением болезни.
Хотя эти данные нуждаются в дальнейшей валидизации, они указывают, что композиция мочевой микрофлоры может предсказывать вероятность рецидива и прогрессии НМИРМП.
4. Влияние микробиома на формирование ответа на лечение
Микробиота и эффективность BCG-терапии
Стандартным методом лечения НМИРМП является внутрипузырная иммунотерапия вакциной БЦЖ (Bacillus Calmette–Guérin).
BCG – аттенуированный штамм Mycobacterium bovis – вводится в мочевой пузырь с целью стимуляции локального противоопухолевого иммунитета. Однако эффективность BCG варьирует: у части пациентов заболевание рецидивирует несмотря на терапию. Одно из объяснений – различия индивидуального мочевого микробиома, который может влиять на приживление и иммунную активность BCG.
Ряд исследований проверили связь состава микробиоты с исходами BCG-терапии. По совокупности данных, альфа- и бета-разнообразие мочевой микрофлоры у пациентов, отвечающих на BCG, статистически не отличается от такового у резистентных пациентов [10]. Тем не менее, выявлены отдельные бактерии, наличие которых ассоциировано с успешным ответом на BCG. В частности, у пациентов-«респондеров» достоверно чаще встречались в моче такие микроорганизмы, как Serratia, Pseudomonas, Brochothrix и Negativicoccus. Эти рода могут каким-то образом синергировать с BCG, усиливая противораковый иммунитет.
Предполагается, что определенные комменсальные бактерии способны блокировать или, наоборот, усиливать действие BCG. Например, известно, что для проникновения в клетки и активации иммунных реакций BCG необходимо связываться с фибронектином и интегриновыми рецепторами уротелия. Если мочевой микробиом уже содержит бактерии, способные конкурировать за эти же участки связывания, они могут снизить эффективность BCG-терапии [10]. Показано, что некоторые условно-патогенные микробы (в теории – те же Staphylococcus или Streptococcus) способны «занимать» рецепторы на поверхности уротелия, тем самым мешая прикреплению BCG и ослабляя вызванное им воспаление.
С другой стороны, ряд бактерий (например, Pseudomonas) способен усиливать местный иммунный ответ и может нефункционально активировать сходные с BCG пути. Эти вопросы активно исследуются, поскольку понимание взаимодействия пробиома и BCG может помочь повысить эффективность терапии.
Пробиотики и профилактика рецидивов
Поскольку некоторые мочевого микробиома проявляют противовоспалительные свойства, возникла идея использовать пробиотики для влияния на течение заболевания. Особое внимание уделяется лактобациллам как составной части нормальной урогенитальной флоры у женщин.
Экспериментальные модели демонстрируют, что введение Lactobacillus способно замедлять рост опухоли мочевого пузыря у животных [16]. У людей еще в 1990-х гг. отмечено, что пероральный прием пробиотика Lactobacillus casei после ТУР опухоли уменьшает частоту рецидива НМИРМП [9, 17, 18].
Более поздние наблюдения и одно когортное исследование показало, что регулярное употребление ферментированных молочных продуктов, богатых лактобациллами, ассоциировано со снижением риска развития рака мочевого пузыря [19].
Недавно было опубликовано, что применение пробиотических препаратов на основе Lactobacillus достоверно уменьшает вероятность рецидива после радикальной цистэктомии [17].
Совокупно эти данные подтверждают, что обогащение мочевого тракта «полезными» микробами потенциально имеет профилактический и терапевтический эффект. Пробиотики могут уменьшать воспаление и препятствовать колонизации патогенами, тем самым создавая менее благоприятные условия для возврата опухоли.
Однако необходимы дополнительные рандомизированные исследования для внедрения пробиотической терапии в стандарты ведения НМИРМП.
5. Метагеномные и 16S-рРНК исследования мочевого микробиома
Приведенные выше сведения о микробном спектре мочи при раке мочевого пузыря основаны главным образом на молекулярно-генетических методах анализа.
16S рРНК секвенирование является «золотым стандартом» для профилирования бактериальных сообществ и широко применялось в рассмотренных работах. ДНК, выделенная из осадка мочи, подвергается ампликонному секвенированию участка гена 16S рибосомной РНК, что позволяет определить таксономический состав даже некультивируемых бактерий.
Например, в исследовании китайской группы (Wu и соавт., 2018) секвенирование 16S-рРНК выявило в моче мужчин с НМИРМП в среднем 120 оперативных таксономических единиц (OTU), тогда как в контрольной группе – лишь около 56 OTU, также ими были определены конкретные различия по родам (Acinetobacter, Anaerococcus, Sphingobacterium повышенное содержание при раке; Serratia, Proteus – сниженное) [9].
Другие работы также подтвердили пригодность 16S-подхода для выявления отличий микробиоты между пациентами и здоровыми. В дополнение к бактериальному профилированию, ряд современных исследований применяет метагеномный (shotgun) секвенс всей ДНК и методики метатранскриптомики и метапротеомики, позволяющие охватить и вирусные компоненты, и оценить функциональную активность микробиома.
Например, в образцах мочи у пациентов с НМИРМП помимо бактерий нередко определяются фрагменты ДНК вирусов (полиомавирус BK, вирусы герпеса и др.), хотя их роль в патогенезе пока неясна [20, 21].
Так, Wu и соавт. (2024) провели комплексный анализ мочи больных раком, сочетая 16S-секвенирование, таргетную метаболомику и цитокиновый профиль [5]. В результате была выявлена связь между определенными бактериями, метаболитами и воспалительными факторами.
Например, повышенное присутствие бактерий из семейства Actinomycetaceae положительно коррелировало с уровнем IL-6 в моче (r=0,58) на фоне НМИРМП, а сами пациенты имели характерный метаболический «отпечаток» – повышение жирных кислот и продуктов их окисления. После хирургического удаления опухоли микробный состав мочи значимо не изменился, оставаясь сходным с дооперационным (что может говорить о персистенции микробного дисбаланса). Зато уровни некоторых метаболитов (ацилкарнитинов) нормализовались [5]. Такой междисциплинарный подход позволил предложить многофакторную панель биомаркеров (см. ниже) и дал ключ к пониманию метаболических последствий микробного дисбиоза при раке мочевого пузыря.
Таким образом, применение современных методов секвенирования и метагеномного анализа существенно продвинуло наши знания о мочевом микробиоме при НМИРМП и его роли в патогенезе.
6. Диагностическое значение мочевого микробиома
Выявленные отличия мочевого микробиома между пациентами с раком и здоровыми позволяют рассматривать микробный профиль мочи как потенциальный диагностический маркер.
Несколько исследований последних лет предлагают алгоритмы распознавания рака мочевого пузыря по составу мочевой флоры. Так, Sheng и соавт. (2025) разработали диагностическую панель на основе 12 ключевых родов бактерий (включая Sphingomonas, Anaerococcus, Acinetobacter, Stenotrophomonas, Aeromonas, Novosphingobium и др.), которая определяла наличие рака с высокой точностью (AUC = 0,89 на обучающей выборке и 0,71 – на валидационной).
Авторы также ввели индекс пациента, интегрирующий микробиомные данные («Patient Differentiation Index»), позволивший достичь около 78% точности на независимых данных [1].
В другом исследовании была предложена комбинированная панель, включающая бактериальный компонент и показатели мочевого метаболома/иммунитета.
В частности, комбинация Actinomycetaceae (семейство бактерий), уровня арахидоновой кислоты (метаболит) и IL-6 (цитокин) дала выдающиеся результаты: чувствительность 94% и специфичность 100% для диагностики рака мочевого пузыря. Эти показатели превосходят традиционные мочевые маркеры (например, цитология, BTA-тест и др.). Хотя подобные панели пока находятся на этапе исследований, они демонстрируют реальную возможность использования мочевого микробиома в ранней диагностике НМИРМП.
7. Прогностическое значение мочевого микробиома
Не менее важно и прогностическое значение микробиоты. Как обсуждалось выше, определенные характеристики мочевого микробиома ассоциированы с риском рецидива и прогрессирования опухоли.
Это открывает перспективу использования микробиомных индикаторов для стратификации пациентов по риску. Например, наличие в моче обильного роста Porphyrobacter или Herbaspirillum может сигнализировать о необходимости более тщательного наблюдения из-за повышенной вероятности рецидива.
С другой стороны, доминирование Lactobacillus и низкое общее разнообразие микробов, напротив, может указывать на благоприятный прогноз.
Конечно, до практического применения этих критериев предстоит провести огромное количество исследований, валидировать результаты на больших выборках и стандартизовать методы. Тем не менее, уже сейчас мочевой микробиом рассматривается как часть «биомаркёрного портрета» пациента с НМИРМП наряду с молекулярно-генетическими показателями опухоли. В будущем профилирование мочевой микрофлоры, вероятно, войдет в комплекс неинвазивных тестов для диагностики и прогнозирования течения рака мочевого пузыря.
Выводы
В последние 5–7 лет исследование мочевого микробиома при немышечно-инвазивном раке мочевого пузыря значительно продвинулось. Показано, что моча пациентов с НМИРМП содержит отличающийся от нормы набор микроорганизмов: повышено разнообразие и доля ряда грамотрицательных условно-патогенных бактерий (Proteobacteria), тогда как «здоровые» симбионты (лактобациллы и др.) угнетены.
Эти микробные сдвиги могут иметь биологические последствия – от активации хронического воспаления и повреждения ДНК уротелия до модуляции местного иммунного ответа.
Состав мочевой микрофлоры коррелирует с клиническим поведением опухоли: выявлены микробные маркеры, условно связанные с риском рецидива и ответом на терапию (например, некоторые бактерии чаще встречаются у пациентов, хорошо отвечающих на БЦЖ).
В то же время пробиотические микроорганизмы, особенно Lactobacillus, вероятно, выполняют протективную роль, что отражается в более низкой заболеваемости и частоте рецидивов при их присутствии. Мочевой микробиом уже показал свою ценность как источник потенциальных биомаркеров: разработаны первые диагностические панели рака мочевого пузыря по микробному составу мочи с высокой чувствительностью и специфичностью.
Однако множество вопросов остается открытыми.
Требуются дальнейшие исследования для выяснения причинно-следственных связей:
- Является ли обнаруженный дисбиоз фактором, способствующим возникновению опухоли, или же он вторичен по отношению к опухолевому процессу?
- Каковы точные механизмы влияния отдельных микробов на клетки мочевого пузыря и иммунную систему?
- Может ли модификация микробиоты (например, пробиотиками или антибиотиками) улучшить исходы лечения НМИРМП?
Для ответа на эти вопросы необходимы как широкомасштабные клинические наблюдения, так и фундаментальные эксперименты. Тем не менее, уже ясно, что мочевой микробиом – неотъемлемая часть опухолевого микросреды при раке мочевого пузыря. Его учет способен обогатить наше понимание патогенеза, улучшить стратификацию пациентов и в перспективе привести к новым методам профилактики и терапии этого заболевания.
Литература
- Sheng, Z., Liu, J., Wang, M. et al. Exploring bladder cancer through urinary microbiota: innovative «urinetypes» classification and establishment of a diagnostic model. J Transl Med 23, 809 (2025). https://doi.org/10.1186/s12967-025-06518-y
- Lopez-Beltran A, Cookson MS, Guercio BJ, Cheng L. Advances in diagnosis and treatment of bladder cancer. 2024. https://doi.org/10.1136/bmj-2023-076743
- Sylvester R, Gontero P, Oddens J, Reply to Stephen B, Williams, Ashish M. Kamat’s Letter to the re: Samantha Cambier, Sylvester RJ, Collette L et al. EORTC Nomograms and Risk Groups for Predicting Recurrence, Progression, and Disease-specific and Overall Survival in Non-Muscle-invasive Stage Ta-T1 Urothelial Bladder Cancer Patients Treated with 1–3 Years of Maintenance Bacillus Calmette-Guerin. Eur Urol. 2016;69:60–69. European Urology. 2016;69(6):E123-E4. https://doi.org/10.1016/j.eururo.2016.01.055
- Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021;71(3):209–49. https://doi.org/10.3322/caac.21660
- Wu, C., Wei, X., Huang, Z. et al. Urinary microbiome dysbiosis is associated with an inflammatory environment and perturbed fatty acids metabolism in the pathogenesis of bladder cancer. J Transl Med 22, 628 (2024). https://doi.org/10.1186/s12967-024-05446-7
- Wolfe AJ, Toh E, Shibata N, et al. Evidence of uncultivated bacteria in the adult female bladder. J Clin Microbiol. 2012;50(4):1376–83. https://doi.org/10.1128/JCM.05852-11.
- Heidar NA, Bhat TA, Shabir U, Hussein AA. The urinary microbiome and bladder cancer. 2023;13(3):812. https://doi.org/10.3390/life13030812.
- Chen MF, Lin PY, Wu CF, Chen WC, Wu CT. IL-6 expression regulates tumorigenicity and correlates with prognosis in bladder cancer. PLoS ONE. 2013;8(4): e61901. https://doi.org/10.1371/journal.pone.0061901.
- Wu P, Zhang G, Zhao J, Chen J, Chen Y, Huang W, Zhong J and Zeng J (2018) Profiling the Urinary Microbiota in Male Patients With Bladder Cancer in China. Cell. Infect. Microbiol. 8:167. doi: 10.3389/fcimb.2018.00167
- Heidar NA, Bhat TA, Shabir U, Hussein AA. The Urinary Microbiome and Bladder Cancer. Life. 2023; 13(3):812. https://doi.org/10.3390/life13030812
- Hussein, A.A.; Elsayed, A.S.; Durrani, M.; Jing, Z.; Iqbal, U.; Gomez, E.C.; Singh, P.K.; Liu, S.; Smith, G.; Tang, L.; et al. Investigating the association between the urinary microbiome and bladder cancer: An exploratory study. Oncol. 2021, 39, 370.e9–370.e19.
- Bi, H.; Tian, Y.; Song, C.; Li, J.; Liu, T.; Chen, Z.; Chen, C.; Huang, Y.; Zhang, Y. Urinary microbiota—A potential biomarker and therapeutic target for bladder cancer. Med. Microbiol. 2019, 68, 1471–1478.
- Oresta B, Braga D, Lazzeri M, et al. The Microbiome of catheter collected urine in males with bladder cancer according to disease stage. J Urol. 2021;205(1):86–93. https://doi.org/10.1097/JU.0000000000001336.
- Zeng J, Zhang G, Chen C, et al. Alterations in urobiome in patients with bladder cancer and implications for clinical outcome: a single-institution study. Front Cell Infect Microbiol. 2020;10: 555508. https://doi.org/10.3389/fcimb.2020.555508.
- Garrett, W.S. Cancer and the microbiota. Science 2015, 348, 80–86.
- Bučević Popović, V., Šitum, M., Chow, CE.T. et al. The urinary microbiome associated with bladder cancer. Sci Rep 8, 12157 (2018). https://doi.org/10.1038/s41598-018-29054-w
- Aso, Y., Akaza, H., Kotake, T., Tsukamoto, T., Imai, K., and Naito, S. (1995). Preventive effect of a Lactobacillus casei preparation on the recurrence of superficial bladder cancer in a double-blind trial. BLP Stud. Group. Eur. Urol. 27, 104–109. doi: 10.1159/000475138
- Zitvogel, L., Daillère, R., Roberti, M. P., Routy, B., and Kroemer, G. (2017). Anticancer effects of the microbiome and its products. Rev. Microbiol. 15, 465–478. doi: 10.1038/nrmicro.2017.44
- Aso, Y.; Akazan, H. Prophylactic effect of a Lactobacillus casei preparation on the recurrence of superficial bladder cancer. BLP Study Group. Int. 1992, 49, 125–129.
- Hrbáček, J.; Hanáček, V.; Kadlečková, D.; Cirbusová, A.; Čermák, P.; Tachezy, R.; Zachoval, R.; Saláková, M. Urinary shedding of common DNA viruses and their possible association with bladder cancer: A qPCR-based study. Neoplasma 2023, 70, 311–318.
- Yao, X.; Xu, Z.; Duan, C.; Zhang, Y.; Wu, X.; Wu, H.; Liu, K.; Mao, X.; Li, B.; Gao, Y.; et al. Role of human papillomavirus and associated viruses in bladder cancer: An updated review. Med. Virol. 2023, 95, e29088.
Материал подготовила Шадеркина В.А.
Представленный материал МОЖЕТ быть использован в научных публикациях, презентациях, докладах
и обсуждениях в узком профессиональном сообществе





















Комментарии