
Рогачиков В.В.
к.м.н., руководитель Центра урологии, нефрологии и литотрипсии; ЧУЗ
«Клиническая Больница
«РЖД-Медицина» им. Н.А. Семашко (г. Москва)

Богорад И.В.
д.м.н., профессор, почетный член Российской Медицинской
Ассоциации (г. Москва)

Кудряшов А.В.
врач-уролог ЧУЗ
«Клиническая Больница
«РЖД-Медицина» им. Н.А. Семашко (г. Москва)

Игнатьев Д.Н.
врач-уролог ЧУЗ «Клиническая Больница «РЖД-Медицина» им. Н.А. Семашко (г. Москва)
Мочекаменная болезнь (далее МКБ) имеет тысячелетнюю историю, всемирное распространение, частое рецидивирование и занимает ведущее место в структуре хирургических болезней органов мочевой системы. Путь становление урологии как клинической дисциплины тернист и связан с этапами зарождения и формирования как науки современной области хирургии. Прогресс технической мысли, достижения фундаментальной науки, закономерно привели к формированию урологии и, в частности, хирургии уролитиаза на базе новых концепций оперативных возможностей, дооперационной диагностики, новых методов физического воздействия на структуру конкремента. Создание и совершенствование новых малотравматичных методик, активное и широкое их внедрение в практику, способствовало вытеснению, применяемых веками открытых травматических вмешательств, и позволило успешно, с минимальными осложнениями удалять камни из мочевых путей.
Часть 2. От экстракорпоральной литотрипсии до перкутанной нефролитолапаксии
К настоящему времени хирургия урологических проблем сделала существенные шаги, не сравнимые с предыдущим историческим периодом (Часть 1. От трансперинеальной литотомии к секционной нефротомии). И тем не менее, достижения хирургии уролитиаза не привели к достаточ ному успеху. Научный и технологический прорыв XVIII-XIX вв. не снял вопрос о перспективах улучшения результатов лечения уролитиаза. Мочекаменная болезнь (далее МКБ) до сих пор продолжает занимать важное место в повседневной практике уролога и практикующих врачей общего профиля. Почему?
«История – сокровищница наших деяний, свидетельница прошлого, пример и поучение для настоящего, предостережение для будущего»
Сервантес де Сааведра
В основе МКБ, как известно, лежат нарушения обменных процессов в организме, зачастую развивающиеся на фоне морфофункциональных изменений в мочевыделительной системе, наследственной предрасположенности, заболеваний эндокринной системы. В среднем риск заболеваемости уролитиазом колеблется в пределах 5-10%.
Распространенность МКБ в Европе колеблется в пределах 5-10%, в США – 7- 15%, в восточных странах – 1-5%. Распространенность уролитиаза зависит от климатических, этнических, диетических и генетических факторов. Частота ре- цидивирования МКБ достигает 50-75% в интервале 5-10 лет. Примерно у 50% больных с рецидивирующим течением на протяжении всей жизни наблюдается лишь 1 эпизод камнеобразования. Большое количество рецидивов характерно для 10% всех случаев МКБ. Наиболее ранний рецидив кальций-оксалатной формы – 7,5 месяцев, фосфатной – 4 месяца.
В России ежегодный прирост числа больных с впервые установленным диагнозом МКБ в 2016 году составил 21,3%. В 2016 г. зарегистрировано 866 742 больных с диагнозом мочекаменная болезнь [1]. Из всех известных форм МКБ, коралловидный нефролитиаз – наиболее тяжелая и составляет от 3% до 30% всех диагностированных случаев (рис. 1, 2) [2].
За последние 20 лет оперативная активность при МКБ возросла с 30% до 97%. Ежегодно в России по поводу МКБ выполняется около 200 000 операций, из них только 17% – высокотехнологичных [3]. Несмотря на использование навигационных методов интраоперационного выявления бессосудистых участков при нефротомии, позволяющих удалять даже коралловидные камни без существенного нарушения функции почки, показания к открытой операции в настоящее время ограничены. По мере развития комбинированных эндоскопических ин- траренальных технологий, к абсолютным показаниям открытого доступа можно отнести только один пункт – нефункционирующая почка, который может быть
легко заменен на лапаро – или ретроперитонеоскопический.
В урологии, как и во всей хирургии, всегда оставались трудные вопросы и проблемы. Нередко их решение являлось камнем преткновения, но, к счастью, на определенный период времени. Конечно, это касается основных стремлений хирургической профессии – снижение травматичности операций, минимальный объем кровопотери, совершенствование диагностики, короткий послеоперационный период и др. Во многом эти задачи удалось решить с внедрением экстракорпоральных и минимально-инвазивных методов фрагментации конкрементов. Совсем недавно, экстракорпоральная и чрескожная нефролитотрипсия явились альтернативой открытым операциям.
Мотивом для разработки новых миниинвазивных методик лечения МКБ, послужили следующие постулаты: 1) несоответствие времени, затрачиваемого на выполнение доступа и завершения основного этапа операции; 2) высокий трав- матизм и значимое уменьшение объема функционирующей паренхимы почки; 3) невозможность интраоперационной визуализации внутренних структур объекта вмешательства; 4) высокий уровень осложнений после стандартных операций;
5) длительный срок реабилитации.

Рис. 3. Аппарат для дробления камней Урат, 2М
Создание и внедрение дистанционных и перкутанных методов лечения МКБ происходило параллельно, с на- чала 50-х годов прошлого столетия, благодаря разработке оборудования для литодеструкции в водной среде, основанного на электро-гидравлическом принципе воздействия, откры- того Л.А. Юткиным (1950 г.), а также возможностям пункционного доступа в полостную систему почки (рис. 3).
Высокоточные и информационноемкие приборы и конструкции способствовали выработке новых подходов к диагностике и лечебным концепциям.
Последние обстоятельства имели исключительную важность для организации подготовки хирургов высокого уровня (рис. 4).
Рис. 4. Сеанс современной экстракорпоральной литотрипсии упациента с высокой степенью ожирения
Новым важным этапом в лечении МКБ явилось первое успешное клиническое применение дистанционной электро-гидравлической литотрипсии (ДУВЛ), выполненное профессо- ром Ch. Chaussy 7 февраля 1980 года в Университетской урологической клинике г. Мюнхен. В нашей стране первая экстракорпоральная фрагментация произведена в 1987 г. в НИИ Урологии МЗ СССР под руководством академика Н.А. Лопаткина.
Первоначально большие надежды возлагались на дистанционные технологии по причине их малой травматичности. Так, в 80-е годы частота применения хирургических методов лечения МКБ, в развитых (в отношении уровня здравоохранения) странах мира, выглядела следующим образом: ДУВЛТ – 87%, перкутанная нефролитотрипсия (далее ПНЛЛ) – 9%, открытый доступ – 4% [4].
По мере разработки, накопления опыта и использования приборов для более эффективных видов формирования ударной волны – электро-магнитных и пьезо-электрических (1985-1986 гг.), электро-кондуктивных (1994 г.), открылись дополнительные возможности, но и существенные ограничения применения ме- тода. Оказалось, что результативность ДУВЛТ зависит от исходных размеров конкремента, его плотности, с увеличением которых эффективность метода снижается и увеличивается число послеоперационных осложнений (обострение хронического пиелонефрита, образование «каменной дорожки» мочеточника, развитие субкапсулярных и паранефральных гематом) [5].
Накопление опыта, дало возможность уменьшить число противопоказаний применения метода. Экспериментально доказано, что ДУВЛТ не вызывает повреждения, даже кальцифицированной, сосудистой стенки и может быть применена при аневризмах брюшного отдела аорты, магистрального ствола и ветвей почечной артерии.
И все же, показания к ДУЛТ должны соответствовать следующим критериям:
- аневризма аорты – не более 5 см;
- аневризма почечной артерии – не более 2 см в диаметре;
- расстояние от фокального пятна не менее 5 см.
Обоснована и клинически подтверждена возможность применения метода у пациентов с нарушением ритма сердца и наличием ЭКС, т.к. синхронизация электро-магнитных импульсов с водителем ритма обеспечивает безопасность его работы [6]. Опыт многочисленных сеансов ДУВЛТ при постинфарктном кардиосклерозе, артериальной гипертензии, ишемической болезни сердца, после аорто- коронарного шунтирования, ангиопластики и стентирования доказал безопас- ность применения метода при серьезных интеркуррентных заболеваниях.
Расширены рамки применения ДУВЛТ при хроническом пиелонефрите, почечной недостаточности, аномалиях развития, кистах и опухолях почек, язвенной патологии ЖКТ, инфравезикальной обструкции, коагулопатиях, ожирении и трансплантированной почки.
Все чаще появляются сообщения о применении метода у беременных (в ранние сроки и после 25 нед.) [7].
Также доказано, что ДУВЛТ при коралловидном нефролитиазе малопродуктивна, а в некоторых случаях абсолютно противопоказана.
Конечно, современные литотрипторы обладают, можно сказать, уникальными возможностями, например, образование стабильной однородной плазмы в фокусе, высоким давлением ударной волны (более 1000 бар) с фрагментацией высокоплотных камней (более 1500 HU), дастинг-эффектом, даже при размерах более 2 см, вариабельным фокальным объемом для адаптации под размеры камня, изменяемой глубиной пенетрации для применения у пациентов с недо статком питания и массой тела до 200 кг, высокой эффективностью и уменьшением необходимости повторных сеансов до 15-20%, ультразвуковой фокусировкой «свободной рукой», сенсорным автозаведением, двойным контролем этапа фрагментации, минимальным уровнем паренхиматозной травмы и геморрагических осложнений.
Однако после многолетнего периода использования дистанционной технологии, определена целесообразность ее применения только при неосложненных формах МКБ, размерах камня не более 2,0 см с плотностью до 1000 единиц HU [8]. Даже в Германии, называемой «матерью ударно-волновых технологий», некоторые крупные госпитали приняли решение не приобретать новые аппараты в связи с прогрессивным развитием более «быстрых» и предсказуемых методов. Для увеличения эффективности лечения и ускорения периода реабилитации, на современном этапе происходит постепенное замещение экстракорпоральных операций мини– и микроперкутанными технологиями, предполагающими литодеструкцию и экстракцию высокоплотных камней малых (менее 1-2 см) размеров.
Создание и развитие специализированной эндоскопической техники в начале 80-х годов (M. Marberger совместно с Richard Volf GmbH, Germany, K. Korth совместно с Olympus Winter und Ibe, Germany, Hautmann совместно с K. Storz, Germany) – контактных литотрипторов (электрогидравлический 1955 г.), ультразвуковой, лазерный – (60-80-е гг.), пневматический (1988 г.), позволили расширить показания для применения малотравматичных вмешательств, в т. ч. при осложненном течении нефролитиаза [9, 10].
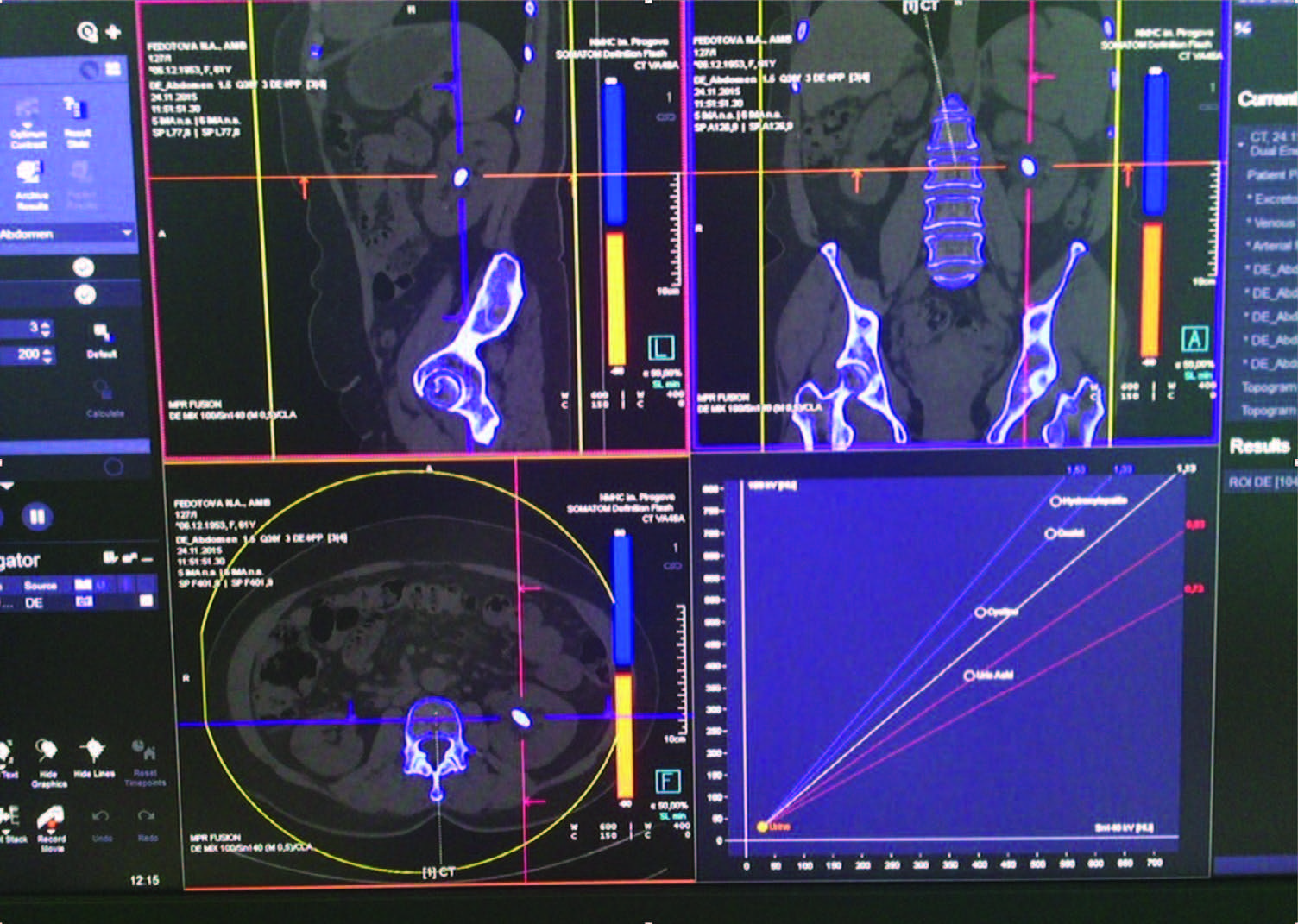
Рис. 5. МСКТ (моделирование доступа, определение структуры камня)
Ретроспективный анализ результатов лечения пациентов с МКБ (1985–2014 гг.) показал, что доля дистанционных технологий за эти годы с 85,6% снизилась до 21,3%, а ретроградных эндоскопических методов с 4,4% возросла до 76% [11]. Совершенствование и внедрение в лечебный процесс новых компьютерных навигационных технологий, расширили возможности и перспективы хирургии уролитиаза.
На современном этапе развития техники, передовые радиологические станции обеспечивают полноценную информацию по объему, плотности и даже предположительной структуре камня, а также определяют возможность получения трехмерного изображения высокого разрешения, оптимального выбора точки пункции и планирования траектории движения инструмента в режиме реального времени (рис. 5).
Наиболее рациональным методом лечения при нефролитиазе является сегодня перкутанная нефролитолапаксия, использующая пункционнодилятационную технику доступа, в сочетании с тремя видами навигации и визуализации (ультразвуковой, рентген-телевизионной и эндоскопической) и различные тех нологии дезинтеграции конкрементов (рис. 6).
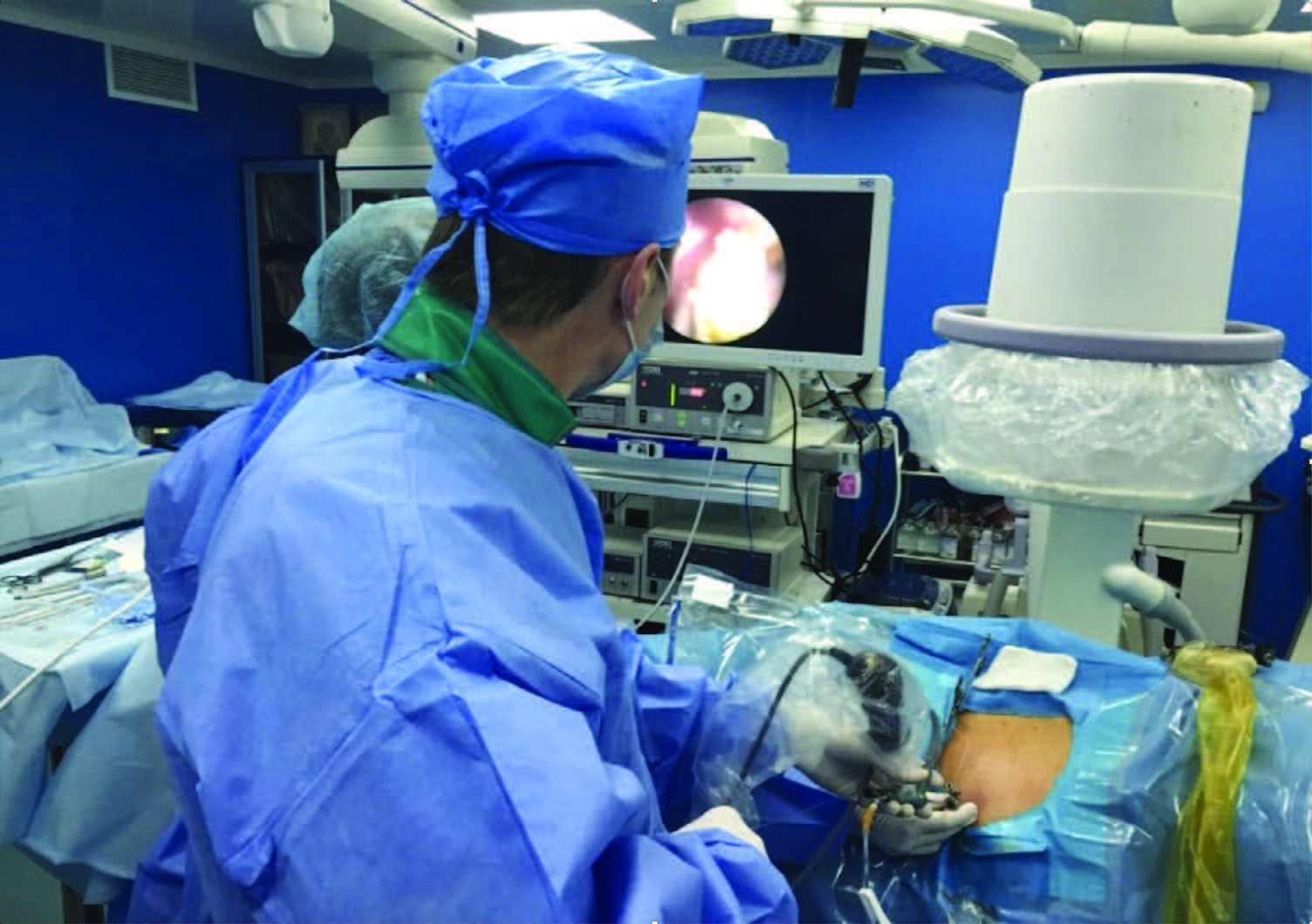
Рис. 6. Перкутанная нефролитолапаксия. Этап нефролитотрипсии
Метод позволил значимо уменьшить площадь травмируемой паренхимы, сохранить ее функциональную полноценность, нивелировать риски интраи послеоперационных осложнений, сократить сроки анальгезии и госпитального периода.
Практический опыт и комплексные научные исследования показали, что:
- Одна из основных проблем МКБ – высокая частота послеоперационных рецидивов, которые могут формироваться у 50% пациентов в течение 5-летнего периода, а ежегодная вероятность рецидива камнеобразования может достигать 14,4 – 15,2% [3];
- На долю чрескожных пособий при нефролитиазе как монотерапии приходится от 45% до 60% оперативных вмешательств [12];
- Функциональная способность почки, после перкутанного доступа восстанавливается в среднем через 72 часа [13];
- Фокальный дефект паренхимы почки после формирования кожно-почечного канала и нефролитотрипсии выявлен при сканировании с технецием только у 18% пациентов [14];
- Глобальное изучение результатов и осложнений перкутанной нефролитолапаксии в 96 специализированных центрах Европы, Азии и Америки подтвердило высокую эффективность и безопасность метода (CROES PCNL Study Group, (2011) [15];
- Распределение результатов: без осложнений – 79%, постоперационных осложнений по Clavien I – 11,1%, II – 5,3%, IIIa – 2,3%, IIIb – 1,3%, IV – 0,5%, V – 0,03% (Ozden E. (2011), Scarpa R. (2011) [16];
- Практический опыт показывает, что для освоения ПНЛЛ хирург должен выполнить не менее 50 операций, а очень хорошие навыки приобретаются после выполнения более 100 вмешательств [17].
Уместно заметить, что качество диагностики и лечения (аксиома!) зависит не только от наличия технологических возможностей и мануального опыта. В целом для быстрейшего восстановления здоровья пациента, в первую очередь необходимо своевременно установить диагноз, назначить и провести соответствующее конгруэнтное лечение. При этом и студент, и выпускник мединститута, а особенно молодой врач, должны четко понимать отличие современного диагноза от того, что понималось под этим в XIX веке и особенно ранее. Диагноз нашего времени – нозологический и патогенетический; диагноз XIX века – преимущественно симптоматический. Не вдаваясь далее в эту проблему, подчеркнем, что диагноз болезни человека – самый сложный процесс познавательной деятельности человека.
- Чрескожная нефролитотрипсия широко известная и высокоэффективная методика лечения МКБ. Тем не менее, в США не более 11% урологов владеют соответствующей квалификацией для выполнения данного оперативного вмешательства, а в РФ, по мнению экспертов, не более 3-5% [9]. В качестве современной ремарки автора – в настоящее время значительно больше.
- Альтернативные методы минимально-инвазивного лечения нефролитиаза также широко известны и направлены на улучшение результатов вмешательства – многопортовая, бездренажная ПНЛЛ, на спине (supine position), ранняя повторная нефроскопия, «sandwich»-хирургия, миди– (мини-, ультра-мини-, микро-) технологии (рис. 7).
Мировой опыт диагностики и лечения нефролитиаза показывает, что для улучшения результатов данного вида операций, назрела необходимость разработки и осуществления мероприятий по оптимизации технологического процесса и дальнейшего улучшения результативности каждого этапа – навигации, чрескожной пункции, формировании доступа, литодеструкции и экстракции, дренирования и закрытия кожно-почечного канала.
Рис. 7. Многопортовая методика при коралловидном нефролитиазе (доступ через среднюю и нижнюю чашечку)
Здесь также уместно будет остановиться на не менее важной, чем техническая сторона, еще на одной проблеме уролитиаза и его лечения.
Рост технической вооруженности хирургии (и урологии!) в XIX в. вызвал определенную настороженность из-за необходимости все чаще прибегать к опосредованным методам изучения больного, показаний многочисленных приборов, биофизических и биохимических данных. Оказалось, что спонтанная ситуация нашла в себе возможность (вероятность!) недооценки личности больного, сложного мира его переживаний, условий жизни и т.д.
Н.М. Амосов, говоря о применении новейших, все более сложных технологических конструкций, отмечал, что наступает эра кибернетики – это не столько техника, сколько перестройка врача.
Эта естественно развивающаяся ситуация в определенной степени актуальна и сегодня. Особенно в комплексе обучения, воспитания – формирования врача, особенно хирурга. И в контексте урологии, необходимо учитывать не только техническую сторону, но и на базе нового, развивающегося клинического мышления и особенностей личности врача и больного.
Появление доказательной медицины отнюдь (как показывает мировая практика) не снимает обсуждаемые проблемы. Постулированный подход, так или иначе, требует осознанного, творческого подхода (а не строгого выполнения канонизированных установок для всех ситуаций). Если обратиться к произведениям (атласам, руководствам, учебникам) корифеев дальнего и ближнего прошлого, их бесценный опыт все равно будет бесконечно долго служить маяком для настоящих врачей в их служении человеку. К примеру, мудрец Гиппократ был к тому же и вдумчивым и осторожным врачом. Быстрое оперирование (отсутствие обезболивания и асептики!) вовсе не было самоцелью. Главное, писал Гиппократ, в действиях хирурга должно быть благо больного. «Во всем том, что требует хирургического воздействия, сечения или прижигания – считал Гиппократ, – рекомендуется в равной мере скорость и медленность, ибо есть нужда и в той и другой. Именно, у кого операция делается одним сечением, разъятие следует делать быстро; ибо так как приходится оперируемым страдать, причиняющее боль должно быть в них наиболее короткое время. Но где необходимо делать многие сечения, там должно употреблять медленную работу рук, ибо скорость причиняет непрерывную и большую боль» [18].
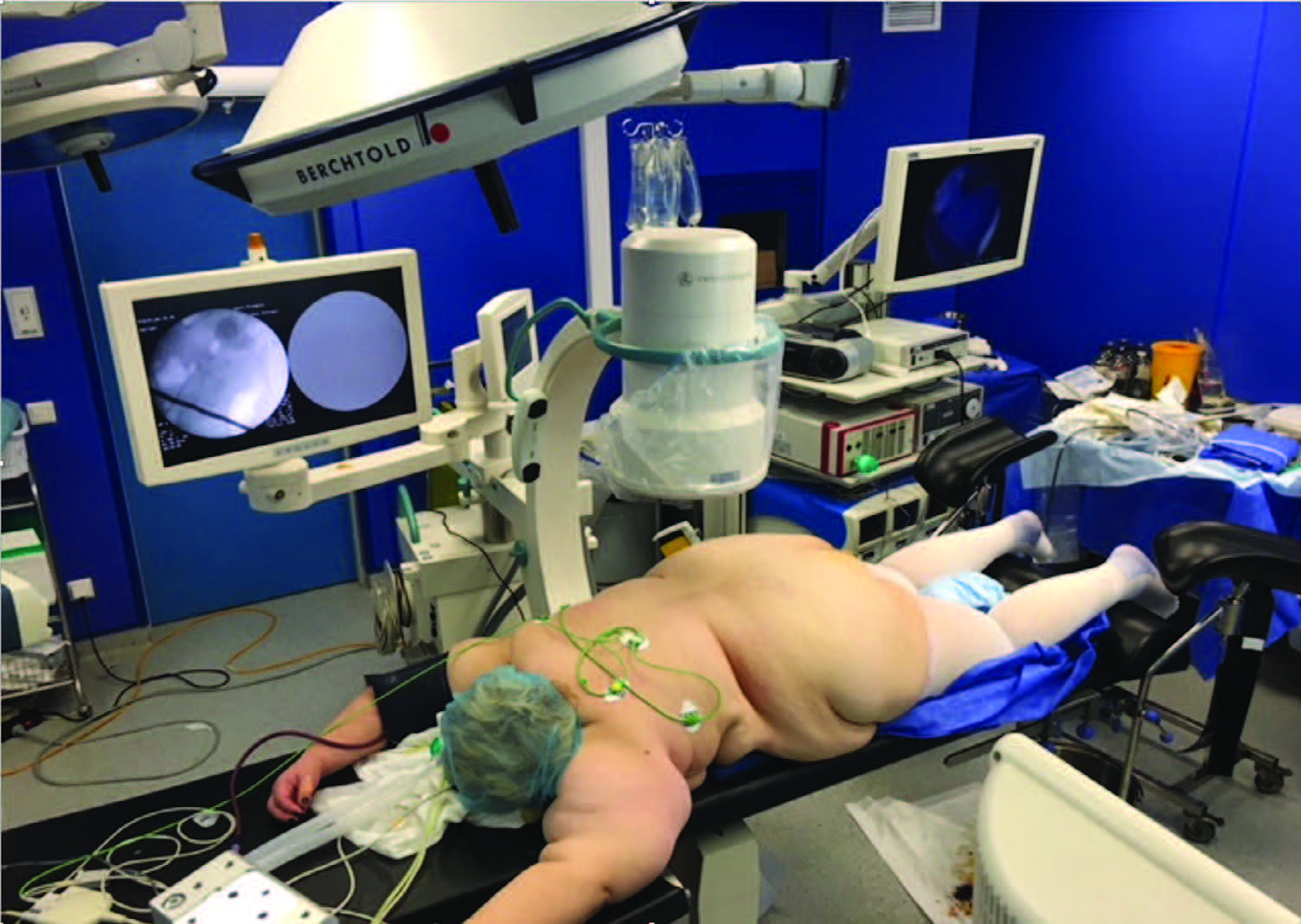
Рис. 8. Классическая позиция при ПНЛЛ (proneposition) у пациента с ожирением
Вернемся к «технологическому» процессу, точнее – стремлению к улучшению лечебного процесса.
В первую очередь принимается решение об оптимальном положении пациента на операционном столе во время основного этапа операции. Классическая позиция в положении на животе (prone position) впервые описана в 1976 г. Рассчитана на уменьшение рисков повреждения толстой кишки и других внутренних органов. Учитывая положительные стороны в виде максимальной площади для манипуляций и удобства установки дополнительных портов, данный вид вмешательства удлиняет время на интраоперационную переукладку пациента, увеличивает анестезиологические риски в связи с компрессией брюшной полости и уменьшением сердечного выброса, особенно при высокой степени ожирения (рис. 8) [19].
К тому же, вероятность сдавления глазного яблока опасно травмой роговицы, повышением внутриглазного давления и ишемическими повреждениями сетчатки [20]. Для пациентов с анкилозирующим спондилоартритом и другими деформациями позвоночника имеются анатомические ограничения для применения позиции. Для коррекции ограничений положения, улучшения легочной вентилляции, снижения интенсивности абдоминальной компрессии, улучшения кровообращения, разработаны специальные прокладки, седла, матраcы, шлемы для придания оптимальной позиции пациента на операционном столе и защиты критических зон [21].
Для обеспечения симультанных нефроскопических и уретероскопических процедур у женщин Т. Леман и Д. Багли (1986 г.) разработали обратную литотомическую позицию. Три года спустя те же авторы упростили методику и предложили prone po- sition с разведенными ногами, что позволило использовать, но с некоторыми ограничениями свободы манипуляций, методику и у мужчин [22]. Модификация положения на животе со сгибанием операционного стола до 30°, применима у пациентов с коротким реберно-подвздошным расстоянием или анатомических особенностях таза, что не исключает развитие респираторных и кардиальных осложнений [23].
Дальнейшие поиски безопасной позиции, привели к использованию бокового положения (Kerbl, 1994) с разгибанием операционного стола и укладкой разведенных ног на подставках. Несмотря на анестезиологические преимущества этой позиции (возможность региональной анестезии), имеется ряд недостатков – трудности рентгенологического позиционирования и осуществления доступа [24]. Модифицированное положение для литотомии с ротацией туловища на здоровую сторону имеет достаточную площадь оптимальной пункции, обеспечивает приемлемый угол наклона инструментов. Однако, использование данной позиции, требует определенной костно-мышечной подвижности и гибкости позвоночника пациента, а также владения хирургом навыками сложного радиологического контроля при осуществлении доступа [25].
В 1988 г. испанский уролог Jose Gabriel Valdivia Uria (Hospital Clinico Universitario Losano Blesa de Zaragosa) разработал теоретические основы оперативного лечения в положении «на спине». Предусматривалось, что направление пункционного тракта должно обеспечивать поддержание низкого интраренального давления и профилактику пиеловенозных рефлюксов, а также пассивное отмывание фрагментов камня. Результаты применения метода Valdivia Uria у 557 пациентов были опубликованы только через 10 лет. Такой довольно внушительный опыт, показал, что положение supine position в меньшей степени опасно повреждением толстой кишки из-за отсутствия абдоминальной компрессии, к недостаткам можно отнести трудности многопортовой методики, неудобства в применении ретроградной и только гибкой уретероскопии [26, 27].
Позднее автор предложил модификацию, позволяющую применять ригидную уретероскпию в сочетании с чрескожными манипуляциями (наклонное положение сочетается с согнутой ипсилатеральной и вытянутой контрлатеральной ногой). Испанский врач Ibarluzea G. (2007 г.) описал и применил новую Galdakao – модифицированную позицию Valdivia Uria, при которой контрлатеральная нога сгибается и достигается достаточный разворот туловища с использованием гелевой подушки под зоной операции. Позиция обеспечивает хирургические и анестезиологические преимущества с возможностями сочетанных ретроградных манипуляций [28]. На наш взгляд, данная укладка является идеальной для проведения сочетанных и комбинированных эндоскопических интраренальных манипуляций. Еще один вариант – модификация позиции Барта – предназначался для улучшения удобства манипуляций в положении на спине с разворотом на 15° и заключался в расположении поддерживающих мешков и гелевых подушек под грудной клеткой и тазом, освобождающих пространство для осуществления доступа и позволяющих применить комбинированные интраренальные технологии (рис. 9) [29].
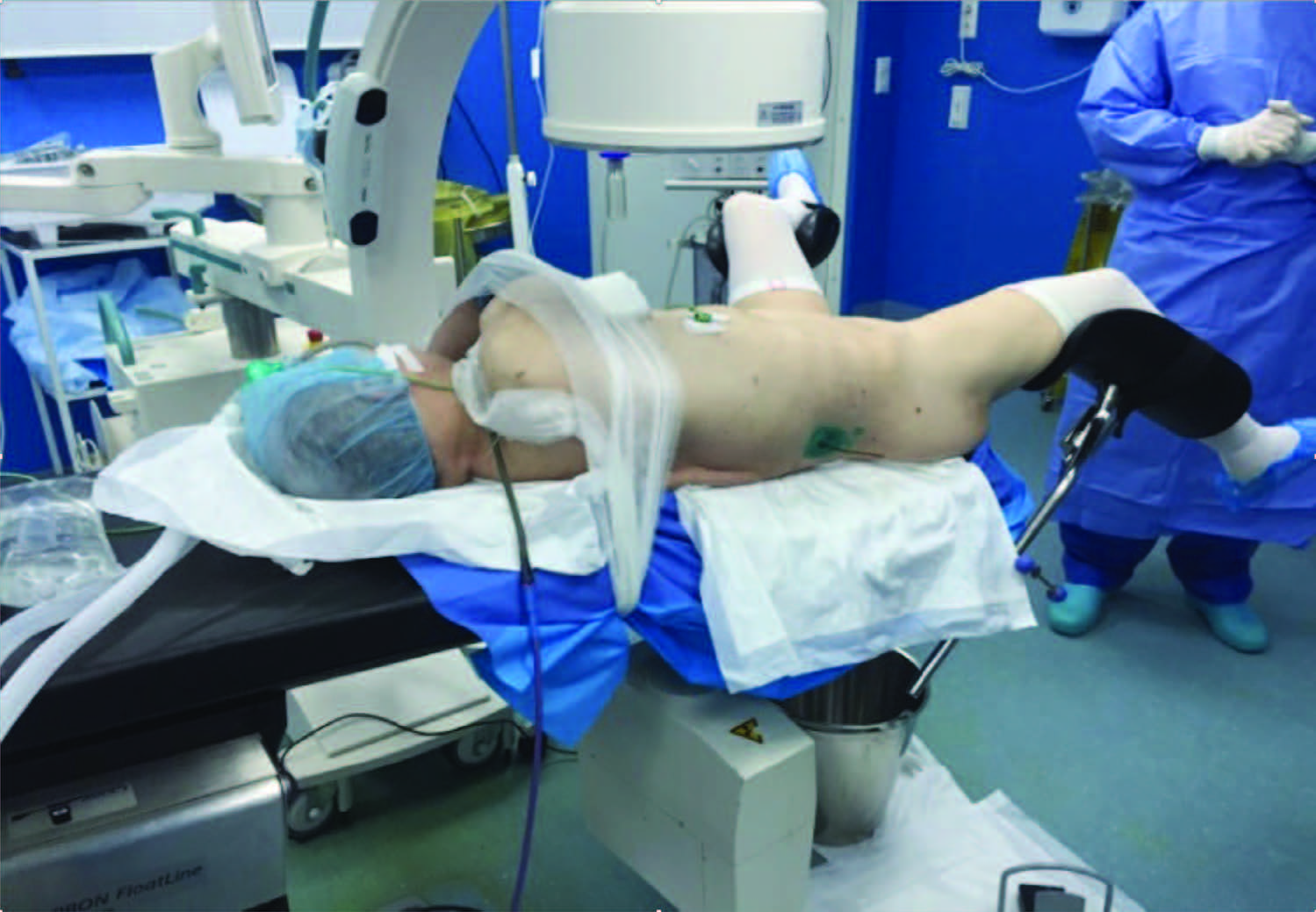
Рис. 9. Укладка пациента в положении на спине (Galdakao-модифицированная позиция Valdivia)
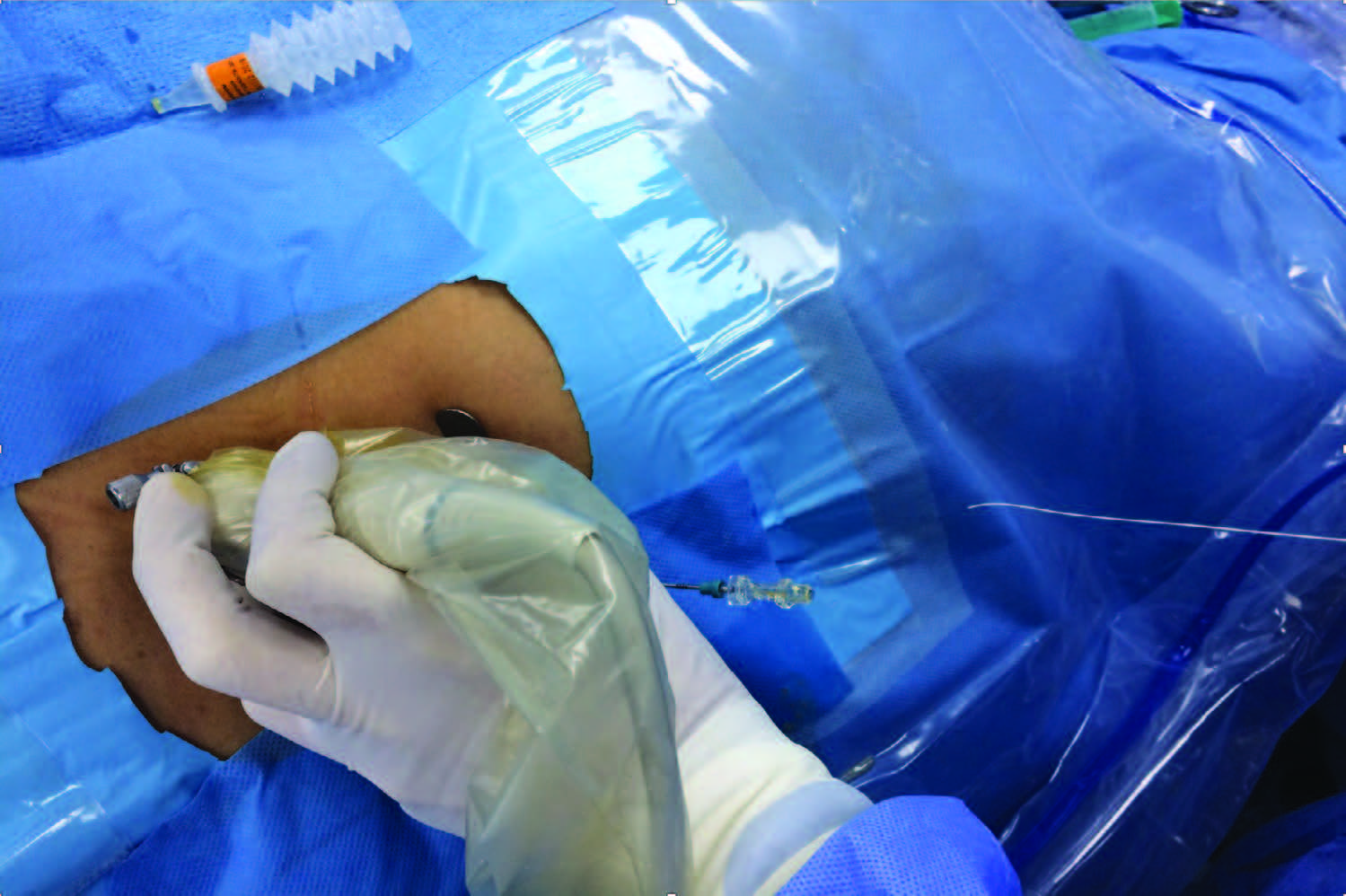
Рис. 10. Ультразвуковая моно-навигация на этапе формирования доступа
Новые возможности манипуляций непосредственно на операционном столе (во время выполнения вмешательства), требует постоянного и строгого контроля всех этапов.
Рентгенологическая, ультразвуковая навигация и эндовидеоскопия – основные методы контроля, как первого, так и последующих этапов перкутанного вмешательства, имеют при этом значительные ограничения для безопасности выполняемых манипуляций. Бипланарная флюороскопия с использованием С-дуги до сих пор наиболее часто (до 60%) применяемый метод [30]. В виде процедуры моно-навигации применяется в ограниченных ситуациях (у 10%) ультрасонография. Она чаще используется у детей, молодых женщин, у лиц астеничного телосложения, в тоже время ультрасонография обладает весьма значимыми преимуществами, как отсутствие лучевой нагрузки и наличие визуального контроля за окружающими висцеральными тканями и внутренними органами (рис. 10) [31].
При отсутствии дилатации полостной системы почки, множественном или комбинированном нефролитиазе, аномалиях топографии почек и морбидном ожирении, возможно применение сочетанной навигации с эндовидеоскопией.
Миниатюризация хирургии нефролитиаза, без преувеличения новый этап – прорыв – в проблеме совершенствования технологии оперативного доступа.
Заманчивые перспективы «всевидящей» иглы с микрооптикой 0,6 мм, улучшают возможности пункционного этапа, но все же требуют обеспечения ультразвуковой и рентгенологической визуализациями.
С развитием ротационной флюороскопии высокого разрешения с интраопе- рационной 3D реконструкцией, появилась возможность получения топической картины камня и планирование оптимального пункционного канала. Специальные алгоритмы конструирования КТ-подобных изображений, обеспечивают хирурга необходимой информацией, менее чем за одну минуту, непосредственно у операционного стола. Программа интегрированной навигации отображает длину, угол траектории иглы, точку кожного входа, автоматически перемещает С-дугу для оптимальной визуализации, а система лазерного перекрестия указывает зону позиционирования инструментов доступа.
3D сонография с новой роботизированной системой пункционной навигации обладает рядом преимуществ: отсутствие лучевой нагрузки и точностманипу ляций. В настоящее время проходит стадию клинических испытаний [32]. Также в настоящее время проходит стадию клинических исследований возможность получения виртуальной проекции ультразвукового пункционного тракта на флюороско- пическую картину, обеспечивающая безопасность этапа формирования кожно-почечного канала [33]. Важно подчеркнуть, что система может применяться как симуляционный тренажер обучения чрескожным методам хирургии МКБ.
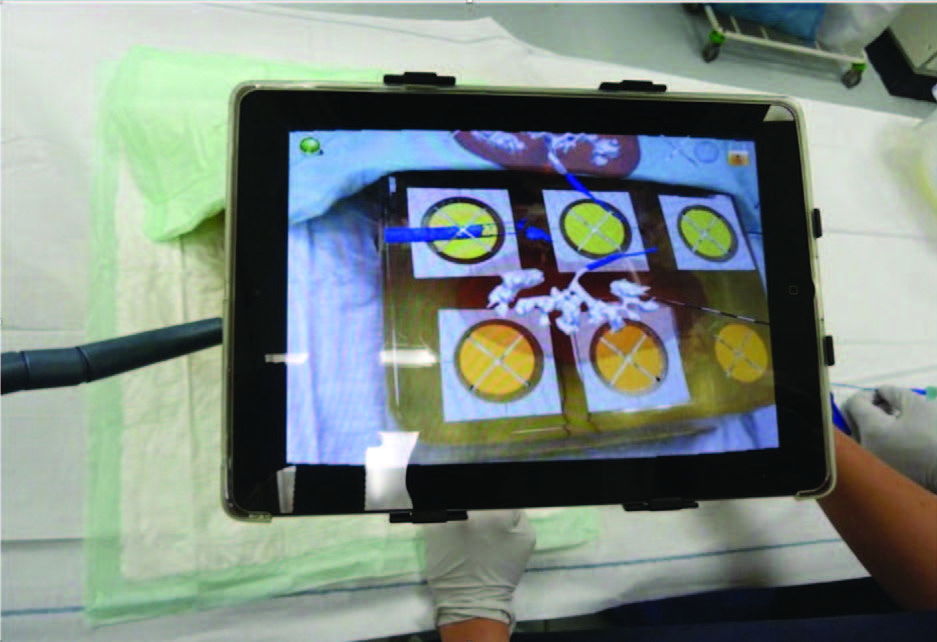
Рис. 11. МСКТ с 3D-реконструкцией
Публикации последнего времени свидетельствуют о возможности выполнения перкутаного доступа с новыми технологиями визуального наблюдения. Так, UroDyna-CT [34] предполагает рентгеноскопическую мультиплановую реконструкцию с контрастным усилением, интегрированную с изображением, полученным при КТ/МРТ исследовании. При этом лазерная система фокусировки Syngo-i-Guide обеспечивает точность и безопасность траектории пункционной иглы. Преимущество системы в малой величине дозовой нагрузки и уменьшении времени этапа пенетрации [34]. Можно полагать, что компьютерная программа наложения 3D-параметров КТ/МРТ на УЗ изображение в режиме ре- ального времени, в сочетании с экспериментальным использованием электромаг- нитного сенсора на кончике иглы, позволит уже в недалеком будущем получить оптимальные результаты при выполнении доступа [35].
Следующим этапом развития компьютер-ассистированной хирургии, нашедшим свое применение при лапароскопических вмешательствах, внедрение новой технологии в перкутанной хирургии нефролитиаза. Суть процедуры следующая: во время МСКТ цветные радио-маркеры фиксируются к коже, интраопера- ционно они служат навигационными точками для формирования виртуальной анатомии зоны интереса.
Инновационная программа DICOM, разработанная в Научно- исследовательском центре рака (Германия), позволяет получить 3D реконструкцию КТ сканирования собирательной системы почки и окружающих органов при различных позициях пациента. Камера iPad фиксирует изображение от стороны доступа, форматирует его и передает через беспроводную локальную сеть серверу устройства управления флюороскопическим столом. Сервер анализирует расположение маркеров относительно iPad и сопоставляет их с позицией видео– и КТ-изображения. Далее сервер создает картину дополненной реальности и передает информацию на iPad (рис. 12) [36].

Рис. 12. IPadнавигация
Рутинно, в настоящее время, после пункции заинтересованной чашечки почки и оптимальной установки рабочего проводника, осуществляется фасциальная дилатация бужами 8-10 CH с последующим выбором метода формирования кожно-почечного канала. При этом выбор инструментария и технологии дилатации зависят от величины и конфигурации камня, его мобильности, диаметра и длины шейки чашечки, типа строения и степени ретенции ЧЛС, отечно-инфильтративных изменений эндотелия, толщины и плотности паренхимы в зоне пункции, а также величины пространства между камнем и стенкой чашечки. В большинстве случаев, применяется методика прогрессивного бужирования телескопическими металлическими дилататорами Alken или пластиковыми дилататорами Amplatz с последующей установкой одноименного кожуха, выбор диаметра которого, определяется величиной эндоскопа [37].
Из преимуществ кожуха можно отметить: стабильность доступа, невозможность абсорбции и экстравазации ирригационной жидкости, обеспечение низкого интраренального давления, возможность извлечения крупных фрагментов конкремента и гемостатическая интубация паренхиматозного тракта.
Однако необходимость смены дилататоров и их количества, сопряжено с пролонгированием этапа и времени рентгенологического скрининга, с риском потери доступа, а также кровотечения с развитием гемотампонады ЧЛС. Этих осложнений лишена методика одномоментного доступа (one-shot), которая имеет относительные ограничения – только при склеротических изменениях паранефрия и паренхимы почки (рис. 13, 14).
Рис. 14. Установка кожуха Амплац 30 CH
Лучшим методом дилатации в настоящее время признана баллонная технология, обладающая неоспоримыми преимуществами: применение одношаговой техники, низкий риск паренхиматозного кровотечения и травматических повреждений по причине радиальной силы воздействия [38].
К наиболее значимым проблемам этапа доступа можно отнести невозможность продвижения внешнего кожуха до просвета чашечки почки при отсутствии пространства для его проникновения, особенно при коралловидном нефролитиазе. Достижение просвета чашечки в таких ситуациях возможно только под эндовизуальным контролем, что, при возникновении паренхиматозного кровотечения, практически крайне затруднительно. Опыт показывает, что в данной ситуации наиболее предпочтительно использование телескопических дилататоров Alken.
Рис. 15. Экстракция высокоплотных фрагментов камня при миниперкутанной нефролитолапаксии
Представляется закономерным совершенствование второго этапа чрескожной технологии – дезинтеграции конкремента, основная цель которой сокращение времени фрагментации и замена экстракции на аспирацию. Рутинно применяемые методы – электро-гидравлический, пневматический и даже ультразвуковой (в меньшей мере), требуют зачастую продолжительной, инструментальной экс- тракции высокоплотных крупных фрагментов камня.
Современные технологии, использующие энергию высокочастотного гольмие- вого (тулиевого) лазера, демонстрируют фрагментацию в «пыль», что в сочетании с автоматизированной ирригационно-аспирационной системой обеспечивают полное «калькулезное освобождение» без необходимости их извлечения.
Стратегия фрагментации и экстракции зависит от трех равноценно-значимых факторов:
- Калькулезный – включает плотность, локализацию, размер и конфигурацию камня;
- Инструментальный – определяется калибром рабочего канала эндоскопа, диаметром внешнего кожуха и моделью нефроскопа;
- Укладка пациента – положение на спине (supine pos.) – предполагает позицию инструмента с наклоном вниз, что облегчает спонтанную миграцию фрагментов.
Традиционно ПНЛЛ заканчивается установкой нефростомического дренажа с целью гемостатической интубации паренхиматозного канала, обеспечения низкого внутрипросветного давления и адекватной уродинамики, исключения паранефральной экстравазации мочи и формирования уриномы, а также для возможности прямого доступа (методика second-look) и проведения контрастного антеградного исследования.
За годы применения методики использовалось множество дренирующих устройств различных размеров и модификации. Так, на ранних этапах преимущественно устанавливались трубки, сопоставимые с диаметром сформированного канала. В настоящее время наибольшее распространение получили нефростомы малого диаметра. Доказана возможность минидренирования (10-12 CH) при инфекционном, коралловидном нефролитиазе, изначальной дилатации ЧЛС, не полном калькулезном освобождении, при интраоперационных осложнениях (перфорация, паренхиматозное кровотечение, повреждение висцеральных органов) и осуществлении макси-доступов (30-36 CH).
Известно, что использование нефростомы малого диаметра (до 10-12 CH) при доступе 30 CH приводит к геморрагическим осложнениям только в 1% наблюдений [39]. В последнее время получило широкое применение безнефростомная и бездренажная методики с важными преимуществами и доказанными постулатами в виде: длительного заживления кожно-почечного канала при пролонгированной нефростомии, отсутствием компрессионного гемостатического эффекта и геморрагических осложнений при использовании дренажа малого диаметра, быстрого закрытия свища и спонтанного гемостаза при дислокации нефростомы в раннем послеоперационном периоде [40, 41]. К тому же, преимущества методики подтверждены результатами рандомизированных исследований, среди них – одномоментное закрытие кожно-почеч- ного канала, уменьшение потребности в послеоперационной анальгезии, сокращение сроков госпитального периода и реабилитации, корректная сопоставимость периоперационных осложнений по количеству, характеру и степени тяжести в сравнении с дренажной техникой. Накоплен опыт бездренажной ПНЛЛ у детей, пациентов с ожирением, старческого возраста, при коралловидном нефролитиазе, в случаях единственной почки, аномалий развития (дистопии, подковообразной почки), ХПН, синхронной билатеральной процедуре [42– 44]. В результате многоцентровых исследований определены критерии применения метода – отсутствие инфекции мочевых путей, использование менее 2 портов, размер камня менее 3 см, время операции менее 2 часов, отсутствие осложнений (перфорация, кровотечение), полное калькулезное освобождение, отсутствие органической инфраренальной обструкции [45]. К альтернативным tubeless методам, нивелирующим риски паренхиматозного кровотечения, относятся:
- механическая компрессия кожно-почечного канала;
- ушивание свищевого хода;
- криоаблация паренхиматозного тракта;
- моно– и биполярная коагуляция паренхиматозных сосудов;
- аппликация абсорбируемых гемостатических материалов (фибрин, желатиновый матрикс с тромбином и без) [46, 47];
Изучение проблем перкутанной хирургии нефролитиаза продолжается и по сей день. Следует сказать, что интенсивное развитие хирургии (и, естественно, урологии), особенно со второй половины XX века обусловлено рядом объективных причин. В частности, одним из главных рычагов являются разработка и использование новых эффективных технологий. Восходящая экспонента, отражающая это направление, во многом обусловлена достижением научных исследований с привлечением специалистов-профессионалов смежных областей науки и техники.
В частности, прогресс урологии, как было показано выше, находится в прямой зависимости от развития естественных наук – биологии, физики, химии, а также радио электроники, математики, техники и др. Достижения в таких областях, как излучение различной природы, ядерно-магнитные резонансные явления, а также прогресс в компьютерных технологиях, телекоммуникациях и многое другое, привели к созданию принципиально новых, высокоэффективных технологий для диагностики и лечения больных.
В заключении обратимся к корифею русской медицины Матвею Яковлевичу Мудрову: «Я намерен сообщить вам новую истину, которой многие не поверят и которую, может быть, не все из вас постигнут… Врачевание не состоит в лечении болезни… Врачевание состоит в лечении самого больного».
Библиографический список:
- Аполихин О.И., Сивков А.В., Комарова В.А., Просянников М.Ю., Голованов С.А., Казаченко А.В., Никушина А.А., Шадеркина В.А. Заболеваемость мочекаменной болезнью в Российской Федерации (2005-2016 годы). Экспериментальная и клиническая урология 2018(4):4-14. [Apolihin O.I., Sivkov A.V., Komarova V.A., Prosyannikov M.Yu., Golovanov S.A., Kazachenko A.V., Nikushina A.A., Shaderkina V.A. Zabolevaemost mochekamennoy boleznyu v Rossiyskoy Federatsii (2005-2016 godyi). Eksperimentalnaya i klinicheskaya urologiya = Experimental and clinical urology 2018(4):4-14. (In Russian)].
- Аляев Ю.Г., Григорян В.А., Руденко В.И., Григорьев Н.А., Еникеев М.Э., Сорокин Н.И. Современные технологии в диагностике и лечении мочекаменной болезни. М.: Литтерра, 2007; 5 с. [Alyaev Yu.G., Grigoryan V.A., Rudenko V.I., Grigorev N.A., Enikeev M.E., Sorokin N.I. Sovremennyie tehnologii v diagnostike i lechenii mochekamennoy bolezni. M.: Litterra, 2007; 5 s. (In Russian)].
- Кривонос О.В., Скачкова Е.И., Малхасян В.А., Пушкарь Д.Ю. Состояние, проблемы и перспективы развития Российской урологической службы. Вестник Российского общества урологов. М.: Вестник РОУ, 2012; 2 c. [Krivonos O.V., Skachkova E.I., Malhasyan V.A., Pushkar D.Yu. Sostoyanie, problemyi i perspektivyi razvitiya Rossiyskoy urologicheskoy sluzhbyi. Vestnik Rossiyskogo obschestva urologov. M.: Vestnik ROU, 2012; 2 c. (In Russian)].
- Paik ML, Resnick MI. Is there a role for open stone surgery? Urologic Clinics 2000; 27(2):323-331.
- Аляев Ю.Г. Мочекаменная болезнь. Современные методы диагностики и лечения. М: ГЭОТАР – Медиа, 2010; 103 с.
- Gentle D.L., Stoller M.L., Bruce J.E., Leslie S.N. Geriatric urolithiаsis. J. Urol 1997; 158(6):2221-2224.
- Дутов В.В. Дистанционная ударно-волновая литотрипсия: назад в будущее. РМЖ. М.: 2014(29)2077.
- Европейская ассоциация урологов “Клинические рекомендации”, раздел “Мочекаменная болезнь”, 2011; 28-31с.
- Теодорович О.В., Борисенко Г.Г., Зеликман М.И., Нарышкин С.А. Анализ профессионального облучения при проведении эндоурологических вмешательств. Вестник Российского научного центра рентгенорадиологии Минздрава России, 2008;1(8). [Teodorovich O.V., Borisenko G.G., Zelikman M.I., Naryishkin S.A. Analiz professionalnogo oblucheniya pri provedenii endourologicheskih vmeshatelstv. Vestnik of the Russian Scientific Center of Roentgenoradiology of the Ministry of Healthcare of the Russian Federation = Vestnik Rossiyskogo nauchnogo tsentra rentgenoradiologii Minzdrava Rossii, 2008;1(8). (In Russian)].
- Bloom D.A., Morgan J.R., Scardino P.L. Thomas Hillier and percutaneous nephrostomy. Urology 1989(33):346-350.
- Doizi S., Raynal G., Traxer O. Evolution of urolithiasis treatment over 30 years in a French academic institution. Prog Urol 2015;25(9):543-548.
- Мартов А.Г., Ергаков Д.В., Серебрянный С.А., Дзеранов Н.К., Лисовченко С.А. Перкутанная хирургия коралловидного нефролитиаза в эпоху ДЛТ. Материалы Пленума правления Российского общества урологов (Сочи, 28-30 апреля 2003); М., 2003; 411-412 с.
- Handa R.K., Evan A.P., Willis L.R., Connors B.A., Gao S., Kim S.C., Tinmouth W.W., Lingeman J.E. Time – course for recovery of renal function after unilateral (single-tract) percutaneous access in the pig. J Endourol 2010;24(2):283-288.
- Unsal A., Koca G., Resorlu B., Bayindir M., Korkmaz M. Effect of percutaneous nephrolithotomy and tract dilatation methods on renal function: assessment by quantitative single-photon emission computed tomography of technetium – 99m – dimercaptosuccinic acid uptake by the kidneys. J Endourol 2010;24(9):1497-1502.
- De La Rosette J., Assimos D., Desai M., Gutierres J., Lingeman J., Scarpa R., Tefekli A. The Clinical Research Office of the Endourological Society Percutaneous Nephrolithotomy Global Study: indications, complications and outcomes in 5803 patients. J Endourol 2011;25(1):11-17.
- Ozden E., Mercimec M.N., Yakupoglu Y.K., Ozkaya O., Serikaya S. Modified Clavien classification in percutaneous nephrolithotomy: assessment of complications in children. J Urol 2011;185(1):264-268.
- Allen D., O’Brien T., Tiptaft R., Glass J. Defining the Learning Curve for percutaneous nephrolithotomy. J Endourol 2005;19(3):279-282.
- Гиппократ. De medico. Гиппократ. Избранные книги. М., 1936;98 с. [Gippokrat. De medico. Gippokrat. Izbrannyie knigi. M., 1936; 98 s. (In Russian)].
- Papatsoris A., Massood J., El-Huseiny T., Maan Z., Saunders P., Buchholz N.P. Improving patient positioning to reduce complications in prone percutaneous nephrolithotomy. J Endourol 2009(23):831-832.
- Cheng M.A., Todorov A., Tempelhoff R., McHugh T., Crowder C.M., Lauryssen C. The effect of prone positioning on intraocular pressure in anesthetized patients. Anesthesiology 2001(95):1351-1355.
- Turner C.D., Anderson J., Gerber G.S. Improved patient positioning for percutaneous nephroscopic procedures using a surgical saadle. J Urol 2000(163):199-200.
- Grasso M., Nord R., Bagley D.H. Prone split-leg and flank roll positioning: simultaneous antegrade and retrograde access to the upper urinary tract. J Endourol 1993(7):307-310.
- Ray A.A., Chung D.G., Honey R.J. Percutaneous nephrolithotmy in the prone and prone-flexed positions: anatomic consid
erations. J Endourol 2009(23):1607-1614.
- El-Husseiny T., Moraitis K., Maan Z., Papatsoris A., Saunders P., Golden B. Percutaneous endourologic procedures in high-risk patients in the lateral decubitus position under regional anesthesia. J Endourol 2009(23):1603-1606.
- Lezrek M., Ammani A., Bazine K., Assebane M., Kasmaoui H., Qarro A. The split-leg modified lateral position for percutaneous renal surgery and optimal retrograde access to the upper urinary tract. Urology 2011(78):217-220.
- Valdivia Uria J.G., Valle Gerhold J., Lopez J.A., Villarroya Rodriguez S., Ambroj Navarro C., Ramirez Fabian M. Technique and complications of percutaneous nephroscopy: experience with 557 patients in the supine position. J Urol 1998(160):1975-1978.
- Tuttle D.N., Yeh B.M., Meng M.V., Breiman R.S., Stoller M.L., Coakley F.V. Risk of injury to adjacent organs with lower-pole fluoroscopically guided percutaneous nephrostomy: evaluation with prone< supine, and multiplanar reformatted CT. J Vasc Interv Radiol 2005(16):1489-1492.
- Ibarluzea G., Scoffone C.M., Cracco C.M., Poggio M., Porpiglia F., Terrone C. Supine Valdivia and modified lithotomy position for simultaneous antegrade and retrograde endourological access. BJU Int 2007(100):233-236.
- Bach C. GA, Kumar P., Buchholz N., Papatsoris A.G., Masood J. The Barts «flank-free» modified supine position for percutaneous nephrolithotomy (2012). BJU Int 2012;89(3):365-8.
- Ritter M., Krombach P., Michel M.S. Percutaneous stone removal. Eur Urol Suppl 2011 (10):433-439.
- Desai M. Ultrasonography-guided punctures – with and without puncture guide. J Endourol 2009(23):1641-1643.
- Boctor EM, Choti MA, Burdette EC, Webster RJ (2008) Three-dimensional ultrasound-guided robotic needle placement: an experimental evaluation. Int J Med Robot 2008(4):180-191.
- Mozer P, Conort P, Leroy A, Baumann M, Payan Y, Troccaz J, Chartier-Kastler E, Richard F. Aid to percutaneous renal access by virtual projection of the ultrasound puncture tract onto fluoroscopic images. J Endourol 2007(21):460-465.
- Ritter M., Rassweiler M.C., Haecker A., Michel M.S. Laser-guided percutaneous kidney access with the UroDyna-CT: first experience of three-dimensional puncture planning with an ex-vivo model. World J Urol 2013(31):1147-1151.
- Appelbaum L., Solbiati L., Sosna J., Nissenbaum Y, Greenbaum N, Goldberg SN. Evaluation of an electromagnetic image-fusion navigation system for biopsy of small lesions: assessment of accuracy in an in vivo swine model. Acad Radiol 2013(20):209-217.
- Mueller M., Rassweiler M.C., Klein J., Seitel A, Gondan M, Baumhauer M. Mobile augmented reality for computer-assisted percutaneous nephrolithotomy. Int J Comput Assist Radio Surg 2013(8):663-675.
- Alken P. Telescopbougierset zur percutanen Nephrostomie. Actuel Urol 1981(12):216-219.
- Clayman R.V., Castaneda-Zuniga W.R., Hunter D.W., Miller RP, Lange PH, K Amplatz K. Rapid balloon dilatation of the nephrostomy track for nephrostolithotomy. Radiology 1983 (147):884-885.
- De Sio M, Autorino R, Quattrone C, Giugliano F, Balsamo R, D'Armiento M. Choosing the nephrostomy size after percutaneous nephrolithotomy. World J Urol 2011(29):707-711.
- Shen P., Liu Y., Wang J. Nephrostomy tube-free versus nephrostomy tube for renal drainage after percutaneous nephrolithotomy: a systematic review and meta-analysis. Urol Int 2012(88):298-306.
- Сrook T.J., Lockyer C.R., Keoghane S.R., Walmsley BH. Totally tubeless percutaneous nephrolithotomy: our experience. J Endourol 2008(22):25-28.
- Agrawal M.S., Agrawal M. Tubeless percutaneous nephrolithotomy. Indian J Urol 2010(26):16-24.
- Falahatkar S., Khosropanah I., RoshaniA, Neiroomand H, Nikpour S, Nadjafi-Semnani M. Tubeless percutaneous nephrolithotomy for staghorn stones. J Endourol 2008(22):1447-1451.
- Aghamir S.M., Hamidi M., Aloosh M., A Mohammadi, Nikoobakht MR, Meysamie A. Efficacy and morbidity following PCNL in patients with renal anomalies: the outcome from a randomized study comparing different imaging modalities for assessment. Minerva Urol Nefrol 2011(63):207-212.
- Wang J., Zhao C., Zhang C., Fan X, Lin Y, Jiang Q. Tubeless vs standard percutaneous nephrolithotomy: a meta-analysis. BJU Int 2011(109):918-924.
- Li R., Louie M.K., Lee H.J., Osann K, Pick DL, Santos R. Prospective randomized trial of three different methods of nephrostomy tract closure after percutaneous neprolithotripsy. BJU Int. 2010(107):1660-1665.
- Choe C.N., L’Esperance J.O., Auge B.K. The use of adjunctive hemostatic agents for tube-less percutaneous nephrolithotomy. J Endourol 2009(23):1733-1738.









Комментарии