«Нужно, конечно, стремиться к техническому прогрессу в медицине, но так, чтобы не растерять драгоценные качества врача…
Несмотря на техническое вооружение, медицина не перестает быть медициной личности»
А.Ф. Билибин
C исторической точки зрения, первое выполнение уретероскопии произошло случайно. H.H. Young (1912), при эндоскопическом исследовании ребенка с уретральным клапаном и инфравезикальной обструкцией, провел педиатрический цистоскоп в дилатированный дистальный отдел мочеточника [1]. Значительного прогресса эндотехнология получила в 1956 году, когда благодаря английскому физику Гарольду Хопкинсу была разработана система стержневых линз, предполагающая использование стеклянных цилиндров в качестве среды и воздушной прослойки между ними. Такая конструкция улучшила светопроводимость, качество изображения и позволила в результате уменьшить диаметр эндоскопа и обеспечила большую долговечность оборудования [40]. Первый отчет об итогах использования гибкой уретероскопии впервые доложил V.F. Marshall (1964 г.) в статье «Волоконная оптика в урологии», основанной на опыте и результатах применения фиброуретероскопа 9 CH, продукт компании American Cystoscope Makers (Pelham Manor, NY) [2].
К концу 70-х годов метод использовался только при исследовании дистального отдела мочеточника (Goodman, 1977, Lyon и соавт., 1979), в связи с ограничениями возможности эндоскопического инструментария и по причине доступности только детского цистоскопа 11 CH. Первый ригидный уретероскоп, разработанный инженерами компании Рихард Вольф имел конструкцию размерами 13; 14,5 и 16 Ch, имея рабочую длину всего 23 см. А первое сообщение об удалении камня мочеточника с помощью ригидного уретероскопа 11 Ch (K.Storz) было опубликовано только в 1980 году (Perez-Castro Ellendt, Martinez-Pineiro) [3].
В 1980 году Bagley, Huffman, Lyon начали совместную работу в Университете Чикаго по развитию и внедрению гибкой фиброоптической уретеропиелоскопии [4]. В 1983 году разработан полуригидный уретероскоп, достаточной длины, с прямым рабочим каналом, позволивший выполнить уретеропиелоскопию и первую контактную ультразвуковую уретеролитотрипсию [5]. С полным правом этот факт можно считать одним из знаменательных этапов в развитии хирургии уролитиаза. Более того, в настоящее время современную диагностику и лечение патологии верхних мочевых путей невозможно представить без ретроградной уретеронефроскопии.
Данный прогресс явился результатом развития технологических возможностей и внедрения инструментария и вспомогательных устройств для ригидной и гибкой эндоскопии. Конструктивные изменения коснулись оптической системы, рабочего канала и отклоняющего механизма. Оптическая система, состоящая из множества стеклянных пучков с различными показателями преломления, улучшила проходимость света, а когерентное расположение волокон в пучке дало возможность передавать изображения. Телескопический эффект обеспечивался проксимально – и дистально-расположенными линзами, что увеличивало поле зрения и возможность фокусировки [6].
Следующее существенное технологическое достижение относится к 1992 г., когда Карл Шторц уменьшил эндоскоп с 9,8 CH до 7,5 CH и успешно использовал миниатюрный инструмент с широким рабочим каналом 3,6 CH. Использование активного дорзально-вентрального отклонения с вторичным дополнительным изгибом увеличило не только маневренность в ЧЛС, но и хирургические оперативные возможности. Однако терапевтические возможности были ограничены эффективностью методов физического воздействия на структуру камня.
Внедрение интракорпорального лазерного литотриптера с гибким световодом и высоким запасом прочности, повысило интерес к ретроградной внутри- почечной хирургии [7]. В 2001 году был выпущен инструмент с изгибом до 270º, что улучшило возможность достижения ранее недоступных отделов верхних мочевых путей и позволило манипулировать в нижне-полярной зоне. Также из технических новинок обратила внимание амортизационная система, обеспечивающая дополнительное отклонение и тракцию на 10 см при достижении глубоких структур [8].
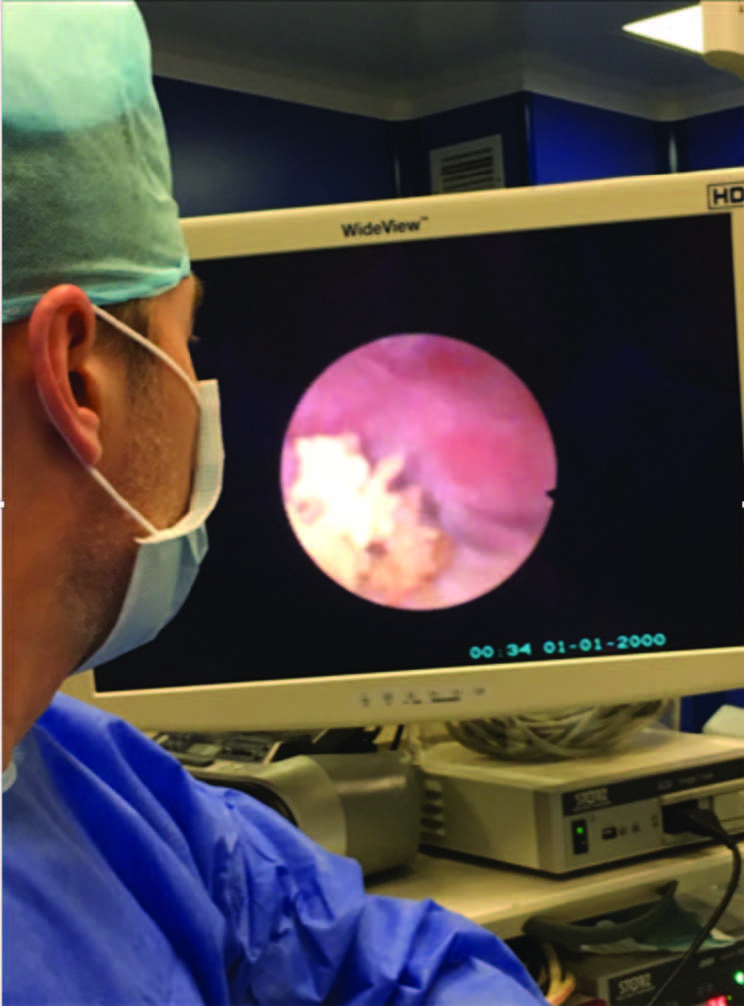
Рис. 1. Изображение высокого разрешения прииспользовании цифровых технологий
Революция эндоскопических технологий в 2006 году привела к внедрению цифровых гибких уретероскопов, что улучшило качество изображения и эргономичность инструмента благодаря интеграции светового кабеля и камеры.
Однако цифровые технологии в описываемый период исключали возможность уменьшения диаметра эндоскопа, чем и определяли необходимость использования мочеточникового кожуха большого диаметра, что увеличивало риски повреждений [9].
Нужно подчеркнуть, что рабочий канал современного фиброскопа хотя и позволяет использовать инструменты большего диаметра, при достаточном уровне орошения ЧЛС, но имеются ограничения инструментальных манипуляций при применении жестких материалов (корзина, проводник, щипцы). При этом достаточный для выполнения задачи изгиб не возможен [10]. Так, присутствие в рабочем канале лазерного волокна приводит к потере величины изгиба на 4,4% и 10,2% для световода 200 и 275 мкм соответственно. Аналогично происходит уменьшение скорости потока ирригационного раствора на 53,7% при использовании волокна 200 мкм, на 62,2% и 99% при проведении инструмента или корзины величиной 1,5 и 3 Ch [11].
Инновационные технологии способствовали разработке цифровых эндоскопов малого диаметра с улучшенными характеристиками изображения, манипуляционной маневренностью и повышенным срокам эксплуатации (рис. 1). К примеру, наконечник прибора, помимо цифрового чипа, укомплектован светодиодами, позволяющим обойтись без подключения светового кабеля. Таким образом, изделие стало легче и эргономичнее, что особо важно при проведении длительной процедуры. Однако основная проблема – недолговечность эндоскопа, в большинстве случаев не превышающая 20-25 оперативных вмешательств, что значительно удорожает лечебный процесс [12]. Для снижения себестоимости каждой процедуры, разработаны одноразовые фиброволоконные уретеропиелоскопы, обеспечивающие высокое качество изображения, приемлемую гибкость и маневренность в труднодоступных зонах [13]. Качество изображения, уменьшенный диаметр инструмента из-за величины микрочипа позволяют экономить операционное время на 20-25% [14].

Рис. 2. Аналоговый и цифровой фиброуретерореноскопы
Снижение термического воздействия при лазерной литотрипсии обеспечивает оснащение дистального конца эндоскопа керамическими кольцами на протяжении 1,5 см.
В 2010 г. впервые применен комбинированный уретероскоп с сочетанием возможностей гибкого и ригидного инструмента, что позволило эффективно фрагментировать интраренальные конкременты без замены инструмента в течение операции. Смещаемый сердечник обеспечивал гибкость наконечника, достижимость всех участков ЧЛС, высокий уровень калькулезного очищения [15].
В 2014 г. начата работа над новой роботической платформой для гибкой нефроскопии. Система опробирована при лечении 81 пациента и характеризуется улучшенной эргономикой манипуляционного процесса [16].
Известно, что важным качеством любого оборудования является его долговечность. В работах ряда исследователей показано, что независимо от производителя фиброэндоскоп требует капитального ремонта после 12-15 процедур или 13 часов использования [17]. O. Traxer выполнил 50 операций с использованием эндоскопа Flex X (K. Storz). При этом максимальное вентральное отклонение уменьшилось с 270 до 208º, максимальное вентральное – с 270 до 133º. Скорость орошения при давлении 100 см вод ст замедлилась с 50 до 40 мл/мин.
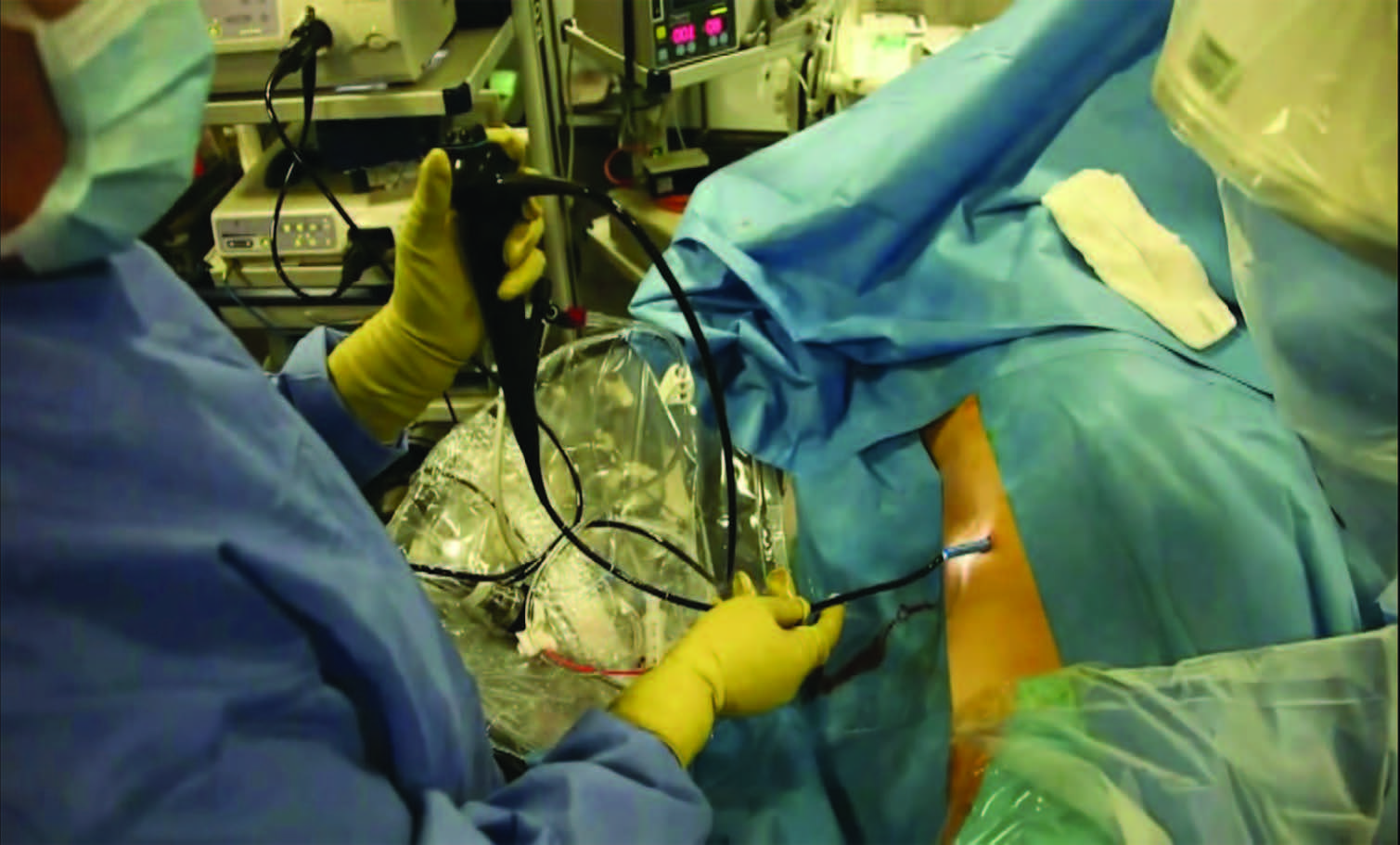
Рис.3.Цифровой эндоскоп с интегрированной системой визуализации и освещения
Доказано, что только 2 фактора имеют прогностическое значение для оценки долговечности – опыт хирурга и техническое усовершенствование инструмента [18]. Например, современные цифровые эндоскопы имеют преимущества в виде улучшенного качества изображения, эквивалентное десятикратному разрешению стандартного оптоволоконного эндоскопа и большую долговечность в связи с отсутствием отдельного световода и головки камеры (рис. 2, 3). К недостаткам относится нестабильность обработки красного спектра и влияние термической перкуссии лазерного пучка на качество изображения [19].
В чем же преимущество данного метода? Благодаря многочисленным научным изысканиям определены показания для диагностической и лечебной гибкой уретеронефроскопии. Эндоскопическая диагностика необходима при отсутствии результативности неинвазивных методик. Это наличие дефекта контрастного наполнения верхних мочевых путей по данным методов визуализации, диагностика причин обструкции, унилатеральная гематурия, определение источника позитивных культуральных и цитологических тестов, оценка последствий травмы. А лечебная тактика предусматривает при необходимости – эндоскопическую дезинтеграцию камня, ретроградную эндоуретеротомию, эндопиелотомии и инфундибулотомию, абляцию уротелиальной опухоли, интралюми- нального гемостаза, удаление инородного тела, ликвидацию камней дивертикула чашечки [20].
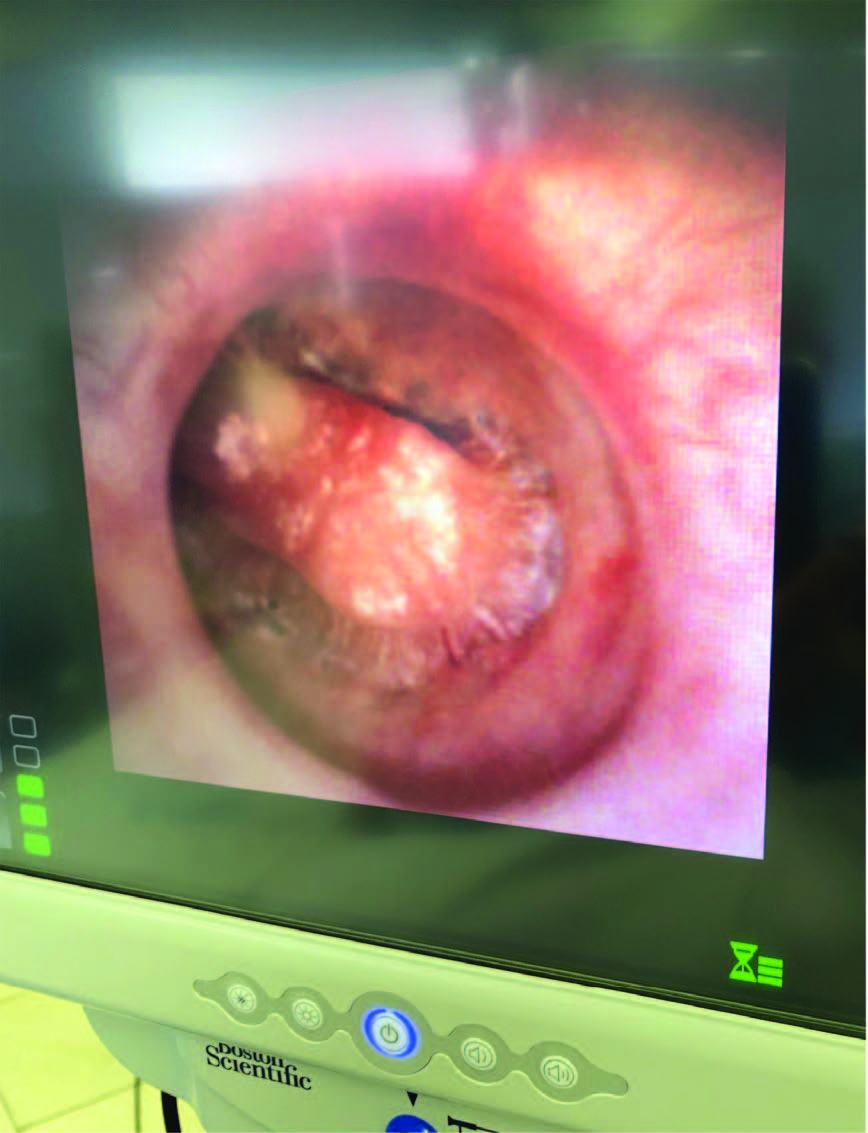
Рис.4.Эндоскопическая картина почечного сосочка
Рутинно, после цистоскопической оценки нижних мочевых путей, в чашечно-лоханочную систему под R-контролем устанавливается проводник с целью выпрямления мочеточника и корректной установки дилататора. После чего необходимо расширение устья и интрамурального отдела, особенно у мужчин молодого возраста, установка двухпросветного катетера для проведения направляющего и страхового проводников.
В настоящее время гибкий эндоскоп малого диаметра (менее 7,5 CH) может быть проведен под оптическим контролем беспрепятственно и без помощи проводника [21]. Метод проведения уретероскопии «без касания» был разработан М. Grasso и предполагает более сложные манипуляции, но при этом устраняет потенциальную травму уротелия, не преднамеренную проксимальную миграцию камней и повреждение новообразований [22]. G. Pablo применили микротехнологии для ликвидации дистальных камней мочеточника, применив уретероскоп, состоящий из внешней оболочки диаметром 4,85 CH, гибкой оптической системы 0,9 мм и соединительного адаптера. Без потребности в дилатации был достигнут 100% уровень очищения от камней средним размером 7,9 мм, без интра– и послеоперационных осложнений и необходимости дренирования мочевых путей [23]. Введение разбавленного контрастного вещества через рабочий канал эндоскопа позволяет разобраться в сложной архитектонике собирательной системы, провести полноценную инспекцию, определить возможности перемещения конкремента в легкодоступную для манипуляций зону. И, тем не менее, несмотря на имеющуюся в распоряжении хирурга технические возможности (и опыт!) наиболее трудоемким продолжает оставаться интраренальный нижнеполярный доступ. Он требует активных и пассивных отклонений дистального отдела инструмента, что, однако, не всегда достаточно для достижения уровня манипуляционного интереса (рис. 4, 5).
Рис.5. «Гибкая» инспекция нижней группы чашечек почки
Например, при длинной (более3 см) шейке нижней чашечки почки, что характерно для строения ЧЛС типа А2 (по FJB Sempaio), а также при величине шеечно-лоханочного угла менее 30º M. Grasso, Ficazzola отметили, что доступ к нижней чашечке оказался не возможен у 7% пациентов при использовании ранней градации эндоскопов с ограничением активной подвижности наконечника, но при этом они достигли высокого уровня калькулезно- го освобождения для когорты пациентов с камнями до 1 см и более 1 см в 95% и 94% [24, 25]. В подобной ситуации может быть полезен маневр «вторичного изгиба», то есть активного сгибания инструмента с одновременной его дистальной тракцией, что находит применение у 60% пациентов. Однако новые типы эндоскопов имеют достаточно возможностей для преодоления этих трудностей, благодаря усовершенствованию отклоняющего механизма и новым методикам оперативной техники. Так, перемещение камня в чашечку для прямой визуализации улучшило эффективность ирригационного потока и прозрачность среды, манипуляционные возможности экстракторов и лазерного волокна, а также увеличило скорость дезинтеграции. Нитилоновая корзина малого диаметра позволяет использовать все возможности механизма отклонения без ущерба доступности любых отделов ЧЛС [26]. Доказано преимущество перемещения камней более 1 см в верхнюю группу чашечек по конечным результатам каменного освобождения, 100% против 29% [27].
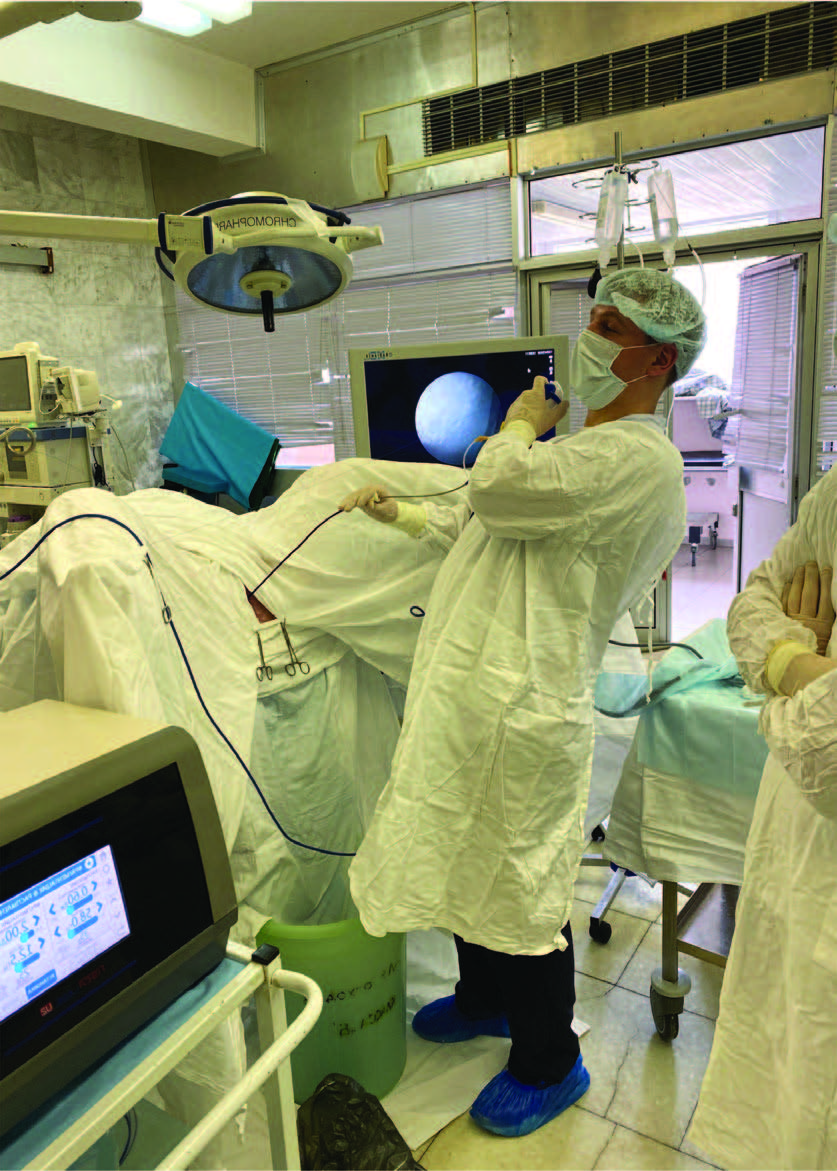
Рис.6.Использование мочеточникового кожуха прифиброволоконной инспекции верхних мочевых путей
Использование мочеточникового кожуха определяется анатомическими и инструментальными возможностями, характеристиками камня, эффективностью микрофрагментирования и предопределяет целесообразность стентирования мочеточника (рис. 6).
По результатам исследования 102 пациентов, выяснено влияние уровня болевого синдрома при пред– и послеоперационном внутреннем дренировании верхних мочевых путей. Доказано, что установка стента до операции нивелирует необходимость его использования после процедуры, а эндоскопия по кожуху требует стентирования для уменьшения интенсивности болевого синдрома [28]. Также определена корреляция между дооперационной растяжимостью мочеточника, результативностью и уровнем осложнений при уретероскопии. Еще в 2011 году R. Getti указал на необходимость предварительного стентирования у пациентов с узким мочеточником, так как у 30% из них первичная эндоскопия оказалась безуспешна по анатомическим причинам [29]. В дополнение к данному постулату, современные исследователи считают необходимым выполнение
калибровочной уретероскопии с целью определения перспектив для одномоментного или повторного вмешательства [30]. В 2017 г. S. Hein с коллегами выполнил исследование с целью оценки возможности снижения воздействия ионизирующего излучения при выполнении стандартизированного протокола ретроградной внутрипочечной хирургии [31]. Отдельные этапы проведены без ионизирующего излучения. Результаты показали, что значимо уменьшилось время облучения в каждой процедуре от 167 сек до 7,4 сек с достижением уровня калькулезного очищения до 100% и сокращением времени операции до 65 мин [31]. Японские авторы проанализировали новый метод навигации во время эндоскопической комбинированной хирургии почки, при котором применена виртуальная сонография с синхронизацией изображения с архивированными данными МСКТ. Технические возможности и, соответственно, эффективность метода превысили существующий уровень осложнений без ущерба [32].
Уместно сделать некоторое отклонение от освещения конкретного материала. Даже приведенные выше факты наглядно показывают, а скорее, подтверждают, что развитие хирургии, и в частности урологии, шло по принципам диалектического процесса перехода количества в качество. При том, как сказал английский философ К. Поппер: «Наука никогда не преследует иллюзорной цели сделать свои ответы окончательными или даже вероятными» [33].
На определенном этапе развития хирургической специальности, оказалось необходимым, наряду с изучением других проблем, исследовать аспекты, связанные с патологическим процессом, операционной травмой, нарушением и восстановлением функций организма. Потребовалось также улучшить возможности диагностики, расширить возможности доступа к патологическому очагу, и при этом обеспечить безопасность самого оператора от воздействия неблагоприятных физических факторов. С особой важностью встал вопрос о повышении квалификации уролога, в частности, в плане умения работать с новой сложной диагностической, операционной техникой и комплексами контроля за жизнедеятельностью организма пациента на всех этапах.
К тому же, помимо накопления опыта у операционного стола, специалист, занимающийся уролитиазом, должен иметь максимально полное представление о теориях камнеобразования, метаболических нарушениях, нормативах экскреции литогенных веществ, защитных и провоцирующих механизмах ингибиторов и промоторов рецидивирования патологического процесса, об этиопатогенезе канальцевых изменений, уровне функциональных нарушений мочевых путей, фармакологической поддержке и возможностях метафилактики. Знания и опыт, приобретаемый в процессе обучения и практики, позволяют выбрать корректную тактику, сократить количество неблагоприятных исходов и осложнений, связанных с оперативным вмешательством, исключить риски рецидивирования.
Замечательный русский хирург С.И. Спасокукоцкий говорил своим ученикам: «Вы не должны быть грыжесеками. Можно и санитара научить оперировать грыжу, он и будет делать ее не хуже вас. Надо научиться научно мыслить» [34]. Как бы продолжая мысль С.И. Спасокукоцкого, С.П. Боткин писал: «Можно быть знакомым и с физиологией, и с патологией, и со средствами, которыми мы пользуемся при лечении больного организма, – и все-таки, без умения приложить эти знания к отдельным индивидуумам, не быть в состоянии разрешить представившуюся задачу, если даже решение ее не переходит за пределы возможного. Это умение применять естествознание к отдельным случаям и составляет собственно искусство лечить».

Рис.7,8.Роботическая система Robof lex Avicenna(Elmed, Turkey)
Надо сказать, что достижения и цели урологии (как и хирургии и медицины в целом) – великий пласт культуры. Применительно к нашей теме, очень правильно и хорошо сказал выдающийся ученый и общественный деятель Д.С. Лихачев: «Культура человечества движется вперед не путем перемещения в «пространстве-времени», а путем накопления ценностей. Ценности не сменяют друг друга, новые не уничтожают старых (если старые действительно настоящие), а присоединяясь к старым, увеличивают их значимость для сегодняшнего дня» [35].
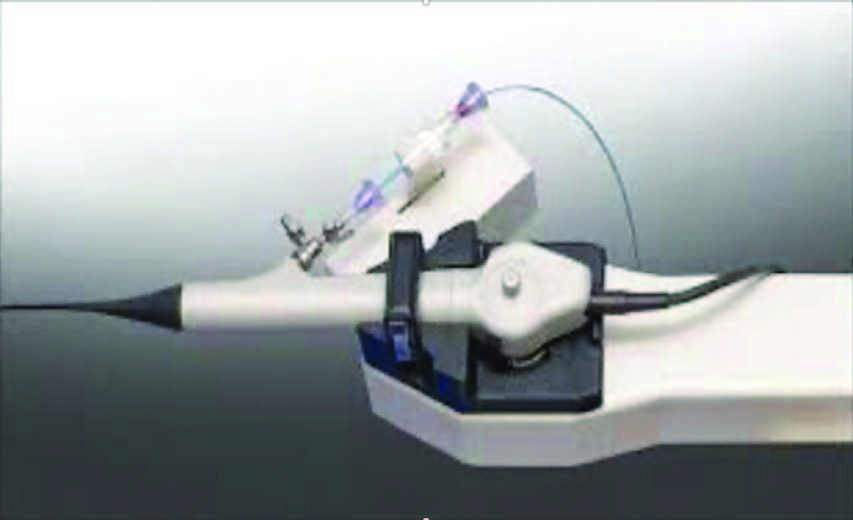
Продолжим о фибронефроскопии – ее техника и трудна исложна. Главная особенность вмешательства необходимость длительной фиксации положения инструмента, чаще в состоянии активного отклонения и ротации наконечника, что создает условия для чрезмерной физической нагрузки на хирургическую бригаду. С целью улучшения эргономики и результатов процедуры разработана и внедрена роботическая система Roboflex Avicenna (ELMED, Turkey) (рис. 7, 8). После короткого этапа фиксации система позволяет закончить процедуру со скоростью фрагментации 29+6 мм 3/мин [36].
Итак, мы видим, что технология гибкой эндоскопии верхних мочевых путей получила широкое распространение в связи с высокой результативностью уровня калькулезного освобождения. Непрерывное совершенствование эндоскопического оборудования, инструментария и методов физического воздействия на камни ускорило развитие метода. Снижение частоты геморрагических и инфекционных осложнений, делает фиброволоконные ретроградные методы предпочтительными для лечения почечных камней размерами до 20 мм. В настоящее время, из процедуры эксклюзивного использования первооткрывателями и энтузиастами, методика превращается в стандарт лечения при нефролитиазе, даже в сложных клинических случаях.
Однако, не рационально считать ее применимой при любом объеме, локализации и структурных характеристиках калькулезного процесса. Только в клинических центрах, оборудованных для экстракорпоральных, перкутанных и интралюминальных методов литотрипсии, возможен выбор оптимальной тактики с использованием моно– или комбинированной техники с учетом анатомических, калькулезных параметров и коморбидности.
Для преодоления ограничений выполнения чрескожных и транс-уретральных эндоскопических технологий, при сочетанной калькулезной патологии верхних мочевых путей, направление научной и технической мысли было закономерно направлено на использование комбинации методов.
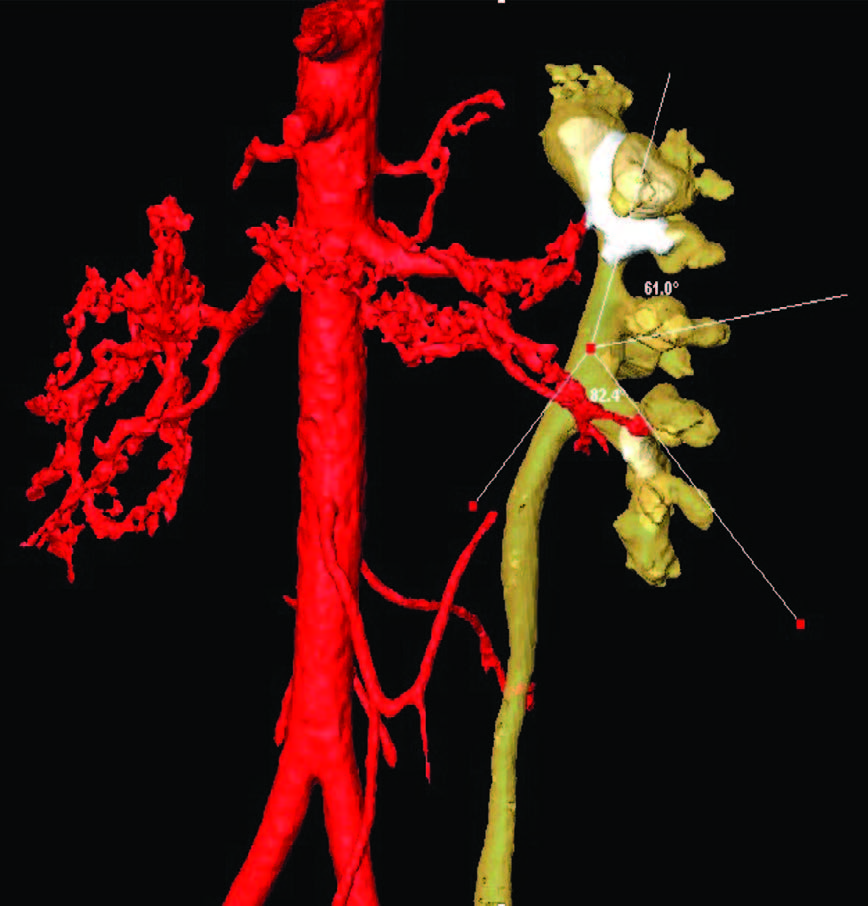
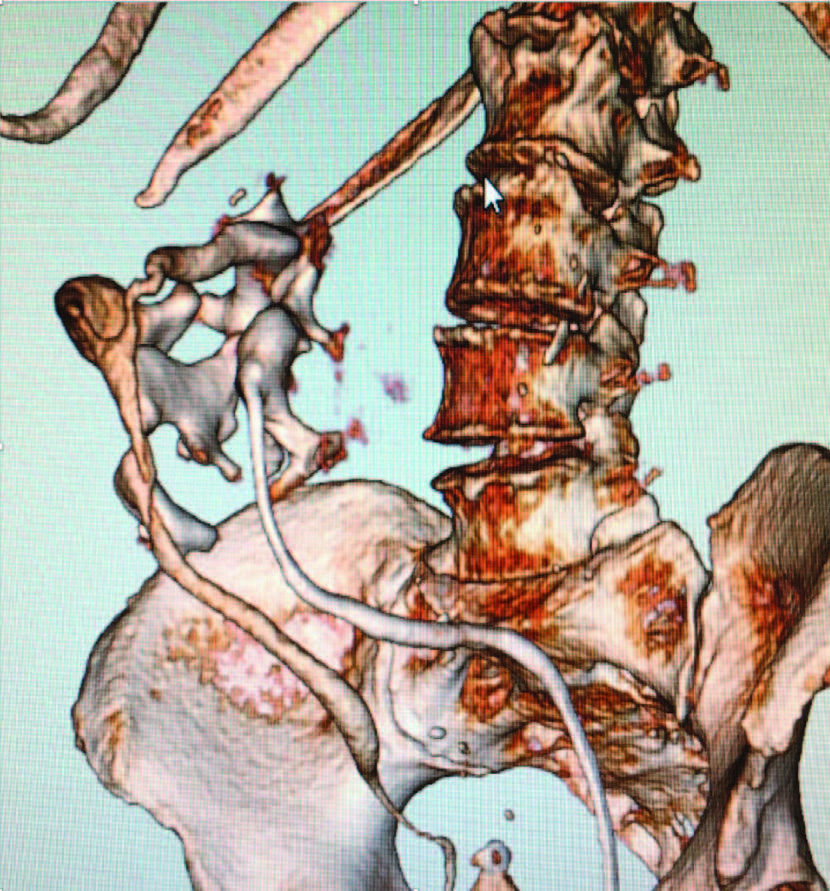
Рис.9.Аномалия развития мочевых путей, требующая примене-ния комбинированных эндоскопических технологий при МКБ
Как альтернатива, у больных коралловидным нефролитиазом, страдающих ожирением, в последние годы применяются методы эндовидеохирургии (лапа- роскопические, ретроперитонеоскопические). Ретроспективные исследования после видеоэндоскопических вмешательств продемонстрировали высокий уровень калькулезного очищения, отсутствие геморрагических и гнойно-септических осложнений. К тому же лапаро– и ретроперитонеоскопические доступы обеспечивают возможность выполнения симультанных операций (иссечение кист, пластика ЛМС, нефропексия, холецистэктомия, герниопластика и др.) и характеризуются короткими сроками госпитального периода [38, 39].
Что же нас ждет в будущем? Какие технологические разработки и инструментальные усовершенствования позволят решить существующие проблемы комбинированной хирургии уролитиаза: оптимальноизиологическое положение пациента на операционном столе, риски респираторных и кардиальных осложнений, эффективность и безопасность анте– и ретроградного доступов, профилактика внутрипочечной гипертензии, возможность применения сочетанных технологий, скорость фрагментации и экстракции, полнота элиминации, необходимость дренирования, уменьшение радиологической нагрузки, профилактика осложнений (полноценный гемостаз, контроль активности мочевой инфекции).
Учитывая современное состояние проблемы, можно предположить, что перспективным направлением будущего хирургии уролитиаза могут быть:
- Сочетанные навигационные технологии с использованием данных МСКТ, МРТ, рентгеноскопии, УЗИ и видеоэндоскопии на этапе осуществления доступа;
- Использование дистанционных (при малом объеме камня) и контактных роботизированных технологий дезинтеграции (при коралловидном и множественном нефролитиазе);
- Применение автоматизированной подачи подогреваемого раствора и аспирации фрагментов при поддержании низкого внутриполостного давления;
- Разработка новых технологий быстрой литодеструкции с использованием лазерной энергии в режиме абляции и микрофрагментации;
- Использование цифровой фиброэндоскопии с целью оптимизации доступа в труднодоступные зоны ЧЛС и полного калькулезного освобождения;
- Комбинация антеградных и ретроградных интраренальных технологий;
- Термальные или биологические методы паренхиматозного гемостаза и закрытия кожно-почечного свища; 8. Технологические разработки и усовершенствование инструментария (бал- лонный кожух-дилататор с изменяемым диаметром (просветом), трансформирующийся мочеточниковый катетер в стент, конструктивное изменение операционного стола для оптимального и физиологического положения пациента, минитюаризация оптики и инструментария, др.); 9. Удешевление одноразового эндо- скопического оборудования.
И наконец, в порядке размышления. Перспективы развития современной хирургии, и урологии в частности, будут определяться в будущем успехами фундаментальных исследований в различных областях человеческого знания (биология, физика, химия, математики, иммунология и др.), всесторонним изучением функционального состояния жизненно важных органов и систем больного на различных стадиях развития патологического процесса, знаниями характера компенсаторных механизмов, которые обеспечивают восстановление и сохранение функций пораженных органов.
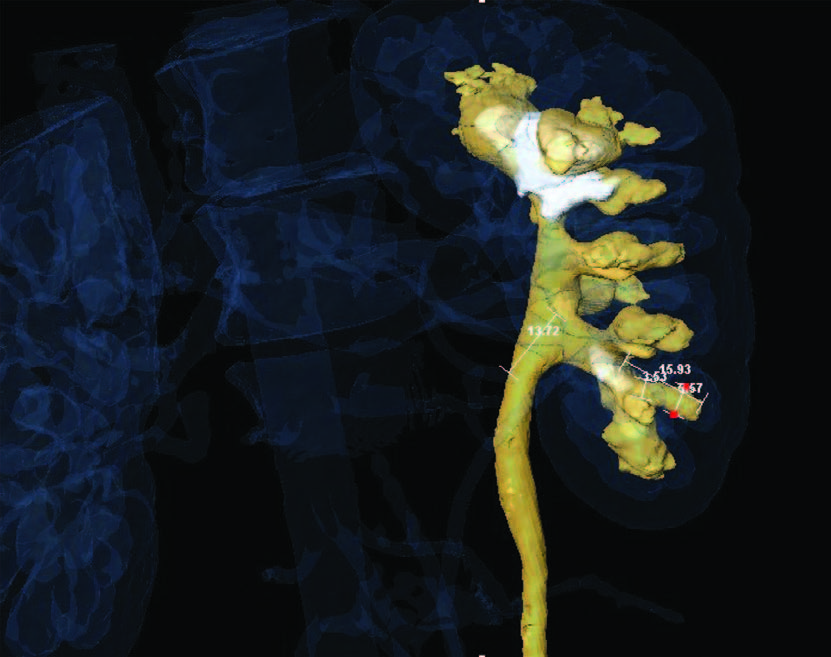
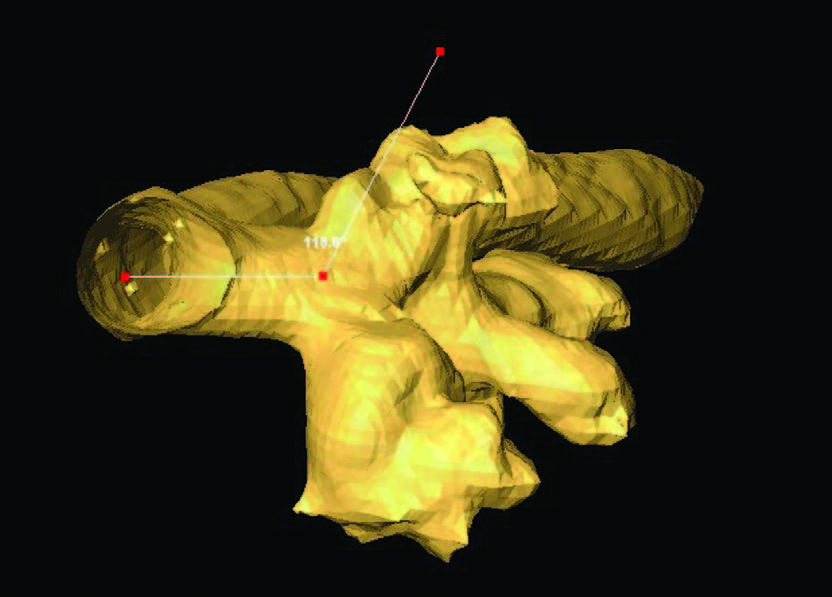
Рис. 10. Морфометрическое предоперационное моделирование(Amira3DAnalysisSoftware, Konrad– Zuse– ZentrumBerlin)
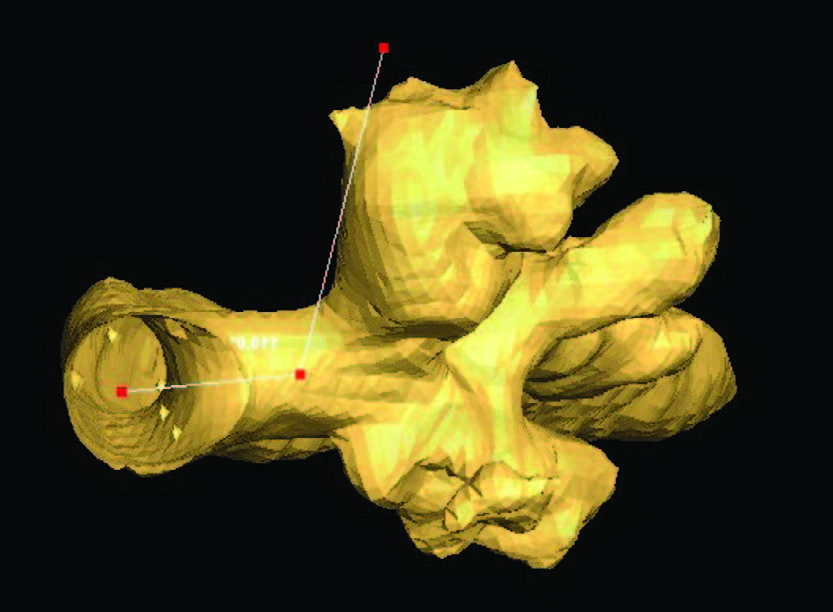
Рис.11,12,13.Морфометрическое определение линейных и объ-емных параметров, угловых значений зоны антеградного доступа приECIRS
Развитие хирургии в широком плане как комплексной науки будет предопределять дальнейшее совершенствование технологий визуализации, предоперационного планирования на основе компьютерной реконструкции объекта вмешательства и медицинской морфометрии (рис. 10-13). Благодаря проведению алгоритмированных измерений и последующего математического описания изучаемого объекта наконец появилась возможность определения морфометрических показателей, характеризующих метрические свойства органа, что служит основой для выявления закономерностей для хирургических пособий, то есть формирования модели перспективного события с предсказуемым
результатом. Поэтому следующим шагом и новым инновационным направлением современной хирургии уролитиаза, основанном на междисциплинарном подходе, явилось применение технологии биомоделирования предстоящего оперативного мероприятия.
Как было показано, разработка и применение достижений научно-технического прогресса, прошло сложный (порой длительный) путь, благодаря объединению усилий медиков и специалистов других областей.
Однако вполне закономерно, что чем выше возможности хирургии, тем выше требования к самим хирургам. Как бы не была высока техническая оснащенность операции, остается неизменной тщательно отработанная методика вмешательства, основанная на виртуальных технических аспектах предстоящей операции, на детальных знаниях строения собирательной системы, фенотипа чашечек, стереометрии, а также возможностями расчета оптимальной точки доступа, длины пункционного хода, объема калькулезного поражения, углов отхождения чашечек.
В перспективе с возрастанием возможностей хирургии, как и всей медицины в целом, соответственно должна возрастать роль образованного, высокопрофессионального, морально честного человека, охраняющего здоровье населения – врача в белом халате. Как тут не вспомнить С.П. Боткина: «Необходимо иметь истинное призвание к практической деятельности врача, чтобы сохранить душевное равновесие при различных неблагоприятных условиях его жизни, не впадая при неудачах в уныние или самообольщение при успехах. Нравственное развитие врача-практика поможет ему сохранить душевное равновесие, которое даст ему возможность исполнить священный долг перед больным и Родиной, что и будет обуславливать истинное счастье его жизни».
Прогнозировать будущее – задача очень сложная и ответственная. Однако с учетом вышесказанного, краткого анализа достижений мировой и отечественной хирургии (конечно, и урологии), тенденций развития науки и техники, можно полагать, что обогащение хирургии новейшей, все более совершенной техникой с высокими разрешающими возможностями, будут неизбежно тесно связаны с ростом авторитета врача, доверия со стороны общества и населения. По-видимому, будут улучшены законы, определяющие конкретные меры защиты пациента и врача, меры реальной ответственности властей за здоровье человека (рис. 14).
И в заключении хочется поделиться проникновенными словами философа, писателя и общественного деятеля Андре Моруа (1885-1967): «Завтра, как и сегодня… врач сохранит свой сан жреца, а вместе с ним и свою страшную, все возрастающую ответственность…И жизнь врача останется такой же, как сегодня, – трудной, тревожной, героической и возвышенной …».
Рис.14.… и конечно востребованной и счастливой!
Библиографический список:
1. Young HH, McKay RW. Congetal valvular obstruction of the prostatic urethra. Surg Gynecol Obstet 1929(48):509.
2. Marshall VF. Fiber optics in urology. J Urol 1964(91):110-114.
3. Pérez-Castro Ellendt E, Martínez-Piñeiro JA. Transurethral ureteroscopy. A current urological procedure. Arch Esp Urol 1980;33(5):445-60.
4. Lyon ES, Huffman JL, Bagley DH. Ureteroscopy and ureteropyeloscopy, Urology 1984;23(5):29-36.
5. Huffman JL, Bagley DH, Schoenberg HW, Lyon ES. Transurethral removal of large ureteral and renal pelvic calculi using ureteroscopic ultrasonic lithotripsy. JUrol 1983 Jul;130(1):31-4.6. Bagley DH. Active versus passive deflection in flexible ureteroscopy. J Endourol 1987(1):15-18.
7. Denstedt JD., Razvi H, Sales JL, Eberwein PM. Preliminary experience with holmium: YAG laser lithotripsy. J Endourol 1995(9):255-258.
8. Bach C, Nesar S, Kumar P, Goyal A, Kachrilas S, Papatsoris A. The new digital flexible ureteroscopes: “size does matter” – increased ureteric access sheath use! Urol Int 2012(89):408-411.
9. Traxer O, Thomas A. Prospective evaluation and classification of ureteral wall injuries resulting from insertion of a ureteral access sheath during retrograde intrarenal surgery. J Urol 2013(189):580-584.
10. Grasso M. Ureteropyeloscopic treatment of ureteral and intrarenal calculi. Urol Clin North Am 2000(27):623-31.
11. Bach T, Geavlete B, Herrmann TR, Gross AJ. Working tools in flexible ureterorenoscopy-influence on flow and deflection: what does matter? J Endourol 2008(22):1639-1643.
12. Defidio L, De Dominicis M, Di Gianfrancesco L. Improving flexible ureterorenoscope durability up to 100 procedures. J Urol 2012(26):1329-1334.
13. Doizi S, Kamphius G, Giusti G, Andreassen KH, Knoll T, Osther PJ. First clinical evaluation of a new single-use flexible ureteroscope (LithoVue): a European prospective multicentric feasibility study. World J Urol 2016;35(5):809-818.
14. Somani BK, Al-Qahtani SM, de Medina SD, Traxer O. Outcomes of flexible ureterorenoscopy and laser fragmentation for renal stones: comparison between digital and conventional ureteroscope. Urology 2013(82):1017-1019.
15. Yinghao S, Yang B, Gao X. The management of renal caliceal calculi with a newly designed ureteroscope: a rigid ureteroscope with a deflectable tip. J Endourol 2010(24):23-26.
16. Saglam R, Muslumanoglu AY, Tokatli Z, Caskurlu T, Sarica K, Tasci AI. A new robot for flexible ureteroscopy: development and early clinical results (IDEAL stage 102b). Eur Urol 2014(66):1092-1100.
17. Afane JS, Olweny EO, Bercowsky E, Sundaram CP, Dunn MD, Shalhav AL. Flexible ureteroscopes: A single center evaluation of the durability and function of the new endoscopes smaller than 9Fr. J Urol 2000(164):1164-8.
18. Traxer O, Dubosq F, Jamali K, Gattegno B, Thibault P. New generation flexible ureterorenoscopes are more durable than previous ones. Urology 2006(68):276-9.
19. Rajamahanty S, Grasso M. Flexible ureteriscopy update: indications, instrumentation and technical advances. IJU 2008;24(4):532-537.
20. Grasso M, Loisides P, Beaghler M, Bagley D. The case for primary endoscopic management of upper urinary tract calculi: I, A critical review of 121 extracorporeal shock-wave lithotripsy failures. Urology 1995(45):363-71.
21. Johnson GB, Grasso M. Exaggerated primary endoscope deflection: Initial clinical experience with prototype flexible ureteroscopes. BJU 2004(93):109-14.
22. Johnson GB, Fraiman M, Grasso M. Broadening experience with the retrograde endoscopic management of upper urinary tract urothelial malignancies. BJU 2005(95):110-3.
23. Pablo G, Bryan S, Pablo C, Luis G, Manuel F. Outpatient micro-ureteroscopy for distal ureteral stone a true minimally invasive procedure. Urology 2018(75):23-25.
24. Jessen JP, Honeck P, Knoll T. Wendt-Nordahi Flexible ureterorenoscopy for lower pole stones: influence of the collecting system’s anatomy. J Endourol 2014(28):146-151.
25. Resorlu B, Oguz U, Resorlu EB, Oztuna D, Unsal A. The impact of pelvicaliceal anatomy on the success of retrograde intrarenal surgery in patients with lower pole renal stones. Urology 2012(79):61-66.26. Kourambas J, Delvecchio F, Munver R, Preminger GM. Nitinol stone retrieval-assisted ureteroscopic management of lower pole renal calculi. J Urol 2000;56(6):935-9.
27. Perlmutter AE, Talug C, Tarry WF, Zaslau S, Mohseni H, Kandzari SJ. Impact of stone location on success rates of endoscopic lithotripsy for nephrolithiasis. Urology 2008(71):214-217.
28. Torricelli FC, De S, Hinck B, Noble M, Monga M. Flexible Uretescopy with a ureteral access sheath: when to stent? Urology 2014;83(2):278-281.
29. Cetti RJ, Biers S, Keoghane SR. The difficult ureter: what is the incidence of pre-stenting. Ann R Coll Surg Engl 2011(93):31-33.
30. Hameed DA, Safwat AS, Osman MM, Gadelmoula MM, Kurkar A, Elgammal MA. Outcome of ureteral ditensibility on the success of ureteroscopy: A prospective hospital-based descriptive study. African Journal of urology 2017;23(1):33-37.
31. Hein S, Schoenthaler M, Wilhelm K, Schlager D, Vach W, Wetterauer U, Miernik A. Ultralow radiation exposure during Flexible ureteroscopy in patients with nephrolithiasis – How far can we go? Urology 2017(108):34-39.
32. Hamamoto S, Unno R, Taguchi K, Ryosuke. A new navigation system of renal puncture for endoscopic combined intrarenal surgery: real-time virtual sonography – guided renal access. Urology 2017(109):44-50.
33. Popper K. The logic of scientific discovery. London, 1960;281 p.
34. Спасокукоцкая М. Г. Жизнь и деятельность С. И. Спасокукоцкого (1870 – 1943). М.: Медгиз, 1960; 260 с.
35. Лихачев Д.С. Письма о добром и прекрасном. М., 1989; 231 с. [Lihachev D.S. Pisma o dobrom i prekrasnom. M., 1989;231 s. (In Russian)].
36. Saglam R, Muslumanoglu A, Tokatli Z, Caskurlu T, Sarica K, Tasci A, Erkurt B, Suer E, Kabakci S, Preminger G, Traxer O, Rassweiler J. A new Robot for flexible ureteroscopy: Development and early clinical results (IDEAL 1-2b). Eur Ur 2014;66(6):1092-1100.
37. Scoffone CM, Cracco CM, Cossu M, Grande S, Poggio M, Scarpa RM. Endoscopic Combined Intrarenal Surgery in Galdakao-Modified Supine Valdivia Position: A new Standard for Percutaneous Nephrolithotomy? European Urology 2008;54(6):1393-1401.
38. Кочкин А.Д., Севрюков Ф.А., Сорокин Д.А., Карпухин И.В., Пучкин А.Б., Семенычев Д.В., Абрамов Д.В. Лапароскопическая пиелолитотомия при коралловидном нефролитиазе у больных с ожирением. Экспериментальная и клиническая урология 2014(1):72-74. [Kochkin A.D., Sevryukov F.A., Sorokin D.A., Karpuhin I.V., Puchkin A.B., Semenyichev D.V., Abramov D.V. Laparoskopicheskaya pielolitotomiya pri korallovidnom nefrolitiaze u bolnyih s ozhireniem. Eksperimentalnaya i klinicheskaya urologiya = Experimental and clinical urology 2014(1):72-74. (In Russian)].
39. Безуглый О.Н., Рамишвили В.Ш., Сулейманов С.И., Кадыров З.А. Наш опыт ретроперитонеоскопической пиелолитотомии. Медицинский вестник Башкортостана 2013;8(2):289-290. [Bezuglyiy O.N., Ramishvili V.Sh., Suleymanov S.I., Kadyirov Z.A. Nash opyit retroperitoneoskopicheskoy pielolitotomii. Meditsinskiy vestnik Bashkortostana = Bashkortostan Medical Journal 2013;8(2):289-290. (In Russian)].
40. Basillote JB, Lee DI, Eichel L, Ralph V. Clayman. Ureteroscopes: flexible rigid, and semirigid. Urol Clin N Am 2004(31):21-32.









Комментарии