Канал TRPA1 – катионный канал, который локализуется на плазматической мембране в чувствительных нейронах мочевого пузыря и других клеток человека и животных. Он отвечает на термические и механические стимулы, а также является основным хемосенсором.
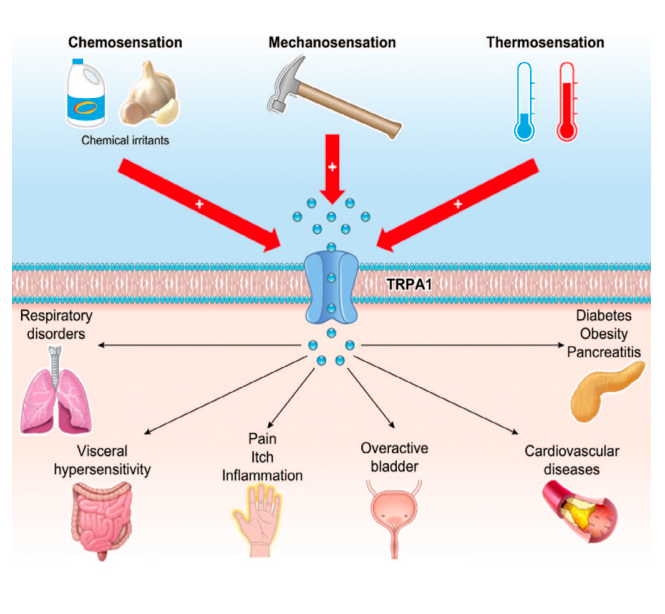
Существуют вещества, которые активируют канал TRPA1 – например, именно к таким относятся аллилизотиоцианат (AITC), определяющий острый вкус горчицы, хрена и васаби, коричный альдегид из корицы, чеснока и лука, слезоточивый газ. Они становятся причиной жжения, механической и термической гиперчувствительности, кашля, раздражения глаз, чихания, образование слизи, а также нейрогенного воспаления.
Известно, что повышенная активность TRPA1 приводит к возникновению хронического кожного зуда и аллергического дерматита, а также связана с «синдромом эпизодической боли» — наследственным заболеванием, которое характеризуется неожиданно возникающей изнурительной болью при стрессе.
В медицинском аспекте TRPA1 сегодня рассматривается как одна из мишеней для создания новых противовоспалительных и обезболивающих лекарственных средств. В урологии канал TRPA1 экспрессируется в уротелиальных клетках и нервных окончаниях мочевого пузыря и, возможно, играет роль в патогенезе гиперактивного мочевого пузыря (ГМП).
Так, например, гипергликемия у людей с сахарным диабетом вызывает накопление высокореактивного дикарбонильного соединения метилглиоксаля (MGO), которое модулирует активность TRPA1. Длительный пероральный прием MGO вызывает дисфункцию мочевого пузыря у мышей. Авторы исследования предположили, что TRPA1 участвует в механизме, который приводит к MGO-индуцированной дисфункции мочевого пузыря. Они оценили экспрессию TRPA1 в мочевом пузыре и влияние 1-часовой внутрипузырной инфузии селективного блокатора TRPA1 HC-030031 (1 нмоль/мин) на цистометрические изменения, вызванные MGO.
Пятинедельные самки мышей C57BL/6 получали 0,5% MGO в питьевой воде в течение 12 недель, тогда как контрольные мыши получали только водопроводную воду.
По сравнению с контрольной группой уровни белка и иммуноокрашивание на изомер гидроимидазолона MG-H1, полученный из MGO, были увеличены в мочевом пузыре группы MGO, что наблюдалось в уротелии и гладких мышцах детрузора. Экспрессия белка TRPA1 была значительно выше в тканях мочевого пузыря MGO по сравнению с контрольной группой с иммуноокрашиванием TRPA1 как собственной пластинки слизистой оболочки, так и уротелия, но не гладких мышц детрузора.
Анализ мочеиспускания у мышей, находящихся в сознании, выявил фенотип гиперактивного мочевого пузыря у мышей, получавших MGO, и характеризовался увеличением количества мочеиспусканий и уменьшением объема одного мочеиспускания.
Цистометрия у анестезированных животных выявила повышенную частоту мочеиспускания, снижение емкости мочевого пузыря и уменьшение объема мочеиспускания в MGO по сравнению с группой носителя, и все эти явления были обращены вспять инфузией HC-030031.
Таким образом, активация TRPA1 связана с MGO-индуцированной гиперактивностью мочевого пузыря у мышей. Блокаторы TRPA1 могут быть полезны для лечения диабетической дисфункции мочевого пузыря у людей с высоким уровнем MGO.
Материал подготовлен командой Уровеб
Источник: https://pubmed.ncbi.nlm.nih.gov/38143915/









Комментарии