С.В. Шкодкин1,2, Ю.Б. Идашкин1 , С.А. Фиронов2 , В.В. Фентисов2 , А.Н. Удовенко2
1 ОГБУЗ «Белгородская областная клиническая больница Святителя Иоасафа»; Белгород, Россия
2 ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»; Белгород, Россия
Введение
Нефронсберегающее лечение при почечно-клеточном раке (ПКР), обеспечивая хорошие долгосрочные онкологические результаты, претендует на приоритет не только при опухолях до 4 см [1-4]. До сих пор одним из основных противопоказаний к проведению нефронсберегающего лечения является невозможность обеспечения гемостаза при опухолях среднего сегмента, особенно при их интраренальном расположении [1, 3]. Общепризнанными критическими моментами в резекции почки являются время ишемии и адекватность гемостаза [4-7]. Другим камнем преткновения является методика удаления опухоли, а именно, энуклеация или резекция с отступом от края опухоли. Данные литературы разноречивы: много ретроспективных исследований, указывающих на преимущества энуклеации [8-11]. Однако их дизайн не безупречен, а большую часть (60-80%) составляют опухоли до 2 см. В некоторых исследованиях показано, что энуклеация почечной опухоли может увеличить частоту положительного хирургического края, особенно при больших опухолях [12, 13]. Несомненно, большую роль играет вариант доступа: эндоскопия или открытая хирургия.
Цель исследования – оценить эффективность открытой резекции почки.
Материалы и методы
За период 2005-2018 года нами выполнено 152 открытые резекции почки (РП) по поводу ПКР. Средний возраст пациентов составил 55,4±16,2 года; соотношение мужчины/женщины - 52,6/47,4%; правосторонняя/левосторонняя локализация опухоли 42,1/57,9% соответственно. В план предоперационного обследования, помимо рентгенографии или СКТ органов грудной клетки, ультразвукового исследования почек, печени, регионарных лимфатических узлов и почечных вен, стандартно включали СКТ в ангиографическом режиме с регистрацией нативной, артериальной, паренхиматозной, венозной и выделительной фаз.
Алгоритм РП включал экстраперитонеальный люмботомический доступ в IХ межреберье с резекцией Х ребра, резекцию в условиях тепловой ишемии при компрессии артериального сосуда, в 92,8% случаев выполнено пережатие сегментарной, либо аберрантной артерии. Резекцию производили, отступая от опухоли 0,5-1 см в пределах неизмененной почечной паренхимы. Визуально оценивали хирургический край удаленной опухоли. «Экспресс» гистологического исследования не выполняли. Парциальную лимфодиссекцию в пределах ворот почки выполняли при наличии лимфоузлов более 0,5 см или у пациентов с опухолями больше чем Т1а.
Результаты и их обсуждение
По абсолютным показаниям оперированы 10,5% пациентов, а именно, 9 пациентов с единственной почкой и 7 с билатеральным раком (в 5 случаях двухсторонняя резекция, в 2 – резекция и нефрэктомия). Относительные показания были выставлены у 29,6% больных, а элективные более чем в половине случаев – 51,6% (рис. 1), что соответствует статистике ведущих российских клиник [3-5].
Внеполюсное расположение опухоли отмечено в 62,5% наблюдений. В 69,1% наблюдений размеры опухолевого узла превысили Т1а , а 23,7% были стадированы как Т2а . При этом 23% пациентов имели высокий риск осложнений нефрон сберегающего лечения по шкале R.E.N.A.L., средний риск отмечен в 65,1%, а низкий в 11,9% (рис. 2).
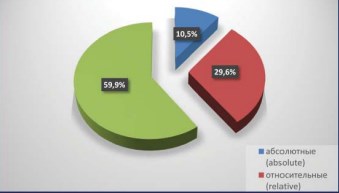
Рисунок 1. Показания к выполнению резекции почки
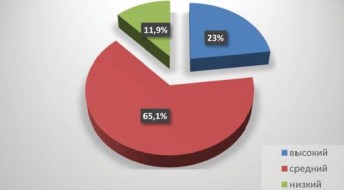
Рисунок 2. Риск интраоперационных осложнений согласно морфометрической шкале R.E.N.A.L.
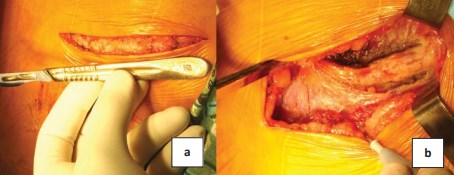
Рисунок 3. Этапы выполнения хирургического доступа: а – кожный разрез в Х межреберье; b – резекция Х ребра
Экстраперитонеальный люмботомический доступ в Х межреберье с резекцией Х ребра обеспечивал прямой выход на почечные сосуды и возможность манипуляций на верхнем полюсе при длине разреза 7-16 см (11,7±4,2 см), (рис. 3). Ранение плеврального синуса отмечено в 15 (9,7%) случаях, диагностировано интраоперационно, ушито без дренажа с аспирацией воздуха, рецидивов пневмо- и гидроторакса не было.
Использование СКТ ангиографии позволило на дооперационном этапе иметь четкое представление о ангиоархитектонике и лоханочно-сосудистых взаимоотношениях в почечном синусе (рис. 4). В 39 (25,7%) наблюдениях имелись аберрантные сосуды, кровоснабжающие опухоль. У 148 (97,4%) пациентов деление почечной артерии на сегментарные отмечалось на уровне или проксимальнее почечной лоханки, и только в 4 (2,6%) наблюдениях зарегистрировано интраренальное деление почечной артерии.
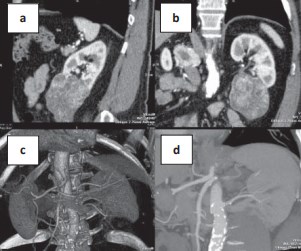
Рисунок 4. СКТ-ангиография пациента с опухолью нижнего полюса левой почки: a – сагитальная плоскость; b – фронтальная плоскость; c – 3D-реконструкция; d – 13 месяцев после операции, фронтальная плоскость
Выделяли сегментарную, субсегментарную или аберрантную артерию, кровоснабжающую опухоль, брали последнюю на держалку (рис. 5а). Опухоль мобилизировали без удаления паРисунок 3. Этапы выполнения хирургического доступа: а – кожный разрез в Х межреберье; b – резекция Х ребра. Figure 3. The steps of the surgical access: a – skin incision in the X intercostal space; b – resection of the X rib. ранефрия. Выключали опухоль из кровотока наложением сосудистого зажима (бульдог) на питающую артерию, вену не клипировали (рис. 5b). Зона ишемии не превышала ¼ органа. Энуклеаций и энуклеорезекций мы не выполняли. Резекцию выполняли с отступом от опухоли 0,5-1 см в пределах визуально неизмененной почечной перенхимы скальпелем или электроножом, принципиальных преимуществ в плане гемостаза при использовании электрохирургии отмечено не было, и инцизия электроножом была несколько затруднена на ишемизированной ткани. Визуально оценивали хирургически край удаленной опухоли (рис. 6а), при необходимости рассекали опухоль (рис. 6б). Экспресс-патогистологии не производили, по данным стандартного морфологического исследования положительный хирургический край не зарегистрирован ни в одном случае. Средний размер отступа от края опухоли при резекции составил 0,7±0,4 см (рис. 6б). Морфологическое исследование в стандартной проводке не выявило положительного хирургического края ни у одного больного. Отдаленные результаты прослежены у 104 пациентов, у которых на сроках наблюдения 87,4±62,5 месяцев не выявлено локального рецидива либо прогрессии заболевания.
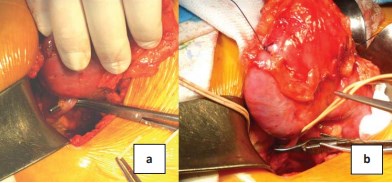
Рисунок 5. Этапы сосудистой изоляции опухоли: а – выделение сегментарной почечной артерии; b – наложение сосудистого зажима на сегментарную почечную артерию
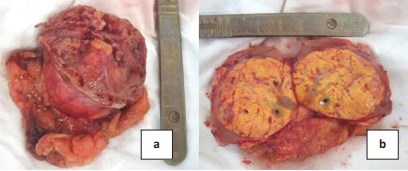
Рисунок 6. Методика оценки хирургического края: а – визуальная оценка края резекции; b – оценка хирургического отступа
Гемостаз осуществляли наложением П-образных швов (Polysorb-0), линию шва укрепляли заплатой из сосудистого протеза (рис. 7). Дренирование полостной системы выполнено в 2 (1,3%), внутренний стент и нефростома. Показанием к дренированию явился риск резидуального нефролитиаза при коралловидном и множественном нефролитиазе. Нефростома установлена вследствие непреодолимого препятствия в интрамуральном отделе мочеточника, удалена на 10 сутки после контроля проходимости мочеточника. Еще один стент (0,7%) установлен в послеоперационном периоде по поводу мочевого свища. Последний отмечен у пациента после резекции почки по поводу опухоли передней поверхности среднего сегмента максимальным размером 5,5 см. Причиной образования свища, на наш взгляд, явилась стриктура лоханочно-мочеточникового сегмента и невозможность двухсторонней компрессии линии шва (риск деформации и нарушения кровоснабжения почки). Свищ закрылся самостоятельно на сроке 2 недель.
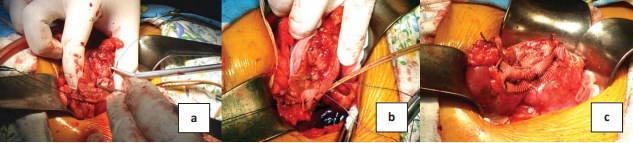
Рисунок 7. Закрытие почечной раны однорядным П-образным швом: а и b – последовательность наложения П-образных горизонтальных швов; c – окончательный вид почечной раны после пуска кровотока
Продолжительность операции составила 109,6±56,7 мин, время частичной ишемии 15,1±8,3 мин, объем кровопотери – 258±93 мл. Отделяемое по дренажам продолжалось в течение 4-12 часов после операции (за исключением выше описанного случая) и составило в среднем 35,7±22,1 мл, дренажи обрезались под повязку на 1 сутки, удалялись на 2-4 сутки послеоперационного периода. Пациенты активизировались через 24 часа, когда удалялся уретральный катетер, в 59 (38,8%) случаях дренирование мочевого пузыря не выполняли. Средний послеоперационный койко-день составил 10,1±4,2. Длительность значимой тепловой ишемии почки по данным различных авторов колеблется от 20 до 40 минут [6, 11]. В литературе освещается возможность использования таких нефропротективных приёмов, как локальная гипотермия за счет обкладывания почки ледяной крошкой во время резекции, локальная гипотермия за счет выключения почки из кровотока и перфузии охлажденным консервирующим раствором, экстракорпоральная резекция почки, компрессия сегментарных сосудов, выполнение резекции без компрессии сосудов почки, в том числе радиочастотная аблация [6 ,7, 11, 14].
Хотелось бы отметить, что у каждого из методов есть как преимущества, так и недостатки. К недостаткам локальных методик защиты нужно отнести необходимость наличия ледяной крошки в ране, перфузионных канюль, что ограничивает возможность манипуляций. Кроме того, необходимость закрытия канюляционных доступов подразумевает выключение кровотока, т.е. тепловую ишемию. Последняя актуальна и при аутотрансплантации после экстракорпоральной резекции. Нулевая ишемия, особенно при сложных опухолях, подразумевает значимую кровопотерю [7, 11, 14, 15]. Это позволяет считать использованную нами сегментарную артериальную ишемию одним из выгодных решений.
Естественно, многие пациенты с низким риском осложнений, согласно морфометрической шкалы, не попали в исследуемую группу ввиду того, что им выполнены лапароскопические операции. Учитывая, что в нашей клинике хирурги выполняют как открытые, так и эндоскопические вмешательства при ПКР, хотелось бы отметить тот факт, что пациенты охотнее соглашаются на открытую резекцию, чем на лапароскопическую нефрэктомию. Это позволяет увеличить пул нефрон сберегающих вмешательств в группах со средним и высоким риском осложнений без ущерба со стороны радикальности.
Парциальная лимфодиссекция выполнена в 83 (54,6%) наблюдениях. Морфологическое исследование удаленных лимфатических узлов в этих наблюдениях было отрицательным.
Выводы
Методика открытой резекции почки с отступом от границы видимой опухоли и визуальным контролем хирургического края обеспечивает хорошие онкологические результаты, не требует выполнения «экспресс» гистологии и является альтернативой нефрэктомии у пациентов с высоким риском осложнений, рассчитанным по морфометрическим шкалам. Для ответа на вопрос о достоинствах энуклеационных и резекционных методик необходимы проспективные исследования, учитывающие не только распространенность опухоли, но и используемый доступ. Вопрос удаления лимфатических узлов, по нашему мнению, нельзя считать закрытым. Целесообразность лимфодиссекции стоит исследовать в отдаленные сроки наблюдения и в сопоставимых группах с высоким риском лимфогенного метастазирования.
Литература
- Zhang M, Zhao Z, Duan X, Deng T, Cai C, Wu W, Zeng G. Partial versus radical nephrectomy for T1b-2N0M0 renal tumors: A propensity score matching study based on the SEER database. PLoS One. 2018;28;13(2):e0193530. DOI:10.1371/journal.pone.0193530
- Marchioni M, Preisser F, Bandini M, Nazzani S, Tian Z, Kapoor A, Cindolo L, Abdollah F, Tilki D, BrigantiA, Montorsi F, Shariat SF, Schips L, Karakiewicz PI. Comparison of Partial Versus Radical Nephrectomy Eff ect on Othercause Mortality, Cancer-specifi c Mortality, and 30-day Mortality in Patients Older Than 75 Years. Eur Urol Focus. 2018;2.pii:S2405-4569(18)30008-7. DOI:10.1016/j. euf.2018.01.007
- Мосоян М.С., Аль-Шукри С.Х., Есаян А.М., Каюков И.Г. Ранние клинико-функциональные показатели у больных раком почки, перенесших резекцию почки или радикальную нефрэктомию. Нефрология. 2012;16:4:100-104.
- Пучков К.В., Филимонов В.Б., Крапивин А.А., Васин Р.В., Васин И.В. Хирургическое лечение рака почки сегодня: лапароскопическая радикальная нефрэктомия и резекция почки. Урология. 2008;1:47-53.
- Павлов А.Ю., Кравцов И.Б. Функциональное состояние почек и течение послеоперационного периода при резекции почки по поводу рака. Справочник врача общей практики. 2013;7:64-69.
- Bertolo R, Garisto J, Dagenais J, Agudelo J, Armanyous S, Lioudis M, Kaouk J. Cold versus warm ischemia robotassisted partial nephrectomy: Comparison of functional outcomes in propensity-score matched “at risk” patients. J Endourol. 2018;21. DOI:10.1089/end.2018.0383
- Arora S, Rogers C. Partial Nephrectomy in Central Renal Tumors. J Endourol. 2018;32(S1):63-S67. DOI:10.1089/ end.2018.0046
- Serni S, Vittori G, Frizzi J, Mari A, Siena G, Lapini A, Carini M, Minervini A. Simple enucleation for the treatment of highly complex renal tumors: Perioperative, functional and oncological results. Eur J Surg Oncol. 2015;41(7):934- 40. DOI:10.1016/j.ejso.2015.02.019
- Calaway AC, Gondim DD, Flack CK, Jacob JM, Idrees MT, Boris RS. Anatomic comparison of traditional and enucleation partial nephrectomy specimens. Urol Oncol. 2017;35(5):221-226. DOI:10.1016/j.urolonc.2016.12.005
- Mari A, Morselli S, Sessa F, Campi R, Di Maida F, Greco I, Siena G, Tuccio A, Vittori G, Serni S, Carini M, Minervini A. Impact of the off -clamp endoscopic robot-assisted simple enucleation (ERASE) of clinical T1 renal tumors on the postoperative renal function: Results from a matchedpair comparison. Eur J Surg Oncol. 2018;44(6):853-858. DOI:10.1016/j.ejso.2018.01.093
- Huang J, Zhang J, Wang Y, Kong W, Xue W, Liu D, Chen Y, Huang Y. Comparing Zero Ischemia Laparoscopic Radio Frequency Ablation Assisted Tumor Enucleationand Laparoscopic Partial Nephrectomy for Clinical T1a Renal Tumor: A Randomized Clinical Trial. J Urol. 2016;195(6):1677-83. DOI:10.1016/j.juro.2015.12.115
- Minervini A, Campi R, Sessa F, Derweesh I, Kaouk JH, Mari A, Rha KH, Sessa M, Volpe A, Carini M, Uzzo RG. Positive surgical margins and local recurrence after simple enucleation and standard partialnephrectomy for malignant renal tumors: systematic review of the literature and meta-analysis of prevalence. Minerva Urol Nefrol. 2017;69(6):523-538. DOI:10.23736/S0393- 2249.17.02864-8
- Wang L, Hughes I, Snarskis C, Alvarez H, Feng J, Gupta GN, Picken MM. Tumor enucleation specimens of small renal tumors more frequently have a positive surgical margin than partial nephrectomy specimens, but this is not associated with local tumor recurrence. Virchows Arch. 2017;470(1):55-61. DOI: 10.1007/s00428-016-2031-9
- Huang J, Zhang J, Wang Y, Kong W, Xue W, Liu D, Chen Y, Huang Y. Comparing Zero Ischemia Laparoscopic Radio Frequency Ablation Assisted Tumor Enucleationand Laparoscopic Partial Nephrectomy for Clinical T1a Renal Tumor: A Randomized Clinical Trial. J Urol. 2016;195(6):1677-83. DOI:10.1016/j.juro.2015.12.115
- Шкодкин С.В., Татаринцев А.М., Идашкин Ю.Б., Любушкин А.В., Фиронов С.А. Экстракорпоральная резекция почки: а стоит ли? Урология. 2016;3:62-69.
Статья опубликована в журнале "Вестник урологии" №2 2018, стр. 54-61









Комментарии