А.В. Пирогов1 , В.В. Сизонов2
1 ГБУЗ Астраханской области «Областная детская клиническая больница им. Н.Н. Силищевой»; Астрахань, Россия
2 ГБУ Ростовской области «Областная детская клиническая больница»; Ростов-на-Дону, Россия
Актуальность
Внедрение в практику везикоскопического (трансвезикального, пневмовезикоскопического) доступа (ВД) при лечении аномалий и заболеваний пузырно-мочеточникового соустья и мочевого пузыря как альтернативы открытой хирургии делает актуальным изучение эффективности данного доступа при лечении наиболее распространенной патологии уретеровезикального сегмента — пузырно-мочеточникового рефлюкса (ПМР) и обструкции уретеро-везикального соустья (ОУВС).
Впервые везикоскопический доступ в 1995 г. описали японские врачи Okamura et al. [1], опубликовав данные о 12-ти пациентах, которым в течение 1992-1994 гг. выполняли тригонопластику. В 2001 г. Gill et al. [2] сообщили о 2х пациентах (10 и 11 лет) с односторонним ПМР, которым была выполнена реимплантация мочеточников по Коэну ВД с заполнением мочевого пузыря глицерином. В 2005 году Yeung et al. [3] впервые предложили вместо глицерина использовать углекислый газ для заполнения мочевого пузыря как в традиционной лапароскопии.
Накопленный за последние годы опыт выполнения оперативных вмешательств на мочевом пузыре с использованием ВД демонстрирует его эффективность на уровне 93% [1-21], что, по существу, равноценно результатам традиционной открытой хирургии — 92-98% [22-23] и выше уровня успеха эндоскопического лечения ПМР при эффективности одной или нескольких процедур, равной 85% [24].
Учитывая достаточно высокую эффективность, технология в настоящее время вызывает все больший интерес как альтернатива других малоинвазивных технологий хирургического лечения. По данным литературы, средний возраст пациентов, которым использовали ВД для коррекции патологии уретеровезикального сегмента и мочевого пузыря, составил чуть более 10 лет [1- 11,13-18, 20], однако имеются сообщения об использовании ВД у пациентов первого года жизни [7, 8, 12, 19].
Цель исследования: в литературе не представлены результаты сравнительного анализа эффективности использования ВД при лечении ПМР и ОУВС, что делает актуальным изучение эффективности реимплантации при ПМР и ОУВС.
Материалы и методы
С апреля 2013 г. по июль 2017 г. с использованием ВД были оперированы 134 пациента по поводу ПМР и 24 пациента по поводу ОУВС, всего 158 детей (табл. 1).
Таблица 1. Структура поражений уретеровезикального сегмента у детей, оперированных с использованием ВД
| № | Диагноз | Количество пациентов |
| 1 | ПМР односторонний | 71 (44,9%) |
| 2 | ПМР двусторонний | 41 (25,9%) |
| 3 | ПМР в удвоенные верхние мочевые пути | 16 (10,1%) |
| 4 | Односторонний ПМР+дивертикул мочевого пузыря Unilateral VUR+Urinary | 1 (0,6%) |
| 5 | ОУВС после эндокоррекции ПМР | 5 (3,1%) |
| 6 | ОУВС | 17 (10,7%) |
| 7 | ОУВС мочеточника верхней половины удвоенной почки | 1 (0,6%) |
| 8 | ОУВС мочеточника верхней половины единственной удвоенной почки, пузырно-мочеточниковый рефлюкс в нижнюю половину | 1 (0,6%) |
| 9 | ОУВС мочеточника, дивертикул мочевого пузыря | 1 (0,6%) |
| 10 | ПМР в удвоенные верхние мочевые пути после рассечения уретероцеле | 4 (2,5%) |
| Итого | 158 (100%) |
Гендерное распределение пациентов — 81 девочка и 77 мальчиков в возрасте от 2х месяцев до 18 лет, средний возраст больных составил 64,2± 51,6 месяцев (табл. 2).
Сформированы две группы пациентов. Первая группа состояла из 134 больных, оперированных по поводу ПМР (девочки (53,7%), 62 мальчика (46,3%)), средний возраст — 69,3± 51,7 мес. 43 пациентам (32,0%) произведена двусторонняя уретероцистонеоимплантация, 91 пациенту (67,9%) — односторонняя уретероцистонеоимплантация. Всего имплантировано 177 рефлюксирующих мочеточников.
Вторая группа состояла из 24х больных, оперированных по поводу ОУВС, из них 18 (75%) с первичным обструктивным мегауретером, 5 (20,8%) — с ОУВС после введения объемообразующего препарата. Гендерное распределение в группе — 9 девочек (37,5%), 15(62,5%) мальчиков. Средний возраст — 35,6± 40,8 мес. Одному пациенту (4,1%) произведена двусторонняя уретероцистонеоимплантация, 23м пациентам (95,8%) — односторонняя уретероцистонеоимплантация. Всего в этой группе имплантировано 25 мочеточников.
Для определения показаний к операции использовали УЗИ, экскреторную урографию, ретроградную микционную цистоуретрографию, радиоизотопное исследование почек. Первое контрольное обследование проводили через 3, 6, или 12 месяцев после операции, которое включало УЗИ, экскреторную урографию, ретроградную микционную цистоуретрографию.
Таблица 2. Возраст больных
| № | Возраст | Количество пациентов |
| 1 | до 1-го года | 25 (15,8%) |
| 2 | 1-3 года | 45 (28,4%) |
| 3 | 4-17 лет | 88 (55,7%) |
| Итого | 158 (100%) |
Таблица 3. Распределение пациентов по степени ПМР и гидронефроза
| Степень ПМР | I | II | III | IV | V | Итого |
| Группа 1 | 15 (8,5%) | 28 (15,8%) | 56 (31,6%) | 58 (32,8%) | 20 (11,3%) | 177 (100%) |
| Степень гидронефроза (SFU) | I | II | III | IV | ||
| Группа 2 | 0 | 0 | 7 (28%) | 18 (72%) | 25 (100%) |
Техника операции. Положение пациента — на спине с разведенными в стороны ногами, подложенным под ягодицы валиком (с целью создания наклона таким образом, чтобы промежность была ротирована кверху и максимально приближена к горизонтальному положению). Под контролем цистоскопа и на фоне тугого наполнения мочевого пузыря стерильной водой осуществляют временную фиксацию мочевого пузыря к передней брюшной стенке. У ребенка младшего возраста и при слабо выраженной подкожно-жировой клетчатке используют крупную колющую или режущую иглу с 0/0, 2/0 или 3/0 нитью (рис. 1a). У пациентов более старшего возраста и при выраженном подкожно-жировом слое фиксацию выполняют путем проведения через пункционную иглу в просвет пузыря фиксирующей нити, пузырный конец которой выводят на переднюю брюшную стенку с помощью лигатурной петли, которую вводят в просвет пузыря через дополнительный прокол кожи (рис. 2b)
.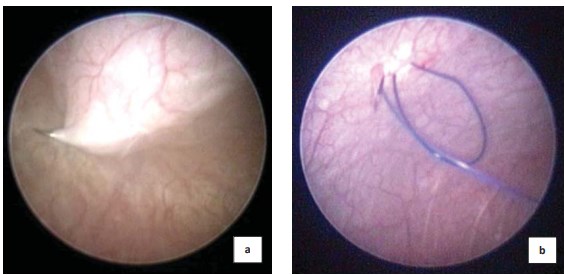
Рисунок 1. Проведение фиксирующей нити у пациентов младшего (a) и старшего возрастов (b)
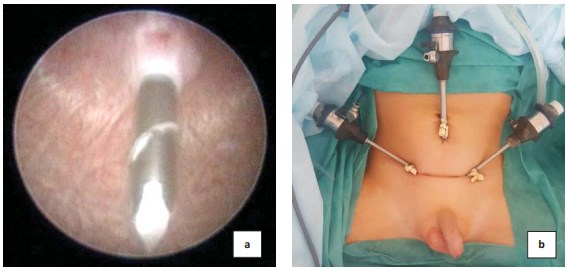
Рисунок 2. Установка троакаров в мочевой пузырь (a) и фиксация их к передней брюшной стенке (b)
Через переднюю брюшную стенку в мочевой пузырь вводят три троакара (рис. 2a). Первый (5 мм) — для оптики, на середине расстояния между пупком и лоном, два манипуляционных (3 мм) — симметрично в правой и левой подвздошно-паховых областях с таким расчетом, чтобы ось сформированного впоследствии подслизистого тоннеля максимально совпадала с осью введенных манипуляторов (рис. 2b).
Жидкость в мочевом пузыре заменяют на углекислый газ, поддерживая его давление во время операции на уровне 10-12 мм рт. ст. В соответствующие троакары вводят лапароскоп и манипуляторы, накладывают шов–держалку на слизистую в зоне устье мочеточника и начинают выделение мочеточника с помощью крючка электрокоагуляции (рис 3a). Затем формируют подслизистый тоннель (рис. 3b).
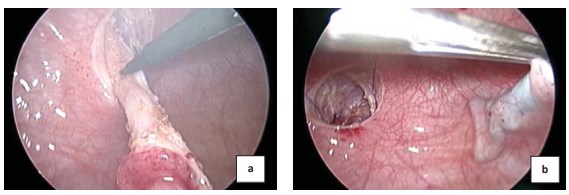
Рисунок 3. Выведение мочеточника в просвет пузыря (a), формирование подслизистого тоннеля (b)
Накладывают скользящий экстракорпоральный шов рассасывающейся мононитью (4/0, 5/0) на детрузор с захватом и фиксацией мочеточника (рис. 4a). Ушивают детрузор в зоне выделения мочеточника. Мочеточник проводят в сформированный подслизистый тоннель (рис. 4b).
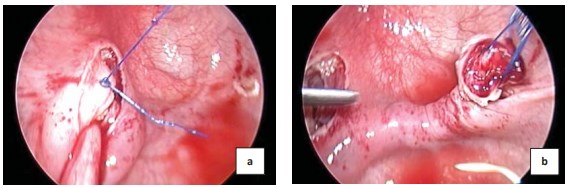
Рисунок 4. Первый шов на детрузор с одновременной фиксацией мочеточника (a), проведение мочеточника в сформированный подслизистый тоннель (b)
Ушивают дефект слизистой мочевого пузыря над областью дооперационной проекции устья мочеточника (рис. 5a). Формируют устье мочеточника в новом месте узловыми интракорпоральными швами (рис. 5b). Резекцию и спатуляцию устья мочеточника при ПМР не производят.
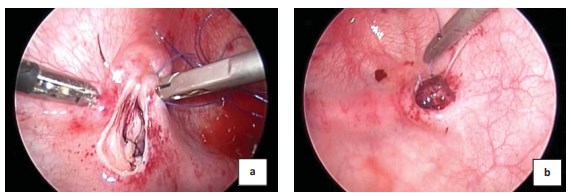
Рисунок 5. Ушивание дефекта слизистой (a) и формированиеартифициального устья мочеточника (b)
При ОУВС производится резекция стенозированного участка мочеточника, и если позволяет его длина, то уретероцистоанастомоз накладывается с выворачиванием стенки мочеточника и формированием нового устья в виде «соска» (рис. 6a), если длина мочеточника не позволяет произвести описанную выше процедур, (это, как правило, происходит при ОУВС после введения объемообразующего препарата), то иссекается пораженный участок и мочеточник фиксируется узловыми швами с соблюдением принципа четкого сопоставления слизистой мочевого пузыря со слизистой мочеточника (рис. 6b).
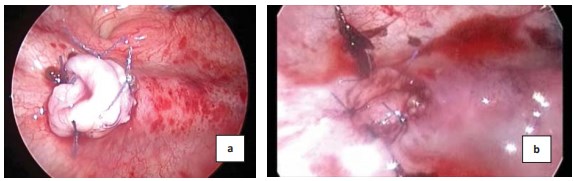
Рисунок 6. Уретероцистоанастомоз с формированием устья в виде соска (a) и формирование устья с четким сопоставлением слизистой мочеточника и слизистой мочевого пузыря (b)
Не были дренированы верхние мочевые пути, у 57-ми (36,0%) из 158-ми пациентов, если после завершения формирования нового устья моча интенсивно выделялась из него в просвет пузыря (рис. 5b). У детей до года и в случаях, когда функция сформированного устья вызывала сомнения, верхние мочевые пути дренировали катетером 4-6 Fr., который вводили ретроградно через артифициальное устье у 101го пациента. Дистальный конец дренажной трубки выводили через уретру у девочек или через троакарные проколы в подвздошно-паховых областях у мальчиков. Средний срок их дренирования составил 3,76±2,8 сут. В группе ПМР верхние мочевые пути дренированы у 84 пациентов (61,7%) сроком на 3,3±1,7 сут. У пациентов с ОУВС верхние мочевые пути дренированы у 17 детей (70,8%) продолжительностью 5,9±7,2 сут. Мочевой пузырь дренировали у всех без исключения пациентов. Среднее время дренирования мочевого пузыря — 3,2±2,2 сут. В группе ПМР — 3,1±2,0 сут. У больных с ОУВС — 3,9±2,9 сут.
Результаты
Средняя продолжительность операций с использованием ВД у всех больных составила 128,6 ±50,0 мин., у больных с ПМР (121,6±44,1 мин.) она была несколько меньше, чем у детей с ОУВС (168,9±62,4 мин.). Послеоперационный койко-день составил 6,3±2,4 сут., в группе ПМР — 5,9±2,1 сут., в группе ОУВС — 8,1±3,1 сут. У пациентов с ПМР рефлюкс устранен у 131 пациента (97,7%), в группе с ОУВС обструкция устранена у 23х пациентов (95,8%) (табл. 4).
Таблица 4. Результаты использования ВД у пациентов с ПМР и ОУВС
| Показатель | Группа 1 | Группа 2 | Р |
| Конверсия | 2 (1,5%) | 1 (4,1%) | |
| Средний возраст, мес. | 69,3 | 35,6 | p< |
| Среднее время операции, мин. | 121,6 | 168,9 | р< |
| Послеоперационный период в стационаре, сут. | 5,9 | 8,1 | р< |
| Разрешение ПМР и ОУВС, % | 97,7 | 95,8 | p>0,05 |
Послеоперационные осложнения возникли в 25случаях (15,8%) и оценивались по классификации Клавьен-Диндо (табл. 5).
Таблица 5. Осложнения ВД по Клавьен-Диндо в исследуемых группах
| Осложнение | Группа 1 | Группа 2 Group 2 (n-24) |
| Общехирургические | ||
| Миграция перкутанного дренажа верхних мочевых путей в мочевой пузырь | 1 (0,7%) (III ст. / gr.) | |
| Подтекание мочи из троакарного прокола после удаления дренажа | 1 (0,7%) (I ст. / gr.) | |
| Околопузырная уринома | 1 (0,7%) (III ст. / gr.) | |
| Наличие и (или) инкрустация шовного материала камнями | 2 (1,4%) (III ст. / gr.) | |
| Дивертикул мочевого пузыря | 1 (4,1%) (I ст. / gr.) | |
| Всего / Total | 5 (3,7%) | 1 (4,1%) |
| Транзиторные нарушения уродинамики в области УВС / | ||
| Обострение пиелонефрита | 4 (2,9%) (I ст. / gr.) | |
| Преходящая обструкция в области УВС | 5 (3,7%) (I ст. / gr.) |
2 (8,3%) (I ст. / gr.) |
| Острая полная обструкция в области УВС в раннем ПП | 1 (0,7%) (III ст. / gr.) | 2 (8,3%) (III ст. / gr.) |
| Всего / Total | 10 (7,4%) | 4 (16,7%) |
| Стойкое нарушение уродинамики в области УВС / | ||
| Стеноз дистального отдела мочеточника | 1 (0,7%) (III ст. / gr.) |
1 (4,1%) (III ст. / gr.) |
| Рецидив | 4 (2,9%) | 1 (4,1%) |
| Всего | 19 (14,2%) | 6 (25%) |
Выявленные осложнения можно разделить на три группы.
Первая группа — это осложнения общехирургического порядка, не связанные с особенностями техники, используемой при реимплантации обструктивных и рефлюксирующих мочеточников. К ним относятся миграция перкутанного дренажа верхних мочевых путей, подтекание мочи из троакарного прокола, околопузырная уринома, инкрустация солями шовного материала. В случае, когда наблюдалось подтекание мочи из троакарного прокола после удаления дренажа, ликвидировать осложнение удалось установкой уретрального катетера. В одном случае при обследовании через год выявлен небольшой дивертикул мочевого пузыря, не вызывающий клинических и лабораторных проявлений. У одного пациента возникла ретроградная миграция наружного дренажа мочеточника в полость мочевого пузыря, потребовавшая трансуретрального его удаления в раннем послеоперационном периоде. В одном случае диагностирована околопузырная уринома, на 9е сутки потребовавшая лапароскопического дренирования. Через несколько лет после операции обнаружены инородные тела мочевого пузыря в виде нерассасывающегося шовного материала с инкрустацией его камнями, ликвидированные трансуретральным удалением.
Вторая группа осложнений — это осложнения, связанные с транзиторными нарушениями пассажа мочи в области артифициального УВС. В трех наблюдениях выявлена острая полная обструкция в области уретеровезикального соустья в раннем послеоперационном периоде, потребовавшая временной установки пункционных нефростом. Связь осложнений этой группы с этиологией патологии УВС существенна, она может быть отнесена к особенностям течения послеоперационного периода после реимплантации по поводу ПМР и ОУВС. Частота развития этих осложнений существенно выше во второй группе, что делает актуальным изучение вопроса о длительности и способе деривации мочи в послеоперационном периоде.
Третья группа осложнений — это группа осложнений, потребовавших повторной реимплантации мочеточников. Среди пациентов третьей группы у одного больного развилась обструкция в области уретеровезикального анастомоза через 6 месяцев после везикоскопической уретероцистонеоимплантации по поводу двустороннего ПМР, ему произведена ретроградная установка внутреннего мочеточникового стента на 2 месяца. Рецидивы возникли у 3 пациентов в группе с ПМР и у 1-го — в группе с ОУВС.
К конверсии пришлось прибегнуть в 3 (1,8%) случаях: однажды в группе с ОУВС (4,1%), и дважды в группе ПМР (1,5%).
Обсуждение
Накопленный опыт демонстрирует, что везикоскопическая операция остается достаточно трудоемким и сложным хирургическим вмешательством, что ограничивает ее широкое использование [2, 4-9, 13-17, 19, 21]. Она требует длительного периода обучения даже у урологов, обладающих хорошими мануальными навыками лапароскопической хирургии.
ЛИТЕРАТУРА
- Okamura K, Ono Y, Yamada Y, Kato T, Tsuji Y, Ohshima S, Miyake K. Endoscopic trigonoplasty for primary vesicoureteric refl ux. Br J Urol. 1995;75(3):390-4.
- Gill IS, Ponsky LE, Desai M, Kay R, Ross JH. Laparoscopic cross-trigonal Cohen ureteroneocystostomy: novel technique. J Urol. 2001;166(5):1811-4.
- Yeung CK, Sihoe JD, Borzi PA. Endoscopic cross-trigonal ureteral reimplantation under carbon dioxide bladder insuffl ation: a novel technique. J Endourol. 2005;19(3):295- 9. doi: 10.1089/end.2005.19.295
- Kutikov A, Guzzo TJ, Canter DJ, Casale P. Initial experience with laparoscopic transvesical ureteral reimplantation at the Children’s Hospital of Philadelphia. J Urol. 2006;176(5):2222-5. doi: 10.1016/j.juro.2006.07.082
- Canon SJ, Jayanthi VR, Patel AS. Vesicoscopic crosstrigonal ureteral reimplantation: a minimally invasive option for repair of vesicoureteral refl ux. J Urol. 2007;178(1):269-73. doi: 10.1016/j.juro.2007.03.059
- Jayanthi V, Patel A. Vesicoscopic ureteral reimplantation: a minimally invasive technique for the defi nitive repair of vesicoureteral refl ux. Adv Urol. 2008:973616. doi: 10.1155/2008/973616
- Valla JS, Steyaert H, Griffi n SJ, Lauron J, Fragoso AC, Arnaud P, Léculée R. Transvesicoscopic Cohen ureteric reimplantation for vesicoureteral refl ux in children: a single-centre 5-year experience. J Pediatr Urol. 2009;5(6):466-71. doi: 10.1016/j.jpurol.2009.03.01
- Hong CH, Kim JH, Jung HJ, Im YJ, Han SW. Single-surgeon experience with transvesicoscopic ureteral reimplantation in children with vesicoureteral refl ux. Urology. 2011;77(6):1465-9. doi: 10.1016/j.urology.2010.11.023
- Chung MS, Han SW, Jung HJ, Im YJ, Han HH, Na JC, Hong CH. Transvesicoscopic ureteral reimplantation in children with bilateral vesicoureteral refl ux: surgical technique and results. J LaparoendoscAdvSurgTech A. 2012;22(3):295-300. doi: 10.1089/lap.2011.0318
- Emir H, Mammadov E, Elicevik M, Buyukunal C, Soylet Y. Transvesicoscopic cross-trigonal ureteroneocystostomy in children: a single-center experience. J Pediatr Urol. 2012;8(1):83-6. doi: 10.1016/j.jpurol.2010.10.005
- Roslan M, Markuszewski MM, Kłącz J, Krajka K. Laparoendoscopic single-site transvesicalureteroneocystostomy for vesicoureteral refl ux in an adult: a one-year follow-up. Urology. 2012;80(3):719-23. doi: 10.1016/j. urology.2012.06.028
- Bi Y, Sun Y. Laparoscopic pneumovesical ureteral tapering and reimplantationfor megaureter. J Pediatr Surg. 2012;47(12):2285-8. doi: 10.1016/j.jpedsurg.2012.09.020
- Шмыров О.С., Врублевский С.Г., Врублевская Е.Н., Врублевский А.С. Эндохирургические вмешательства в коррекции патологии уретеро-везикального сегмента у детей. Детская хирургия. 2014;4:25-28.
- Schober MS, Jayanthi VR. Vesicoscopic ureteral reimplant: is there a role in the age of robotics? UrolClinNorthAm. 2015;42(1):53-9. doi: 10.1016/j.ucl.2014.09.005
- Soh S, Kobori Y, Shin T, Suzuki K, Iwahata T, Sadaoka Y, Sato R, Nishi M, Iwamura M, Okada H. Transvesicoscopic ureteral reimplantation: Politano-Leadbetter versus Cohen technique. Int J Urol. 2015;22(4):394-9. doi: 10.1111/iju.12702
- Choi H, Park JY, Bae JH. Initial experiences of laparoscopic intravesicaldetrusorraphy using the Politano-Leadbetter technique. J PediatrUrol. 2016;12(2):110.e1-7. doi: 10.1016/j.jpurol.2015.07.014
- Ansari MS, Yadav P, Arora S, Singh P, Sekhon V. Bilateral Transvesicoscopic Cross-trigonal Ureteric Reimplantation in Children: Surgical Subtleties and a Prospective Summary. Urology. 2017;101:67-72. doi: 10.1016/j. urology.2016.11.034
- Kim SW, Lim NL, Lee YS, Han SW, Im YJ. Laparoscopic Intravesical Detrusorrhaphy With Ureteral Plication for Megaureter: A Novel Technique. Urology. 2015;86(1):187-91. doi: 10.1016/j.urology.2015.02.023
- Liu X, Liu JH, Zhang DY, Hua Y, Lin T, Wei GH, He DW. Retrospective study to determine the short-term outcomes of a modified pneumovesical Glenn-Anderson procedure for treating primary obstructing megaureter. J PediatrUrol. 2015;11(5):266.e1-6. doi: 10.1016/j. jpurol.2015.03.020
- Naitoh Y, Oishi M, Kobayashi K, Yamada Y, Nakamura T, Johnin K, Hongo F, Naya Y, Okihara K, Kawauchi A. Transvesical laparoscopic surgery for double renal pelvis and ureter with or without ureterocele. Int J Urol. 2016;23(4):332-6. doi: 10.1111/iju.13049
- Marte A, Cavaiuolo S, Esposito M, Pintozzi L. Vesicoscopic Treatment of Symptomatic Congenital Bladder Diverticula in Children: A 7-Year Experience. Eur J Pediatr Surg. 2016;26(3):240-4. doi: 10.1055/s-0035-1551564
- DuckeƩ JW, Walker RD, Weiss R. Surgical results: International Refl ux Study in Children--United States branch. J Urol. 1992;148:1674-5.
- Hjälmås K, Löhr G, Tamminen-Möbius T, Seppänen J, Olbing H, Wikström S. Surgical results in the International Refl ux Study in Children (Europe). J Urol. 1992;148:1657- 61.
- Elder JS, Diaz M, Caldamone AA, Cendron M, Greenfi eld S, Hurwitz R, Kirsch A, Koyle MA, Pope J, Shapiro E. Endoscopic therapy for vesicoureteral refl ux: ametaanalysis. I. Refl ux resolution and urinary tract infection. J Urol. 2006;175(2):716-22. doi: 10.1016/S0022- 5347(05)00210-7
Статья опубликована в журнале "Вестник урологии" №4 2017, стр. 47-57









Комментарии