Камалов А.А., Ефремов Е.А., Дорофеев С.Д., Мельник Я.И., Охоботов Д.А.
(ФГУ НИИ урологии Росздрава, директор академик РАМН Н.А. Лопаткин)
Введение
По данным международной статистики доброкачественная гиперплазия предстательной железы (ДГПЖ) наблюдается в среднем у 80% мужчин в возрасте от 60 лет и старше. По данным ООН численность населения в возрасте старше 60 лет к концу века возросла, в сравнении с его серединой более чем в 3 раза. Учитывая тенденцию старения населения планеты, можно предположить возрастание актуальности данной проблемы [1].
ДГПЖ является одним из наиболее распространенных заболеваний мужчин пожилого возраста и определяется гистологически наличием доброкачественной ткани, расположенной в окружности проксимального сегмента мочеиспускательного канала [2].
J.Isaacs и D.Coffey, 1989 г., на основании аутопсийных исследований заключают, что при профилактическом обследовании мужчин старше 50 лет ДГПЖ обнаруживается в 10 – 15% случаев, однако клинические проявления болезни наблюдаются далеко не у всех (Лопаткин Н.А. с соавт.,1982). У 80 – 85% мужчин 60 лет и старше имеет место в той или иной степени увеличение предстательной железы (Шабад А.Л., 1980).
По данным Попова М.Г. (1988 г.) частота заболеваемости ДГПЖ в возрасте старше 50 лет колеблется от 30 до 80% , а Leisner K.H.e.a., (1979 г.) считают, что у мужчин старше 70 лет заболевание встречается в 90 – 100% случаев.
Родоманом В.Е. с соавт. (1993 г.) при обследовании 648 мужчин в возрасте от 50 до 86 лет (средний возраст 66,2 года) ДГПЖ была диагностирована у 242 (37,34%) среди них от 50 до 59 лет – 11,3% , от 60 до 69 лет – 36,5%, от 70 до 79 лет – 42,8%, 80 лет и старше – 94% [3].
Заболевание проявляется жалобами на прогрессирующее ухудшение качества самостоятельного мочеиспускания: затрудненным мочеиспусканием тонкой вялой струей, чувством неполного опорожнения мочевого пузыря, вынужденным ночным мочеиспусканием от одного раза и чаще.
Таким образом, лечение пациентов с ДГПЖ является важной задачей современной урологии в связи с распространенностью данного заболевания. Медикаментозная терапия ДГПЖ – одна из наиболее динамично развивающихся областей урологии. Вместе с тем, механизмы действия некоторых препаратов изучены недостаточно, отсутствуют чёткие показания к применению большинства лекарственных средств. Основные группы лекарственных средств, применяющиеся для лечения ДГПЖ: гормональные препараты (аналоги гонадотропных рилизинг-гормонов, антиандрогены, гестагены, антиэстрогены, ингибиторы ароматазы, антагонисты пролактина); ингибиторы 5-α редуктазы; α-адреноблокаторы; растительные препараты; прочие (полиеновые антибиотики, аминокислотные комплексы и экстракты органов животных).
При лечении ДГПЖ применяются разнообразные лекарственные препараты растительного и животного происхождения. Один из них – «Витапрост®», активным веществом которого является эндогенная субстанция Сампрост (простаты экстракт) - комплекс водорастворимых биологически активных пептидов, выделенных из предстательной железы ткани простаты быков и бычков, достигших половой зрелости путем жёсткого кислотного гидролиза, глубоко разрушающего клеточные структуры. Особенности выделения этих пептидов нивелируют их молекулярную видоспецифичность, в результате чего полученные препараты лишаются антигенных свойств и ассоциированных с ними побочных эффектов [4].
Экстракт простаты обладает органотропным действием в отношении предстательной железы. Как все пептидные биорегуляторы, простаты экстракт обладает антиагрегантными и антикоагулянтными свойствами, усиливает синтез антигистаминовых и антисеротониновых антител, улучшает микроциркуляцию в пораженном органе. На этом основана его способность уменьшать отек и активность воспалительных процессов при заболеваниях предстательной железы. Существенным является также наличие у простаты экстракта иммуномодулирующих свойств [4].
В 2001 году в НИИ Урологии МЗ РФ проведено открытое несравнительное исследование по изучению эффективности и безопасности препарата «Витапрост®» в форме суппозиториев (доза по Простаты экстракту - 50 мг) при хроническом простатите (ХП). Исследование продемонстрировало хорошую эффективность препарата при немногочисленных нежелательных явлениях. На основании полученных данных сделаны выводы о том, что «Витапрост®» может быть применён в комплексной терапии хронического бактериального и абактериального простатита у пациентов всех возрастных групп, в том числе в сочетании с доброкачественной гиперплазией простаты [5].
Сегодня компанией «Нижфарм» разработана новая форма препарата - «Витапрост® Форте» суппозитории ректальные 100 мг», что позволяет врачу и пациенту варьировать режим дозирования препарата, осуществляя патогенетическую терапию заболеваний предстательной железы и функционально связанных с ней органов. «Витапрост® Форте» показан при различных заболеваниях и патологических состояниях мужской урогенитальной сферы, в том числе и при гиперплазии предстательной железы.
В ФГУ «НИИ Урологии Росздрава» (г. Москва) в 2006 году в соответствии с разрешением Федеральной службы по надзору в сфере здравоохранения и социального развития № 133 от 2 мая 2006 года проведено сравнительное рандомизированное плацебоконтролируемое клиническое исследование эффективности и безопасности препарата «Витапрост® Форте», суппозитории ректальные 100 мг, производства ОАО «Нижфарм», Россия, у пациентов с доброкачественной гиперплазией предстательной железы.
Препарат «Витапрост® Форте суппозитории ректальные 100 мг» представляет собой суппозитории от белого с желтоватым до кремового с сероватым оттенком цвета, торпедообразной формы. Один суппозиторий содержит: в качестве активного вещества: Сампроста субстанцию (простаты экстракт) – 0,1 г (в пересчёте на водорастворимые пептиды – 0,020 г) и вспомогательные вещества: витепсол - достаточное количество для получения суппозитория массой 1,25 г.
Цели исследования
При планировании исследования были поставлены основная, первичные и вторичная цели.
Основной целью данного исследования явилась оценка эффективности и безопасности лекарственного препарата «Витапрост® Форте суппозитории ректальные 100 мг» в лечении пациентов с доброкачественной гиперплазией предстательной железы.
Первичными целями исследования были:
- оценка динамики симптомов ДГПЖ по шкале международной системы суммарной оценки заболеваний простаты (IPSS-Q)
- определение степени выраженности инфравезикальной обструкции, обусловленной ДГПЖ по данным трансректального УЗИ, урофлоуметрии, определения объема остаточной мочи.
- оценка степени уменьшения выраженности воспалительного процесса в предстательной железе, способствующего нарушению самостоятельного мочеиспускания (по показателям трансректального УЗИ простаты)
Вторичная цель – оценка переносимости препарата «Витапрост® Форте» на основе анализа зарегистрированных нежелательных явлений и изменений лабораторных показателей клинического, биохимического анализов крови и клинического анализа мочи.
Материалы и методы
В исследование было включено 120 пациентов, соответствовавших следующим критериям включения:
- мужчины с диагнозом ДГПЖ, находящиеся на амбулаторном лечении и наблюдении.
- пациенты, имеющие умеренно выраженную инфравезикальную обструкцию (максимальная объёмная скорость мочеиспускания (Qmax) 8,0 мл/с – 14,0 мл/с).
- пациенты, подписавшие информированное согласие на участие в исследовании.
В исследование не включались пациенты, которые на момент визита 1:
- нуждались в оперативном вмешательстве или применении любого другого вида лечения ДГПЖ;
- имели диагностированные заболевания МПС (кроме ДГПЖ и простатита), уретры и другие;
- имели выраженные нарушения функции печени и/или почек, и/или других жизненно важных органов, сопровождающиеся декомпенсацией их функций;
- не были способны адекватно отвечать на вопросы исследователя, заполнять необходимые документы и применять исследуемый препарат;
- участвовали в исследовании какого-либо другого лекарственного препарата.
Все пациенты, соответствующие критериям включения и включенные в исследование были рандомизированы на три группы численностью 40 человек каждая:
- Пациенты основной группы получали препарат «Витапрост® Форте суппозитории ректальные 100 мг» по 1 суппозиторию 1 раз в сутки.
- Пациенты первой контрольной группы получали препарат Тамсулозин («Омник») производства «Яманучи Юроп Б.В.», Нидерланды, из группы α-адреноблокаторов по 1 таблетке 1 раз в сутки.
- Пациенты второй контрольной группы получали плацебо по 1 суппозиторию 1 раз в сутки.
Длительность лечения во всех трёх группах составляла 30 дней.
11 пациентов основной группы (Витапрост® Форте), 11 пациентов контрольной группы (Омник), 21 пациент контрольной группы (плацебо) имели сопутствующие заболевания, в том числе: язвенную болезнь желудка и двенадцатиперстной кишки, гипертоническую болезнь 1-2 степеней, ИБС, сахарный диабет 2 типа и другие. Два пациента из основной группы (5%) и 1 пациент из группы плацебо (2,5%) перенесли инфаркт миокарда, 1 пациент из основной группы (2,5%) – острое нарушение мозгового кровообращения. Кроме этого, некоторые пациенты были подвергнуты в анамнезе оперативным вмешательствам: аппендэктомии, холецистэктомии, герниотомии и другим, а также биопсии простаты.
Исследование включало 5 визитов, в ходе которых проводились сбор анамнеза и физикальный осмотр пациента, регистрация симптоматики ДГПЖ с использованием шкалы международной системы суммарной оценки заболеваний простаты (IPSS-Q), пальцевое ректальное и трансректальное ультразвуковое исследование с допплерографией сосудов предстательной железы, клинические и биохимические лабораторные исследования крови и мочи, анализ крови на PSA, определение объема остаточной мочи, урофлоуметрия.
Результаты исследования:
Результаты лабораторных методов обследования:
По данным проведенного динамического исследования клинических, а также биохимических анализов крови достоверные параметры для всех рассматриваемых групп колебались в пределах физиологических нормативов, либо не имели клинического значения.
Общий анализ мочи: сравниваемые изменения таких параметров, как уровень белка, удельного веса, содержания бактерий в поле зрения, pH, не выявило достоверных изменений во всех сравниваемых группах. При этом колебания значений определялись в пределах нормальных значений.
Результаты трансректального ультразвукового исследования простаты:
Данные трансректального УЗИ простаты являлись одними из параметров эффективности, используемых для оценки терапевтического эффекта терапии и степени выраженности воспалительного процесса в предстательной железе.
В основной группе на фоне приёма препарата «Витапрост® Форте» было достигнуто незначительное, но статистически достоверное снижение среднего значения объёма предстательной железы (с 46,05см3 на визите 0 до 44,01см3 на визите 4). Среди пациентов, принимавших Омник, было выявлено статистически достоверное умеренное увеличение объёма простаты с 44,4 см3 до 45,33см3 к концу исследования. В группе плацебо также зафиксировано последовательное увеличение объёма простаты от визита 0 к визиту 3 и визиту 4, но статистически недостоверное.
Результаты урофлоуметрии
Одними из основных параметров, используемых для оценки терапевтического эффекта применения препарата «Витапрост® Форте», были показатели урофлоуметрии и величины объёма остаточной мочи, характеризующие степень нарушения мочеиспускания на фоне развития ДГПЖ и функциональное состояние детрузора.
Таблица 1. Значения основных параметров мочеиспускания у пациентов трёх групп.
|
Основная группа |
Омник |
Плацебо |
||||||
Визит 0 |
Визит 3 |
Визит 4 |
Визит 0 |
Визит 3 |
Визит 4 |
Визит 0 |
Визит 3 |
Визит 4 |
|
| Максимальная объёмная скорость мочеиспускания (мл/с) | |||||||||
| Минимальное и максимальное значения | 8-14 | 9-16 | 8-18 | 8-14 | 8-16 | 7-14 | 8-14 | 7-16 | 8-16 |
| Среднее арифметическое и стандартное отклонение | 10,48 ±1,8 | 11,48 ±2,05 | 11,71± 2,292 | 10,13±1,429 | 11,34± 2,214 | 10,18±1,662 | 10,55±2,112 | 10,23±2,044 | 10,15±2,248 |
| р | <10-5 | <10-5 | <10-5 | 0,826 | 0,041 | 0,003 | |||
| Средняя объёмная скорость мочеиспускания (мл/с) | |||||||||
| Минимальное и максимальное значения | 3-8 | 3-9 | 3-9 | 2-8 | 2,8-8 | 3-8 | 3-9 | 3-8 | 3-10 |
| Среднее арифметическое и стандартное отклонение | 5,05 ±1,1 | 5,7 ±1,38 | 5,88 ±1,38 | 4,76±1,179 | 5,445 ±1,329 | 4,875±1,159 | 5,162±1,273 | 5,062±1,145 | 5,225±1,405 |
| р | <10-5 | <10-5 | <10-5 | 0,002 | 0,468 | 0,181 | |||
* - недостоверное значение
В основной группе (Витапрост® Форте) достигнуто увеличение среднего значения максимальной объёмной скорости мочеиспускания с 10,48 мл/сек на визите 0 до 11,48 мл/сек к визиту 3 и 11,71 мл/сек на визите 4. Эти изменения были статистически достоверны. При этом максимальные значения этого параметра среди пациентов, принимавших «Витапрост® Форте», возросли до 16 и 18 мл/сек на визитах 3 и 4 соответственно, достигнув нормальных значений. На фоне приёма Омника также увеличилась Qmax от визита 0 к визиту 3 (с 10,13 до 11,34 мл/сек), но дальнейшее изменение этого показателя было недостоверно. Среди пациентов, принимавших плацебо, отмечено последовательное уменьшение Qmax от визита 0 к визитам 3 и 4.
Результаты определения объёма остаточной мочи
Таблица 2. Величины объёма остаточной мочи у пациентов трёх групп.
|
Объём остаточной мочи (мл) |
Основная группа |
Омник |
Плацебо |
||||||
Визит 0 |
Визит 3 |
Визит 4 |
Визит 0 |
Визит 3 |
Визит 4 |
Визит 0 |
Визит 3 |
Визит 4 |
|
| Минимальное и максимальное значения | 0-139 | 0-98 | 0-85 | 0-100 | 0-74 | 0-95 | 0-95 | 0-89 | 0-142 |
| Среднее арифметическое и стандартное отклонение | 51,95 ±31,3 | 30,42 ±25,61 | 28,62 ±24,39 | 49,7±25,11 | 31,35±24,22 | 48,38±25,2 | 45,85±25,19 | 49,53±25,07 | 54,95±29,59 |
| р | <10-5 | <10-5 | <10-5 | <10-5 | 0,208 | 0,090 | |||
* - недостоверное значение
В группе получавшей Витапрост® Форте от 0 к 4 визиту идет достоверное сниженное среднего значения объема остаточной мочи, несмотря на прекращение приема препарата на 3 визите, что может свидетельствовать о терапевтическом последействии препарата Витапрост® Форте (терапевтическое действие которого продолжается с прекращением курса лечения).
У пациентов, принимавших Омник отмечается достоверное сниженное среднего значения объема остаточной мочи от 0 к 3 визиту, а далее от 3 к 4 визиту (после отмены препарата) объём остаточной мочи увеличивается. Данное увеличение указывает на симптоматическое действие препарата Омник, после прекращения приема которого первоначальные показатели объема остаточной мочи возвращаются к исходным.
В группе плацебо, напротив, объём остаточной мочи увеличивался от визита к визиту, хотя увеличение это и не было статистически достоверно.
Результаты анкетирования пациентов по шкале IPSS.
Одним из параметров эффективности терапии, используемом при статистическом анализе данных исследования для оценки степени выраженности обструктивной и ирритативной симптоматики ДГПЖ являлась сумма баллов по шкале IPSS. Результаты проведенного анкетирования приведены в таблицах 3 и 4.
Таблица 3. Динамика суммарного балла по шкале IPSS
|
Количество пациентов
n (%) |
||||||||
Количество баллов |
Основная группа |
Омник |
Плацебо |
||||||
Визит 0 |
Визит 3 |
Визит 4 |
Визит 0 |
Визит 3 |
Визит 4 |
Визит 0 |
Визит 3 |
Визит 4 |
|
| 0 – 7 (незначительная) | 2 (5%) | 9 (22,5%) | 12 (30%) | 4 (10%) | 14 (35%) | 8 (20%) | 3 (7,5%) | 3 (7,5%) | 3 (7,5%) |
| 8 – 19 (умеренная) | 35 (87,5%) | 29 (72,5%) | 26 (65%) | 33 (82,5%) | 24 (60%) | 30 (75%) | 33 (82,5%) | 34 (85%) | 34 (85%) |
| 20 – 35 (выраженная) | 3 (7,5%) | 2 (5%) | 2 (5%) | 3 (7,5%) | 2 (5%) | 2 (5%) | 4 (10%) | 3 (7,5%) | 3 (7,5%) |
При анализе результатов исследования отдельно оценивалось количество пациентов с незначительной симптоматикой ДГПЖ (сумма баллов 0-7), умеренной (сумма баллов 8-19) и выраженной (сумма баллов 20-35). В основной группе на 0 визите прослеживается преимущественное преобладание пациентов с умеренным количеством баллов по шкале IPSS – 35 (87,5%) пациентов, далее к 4 визиту этот показатель снижается до 26 (65%). Это связано с тем, что препарат влияет на субъективную симптоматику и достоверно уменьшает симптоматику исходного заболевания, в результате чего количество пациентов с незначительными симптомами последовательно увеличилось от визита 0 к визиту 4 с 2 (5%) до 12 (30%).
В группе пациентов, принимающих Омник, данная тенденция прослеживается от 0 визита к 3 визиту, однако снижение субъективной симптоматики требует проведения постоянной терапии, и поэтому после отмены приема Омника субъективная симптоматика постепенно возвращается к 4 визиту, что является дополнительной иллюстрацией к различиям в механизме действия препаратов и подтверждением симптоматического действия препарата Омник.
Динамика средних значений суммарного балла по шкале IPSS
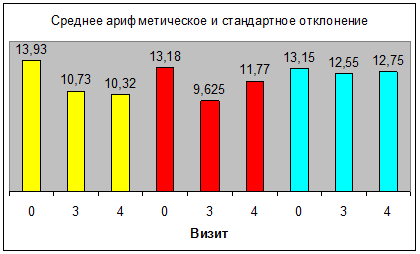
![]() — Витапрост® Форте
— Витапрост® Форте
![]() — Омник
— Омник
![]() — Плацебо
— Плацебо
Среднее значение суммарного показателя по шкале IPSS снизилось в основной группе с 13,39 на визите 0 до 10,73 и 10,32 баллов на визитах 3 и 4. Снижение численного значения этого показателя также достигнуто среди пациентов группы Омник: с 13,18 на 0 визите до 9,625 баллов к третьему визиту. Однако затем зафиксировано его увеличение до 11,77 баллов на визите 4. Изменение среднего значения суммарного балла в группе плацебо статистически недостоверны.
В оценке степени выраженности симптомов ДГПЖ немаловажную роль играет и оценка пациентом качества жизни (Q). Динамика средних значений оценки пациентом качества жизни при анкетировании по шкале IPSS приведена в таблице 4.
Оценка эффекта |
Количество пациентов
n (%) |
|||||
2 визит |
3 визит |
4 визит |
||||
Пациент |
Врач |
Пациент |
Врач |
Пациент |
Врач |
|
| Выраженный | 0 | 0 | 1 (2,5%) | 10 (25%) | 1 (2,5%) | 13 (32,5%) |
| Хороший | 6 (15%) | 4 (10%) | 12 (30%) | 19 (47,5%) | 14 (35%) | 12 (30%) |
| Удовлетворительный | 33 (82,5%) | 35 (87,5%) | 25 (62,5%) | 11 (27,5%) | 23 (57,5%) | 14 (35%) |
| Неудовлетворительный | 1 (2,5%) | 1 (2,5%) | 2 (5%) | 0 | 2 (5%) | 1 (2,5%) |
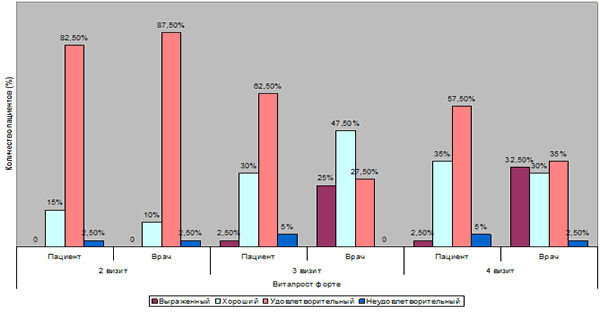
Таблица 6. Оценка эффективности терапии пациентом и врачом в контрольных группах
|
Оценка эффекта |
Количество пациентов
n (%) |
|||||||||||
Омник |
Плацебо |
|||||||||||
2
визит |
3
визит |
4
визит |
2
визит |
3
визит |
4
визит |
|||||||
П-т |
Врач |
П-т |
Врач |
П-т |
Врач |
П-т |
Врач |
П-т |
Врач |
П-т |
Врач |
|
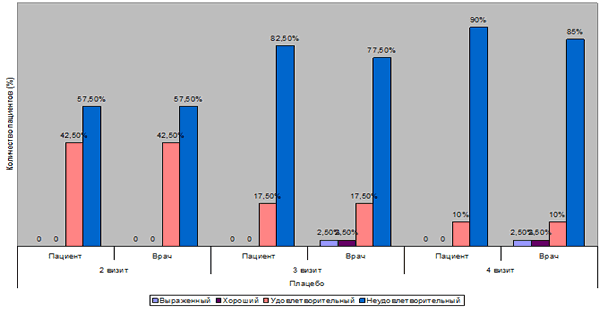
| Выраженный | 0 | 0 | 0 | 9 22,5% | 0 | 2 5% | 0 | 0 | 0 | 1 2,5% | 0 | 1 2,5% |
| Хороший | 7 17,5% | 5 12,5% | 12 30% | 11 27,5% | 1 2,5% | 5 12,5% | 0 | 0 | 0 | 1 2,5% | 0 | 1 2,5% |
| Удовлетворительный | 31 77,5% | 35 87,5% | 27 67,5% | 20 50% | 21 52,5% | 17 42,5% | 17 42,5% | 17 42,5% | 7 17,5% | 7 17,5% | 4 10% | 4 10% |
| Неудовлетворительный | 2 5% | 0 | 1 2,5% | 0 | 18 45% | 16 40% | 23 57,5% | 23 57,5% | 33 82,5% | 31 77,5% | 36 90% | 34 85% |

Как видно из приведенных данных, во время 3 визита пациенты всех трех групп оценивали эффективность всего проведенного курса терапии. При этом в основной группе и группе, получавшей в качестве лечения Омник, преобладали пациенты с удовлетворительным эффектом (62,5% (25 пациентов) и 67,5% (27 пациентов)). В этих группах зарегистрирован одинаковый по встречаемости хороший эффект (по 30% (12 пациентов)). Выраженный эффект отмечен у одного пациента основной группы (2,5%), в группе Омника выраженного эффекта не отмечено ни в одном из случаев. Неудовлетворительный эффект выявлен у двух пациентов основной группы (5%) и у одного пациента в группе Омника (2,5%). В группе плацебо не зарегистрировано ни одного случая выраженного и хорошего эффекта. Пациенты, получавшие плацебо в основном представлены неудовлетворительным (82,5% (33 пациента)), а также удовлетворительным (17,5% (7 пациентов)) результатом.
Анализ данных об эффективности лечения на 3 визите со стороны врача демонстрируют, что у 47,5% (19) пациентов в основной группе отмечен хороший эффект, в группе Омника значительно ниже - 27,5% (11 пациентов).
В основной группе удовлетворительный эффект зафиксирован в 27,5% (11 пациентов) случаев (в группе Омника – 50% (20 пациентов)), частота встречаемости выраженного эффекта в основной группе возросла от 0 до 25% (10 пациентов).
Пациенты, получавшие плацебо, к визиту 3 по мнению врача представлены в основном неудовлетворительным результатом (77,5% (31 пациент)), а также удовлетворительным (17,5% (7 пациентов)). В одном случае хороший, а в одном выраженный эффект (по 2,5% в каждом наблюдении) отмечен в группе, получавшей плацебо на момент 3 визита.
Полученные в ходе исследования данные могут говорить о том, что в ходе проведенного лечения исследуемым препаратом Витапрост® Форте, а также Омником по сравнению с плацебо отмечена высокая сопоставимая эффективность терапии, как со стороны пациента, так и со стороны врача. За период лечения от 2 к 3 визиту отмечена положительная динамика в оценке эффективности, как в основной группе, так и в группе пациентов, получавших Омник. При этом в основной группе обращает на себя внимание трансформация представления преобладания пациентов. Так на 2 визите у преобладающего количества пациентов отмечен эффект как удовлетворительный (87,5% (35 пациентов)), к 3 визиту преобладают пациенты с хорошим эффектом (47,5% (19 пациентов)).
После прекращения терапии к 4 визиту в группе Витапрост® Форте отмечается такое же количество пациентов с выраженным эффектом, как и на визите 3 (1 пациент), на визите 4 – 1 пациент, количество пациентов с хорошим эффектом увеличилось с визита 3 – 12 пациентов, на визите 4 их стало 14, что говорит о терапевтическом последействии препарата Витапрост® Форте, терапевтическое действие которого продолжается с прекращением курса лечения.
После прекращения терапии к 4 визиту в группе Омник отмечается увеличение пациентов с неудовлетворительным эффектом, так на визите 3 это был 1 пациент, а к визиту 4 их стало 18, что говорит о прекращении действия препарата Омник сразу после завершения терапии.
В группе плацебо по мнению пациентов неудовлетворительный эффект зафиксирован в 90% (36 пациентов) случаев, удовлетворительный – в 10% (4 пациента). Хорошего, а также выраженного эффекта не выявлено ни в одном из случаев.
Со стороны врача ко времени 4 визита у пациентов основной группы удовлетворительный, выраженный, а также хороший эффекты распределились практически в равных долевых пропорциях: удовлетворительный 35% (14 пациентов), хороший 30% (12 пациентов), выраженный 32,5% (13 пациентов) при одном случае неудовлетворительного результата.
После прекращения терапии к 4 визиту в группе Витапрост® Форте отмечается увеличение пациентов с выраженным эффектом, так на визите 3 это было 10 пациентов, а к визиту 4 их стало 13, что также свидетельствует о терапевтическом последействии исследуемого препарата.
В группе Омник частота встречаемости эффектов от проведенного лечения иная: удовлетворительный и неудовлетворительный эффекты преобладают - 17 и16 пациентов соответственно (42,5% и 40%). Хороший эффект отмечен в 12,5% (5 пациентов) случаев, выраженный эффект был у 2 пациентов (5%).
В группе плацебо: неудовлетворительый эффект - 85% (34 пациента), удовлетворительный- 10% (4 пациента), хороший и выраженный эффекты – по одному наблюдению (по 2,5%).
Таким образом, к моменту наблюдения через 15 дней после завершения лечения в группе Омник наблюдается тенденция к снижению эффективности от проведенной терапии на фоне завершения использования препаратов по сравнению с плацебо, чья низкая эффективность была заведомо ожидаемой и подтверждена документально в данном исследовании. Выраженное и резкое снижение оценки эффективности лечения после прекращения приема препарата в группе Омник объяснимо с позиции рассмотрения принципов проведения симптоматического лечения, механизма действия и периода полувыведения препарата.
Лучшие параметры оценки эффективности в основной группе после прекращения лечения можно объяснить специфическим органотропным действием исследуемого препарата, этиопатогенетическим механизмом действия препарата, а также это может свидетельствовать о терапевтическом последействии препарата Витапрост® Форте, терапевтическое действие которого продолжается с прекращением курса лечения.
Оценка переносимости препарата
За всё время проведения исследования зафиксировано два нежелательных явления. В одном случае между 3 и 4 визитом (уже после прекращения приема препарата) пациент из основной группы отметил усиление дизурических явлений (в т.ч. ночной поллакиурии). Данное событие было расценено как НЯ лёгкой степени тяжести, несерьезное и не требовало дополнительной терапии, взаимосвязи между данным нежелательным явлением и терапией препаратом Витапрост® Форте не было.
У другого пациента, получавшего плацебо, между 3 и 4 визитом выявлено ухудшение параметров мочеиспускания и увеличение объёма простаты. Это также было расценено как НЯ лёгкой степени, несерьезное, не требовало дополнительной терапии, взаимосвязи между данным нежелательным явлением и применением плацебо не было.
Аллергических реакций у пациентов трёх групп не отмечено.
Обсуждение результатов
Проведённое клиническое исследование показало, что применение препарата «Витапрост® Форте», суппозитории ректальные, в качестве монотерапии ДГПЖ вызывает умеренное статистически достоверное уменьшение объёма предстательной железы. Положительный эффект может быть объяснен специфическим прямым и непрямым органотропным действием основного действующего вещества препарата (экстракта простаты) на простату, что приводит к снижению пролиферативной активности клеток предстательной железы и торможению развития ДГПЖ, усилению синтеза антигистаминовых и антисеротониновых антител, что, в конечном счете, способствует уменьшению отека органа и снижению активности сопутствующих воспалительных процессов.
Немалую роль играет и способность экстракта простаты уменьшать отек и активность воспалительных процессов в органе за счёт улучшения в нём микроциркуляции. С антиагрегантными и антикоагулянтными свойствами экстракта простаты связано и умеренное улучшение кровообращения в органе, проявившееся статистически достоверным увеличением максимальной линейной скорости кровотока после первых 15 дней терапии.
При анализе результатов исследования на фоне терапии препаратом «Витапрост® Форте» отмечено и уменьшение инфравезикальной обструкции, что выразилось в увеличении максимальной и средней объёмных скоростей мочеиспускания и уменьшении объёма остаточной мочи. При этом положительные изменения сохранялись в течение 15 дней после окончания приёма препарата. Уменьшение выраженности обструктивной, а также ирритативной симптоматики при приёме исследуемого препарата подтверждается и анкетированием пациентов с помощью Международной шкалы простатических симптомов IPSS, при анализе данных которой выявлено уменьшение суммарного балла и балла оценки пациентом качества жизни. Данные изменения объясняются этиопатогенетическим механизмом действия препарата на ДГПЖ, а также свидетельствуют о терапевтическом последействии препарата Витапрост® Форте, терапевтическое действие которого продолжается с прекращением курса лечения.
За время наблюдения у пациентов, применявших «Витапрост® Форте», суппозитории ректальные, отмечено только одно нежелательное явление лёгкой степени тяжести, взаимосвязи между данным нежелательным явлением и терапией препаратом Витапрост® Форте не было. Нежелательных явлений средней и тяжёлой степеней тяжести не выявлено. Это, а также отсутствие статистически достоверных отрицательных изменений клинических и биохимических параметров крови и мочи у пациентов обеих групп за время наблюдения свидетельствует о хорошей переносимости и безопасности препарата.
Заключение
Всё вышеизложенное позволяет рекомендовать препарат «Витапрост® Форте», суппозитории ректальные, к применению в монотерапии ДГПЖ у пациентов с умеренно выраженной инфравезикальной обструкцией вне зависимости от возраста и наличия сопутствующих заболеваний.
Список литературы
- Emberton M, Andriole GL, de la Rosette Jet al. BPH. A progressive disease of the ageing male. Urology 2003; 61: 267– 73
Barry M.J., Beckley 5., BoyleP., et. α1.: Importance of understanding the epidemiology and naturα1history of BPH. In: Proceedings of the Internationα1 Consultation on BPH, WHO, 1997, p. 25. - Материалы Симпозиума Правления Общества Урологов России, Саратов, 1998
- Аденома предстательной железы. Родоман B.E., Авдошин В.П., Першин С.В. М.: Изд-во Рос. Ун-та дружбы народов, 1993
- Горбачев А.Г., Бобков Ю.А., Аль-Шукри С.Х. Роль простатилена в патогенетическом лечении хронического простатита // Материалы международного симпозиума «Геронтологические аспекты пептидной регуляции функций организма». -1996. - С. 36.
- Камалов А.А., Дорофеев С.Д. Современные взгляды на проблему хронического простатита // Русский Медицинский Журнал. –2003. -Том 11. - №4.
Резюме
Статья посвящена исследованию эффективности и безопасности препарата «Витапрост® Форте» суппозитории ректальные в терапии пациентов с доброкачественной гиперплазией предстательной железы.
Представлены сведения об эпидемиологии и принципах лечения доброкачественной гиперплазии предстательной железы, а также о механизмах действия и клинической эффективности и безопасности препарата Витапрост.
Активным веществом препарата «Витапрост®» является комплекс водорастворимых биологически активных пептидов, выделенных из предстательной железы бычков и быков. Экстракт простаты обладает органотропным действием в отношении предстательной железы. Он снижает пролиферативную активность клеток, приводя к торможению развития доброкачественной гиперплазии простаты; уменьшает отек и активность воспалительных процессов при заболеваниях предстательной железы.
Настоящее клиническое исследование показало, что применение препарата «Витапрост® Форте», суппозитории ректальные, в качестве монотерапии ДГПЖ вызывает умеренное статистически достоверное уменьшение объёма предстательной железы. При анализе результатов исследования на фоне терапии препаратом «Витапрост® Форте» отмечено и уменьшение инфравезикальной обструкции, что выразилось в увеличении максимальной и средней объёмных скоростей мочеиспускания и уменьшении объёма остаточной мочи. Уменьшение выраженности обструктивной, а также ирритативной симптоматики при приёме исследуемого препарата подтверждается и анкетированием пациентов с помощью Международной шкалы простатических симптомов IPSS, при анализе данных которой выявлено уменьшение суммарного балла и балла оценки пациентом качества жизни.
Препарат «Витапрост® Форте», суппозитории ректальные, может быть использован в монотерапии доброкачественной гиперплазии предстательной железы у пациентов с умеренно выраженной инфравезикальной обструкцией вне зависимости от возраста и наличия сопутствующих заболеваний.







Комментарии