М. Н. Слесаревская, А. В. Соколов, А. В. Жарких
Кафедра урологии СПбГМУ им. акад. И. П. Павлова
Цель исследования: доказать преимущества лазерной коагуляции лейкоплакии мочевого пузыря. Пациенты и методы: 117 пациентам (женщинам) с диагнозом лейкоплакия мочевого пузыря была выполнена коагуляция измененной слизистой высокоэнергетическим лазером с помощью аппарата «Лахта-Милон» (Россия) с длиной волны 0,81 мкм и выходной мощностью 16 Вт. Данный способ лечения позволял удалить измененную слизистую оболочку мочевого пузыря, не травмируя более глубокие слои стенки и не затрагивая собственную пластинку и мышечный слой.
Результаты: доказан более стойкий эффект уменьшения болевого симптома тазовой и уретральной локализации, дизурии, нормализации уродинамических показателей в результате проведения оперативного лечения — лазерной коагуляции измененной слизистой мочевого пузыря у больных хроническим циститом с плоскоклеточной метаплазией эпителия мочевого пузыря.
Заключение: минимальная хирургическая травма, хороший гемостаз, отсутствие интраоперационных осложнений, быстрое очищение (до 1 месяца) слизистой мочевого пузыря от струпа, короткий период послеоперационной реабилитации являются главными преимуществами лазерной коагуляции измененной слизистой мочевого пузыря.
Ключевые слова: хронический цистит; лейкоплакия мочевого пузыря; хирургические методы лечения лейкоплакии мочевого пузыря; диодные лазеры.
Введение
Циститы являются наиболее частыми урологическими заболеваниями. Ежегодно около 3 миллионов пациентов обращаются к врачу по поводу различных форм цистита только в США [14]. Бактериальная инфекция является наиболее частой причиной хронического цистита. Около 40–50 % женщин хоть один раз в жизни перенесли острый цистит, 20–30 % женщин испытывают рецидив в течение 3–4 месяцев после первого эпизода инфекции мочевых путей [14]. Около 10–20 % из них страдают рецидивирующим циститом в течение всей жизни [16]. Диагноз «рецидивирующий цистит» подразумевает 2 обострения цистита в течение 6 месяцев или 3 обострения в течение года, что оказывает значительное влияние не только на качество жизни пациенток, но и большое социальноэкономическое воздействие на общество в целом [15].
При цистоскопии и биопсии измененной слизистой мочевого пузыря у больных, страдающих хроническим циститом, в 56–82 % случаях выявляют плоскоклеточную метаплазию эпителия с различной степенью ороговения, представленную очагами белесоватого налета, четко отграниченными от неизмененной слизистой — очагами лейкоплакии мочевого пузыря [2, 4, 5]. Развитие в мочевом пузыре многослойного плоского эпителия связано с тем, что среди всех форм эпидермального эпителия многослойный плоский является наиболее стабильным при длительно действующих неблагоприятных факторах [2]. Первое описание лейкоплакии сделано Rokitansky в 1861 г. После этого данные литературы разноречивы. Многие авторы связывают изменения эпителия с длительным воздействием инфекции (не уточняя вид патогена), другие — с аллергическими факторами, эстрогенной недостаточностью, нейрогенными причинами [9]. Чаще всего описание лейкоплакии встречается в статьях, посвященных предраковым заболеваниям мочевого пузыря [4, 6].
Плоскоклеточная метаплазия эпителия — это уже запущенная форма метаплазии, когда в ответ на длительное воздействие инфекции происходит замещение переходного эпителия на плоский, без ороговения или с лейкокератозом. Для диагностики последней формы необходимо наличие основных морфологических критериев: плоскоклеточной метаплазии, паракератоза, акантоза. Клиническими проявлениями лейкоплакии мочевого пузыря являются стойкая дизурия, императивные позывы к мочеиспусканию, поллакиурия и хроническая уретральная боль в сочетании или изолированно с хронической тазовой болью.
Необходимо отметить, что до настоящего времени не существует общепринятого алгоритма диагностики лейкоплакии мочевого пузыря, не выработана единая тактика лечения в зависимости от стадии патологического процесса, нет единого мнения о тактике хирургического лечения лейкоплакии мочевого пузыря. Применяемые консервативные методы лечения хронического цистита, включающие в себя курсы антибактериальных препаратов, противовоспалительное лечение, инстилляции мочевого пузыря растворами антисептиков, физиотерапевтические процедуры на область мочевого пузыря, приносят временное клиническое улучшение состояния пациента, но практически не влияют на измененный по типу лейкоплакии слой слизистой оболочки [2, 3]. Разнообразные способы хирургического лечения лейкоплакии мочевого пузыря (трансуретральная резекция, электрокоагуляция, вапоризация) приводят к удалению измененного слоя слизистой, формированию в месте воздействия зоны выраженной ишемии, что обусловливает длительный период восстановления измененной стенки мочевого пузыря (6 месяцев и более), клинически сопровождающийся симптомами стойкой дизурии и возможным рецидивом заболевания [1, 8].
Недостаточная эффективность диагностических и лечебных мероприятий у больных с лейкоплакией мочевого пузыря приводит к формированию неврозоподобных состояний, что определяет стойкую физическую, эмоциональную и социальную дезадаптацию этих пациентов [8].
К патогенетическим методам лечения хронического цистита относят хирургическое лечение, направленное на коррекцию анатомических изменений в стенке мочевого пузыря и устранение причин нарушения уродинамики. Совершенствование эндоскопических технологий, применение новых принципов коагуляции измененных тканей позволяют расширить варианты методов лечения лейкоплакии мочевого пузыря. Одним из перспективных методов хирургического лечения лейкоплакии мочевого пузыря является лазерная коагуляция.
В последние годы высокоэнергетические лазеры стали в урологии такими же обычными инструментами хирурга, как и давно известные электронож и электрокоагулятор. В 2000 году Нобелевская премия по физике была присуждена выдающемуся отечественному ученому Ж. И. Алферову за вклад в создание полупроводниковых лазерных источников. Замену привычных твердотельных лазеров с ламповой накачкой диодными лазерами по значимости можно сравнить с заменой радиоламп интегральными чипами. На сегодня в хирургии наибольшее распространение получили диодные лазерные аппараты с длинами волн в диапазоне от 0,8 до 1,06 мкм. Излучение в так называемом «ближнем инфракрасном (ИК) диапазоне» хорошо распространяется по гибким световодам. Мощность излучения современных диодных аппаратов достигает 180 Вт. Одной из характерных особенностей лазерного излучения ближнего ИК диапазона является его «цветовая зависимость», т. е. характеристики поглощения, а следовательно, и эффект воздействия зависят от пигментации тканей. Спектральные характеристики лазерного излучения определяют степень его поглощения тканями, что влияет на характер биологических эффектов. Выбирая ту или иную длину волны при воздействии на конкретную ткань, мы можем прогнозировать лечебный эффект.
Лазеры диапазона 0,8–1,06 мкм можно охарактеризовать как тепловые, т. е. основным фактором физического воздействия является тепловая энергия, выделяющаяся при взаимодействии лазерного излучения с биологической тканью. Температура в области контакта в зависимости от параметров излучения и характеристик тканей может достигать 1500 °C. Воздействие высокоинтенсивного лазерного луча на биологические ткани вызывает испарение, коагуляцию и карбонизацию (обугливание). Выраженность этих процессов зависит от температуры нагрева ткани на облучаемом участке. Полная карбонизация биологической ткани происходит при температуре не ниже 200 °C, а при температуре выше 450 °C начинается ее испарение. Максимальная интенсивность испарения (вапоризация) наблюдается при температуре 800–1000 °C [10, 11].
Особенности применения высокоэнергетических лазеров для лечения заболеваний мочевого пузыря прежде всего обусловлены анатомофизиологическими особенностями его строения, которые связаны с обильным кровоснабжением и наличием жидкой среды — мочи. Эффективность проводимой операции зависит от среды, в которой осуществляется лазерное воздействие. При работе в водной среде требуется мощность, в несколько раз большая, поскольку вода за счет хорошей теплопроводности и светопреломления снижает степень теплового воздействия на ткань и уменьшает плотность мощности лазерного пучка.
Излучение с длиной волны 0,81 мкм глубоко проникает в ткани, что способствует объемному прогреву и коагуляции, но не является оптимальным для достижения режущего эффекта [13]. На рисунке 1 представлена степень поглощения в воде лазерного излучения в зависимости от длины волны.
Следует отметить, что, помимо поглощения на глубину проникновения излучения 0,81 мкм сильное влияние оказывает коэффициент рассеивания. Благодаря рассеиванию излучение в биологической ткани распространяется не только вдоль первоначального направления, но и в стороны. Использование контактных методов воздействия позволяет в какой-то мере компенсировать глубокое проникновение, но всегда имеется потенциальная опасность нежелательного воздействия на подлежащие структуры. В этом случае следует учитывать, что при контактном режиме происходит нагрев тканей до температуры 1500 °С и обугливание биологических структур, при котором резко возрастает поглощение [7].
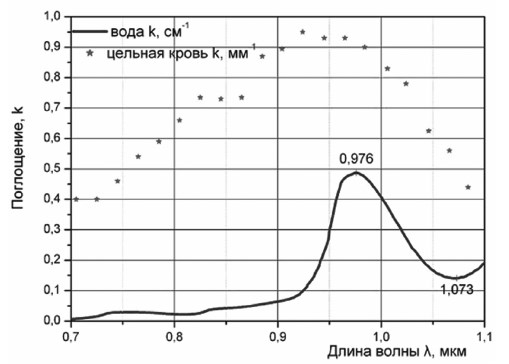
Рис. 1. Степень поглощения лазерного излучения в воде в зависимости от дины волны.
Лазерное хирургическое вмешательство в контактном режиме при относительно небольшой мощности вызывает четко ограниченную гомогенную зону карбонизации, в которой излучение полностью поглощается и вызывает точечное выпаривание тканей. При этом глубина проникновения лазерного излучения незначительная, а гемостатическое действие выраженное, что особенно важно при работе с насыщенными кровью тканями мочевого пузыря. В полости мочевого пузыря происходит достаточное охлаждение дистального конца волокна. Контактный метод используют для минимизации области некроза при рассечении или удалении тканей. Физические процессы, происходящие при контактном воздействии, можно описать следующим образом. После того, как между торцом волокна и биологической тканью образовался углерод, по сравнению со слабо пигментированной тканью многократно возрастает поглощение лазерного излучения в области карбонизации и начинается выжигание тканей. При этом дополнительно выделяется углерод, способствующий локализации области поглощения лазерной энергии, а раскаляющийся при этом конец волокна также способствует рассечению тканей. Таким образом, при контактном воздействии происходит комбинированное рассечение тканей с помощью концентрированного лазерного луча и раскаленного конца волокна. Целесообразно использовать в качестве манипулятора обнаженный конец световода, так как обработка дистального конца волокна позволяет менять геометрию светового пятна, а значит, плотность мощности, что доказано экспериментально.
Контактный метод имеет ряд несомненных преимуществ: 1) значительно сужается зона некроза; 2) у дистального торца световода, контактирующего с оперируемой тканью, хорошая теплоотдача, следовательно, отпадает необходимость в его охлаждении; 3) необходимый эффект может быть достигнут при меньшей мощности; 4) сохраняется привычный для хирурга контакт инструмента с тканью; 5) нет необходимости в маркере, что удешевляет производство аппаратуры; 6) оперативное вмешательство производится более локализованно. Техника проведения операций в контактном режиме предусматривает равномерное, без задержек или остановок, продвижение волокна, что предотвращает избыточное тепловыделение и позволяет уменьшить зону некроза.
Большие новые возможности лазерной хирургии связаны с импульсным режимом излучения. Проведение тепла через ткань происходит достаточно медленно. Время, необходимое для поглощения энергии излучения (превращения электромагнитной энергии в энергию вибраций и колебания молекул), незначительно, а время теплопроведения в соседние с «целевыми» ткани достаточно большое, до 600 мс. Именно эта температурная «релаксация», протекающая длительно, является важным моментом в лазерной хирургии. Ограничение времени лазерного воздействия позволяет минимизировать температурное воздействие на окружающие ткани. Быстрое испарение, которое возникает при использовании сверхбыстрых импульсов, позволяет уменьшить температурную «релаксацию», уменьшить разогревание окружающих разрез тканей. В идеале необходимо, чтобы длительность импульсов лазерного воздействия была лишь незначительно больше, чем время температурной релаксации, а интервал между импульсами был достаточным для охлаждения места воздействия за счет излучения тепла в окружающую среду. Если плотность энергии превышает порог парообразования, то энергия достаточно быстро отводится от хирургического поля. Подбирая оптимальное соотношение между частотой следования импульсов и мощностью импульса излучения, можно ограничить объем поражения ткани кратером с резким краем, глубина которого зависит от оптической глубины проникновения излучения данной длины волны. Применение импульсного лазерного излучения определенной длины волны позволяет локально нагревать ткань, ограниченную характерной для данной температуры зоной поглощения.
Механизм действия импульсных инфракрасных лазеров определяется высоким коэффициентом поглощения их излучения в воде. Происходит очень быстрый разогрев молекул воды, а от них и неводных компонентов тканей, за счет чего происходит стремительное испарение тканевой воды и удаление фрагментов тканевых структур с образованием аблационного кратера. Вместе с удаленным перегретым материалом удаляется избыток тепловой энергии, за счет чего повреждения за пределами аблационного кратера минимальны. По такому принципу взаимодействуют с тканью лазерные аппараты Er: YAG (γ = 2,94 мкм); Ho: YAG (γ = 2,12 мкм); TmHo-Cr: YAG (γ = 2,15 мкм) и др.
Благодаря незначительным термическим повреждениям, возникающим в результате воздействия импульсных лазеров, отмечается быстрое и качественное заживление раны, отсутствие в послеоперационном периоде воспалительных явлений, что крайне актуально для урологии, когда манипуляции производятся в труднодоступных областях. В то же время минимальный объем коагуляции, возникающей в результате воздействия импульсных лазеров, представляет проблему в случае работы на васкуляризированных тканях, так как коагулирующий эффект может оказаться недостаточным.
Создание полупроводниковых приборов, обеспечивающих возможность работы одновременно как в импульсном, так и в постоянном режиме, является новым этапом в развитии лазерной хирургии. Возможность прецизионного манипулирования и осуществления эффективного гемостаза в рамках одного хирургического вмешательства при использовании одного прибора определяет место полупроводниковых лазеров в различных областях хирургии.
Пациенты и методы исследованияПроведен анализ результатов лечения 117 женщин с лейкоплакией мочевого пузыря, находившихся в клинике урологии СПбГМУ имени акад. И. П. Павлова с 2007 по 2011 год. Всем пациенткам была выполнена коагуляция измененной слизистой мочевого пузыря высокоэнергетическим лазером с помощью лазерного аппарата «Лахта-Милон» (Россия). Длина волны лазерного излучения у использованного нами аппарата составила 0,81 мкм, а выходная мощность лазера 16 Вт. Лазерное излучение передавалось по оптическому волокну диаметром 400 мкм.
Средний возраст наблюдаемых нами больных составил 27,31 ± 12,4 года и варьировал в диапазоне от 20 до 64 лет. Продолжительность заболевания составила от 6 месяцев до 6 лет. У 102 (87,2 %) из 117 женщин лейкоплакия была выявлена в срок менее 3 лет до начала лечения. Критериями включения в исследование были рецидивирующее течение хронического цистита в сочетании с типичной для лейкоплакии мочевого пузыря цистоскопической картиной. Пациенток с симптоматикой острого цистита или обострения хронического цистита, сопровождающейся бактериурии и лейкоцитурии, в настоящее исследование не включали. Всем больным выполняли лабораторные исследования: общий анализ крови и мочи, биохимический анализ крови, посев мочи на флору и чувствительность к антибиотикам, цитологическое исследование мочевого осадка на атипичные клетки (три раза), урофлоуметрию. Оценку интенсивности симптоматики проводили на основании результатов анализа заполняемых пациентками анкет «Шкала симптомов тазовой боли, императивного учащенного мочеиспускания» [18] и дневников мочеиспускания. Эффективность лечения оценивали через cемь суток, 1, 6 и 12 месяцев после проведенного оперативного вмешательства. Критериями излеченности больных считали отсутствие следующих признаков: жалоб на учащенное и болезненное мочеиспускание, болей внизу живота в покое и при половом контакте, лейкоцитурии, слоя лейкоплакии слизистой оболочки мочевого пузыря при уретроцистоскопии.
Методика лазерной коагуляции измененной слизистой мочевого пузыря у больных с лейкоплакией мочевого пузыря была следующей. Под внутривенной анестезией выполняли цистоскопию. В рабочий канал цистоскопа устанавливали гибкий кварцевый световод. Лазерную коагуляцию выполняли контактным методом в непрерывном или импульсном режиме с мощностью от 10 до 16 Вт. Торец световода подводили к участку измененной слизистой мочевого пузыря. Таким образом выполняли коагуляцию всей измененной слизистой мочевого пузыря.
Результаты
У всех 117 больных во время оперативных вмешательства и в раннем послеоперационном периоде не было отмечено осложнений. Мы не наблюдали макрогематурию и задержку мочеиспускания ни у одной пациентки. Продолжительность операции зависела от площади измененной слизистой мочевого пузыря. Через несколько суток после операции отмечалось исчезновение дизурии, урежение позывов к мочеиспусканию, снижение их императивности, уменьшение ноктурии. Средний послеоперационный койко-день после лазерной коагуляции лейкоплакии мочевого пузыря составил 3,7 ± 2,3 суток.
Через 7 дней после лазерной коагуляции лейкоплакии мочевого пузыря 92 (78,6 %) больных активных жалоб не предъявляли. Мочеиспускание было свободным, безболезненным. У остальных 25 (21,4 %) женщин отмечали умеренно болезненные мочеиспускания и небольшую тянущую боль внизу живота. При контрольном обследовании через 1 месяц после проведенного лечения клиническое улучшение отметили 104 больные (88,9 %), при этом 91 (77,8 %) не предъявляли никаких жалоб. В этот период отмечено уменьшение выраженности болей в области мочевого пузыря, влагалища, промежности, уретры по результатам анализа анкет «Шкала симптомов тазовой боли, императивного учащенного мочеиспускания», значительное снижение частоты дневных и ночных мочеиспусканий, императивных позывов по данным дневников мочеиспускания, увеличение скорости потока мочи (Qmax) по данным урофлоуметрии (таблица 1).
По результатам контрольного обследования пациенток через 6 месяцев после проведенного оперативного лечения частота мочеиспускания снизилась в 1,7 раза, а через 12 месяцев — в 1,5 раза по сравнению с исходными показателями (p < 0,05). Интенсивность болевого симптома стала меньше в 2,3 раза и в 2,1 раза соответственно через 6 и 12 месяцев по сравнению с начальными данными (p < 0,05).
Через 12 месяцев после лазерной коагуляции метаплазированной слизистой у всех больных клиническое состояние оценивали как удовлетворительное. Количество мочеиспусканий за сутки в среднем составило 7,1 ± 2,6, что достоверно меньше исходного значения до лечения (p < 0,05). Отмечено также снижение числа ночных мочеиспусканий, увеличение среднеэффективного объема мочевого пузыря и повышение максимальной скорости мочеиспускания (p < 0,05) (таблица 1).
При контрольной уретроцистоскопии 1 месяц после операции у всех больных слизистая мочевого пузыря в зоне лазерной коагуляции бледно-розового цвета с умеренно выраженным сосудистым рисунком, четко отграниченная от неизмененной ткани области мочепузырного треугольника. Фрагментов лейкоплакии не определялось. У 36 (30,8 %) больных в области мочепузырного треугольника, больше в шейке мочевого пузыря, визуализированы гиперемия и отек слизистой оболочки умеренной степени выраженности.
Уретроцистоскопия, выполненная через 6 месяцев после проведенного лечения, не выявила слоя метаплазированной слизистой мочевого пузыря у 112 (95,7 %) больных. У 27 (23,1 %) пациенток фрагмент регенерированной стенки мочевого пузыря был изменен по типу умеренного отека и гиперемии. Выявленные изменения стенки мочевого пузыря свидетельствовали о сохраняющемся хроническом воспалительном процессе.
Динамика клинических и уродинамических показателей больных после лазерной коагуляции лейкоплакии мочевого пузыря (n = 117)
| Показатели | Результаты (M ± σ) | |||
| До лечения | Через 3 месяца | Через 6 месяцев | Через 12 месяцев | |
| «Шкала симптомов тазовой боли, императивного учащенного мочеиспускания», баллы |
19,3 ± 3,8 | 7,6 ± 3,4* | 8,5 ± 4,3* | 9,1 ± 4,9* |
| Количество мочеиспусканий за сутки | 10,8 ± 3,4 | 5,9 ± 1,2* | 6,4 ± 2,3* | 7,1 ± 2,6* |
| Количество ночных мочеиспусканий, за сутки | 1,8 ± 1,3 | 1,1 ± 0,7* | 1,3 ± 0,8* | 1,2 ± 0,9* |
| Среднеэффективный объем мочевого пузыря, мл | 128,2 ± 21,2 | 201,4 ± 3,6* | 196,4 ± 23,7* | 182,1 ± 25,3* |
| Максимальная скорость потока мочи (qmax), мл / сек | 17,4 ± 1,8 | 25,6 ± 5,8* | 23,1 ± 3,9* | 21,6 ± 4,2* |
| * — различие достоверно по сравнению с показателем до лечения (p < 0,05). | ||||
Контрольное эндоскопическое исследование мочевого пузыря через 12 месяцев после проведенного лечения выявило наличие рыхлого слоя лейкоплакии в области шейки у 5 (4,3 %) больных. В 18,8 % случаях в месте коагуляции метаплазированной слизистой определялись умеренно выраженные гиперемия и отек.
Обсуждение
Метаплазия переходного эпителия с лейкокератозом развивается в ответ на действие хронической инфекции. На наш взгляд, важным является то, что на этом фоне отсутствуют выраженные воспалительные изменения в анализах мочи и слизистой мочевого пузыря, но сохраняются классические жалобы на дизурию и поллакиурию. Лазерная коагуляция позволяет удалять измененную слизистую оболочку мочевого пузыря, не травмируя более глубокие слои стенки и не затрагивая собственную пластинку и мышечный слой. Нагревание ткани, очаг гипертермии в лейкоплакической бляшке способствует не только удалению измененного эпителия, но и гибели патогенных микроорганизмов в субэпителиальных слоях. Привлекательность лазерной коагуляции измененной слизистой мочевого пузыря заключается в ее способности пересекать и испарять ткань, причиняя ей минимальные повреждения. Разрезы тканей лазерным лучом практически бескровны. Это обусловлено образованием коагуляционного «лазерного» тромба. «Лазерный» коагуляционный некроз качественно отличается от некроза, вызываемого электрокоагуляцией или криодеструкцией тем, что его зона намного меньше. Заживление тканевого дефекта происходит значительно быстрее. На границе «лазерной» раны наблюдается совсем незначительная лейкоцитарная инфильтрация, что ведет за собой уменьшение зоны воспалительного отека и сокращения фазы пролиферации. Лазерное излучение обеспечивает стерильность послеоперационной раны, снижает опасность развития инфекционно-воспалительных осложнений в послеоперационном периоде, способствует формированию более нежного рубца.
Таким образом, по нашему мнению, преимуществами применения методов эндоскопической лазерной хирургии при лейкоплакии мочевого пузыря являются: минимизация хирургической травмы, высокая точность оперативного вмешательства в закрытых полостях и областях, которые недоступны прямому визуальному контролю, хороший гемостаз, позволяющий оперировать больных с нарушениями свертываемости крови. уменьшение отека при оперативных вмешательствах, формирование биологического барьера в месте лазерного воздействия.
Заключение
Полученные результаты лечения лейкоплакии мочевого пузыря с помощью лазерной коагуляции свидетельствуют о высокой эффективности данного метода, позволяющего за сравнительно короткий период добиться положительного эффекта. Минимальная хирургическая травма, хороший гемостаз, отсутствие интраоперационных осложнений, средний послеоперационный койко-день 3,7 ± 2,3 быстрое очищение (до 1 месяца) слизистой мочевого пузыря от струпа, короткий период послеоперационной реабилитации являются главными преимуществами лазерной коагуляции измененной слизистой мочевого пузыря.
Список литературы
1. Астапов А. И. Трансуретральная электровапоризация в комплексном лечении женщин, страдающих хроническим циститом: Автореф. дис . ... канд. мед. наук. М., 2003. 27 с.
2. Возианов А. Ф., Романенко А. М., Клименко И. А. Предрак и ранние формы рака мочевого пузыря. Киев: «Здоровье», 1994. 223 с.
3. Елисеенко А. Г. Медикаментозная и хирургическая коррекция функциональных и органических изменений мочевого пузыря при хроническом цистите: Автореф. дис. ... канд. мед. наук. СПб., 2005. 25 с.
4. Клименко И. А., Романенко А. М. Клинико‑морфологические особенности лейкоплакии мочевого пузыря // Вопр. онкологии. 1986. Т. 32. № 6. С. 76–82.
5. Лоран О. Б., Синякова Л. А., Косова И. В. Рецидивирующие инфекции мочевых путей. М.: Медицинское информационное агентство, 2008. 29 с.
6. Матвеев Б. П., Фигурин К. М., Карякин О. Б. Рак мочевого пузыря. М.: Вердана, 2001. 243 с.
7. Минаев В. П. Лазерные аппараты для хирургии и «силовой терапии» на основе мощных полупроводниковых и волоконных лазеров // Лазерная медицина. 2005. Т. 9. № 4. С. 50–55.
8. Неймарк А. И., Чулюкова И. И., Мазырко А. В. и др. Лечение стойкой дизурии у женщин // Урология. 2003. № 1. С. 46–49.
9. Проскура О. В. Цисталгия // Вопросы урологии. Вып. 1. Киев, 1964. С. 55–61.
10. Плетнев С. Д. Лазеры в клинической медицине. М.: Медицина. 1981. 400 с.
11. Приезжев А. В., Турчин В. В., Шубочкин Л. Г. Лазерная диагностика в биологии и медицине. М.: Наука, 1989. 238 с.
12. Burkhard F. C., Blick N., Hochreiter W. W., Studer U. E. Urinary urgency, fre‑ quency and chronic urethral and/or pelvic pain in females Can Doxycyclin help? // J. Urol. 2004. Vol. 172, № 1. P. 232–235.
13. Dupuy C. G., Hwang C. J., Benvenuti D. et al. High power diode laser system near 1 mm and comparative tissue interaction studies // SPIE Biomedical Optics. 1994. 2131: 43: P.1–6.
14. Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs // Am. J. Med. 2002. Vol.113. Suppl 1A. P.5–13.
15. Foxman B., Barlow R., D'Arcy H. et al. Urinary tract infection: self‑re‑ ported incidence and associated costs // Ann Epidemiol. 2000. Vol 10. P509–515.
16. Hooton T. M., Stamm W. E. Diagnosis and treatment of uncomplicated urinary tract infection // Infect Dis Clin North Am. 1997. Vol. 11. P. 551–581.
17. Parsons C. L., Zupkas P., Parsons J. K. Intravesical potassium sensitivity in patients with interstitial cystitis and urethral syndrome // Urol‑ ogy. 2002. Vol. 60. P. 573–578 .
Aadvantages of laser coagulation for bladder leukoplakia
Slesarevskaja M. N., Sokolov A. V., Zarkih A. V.
Summary. THE AIM OF STUDY is evaluating of laser coagulation efficiency for bladder leukoplakia. Patients and methods: Laser coagulation of changed mucosa was carried out for 117 female patients with bladder leukoplakia using high energetic laser “LahtaMilon” (Russia) with wave-length 0.81 µm and energy output 16 W. This way of treatment allows for changed bladder mucosa removal without dipper wall lays, lamina propria and muscle lay damages.
Results: The more permanent effect of pelvic and urethral pain decreasing as well as dysuria, urodynamic parameters normalization after laser coagulation of chanced mucosa of bladder in patients with chronic cystitis in combination with bladder planocellular epithelial metaplasia was proofed.
Cоnclusion: The main advantages of laser coagulation for chanced bladder mucosa are minimal surgical trauma, good haemostasis, absence of intraoperative complications, fast (under one month) elimination of bladder’s tunica mucosa from eschar, short period of rehabilitation after surgical operation.
Key words: chronic cystitis; bladder leukoplakia; surgical methods of bladder leukoplakia’s treatment; diode lasers.









Комментарии