С. Х. Аль-Шукри, Р. Э. Амдий, И. В. Кузьмин
Кафедра урологии Санкт-Петербургского государственного медицинского университета им. акад. И. П. Павлова
Цель исследования. Оценка снижения сократимости мочевого пузыря детрузора у больных доброкачественной гиперплазией предстательной железы (ДГПЖ). Пациенты и методы. Для определения сократимости детрузора, 146 больным ДГПЖ, средний возраст 62,1 ± 0,8 лет, было проведено комплексное урологическое обследование, включавшее уродинамическое исследование с выполнением урофлоуметрии и микционной цистометрии (исследование «давление-поток»). Интерпретацию результатов микционной цистометрии проводили по номограмме W. Shafer, также был определен индекс опорожнения мочевого пузыря как процентное отношение объема мочеиспускания к максимальной цистометрической емкости мочевого пузыря. Результаты. Снижение сократимости детрузора было выявлено у 56,2 % обследованных больных ДГПЖ. Результаты определения сократимости мочевого пузыря по номограмме Шафера зависят от степени инфравезикальной обструкции (ИВО). Индекс опорожнения мочевого пузыря не зависит от наличия и степени ИВО и характеризует как степень опорожнения мочевого пузыря, так и длительность сокращения. Наличие такой сопутствующей патологии как остеохондроз поясничного отдела позвоночника и сахарный диабет ухудшают опорожнение мочевого мочевого пузыря. Оценка сократимости достоверно может быть проведена только на основе уродинамического исследования, т. к. при оценке сократимости детрузора результаты общепринятого обследования больных ДГПЖ малоинформативны. Заключение. У значительного количества больных ДГПЖ нарушение функции нижних мочевых путей обусловлено не наличием инфравезикальной обструкции, а снижением сократимости мочевого пузыря, что следует учитывать при определении тактики лечения.
Ключевые слова: доброкачественная гиперплазия предстательной железы; уродинамические исследования; снижение сократимости мочевого пузыря.
Введение
Сниженная сократительная способность мочевого пузыря может быть причиной дизурии, уменьшения скорости мочеиспускания и наличия остаточной мочи у больных доброкачественной гиперплазией предстательной железы (ДГПЖ) в даже при отсутствии инфравезикальной обструкции (ИВО) [1, 6, 7]. При выборе тактики лечения достаточно часто показатели сократимости детрузора не принимаются во внимание [14]. У пациентов со сниженной сократимостью мочевого пузыря после трансуретральной резекции предстательной железы (ТУРП) не наблюдается улучшения симптоматики, показателей урофлоуметрии, снижения количества остаточной мочи [6, 14].
В то же время сегодня нет общепризнанных методик определения сократимости детрузора. В своих последних докладах по стандартизации терминологии функции нижних мочевых путей, опубликованных в 2002 и в 2010 гг., Комитет по стандартизации Международного общества по недержанию мочи (ICS) определил снижение сократительной активности детрузора как сокращение сниженной силы и/или длительности, приводящее к удлинению времени опорожнения мочевого пузыря и/или невозможности полного опорожнения мочевого пузыря в течение нормального промежутка времени [3, 8].
В отличие от диагностики ИВО, Комитетом по стандартизации ICS не предложено никаких, даже вспомогательных, методик для определения сократимости детрузора.
В настоящее время сократимость детрузора наиболее часто определяют с помощью номограммы Шафера [11], индекса сократимости и индекса опорожнения мочевого пузыря [2].
Цель работы
Оценка сократимости детрузора у больных ДГПЖ.
Пациенты и методы
Для уточнения особенностей изменения функции НМП, в том числе и сократимости детрузора, 146 больным ДГПЖ, средний возраст которых составил 62,1 ± 0,8 лет, было проведено комплексное урологическое обследование, включавшее оценку жалоб по шкале IPSS, ультразвуковое исследование мочевого пузыря и предстательной железы с определением количества остаточной мочи и уродинамическое исследование с выполнением урофлоуметрии и микционной цистометрии (исследование «давление–поток»).
Микционная цистометрия проводилась на уродинамической установке DANTEC “MENUET” (Дания). При выполнении исследования P/F в положении больного стоя мочевой пузырь наполняли стерильной жидкостью со скоростью 50 мл/с через двухходовой трансуретральный катетер № 7 по шкале Шарьера, при этом автоматически измерялось давление в мочевом пузыре (Pves), объем введенной в него жидкости (V), давление в брюшной полости (Pabd) через ректальный катетер. В момент максимально возможного для данного больного наполнения мочевого пузыря (достижения максимальной цистометрической емкости, MCC) больному предлагали помочиться. В фазу опорожнения мочевого пузыря помимо Pves, Pabd и Pdet также измерялась скорость тока мочи (Q). Терминология, оборудование и методы проведения уродинамических исследований, используемые в нашей работе, соответствуют рекомендациям ICS [3, 7].
Интерпретацию результатов микционной цистометрии для определения сократимости детрузора и ИВО проводили по методике W. Shafer (1990) с использованием предложенной автором номограммы. Номограмма Шафера позволяет, наряду с определением степени ИВО, определять и сократимость детрузора. В зависимости от силы сокращения номограмма разделена на 4 области. Сила сокращения детрузора определяется по положению точки, соответствующей детрузорному давлению при максимальном потоке мочи в одной из этих областей. Область VW соответствует очень слабому сокращению детрузора, область W — слабому сокращению, область N — нормальному и область ST — сильному. Также определялся индекс сократимости мочевого пузыря по формуле: индекс сократимости мочевого пузыря = детрузорное давление при максимальной скорости мочеиспускания (см. вод. ст.) + 5 × максимальная скорость мочеиспускания (мл/с) [2]. При сильной сократимости этот индекс более 150, при нормальной сократимости он находится в промежутке от 100 до 150 и при слабой сократимости значение индекса менее 100.
Следует отметить, что линии номограммы Абрамса, разделяющие области сильной, нормальной и слабой сократимости полностью совпадают с линиями номограммы Шафера, ограничивающими аналогичные зоны. Вследствие чего при использовании индекса сократимости Абрамса вывод о наличии сильной и нормальной сократимости полностью совпадает с таковым при применении номограммы Шафера, а слабая сократимость по Абрамсу соответствует как слабой, так и очень слабой сократимости по Шаферу [2].
Также нами был определен индекс опорожнения мочевого пузыря по методу P. Abrams как процентное отношение объема мочеиспускания к максимальной цистометрической емкости мочевого пузыря [2].
При статистической обработке для анализа межгрупповых различий применяли t-критерий Стьюдента. Для оценки взаимозависимости признаков пользовались методами корреляционного анализа и использовали ранговый критерий корреляции Спирмена (rS). При сравнении относительных величин пользовались биномиальным тестом, сложных таблиц распределения — критерием Пирсона хи-квадрат (χ2).
Результаты
При определении сократимости детрузора по номограмме Шафера у 10 (6,8 %) больных ДГПЖ была диагностирована очень слабая сократимость детрузора (VW), у 72 (49,4 %) — слабая, у 53 (36,3 %) — нормальная (N) и у 11 (7,5 %) — сильная (ST).
Группы больных с разной сократимостью детрузора не различались по возрасту (p > 0,1; t — критерий Стьюдента). Так, средний возраст больных с очень слабой сократимостью мочевого пузыря составил 63,2 ± 4,1 г., с слабой — 64,3 ± 1,8 г., нормальной — 63,5 ± 1,1 г. и сильной — 65,8 ± 3,1 г.
Длительность заболевания у этих групп пациентов также не различалась (p > 0,1; t — критерий Стьюдента). Так, у больных с очень слабой сократимостью длительность заболевания составила 36,2 ± 11,8 мес., с слабой — 61,3 ± 9,3 мес., нормальной — 42,2 ± 8,9 мес. и сильной — 69,6 ± 19,2 мес.
Пациенты с очень слабой или слабой сократимостью детрузора чаще по сравнению с больными с нормальной и сильной сократимостью страдали сахарным диабетом (rs = –0,22; t = –2,3; p = 0,02). Так, сахарный диабет был у 4 (40,0 %) пациентов с очень слабой сократимостью, у 9 (12,5 %) больных с слабой сократимостью, у 2 (3,7 %) пациентов с нормальной сократимостью детрузора. Пациенты с сильной сократимостью детрузора сахарным диабетом не страдали.
У больных ДГПЖ не было обнаружено различий в симптоматике заболевания и качестве жизни, которые оценивались по анкете IPSS. Причем также не было различий как в сумме обструктивных, так и ирритативных симптомов этой анкеты (табл. 1).
Таблица 1. Симптоматика заболевания согласно шкале IPSS у больных ДГПЖ с различной сократимостью детрузора
| Сократимость детрузора по номограмме Шафера | ||||
| Очень слабая (VW) n = 10 | Слабая (W) n = 72 | Нормальная (N) n = 53 | Сильная (ST) n = 11 | |
| Сумма обструктивных симптомов, баллы |
10,1 ± 2,2 | 11,2 ± 2,3 | 8,5 ± 2,3 | 8,7 ± 3,1 |
| Сумма ирритативных симптомов, баллы |
8,4 ± 2,4 | 9,2 ± 2,1 | 9,0 ± 1,9 | 11,0 ± 2,8 |
| Сумма баллов по шкале IPSS, баллы | 18,5 ± 2,1 | 20,4 ± 1,9 | 17,5 ± 1,9 | 19,7 ± 2,9 |
| Индекс качества жиз ни, баллы | 3,6 ± 0,9 | 4,1 ± 0,4 | 3,9 ± 1,5 | 4,3 ± 1,8 |
Таблица 2. Основные клинические показатели у больных ДГПЖ
| Клинический показатель | Сократимость детрузора по номограмме Шафера | |||
| Очень слабая (WV) n = 10 | Слабая (V) n = 72 | Нормальная (N) n = 53 | Сильная (ST) n = 11 | |
| Объем предстательной железы, мл | 26,4 ± 3,9* | 42,6 ± 1,8 | 48,7 ± 3,1 | 62,6 ± 8,3* |
| Максимальный размер предстательной железы, см |
4,0 ± 0,2** | 4,8 ± 0,1 | 4,9 ± 0,9 | 5,2 ± 0,2 |
| Минимальный размер предстательной железы, см |
3,3 ± 0,1* | 3,8 ± 0,1 | 4,0 ± 0,1 | 4,5 ± 0,2** |
| Средний размер предстательной железы, см |
3,6 ± 0,2** | 4,2 ± 0,1 | 4,5 ± 0,1 | 4,9 ± 0,2* |
| Объем остаточной мочи, мл | 128,6 ± 54,1 | 65,6 ± 12,8 | 62,2 ± 15,1 | 114,4 ± 32,6 |
| Примечание: * — достоверные различия по сравнению с больными ДГПЖ со слабой сократимостью детрузора (p < 0,05); ** — достоверные различия по сравнению с больными ДГПЖ со слабой сократимостью детрузора (p < 0,01); |
||||
При анализе результатов обследования больных ДГПЖ с различной сократимостью детрузора нами не было обнаружено достоверных различий по такому клиническому показателю как объем остаточной мочи (табл. 2).
Достоверные различия были обнаружены по размерам и объему предстательной железы при сравнении пациентов со слабой сократимостью с группами больных с очень слабой и сильной сократимостью детрузора (табл. 2).
Следует принимать во внимание, что основными причинами нарушения функции нижних мочевых путей является ИВО или нарушение сократимости детрузора. При небольших размерах предстательной железы наличие ИВО маловероятно и в этом случае причиной нарушения функции нижних мочевых путей будет являться нарушение сократимости детрузора.
Обращает на себя внимание, что не обнаружено различий по таким важным показателям урофлоуметрии как максимальная и средняя скорость мочеиспускания у больных ДГПЖ со слабой и нормальной сократимостью детрузора, что весьма важно в клинической практике (табл. 3).
При использовании номограммы Шафера как наличие и степень ИВО, так и сократимость детрузора определяются по одним и тем же показателям: максимальной скорости мочеиспускания и соответствующему ей детрузорному давлению. В связи с этим при таком подходе к определению сократимости весьма выражена взаимосвязь между степенью ИВО и сократимостью детрузора, (rs = 0,47; p < 0,01; n = 146), что иллюстрирует рисунок 1.
Таким образом, при отсутствии или невыраженной ИВО сильное сокращение детрузора не может развиться, т. к. для опорожнения мочевого пузыря достаточно несильного сокращения детрузора.
Полагаем, что определение у 72 (49,4 %) больных слабого сокращения детрузора по номограмме Шафера обусловлено не только патологией детрузора, но и отсутствием или слабой ИВО. 0-я и 1-я степень ИВО была диагностирована у 35 (24,0 %) обследованных больных ДГПЖ, а 2-я степень — у 46 (31,5) %, что сопоставимо с частотой обнаружения слабой сократимости детрузора.
При анализе другого показателя сократимости мочевого пузыря, индекса опорожнения, нами было обнаружено, что этот показатель не зависит от наличия и степени ИВО (r = –0,052; p = 0,8; n = 146) (рис. 2).
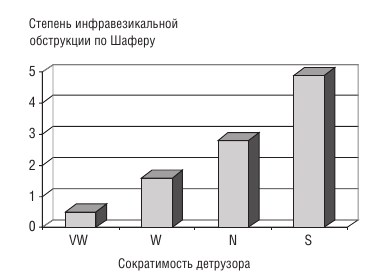
Рис. 1. Степень инфравезикальной обструкции и сократимость детрузора по номограмме Шафера у больных ДГПЖ
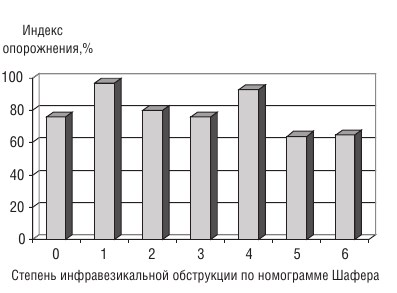
Рис. 2. Индекс опорожнения мочевого пузыря и степень ИВО по номограмме Шафера
Основные показатели урофлоуметрии у больных ДГПЖ с различной сократимостью детрузора
| Показатель урофлоуметрии | Сократимость детрузора по номограмме Шафера | |||
| Очень слабая (WV) n = 10 | Слабая (V) n = 72 | Нормальная (N) n = 53 | Сильная (ST) n = 11 | |
| Максимальная скорость мочеиспускания, мл/с |
14,4 ± 3,5 | 13,5 ± 1,9 | 14,9 ± 2,4 | 13,6 ± 2,9 |
| Средняя скорость мочеиспускания, мл/с | 8,8 ± 2,4 | 7,8 ± 1,4 | 7,3 ± 1,6 | 6,4 ± 1,7 |
| Объем мочеиспускания, мл | 315,8 ± 134,1* | 194,9 ± 11,5 | 240,3 ± 25,9* | 215,4 ± 47,8 |
| Время задержки перед началом мочеиспускания, с |
4,6 ± 2,0 | 4,1 ± 1,2 | 4,1 ± 1,8 | 5,4 ± 2,6 |
| Время мочеиспускания, с | 34,4 ± 8,3 | 34,7 ± 2,9 | 36,6 ± 3,3 | 36,9 ± 7,0 |
| Время мочеотделения | 34,1 ± 6,9 | 29,5 ± 2,6 | 33,0 ± 3,3 | 34,1 ± 7,5 |
| Время достижения максим. скорости мочеиспускания, с | 7,0 ± 2,1 | 10,7 ± 1,6 | 7,8 ± 1,3** | 8,0 ± 2,2 |
| Примечание: * — достоверные различия по сравнению с больными ДГПЖ со слабой сократимостью детрузора (p < 0,05); ** — достоверные различия по сравнению с больными ДГПЖ со слабой сократимостью детрузора (p < 0,01). |
||||
На индекс опорожнения мочевого пузыря влияют сопутствующие заболевания: неврологическая патология (r = –0,19; p = 0,04;) и, прежде всего, остеохондроз поясничного отдела позвоночника (r = –0,17; p = 0,04), сахарный диабет (rs = –0,16; p = 0,09).
Не обнаружено зависимости индекса опорожнения мочевого пузыря от размеров и объема предстательной железы. Следует отметить, что при использовании номограммы Шафера обнаружена выраженная взаимосвязь между размерами предстательной железы и сократимостью мочевого пузыря. Это обусловлено зависимостью степени ИВО от размеров предстательной железы.
Индекс опорожнения мочевого пузыря весьма выражено зависит от количества остаточной мочи (r = –0,39; p = 0,01) и в меньшей степени от таких показателей урофлоуметрии как максимальная и средняя скорость мочеиспускания (r = 0,15; p = 0,03; r = 0,18; p = 0,01), время мочеиспускания (r = –0,16; p = 0,03) и достижения максимальной скорости мочеиспускания
Весьма интересным представляется факт, что существует выраженная взаимосвязь между индексом опорожнения мочевого пузыря и средней скоростью мочеиспускания при цистометрии (r = 0,46; p = 0,001; r = 0,47; p = 0,001). Средняя скорость мочеиспускания при цистометрии характеризует длительность сокращения мочевого пузыря в зависимости от объема выделенной жидкости.
Обсуждение
Проведенное нами исследование выявило cнижение сократимости детрузора у 56,2 % обследованных больных ДГПЖ. Результаты нашего исследования показали, что нарушение функции нижних мочевых путей у больных ДГПЖ обусловлено не только ИВО, но и снижением сократимости детрузора.
Наличие такой сопутствующей патологии как остеохондроз поясничного отдела позвоночника и сахарный диабет ухудшают опорожнение мочевого пузыря. Влияние сахарного диабета и неврологической патологии на сократимость детрузора отмечали S. A. Kaplan и соавт. (1995) и T. Yamamoto и соавт. (2006). В то же время этими авторами не выявлено влияния остеохондроза поясничного отдела позвоночника на сократимость детрузора.
При нарушении сократимости детрузора возникают симптомы расстройств мочеиспускания, однако они не специфичны для пациентов с различной сократимостью мочевого пузыря и на основе их оценки невозможно определить сократимость мочевого пузыря. Результаты нашей работы схожи с таковыми M. B. Chancellor и соавт. (1994), не обнаружившими взаимосвязи между симптоматикой ДГПЖ и функциональным состоянием нижних мочевых путей.
При оперативном лечении больных ДГПЖ со сниженной сократимостью детрузора существует намного больший риск развития такого осложнения как стрессовое недержание мочи.
R. G. Hindley и соавт. (2002) полагают, что при нарушении сократимости мочевого пузыря объем остаточной мочи всегда более 300 мл. Однако согласно нашим результатам, у больных с очень слабой и слабой сократимостью детрузора по номограмме Шафера средний объем остаточной мочи был от 13 до 350 мл и в среднем составил 95,6 мл. По нашему мнению, это связано как с развитием механизмов компенсации, так и с погрешностью определения больших количеств остаточной мочи по данным ультразвукового обследования.
Весьма интересным представляется факт, что у больных с небольшими размерами предстательной железы (объем простаты менее 30 мл) чаще наблюдалось снижение сократимости детрузора. Мы полагаем, что данные различия обусловлены наличием взаимосвязи между размерами простаты и степенью ИВО [10]. В свою очередь сократимость детрузора при определении по номограмме Шафера также зависит от наличия и степени ИВО. Сильное сокращение детрузора развивается при наличии ИВО, в отсутствие же ИВО достаточно несильного сокращения для опорожнения мочевого пузыря.
Основными причинами нарушения функции нижних мочевых путей является ИВО или нарушение сократимости детрузора. При небольших размерах предстательной железы наличие ИВО маловероятно, и в этом случае причиной нарушения функции нижних мочевых путей будет являться нарушение сократимости детрузора.
Обращает на себя внимание, что не обнаружено различий по таким важным показателям урофлоуметрии как максимальная и средняя скорость мочеиспускания у больных ДГПЖ со слабой и нормальной сократимостью детрузора. Мы, как и M. B. Chancellor c соавт.(1991) и G. E. Van Venrooij с соавт. (2002), не обнаружили различий по этим показателям урофлоуметрии у больных ДГПЖ со сниженной и нормальной сократимостью.
Таким образом, по показателям урофлоуметрии невозможно определить наличие нарушений сократимости детрузора.
Индекс опорожнения мочевого пузыря не зависит от наличия и степени ИВО (в отличие от определения сократимости по номограмме Шафера) и характеризует как степень опорожнения мочевого пузыря, так и длительность сокращения. Учитывая, что результаты определения сократимости мочевого пузыря по номограмме Шафера зависят от степени ИВО и характеризуют только один из аспектов сократимости детрузора — силу сокращения, использование индекса опорожнения мочевого пузыря во многих случаях предпочтительней.
Заключение
Снижение сократимости детрузора весьма часто встречается у больных ДГПЖ. Во многих случаях нарушение функции нижних мочевых путей обусловлено не наличием инфравезикальной обструкции, а снижением сократимости мочевого пузыря. Оценка сократимости достоверно может быть проведена на основе уродинамического исследования, т. к. результаты общепринятого обследования больных ДГПЖ малоинформативны при оценке сократимости детрузора.
Список литературы
1. Пушкарь Д. Ю., Раснер П. И. Алгоритм обследования и лечения больных с доброкачественной гиперплазией предстательной железы // Рус. мед. журн. 2002. Т. 10 (26). С. 3–6.
2. Abrams P. Bladder outlet obstruction index, blader contractility index and bladder voiding efficiency: three simple indices to define bladder voiding function // BJU International. 1999. Vol. 84. P. 745–750.
3. Abrams P., Cardozo L., Fall M. et al. The standardization of terminology in lower urinary tract function: report from the Standardisation Subcommittee of the International Continence Society // Neurourol. Urodynam. 2002. Vol. 21 (2). P. 167–178.
4. Chancellor M. B., Blaivas J. G., Kaplan S. A., Axelrod S. Bladder outlet obstruction versus impaired detrusor contractility: the role of outflow // J. Urol. 1991. Vol. 145(4). P. 810–812.
5. Chancellor M. B., Rivas D. A., Keeley F. et al. Similarity of the American Urological Association symptom index among men with benign prostatic hyperplasia, urethral obstruction not due to BPH and detrusor instability without bladder outlet obstruction // Br. J. Urol. 1994. Vol. 74 (2). P. 200–203.
6. Gomes C. M., Nunes R. V., Araújo R. M. et al. Urodynamic evaluation of patients with lower urinary tract symptoms and small prostate volume // Urol. Int. 2008. Vol. 81(2). P. 129–134
7. Griffiths D. J., McCracen P. N., Harrisson G. M. et al. Urge incontinence and impaired detrusor contractility in the elderly // Neurourol. Urodyn. 2008. Vol. 21. P. 126–131.
8. Haylen B. T., de Ridder D., Freeman R. M. et al. An International Urogynecological Association (IUGA) / International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction // Neurourol. Urodyn. 2010. Vol. 29 (1). P. 4–20.
9. Hindley R. G., Brierly R. D., McLarty E. et al. A qualitative ultrastructural study of the hypocontractile detrusor // J. Urol. 2002. Vol. 168 (1). P. 126–131
10. Kaplan S. A., Te A. E., Blaivas J. G. Urodynamic findings in patients with diabetic cystopathy // J. Urol. 1995. Vol. 153. P. 342–344.
11. Shafer W. Basic principles and clinical application of advanced analysis of bladder voiding function // Urol. Clin. North. Am. 1990. Vol. 17 (2). P. 553–566.
12. Schafer W., Abrams P., Liao L. et al. Good urodynamic practices: uroflowmetry, filling cystometry, and pressure-flow studies // Neurourol. Urodyn. 2002. Vol. 21(3). P. 261–274.
13. Steele G. S., Sullivan M. P., Sleep D. J., Yalla S. V. Combination of symptom score, flow rate and prostate volume for predicting bladder outflow obstruction in men with lower urinary tract symptoms // J. Urol. 2000. Vol. 164 (2). P. 344–348.
14. Thomas A. W., Cannon A., Bartlett E. et al. The natural history of lower urinary tract dysfunction in men: the influence of detrusor underactivity on the outcome after transurethral resection of the prostate with minimum 10-year urodynamic follow-up // BJU International. 2004. Vol. 93. P. 745–750.
15. Van Venrooij G. E., Eckhardt M. D., Boon T. A. Data from frequency-volume charts versus maximum free flow rate, residual volume, and voiding cystometric estimated urethral obstruction grade and detrusor contractility grade in men with lower urinary tract symptoms suggestive of benign prostatic hyperplasia // Neurourol. Urodyn. 2002. Vol. 21 (5). P. 450–456.
16. Yamamoto T., Sakakibara R., Uchiyama T. et al. Neurological diseases that cause detrusor hyperactivity with impaired contractile function // Neurourol. Urodyn. 2006. Vol. 25 (2). P. 119–123.
Decrease of urinary bladder contractility in patients with benign prostate hyperplasia
Al-Shukri S. Kh., Amdiy R. E., Kuzmin I. V.
Summary. Aim of the study. Estimation of the decrease of urinary bladder contractility in patients with benign prostate hyperplasia (BPH). Patients and methods. In 146 BPH patients (mean age 62,1 ± 0,8) urodynamic investigation including uroflowmetry and pressure-flow study was performed. The results of miction cystometry were evaluated using Shafer nomogram, the emptying idex was calculated as relation of voiding volume to maximal cystometric capacity. Results. 56,2% BPH patients showed the decreased detrusor contractility. The results of urinary bladder contractility estimation by Shafer nomogram are dependent on the degree of infravesical obstruction (IVO). The emptying index is not related to the presence and degree of IVO and characterizes the degree of urinary bladder emptying as well as contraction duration. Concomitant lumbar osteochondrosis and diabetes detoriates urinary bladder emptying. Reliable contractility estimation may only be performed based on urodynamic study since basic BPH patients examination is not sufficient. Conclusion. In has to be considered during treatment strategy planning that in many BPH patients low urinary truct disfunction is determined by the decrease of urinary bladder contractility and not by IVO.
Key words: benign prostate hyperplasia; urodynamic study; decrease of urinary bladder contractility









Комментарии