© А. В. Антонов
Кафедра урологии Первого Санкт-Петербургского государственного медицинского университета имени акад. И. П. Павлова
Лекция посвящена эндовидеохирургическому лечению больных с нарушенной проходимостью пиелоуретерального сегмента. Рассмотрены причины нарушения оттока мочи из почки, показания к оперативному лечению. Подробно описаны различные методы оперативного лечения стриктур прилоханочного отдела мочеточника. Описана техника эндовидеохирургических операций на этой области, приведены рекомендации по послеоперационному ведению больных.
Ключевые слова: пиелоуретеральный сегмент; эндовидеохирургия; стриктура мочеточника.
Нарушение проходимости верхних отделов мочеточника в основном приходится на лоханочномочеточниковое соустье. Причинами стриктур этого отдела мочевыделительной системы могут быть пороки развития, рубцовые изменения клетчатки, конкременты, кисты и опухоли, сдавливающие мочеточник извне, нефроптоз и другие. С учетом большого разнообразия механизмов сужения мочеточника, существует множество способов восстановления его проходимости для адекватного оттока мочи из почки.
Для устранения временной причины нарушения оттока мочи из почки используется катетеризация мочеточника, дренирование почки стентом или чрескожная пункционная нефростомия, иными словами, установка в почку дренажа. После устранения причины нарушения оттока мочи из почки дренаж удаляется. Временной и внезапной причиной нарушения проходимости мочеточника чаще всего бывает камень или воспалительные изменения, вызывающие отек тканей.
Если сужение мочеточника связано со стриктурой, рубцовыми изменениями или сдавлением мочеточника извне и дренирование почки не позволяет решить задачу радикально, необходимо оперативное лечение. Оперативные вмешательства по восстановлению адекватного оттока мочи из почки условно можно разделить на операции по устранению внешних причин, сужающих просвет мочеточника, и пластические операции, проводимые непосредственно на пиелоуретеральном сегменте.
Рубцы, сдавливающие мочеточник, могут образоваться в результате пиелонефрита, длительного нахождения камня в одном месте, литотрипсии, операции и других причин. Мочеточник может иметь фиксированный перегиб (особенно при нефроптозе)
или просто быть сдавлен рубцами. Основной операцией при рубцовых поражениях тканей, окружающих мочеточник, является уретеролиз. Если рубцовое нарушение проходимости пиелоуретерального сегмента вызвано сместившимся из лоханки конкрементом или привело к вторичному камнеобразо-ванию, одновременно выполняется удаление этого конкремента.
Наличие фиксированного перегиба имеет принципиальное значение во время выполнения операции. При сдавлении мочеточника достаточно освободить его из рубцов, а при наличии перегиба необходимо не только выпрямить его, но и зафиксировать в таком положении. Оптимальным методом фиксации является стентирование мочеточника на несколько недель. Это позволяет новым рубцам сформироваться на месте операции таким образом, чтобы ход мочеточника не имел резких перегибов.
В ситуациях, когда нарушение проходимости мочеточника вызывает дополнительный сосуд, может быть выполнено пересечение сосуда или пластическая операция. Если прекращение кровотока по артерии не вызывает значимой ишемии почечной ткани, ее обычно пересекают. Если артерия крупная, выполняется реконструктивная операция — антевазальный уретеропиелоанастомоз или дислокация сосуда.
Пластические операции, направленные на восстановление проходимости пиелоуретерального сегмента, относятся к сложным хирургическим вмешательствам. Успех операции зависит от точности и тщательности соединения тканей швами и надежности узлов. Многообразие вариантов строения лоханки и мочеточника обусловливает большое количество вариантов пластических операций.
При стриктурах лоханочно-мочеточникового соустья кроме традиционных операций с успехом применяются эндоуретеротомия, бужирование и баллонная дилатация мочеточников, эндовидеохирургические вмешательства. Эти манипуляции прочно вошли в повседневную практику и во многих случаях стали альтернативой открытой хирургии.
По объему травмируемых тканей самыми щадящими, безусловно, являются трансуретральные и транскутанные доступы к полостной системе почки и верхним отделам мочеточника. Однако баллонная дилатация и эндоуретеротомия не являются радикальными методами лечения нарушения проходимости пиелоуретерального сегмента, они дают много рецидивов заболевания; кроме того, доступность этих методов для больных в России низкая.
Особенностью пластических операций на лоханочно-мочеточниковом соустье является то, что стриктуры мочеточника, требующие оперативной коррекции, почти всегда осложнены пиелонефритом той или иной степени активности. Для профилактики рубцовых рецидивов стриктур все операции мы проводили на фоне противовоспалительной терапии и оперировали больных только при отсутствии активной фазы хронического пиелонефрита.
Пластические операции с формированием нового анастомоза между лоханкой и мочеточником у нас в клинике выполняются разными методами и разными доступами, что связано с большим разнообразием строения пиелоуретерального сегмента и наличием сопутствующих факторов (дополнительные сосуды, камни и др). Используя эн-довидеохирургический доступ, мы не предлагаем принципиально новых методов оперативного лечения стриктур пиелоуретерального сегмента, речь идет лишь о соединении воедино опыта открытых пиелоуретеральных пластик и эндовидеохирургических методов лечения. Для выполнения таких операций не требуется специального оборудования, достаточно стандартного набора аппаратуры и инструментов для выполнения холецистэктомии, однако требуется отточенная мануальная хирургическая техника.
Пластические операции, проводимые непосредственно на пиелоуретеральном сегменте, можно условно разделить на операции с сохранением целостности «мочевой дорожки» и без такового, то есть с резекцией суженного участка.
Большинство публикаций свидетельствует о лучших результатах операций с пересечением «мочевой дорожки». Мы согласны с этим мнением частично — при врожденных стриктурах, особенно у детей, необходимо иссекать суженный сегмент.
Но если стриктура приобретенная, вызвана рубцовым процессом, например, вследствие длительного нахождения конкремента в этом месте, операции с перемещением лоскута лоханки в пиелоурете-ральный сегмент без его резекции или иные реконструктивные методики могут с успехом применяться. Это подтверждает наш опыт проведения таких операций: мы не выявили статистически достоверной разницы в количестве рецидивов стриктур после вмешательств без иссечения суженного участка пиелоуретерального сегмента и с его иссечением у больных с рубцовыми стриктурами пиелоурете-рального сегмента.
Практически все известные варианты пластических операций называются по авторам, предложившим эту методику. Однако иногда различия между отдельными способами операций настолько незначительны, что очень трудно бывает определить авторство, особенно если речь идет не о рисунке на бумаге, а о практическом воплощении методики в операционной. Так в «Атласе операций на органах мочеполовой системы» (Д. П. Чухриенко и А. В. Люлько, 1972 г.) на соседних — 74 и 75 страницах представлены методики операций с сохранением «мочевой дорожки» разных авторов (При-стеля и Джибсона). Разница между методиками заключается в форме верхнего угла раны лоханки (рис. 1). Оперирующие хирурги понимают, что для практической работы разницы между этими методиками нет.
Известно несколько очень похожих друг на друга методов операций с сохранением «мочевой дорожки» и перемещением треугольного лоскута из лоханки в суженный пиелоуретеральный сегмент. Они с успехом применяются и наиболее предпочтительны в том случае, когда необходимо иссекать мочеточник на большом протяжении и при наложении анастомоза между мочеточником и лоханкой после резекции возникает натяжение. В различных литературных источниках авторство этих методик принадлежит Deuticke, Foley, Prince, Culp de Weerd, Scardino и другим (рис. 2).
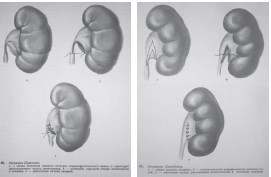
Рис. 1. Операции с сохранением «мочевой дорожки» по методам Пристеля и Джибсона (Д. П. Чухриенко,
А. В. Люлько «Атлас операций на органах мочеполовой системы» 1972 г.)
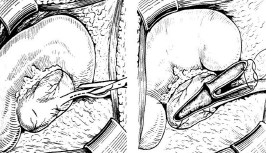
Рис. 2. Пластика с перемещением лоскута лоханки в узкую часть пиелоуретерального сегмента. Рисунок из руководства «Оперативная урология» под ред. Н. А. Лопаткина, 1986 г.
Разница в результатах пластики, выполненной по разным способам перемещения лоскута лоханки в узкую часть пиелоуретерального сегмента, сводится к форме и расположению шва (направлению угла) мочеточника, при этом форма самой лоханки и пиелоуретерального сегмента при различных методиках идентичны (рис. 3).
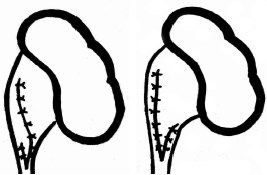
Рис. 3. Результаты различных пластических операций с перемещением лоскута
Классическим вариантом операции с пересечением «мочевой дорожки» и резекцией стриктуры с наложением широкого анастомоза между мочеточником и лоханкой является методика Heynes-Anderson. Похожую методику предложил Kucera. Эти два метода отличаются обработкой культи мочеточника: при операции Kucera помимо косого среза производится дополнительное продольное рассечение мочеточника приблизительно на 1 см, что позволяет наложить более широкий анастомоз с лоханкой (рис. 4). По некоторым литературным источникам обработка культи мочеточника с его рассечением относится к методике Heynes-Anderson, а без рассечения — Kucera.
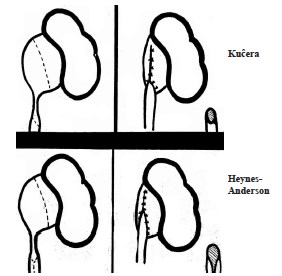
Рис. 4. Варианты пластики пиелоуретерального сегмента с пересечением «мочевой дорожки» по авторам
Мы в своей практике используем различные варианты пластических операций, в последнее время подавляющее большинство из них выполняются лапароскопическим доступом с иссечением суженного участка и наложением уретеропиелоанастомоза.
Один из методов, который дает «красивый» результат и занимает минимальное время, больше всего напоминает методику Кюстера и является уретеропиелоанастомозом с иссечением области стриктуры и обработкой культи мочеточника с продольным разрезом (рис. 5).
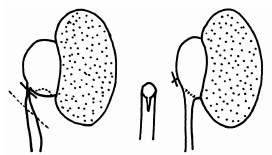
Рис. 5. Вариант уретеропиелоанастомоза
Техника операции следующая: выделяется лоханка, пиелоуретеральный сегмент и мочеточник. Мочеточник клипируется непосредственно у лоханки, суженная часть отсекается на уровне его нормального просвета. Оставшаяся культя мочеточника рассекается вдоль для последующего формирования широкого анастомоза с лоханкой. Пока идет обработка мочеточника, лоханка расширяется выделяющейся мочой и становится отчетливо видна ее нижняя точка, где и производится разрез длиной, соответствующей просвету подготовленно-
го мочеточника (1,5–2 см). Формируется анастомоз лоханки и мочеточника на стенте 6–7 Fr. Для удобства первоначально накладывается шов на дальнюю от хирурга стенку анастомоза, потом антеградно устанавливается стент, после чего формируется ближняя полуокружность анастомоза. Вся операция продолжается 1,5–2 часа.
Для выполнения эндовидехирургической пластики пиелоуретерального сегмента мы применяем лапароскопический и люмбоскопический доступы. Независимо от методики операции лоханка и мочеточник сшиваются, отступя от края разреза 1-2 мм, непрерывным швом с шагом 1-2 мм рассасывающимися нитками (викрил) 4-0 на колющей игле. Если стенка лоханки гипертрофирована и шов круглой иглой затруднителен, допустимо использование режущей иглы. Лоханка дренируется стентом размером 6-7 Fr на 1-2 месяца. Это единственный дренаж, который остается в просвете мочевыделительной системы. В мочевой пузырь обязательно устанавливается катетер Foley 16-18 Fr, который остается на 2-3 дня после прекращения поступления мочи по забрюшинному дренажу. Забрюшинное пространство дренируется одной силиконовой трубкой диаметром 5 мм, установленной к сформированному анастомозу.
При хирургическом доступе мы учитываем особенности анатомии области ворот почки у каждого больного. К передней поверхности лоханки прилежат почечные сосуды, поэтому подойти к ней часто удобнее сзади, в этой ситуации ретроперитонеаль-ный доступ менее опасен и более удобен, чем трансперитонеальный. Для наложения антевазального пиелоуретерального анастомоза предпочтительнее подойти к воротам почки спереди, в этой ситуации удобнее лапароскопический доступ. При значительном расширении лоханки сосуды не мешают работе и выбор доступа зависит от предпочтений хирурга. Больной независимо от доступа во время операции находится в латеропозиции. Для обезболивания применяют эндотрахеальный наркоз с искусственной вентиляцией легких.
Топография эндопортов и способы создания пневморетроперитонеума рассматривались в предыдущих лекциях. Особенностью пластических операций является необходимость в наложении швов большой протяженности и формирования узлов, поэтому объем полости удобнее делать несколько больше, чем минимально необходимый.
При уретеролизе по поводу рубцовой стриктуры пиелоуретерального сегмента мочеточник и лоханку обычно освобождают от рубцов по одной поверхности. В случае фиксированного перегиба мочеточника приходится выделять его по всему диаметру. Для уменьшения риска развития рецидива рубцовой стриктуры и перегибов мочеточника (как и при открытой операции), необходима ретроградная установка стента (без вскрытия просвета мочевыделительной системы). Операция уретеролиза заканчивается ушиванием троакарных ран и дренированием забрюшинного пространства на одни сутки.
Если нарушение проходимости лоханочномочеточникового соустья вызвано перекрестом мочеточника с дополнительными сосудами, в зависимости от их просвета выполняется пересечение сосуда, его дислокация или антевазальный уретеро-пиелоанастомоз. Для выявления дополнительного сосуда, суживающего просвет мочеточника, можно выполнить доплерографическое исследование этой области, но оптимальным методом является ангиография, она определяет зону кровоснабжения дополнительной артерии. Однако если это не сделано до операции, во время операции мы пережимали сосуд на несколько минут и следили за изменением окраски поверхности почки. По цианозу, который появится на поверхности почки, можно оценить последствия пересечения сосуда и решить вопрос об объеме операции.
Во время эндовидеохирургических пластических операций на лоханочно-мочеточниковом соустье самым сложным этапом является наложение первого шва, от него во многом зависит качество выполнения всей операции. Для оптимизации этого этапа мы использовали различные технические приемы и разработали свою методику. Наложение анастомоза лучше начинать с формирования его нижней точки, первый прокол иглы делать в нижней точке разреза лоханки со стороны адвентиции, а затем мочеточник в нижней точке разреза прокладывать со стороны слизистой оболочки. Такая последовательность создает лучшие технические возможности при наложении этого шва и формировании узла. После наложения шва накладывается обычный морской узел, он получается с наружной стороны лоханки. Этот технический прием хорошо использовать при отсутствии натяжения между лоханкой и мочеточником.
Если ткани мочеточника и лоханки сходятся с натяжением, целесообразно повторить первый шов до завязывания первого узла. Это предотвратит расхождение краев анастомоза и прорезание шва при завязывании нитей. При имеющемся натяжении удобнее экстракорпорально на конце нити сформировать затягивающуюся петлю, в которую завести конец нити с иглой после шва и завязать этот узел. Сшиваемые края при этом лучше совмещать не натяжением нитей, а инструментами. Двойной шов ниткой с петлей на конце накладывать тоже проще, узел в ее основании не позволяет нити выскальзывать из прокола стенки лоханки. Короткий конец нити у петли после затягивания узла не срезается или срезается таким образом, чтобы его можно было использовать потом для последнего узла при завершении наложения анастомоза.
После формирования нижней точки анастомоза накладывается непрерывный шов на дальнюю от хирурга полуокружность. Расстояние между вколами на лоханке делается несколько большим, чем на мочеточнике, чтобы растянуть стенку последнего. Последний стяжек на верхней точке полуокружности анастомоза делается с захлестом, чтобы закрепить весь шов.
Через оставшийся дефект будущего анастомоза устанавливается стент. Этот этап сопряжен с техническими трудностями. Если стент на нижнем конце имеет «свиной хвост», то устанавливать его надо на струне, при установке стента возможно повреждение мочеточника. Так, у нас дважды стент оказался в брюшной полости, пройдя через стенку мочеточника и брюшину, причем мы устанавливали его без видимых усилий. Несколько раз стент не доходил до мочевого пузыря, что в послеоперационном периоде потребовало уретероскопии для его извлечения. Помня эти досадные осложнения, мы не форсируем интраоперационную антеград-ную установку стента и при затруднениях ставим его ретроградно. Установку стента до операции мы не практикуем, он затрудняет иссечение суженного участка пиелоуретерального сегмента и наложение швов при формировании анастомоза. В лоханку стент устанавливается без применения струны и это действие обычно не вызывает затруднений.
После установки стента продолжается начатый непрерывный шов на ближнюю к хирургу полуокружность анастомоза, до его нижней точки, где оставшийся короткий конец нити и нить с иглой на конце связываются.
В ряде операций мы пытались наложить анастомоз специальной нитью с двумя иглами и узлом в центре. Изготовить ее легко: два отрезка нити длиной около 10 см с иглами связываются между собой широким узлом, который не проходит через прокол ткани, накладывается первый шов, как описано выше, узел на нити помогает стянуть края анастомоза, после чего завязывается морской узел, фиксирующий первый стяжек непрерывного шва. Одной нитью с иглой накладывается непрерывный шов на дальнюю от хирурга полуокружность анастомоза, последний стяжек шва делается с захлестом для закрепления нити. Через разрез в мочеточник и лоханку устанавливается стент. Второй нитью с иглой от первого шва накладывается непрерывный шов на переднюю полуокружность анастомоза, после чего концы нитей с иглами связываются. На практике этот способ оказался не таким удобным, как в теории — свободный конец нити мешает работать, трудно точно рассчитать длину нитей при разных размерах анастомоза, самый трудоемкий этап — наложение первого шва выполняется в плохих условиях, когда нити длинные, путаются, трудно вязать узлы в ограниченной операционной полости.
Если возможность выполнения эндовидеохирургических пластических операций на лоханочномочеточниковом сегменте не требует доказательств, то преимущества эндовидеохирургических операций перед открытыми вызывают сомнения. Мы провели сравнение результатов эндовидеохирургических вмешательств и открытых операций, выполненных по различным методикам по следующим критериям: длительность вмешательства и наркоза, крово-потеря, выраженность болевого синдрома, сроки заживления мочевых свищей, длительность пребывания больного в стационаре, длительность периода нетрудоспособности у работающих и реабилитации у неработающих, функциональное состояние почек, активность пиелонефрита, состояние уроди-намики, качество жизни в послеоперационном периоде по опроснику «SF-36 Health Status Survey», осложнения, отдаленные результаты.
Статистически достоверных различий между отдаленными результатами различных вариантов пластических эндовидеохирургических и открытых операций на пиелоуретеральном сегменте не получено (р > 0,10). Это вполне ожидаемый результат, действительно, если качественно выполнить операцию и получить красивое и широкое соустье лоханки и мочеточника, то почему нужно ожидать плохих результатов?
При сравнении ближайших результатов разница была выявлена, и это тоже ожидаемый результат, малоинвазивность эндовидеохирургического способа благотворно влияет в основном на ближайший послеоперационный период, который мало отличался от любых других вмешательств этим доступом. На следующий день после операции больные не требовали назначения анальгетиков, самостоятельно ходили.
Единственный показатель, по которому эндовидеохирургическая операция уступает открытой — длительность операции и наркоза, однако в последние два года при работе постоянной, «сработанной» операционной бригады с большим стажем продолжительность операции составляет от 1,5 до 2 часов. Хочется верить, что этот результат будет стандартным для всех хирургов, а с развитием метода и применением последних достижений медицинской техники будет неуклонно сокращаться.
Основной особенностью послеоперационного периода после уретеропиелопрластики является наличие протяженного шва и возможность подтекания мочи. По этой причине паранефральный дренаж удалялся не ранее 4-го «сухого» дня — после прекращения поступления по нему мочи. Обычно скудное отделение мочи было 1-2 дня, а сроки пребывания больных в стационаре не превышали 8 дней, период полной реабилитации составлял приблизительно 2 недели. Стент извлекался цистоскопически не ранее, чем через 15 дней, чаще оставлялся до 2-3 месяцев после операции. Это зависело от того, насколько легко больные переносили присутствие у них стента.
После эндовидеохирургических операций за весь период наблюдения зафиксировано 2 послеоперационных осложнения, которые не повлияли на результат лечения, но потребовали проведения дополнительных лечебных мероприятий. В одном случае мы не дренировали мочевой пузырь, и моча стала обильно течь по забрюшинному дренажу. Это было связано с пузырно-мочеточниковым рефлюксом по стенту. Свищ закрылся после установки в мочевой пузырь катетера Foley. У другого больного на 2-й день после операции выпал дренаж из забрю-шинного пространства. При контрольном ультразвуковом исследовании на 4-й день выявлен мочевой затек, была выполнена диагностическая люмбоскопия. Дефект анастомоза не выявлен, рана дренирована, свищ закрылся самостоятельно. При контрольном обследовании через 4 месяца у этого больного нарушения оттока мочи из почки не выявлено, лоханка уменьшилась в размерах по сравнению с предоперационным периодом с 3,8 до 2,5 см.
Для объективного исследования качества жизни больных использован опросник «SF-36 Health Status Survey». 36 пунктов анкеты сгруппированы в шкалы. Показатели каждой шкалы варьируют между 0 и 100, где 100 баллов соответствует полному здоровью. Все шкалы формируют два блока: физический компонент здоровья (Physical health — PH) и психологический компонент здоровья (Mental health — MH).
На 5-7-й день после различных вариантов операций установлено, что физический компонент здоровья (PH) после эндовидеохирургических вмешательств составил 68,64 ±3,85 балла. Это является достоверно лучшим показателем (р < 0,05), чем у пациентов после открытых операций — 50,84 ±4,24 балла.
При сравнении психологического компонента здоровья у пациентов со стриктурами лоханочномочеточникового соустья после операций традиционными и эндовидеохирургическими методами статистически достоверных различий не выявлено.
Таким образом, при пластике пиелоуретераль-ного сегмента эндовидеохирургические методики не только применимы, но и имеют явные преимущества по сравнению с открытыми операциями. Их выгодно отличают показатели качества жизни после операции и сроки выздоровления больных при равных показателях функционального состояния оперированной почки, степени нарушения уродинамики верхних мочевых путей, активности пиелонефрита и отдаленных результатов. Эндовидеохирургия является альтернативой открытой хирургии при пластических операциях на лоханочномочеточниковом соустье.









Комментарии