Коллектив авторов:
М.И. Давидов – врач-уролог высшей категории, к.м.н., доцент кафедры факультетской хирургии и урологии ФГБОУ ВО Пермский государственный медицинский университет им. акад. Е.А.Вагнера, Пермь, Россия; e-mail: gileva_olga@list.ru. ID 307366. ORCID 0000-0002-8932-2844
М.Н. Мельцина – врач-уролог, поликлиника Пермского краевого центра ФМБА России, Пермь, Россия
Н.Е. Бунова – врач-уролог высшей категории, городская клиническая поликлиника № 2, Пермь, Россия
А.М. Метелкин – врач-уролог, городская клиническая поликлиника № 1, Пермь, Россия
О.Р. Пруссаков – врач-уролог, городская клиническая поликлиника № 1, Пермь, Россия
А.А. Лунев – врач-уролог, поликлиника ГБ им. С.Н. Гринберга, Закамск, Россия.
Ведущим направлением в лечении острого неосложненного цистита у женщин считается антибиотикотерапия, поскольку эрадикация возбудителя при этом заболевании является главной задачей. Препаратом первой линии в Европе и России в настоящее время является фосфомицина трометамол. Эффективность такой терапии острого цистита достигает 89–95%. Однако, несмотря на высокую эффективность антибактериальной терапии, симптомы заболевания из-за продолжающегося воспалительного процесса в стенке мочевого пузыря могут оставаться некоторое время даже на фоне лечения. При этом часто пациентки желают избавиться от боли и частых позывов в самые кратчайшие сроки. Сохраняющийся болевой синдром и дизурия сильно снижают качество жизни, нарушая привычный ритм жизни больных. Болевой симптомокомплекс особенно беспокоит пациентов, ухудшает их качество жизни, подрывает доверие к назначенному лечению и врачу.
Урологи Пермского края М.И. Давидов, М.Н. Мельцина, Н.Е. Бунова, А.М. Метелкин, О.Р. Пруссаков, А.А. Лунев провели многоцентровое исследование, в котором изучили эффективность и безопасность комбинированной терапии острого неосложненного цистита у женщин трудоспособного возраста. Исследование проводилось в 5 поликлиниках Пермского края (Профессорской поликлинике Пермского государственного медицинского университета им. Е.А. Вагнера, поликлинике Пермского краевого центра ФМБА России, городских клинических поликлиниках № 1 и № 2 Перми, поликлинике ГБ им. Гринберга
Закамска) с 1 сентября 2020 г. по 30 апреля 2021 г.
Дизайн исследования
В исследование были включены 152 женщины в возрасте от 18 до 60 лет с острым неосложненным циститом. Для диагностики использовали следующие методы: сбор анамнеза, оценка симптомов заболевания по шкале ACSS (Acute Cystitis Symptom Score), анкетирование по Визуальной аналоговой шкале боли (ВАШ), физикальное исследование с осмотром наружных половых органов, общий анализ крови, общий анализ мочи с микроскопией, бактериологический анализ мочи, ультразвуковое исследование мочевого пузыря, почек и женских половых органов (для дифференциальной диагностики). Все исследования проводили в динамике.
Бактериологическое исследование средней порции пузырной мочи включало посев биоматериала на искусственные питательные среды, выделение чистой культуры возбудителя и ее количественную оценку в КоЕ/мл. Среди обнаруженных штаммов преобладала E.coli(81,7%), реже высевались Enterococcus faecalis, Klebsiella pneumoniaи другие микроорганизмы.
Большое значение в ходе проведения исследования придавали анкетированию с помощью стандартной 10-балльной Visual Analogue Scale – Визуальной аналоговой шкалы (ВАШ) боли. После получения инструкции по заполнению ВАШ, пациенты ставили отметку по шкале от 0 до 10 баллов (в соответствии с субъективной оценкой выраженности боли) при первичном осмотре, а затем через 6, 12, 24 и 48 ч.
При оценке клиники заболевания и эффективности проводимого лечения большое значение придавали шкале ACSS, определяя в динамике сумму баллов «Характерных симптомов» (Typical) по ответам на вопросы 1–5 шкалы, сумму баллов качества жизни QoL по ответам на вопросы 11–13, а при повторных осмотрах большое значение имел ответ на вопрос об изменении самочувствия (Dynamics).
В исследовании не участвовали пациенты с осложненным циститом, в том числе на фоне различного рода дренирования мочевых путей, с сопутствующими урологическими заболеваниями (МКБ, стрессовое недержание мочи и др.), операции на мочевых путях в анамнезе, беременность, сахарный диабет.
Больные при первом визите случайным способом (методом конвертов) были рандомизированы на 2 группы.
Первую (основную) группу составили 76 женщин, которые перорально получали исследуемый препарат феназопиридин (Феназалгин®) в дозе по 200 мг (2 таблетки) 3 раза в день в течение двух суток (суммарная доза 1200 мг) и антибиотик фосфомицина трометамол (Монурал) в дозе 3 г однократно.
Вторую группу (сравнения) составили 76 женщин, которые перорально по- лучали препарат но-шпа в дозе по 80 мг (2 таблетки) 3 раза в день в течение двух суток (суммарная доза 480 мг) и 3 г фосфомицина трометамол (Монурал) однократно.
Результаты исследования
У всех больных основной группы отмечено значительное снижение уровня болевой симптоматики. Как показал сбор анамнеза, пациенты начинали чувствовать уменьшение боли уже через 20 мин после приема препарата Феназалгин®. В дальнейшем у больных постепенно исчезали боль и дискомфорт в надлобковой области, внизу живота и в глубине малого таза; боль, резь и жжение во время мочеиспускания.
В основной группе исходный показатель при первом визите составлял 7,2 ± 0,5 балла, что по шкале характеризуется, как «очень сильная боль». Однако уже через 20 мин после приема Феназалгина® боль начинала уменьшаться. Через 24 ч этот показатель составил лишь 0,4 ± 0,05 балла, снизившись на 94,5% по сравнению с исходным уровнем до лечения, или в 18,0 раза! При этом 53 (69,7%) больных к этому сроку уже не чувствовали никакой боли. А через 48 ч все 76 (100%) больных основной группы указали на отметку «0» в анкете ВАШ, что документально свидетельствовало об отсутствии у них болевых ощущений.
Иную картину наблюдали в группе сравнения, где используемая комбинация но-шпы и фосфомицина не позволила достичь должного положительного эффекта в купировании боли. По всем показателям анкеты ВАШ статистически достоверно (при p< 0,001) наблюдали более высокие цифры, чем в основной группе, через 6, 12, 24 и 48 ч от начала применения препаратов (рис.1).
Цифровые показатели уровня всех 5 характерных симптомов заболевания в процессе лечения снижаются, и это снижение достоверно (p< 0,001 по большинству показателей) выраженнее в 1 группе, где больные принимали, наряду с антибиотиком фосфомицином, Феназалгин®. Отмечено, что именно в основной группе значительно уменьшалась выраженность симптомов, связанных с болью (боль и жжение при мочеиспускании, боль внизу живота) и частотой мочеиспускания (учащение мочеиспускания, сильные и неудержимые позывы к нему).
В основной группе особенно выраженное снижение симптоматики происходило в первые трое суток наблюдения, то есть в период применения больными Феназалгина®. Так показатель, характеризующий сильные и неудержимые позывы на мочеиспускание, в основной группе за трое первых суток лечения уменьшился с 2,5 до 0,45 балла, то есть на 82%, а в следующие 3 дня – до 0,03 балла, то есть только на 16,8%. Выраженность симптома «Боли или жжение при мочеиспускании» в основной группе за первые трое суток уменьшилась с 2,6 до 0,4 балла, то есть на 84,6 %, а в следующие 3 дня до 0,04 балла, то есть только на 13,9%.
Такой эффект можно объяснить действием Феназалгина®, который применялся перорально в первые двое суток, но, в связи с тем, что период полувыведения препарата составляет 7,4 ч, продолжал свое действие в организме и на третьи сутки от начала лечения.
В 1 группе отмечена более выраженная и быстрая нормализация анализа мочи с исчезновением лейкоцитурии. Через 3 суток лечения антибиотиком фосфомицином с добавлением Феназалгина® число лейкоцитов в поле зрения микроскопа в среднем составило 10,2 ± 2,5, что достоверно (p< 0,05) меньше, чем в группе сравнения, где фосфомицин дополнялся препаратом но-шпа (17,8 ± 2,8). Бактериологические исследования, проведенные в динамике, показали, что через
6 суток в 1 группе эрадикация возбудителя наступила у 62 из 64 больных с исходной бактериурией (96,9%), персистенция со снижением микробного числа – у 2 (3,1%); во 2 группе эрадикация произошла у 60 из 62 (96,8%) больных, персистенция – у 2 (3,2%). Таким образом, при комплексном лечении острого неосложненного цистита фосфомицином и феназопиридином (Феназалгин®) клиническая эффективность составила 97,4%, бактериологическая эффективность – 96,9%
Побочные эффекты Феназалгина® выявлены у 1 (1,3%) больной в виде умеренной тошноты, что однако не привело к отказу ее от дальнейшего приема препарата.
На яркое окрашивание мочи в красно-оранжевый цвет обратили внимание 11 (14,5%) больных, мочи и кала – 2 (2,6%), однако все больные были предупреждены о таком явлении до начала лечения, поэтому это не вызвало у них негативной реакции, и нами, как и другими авторами, не считалось побочным эффектом терапии. Серьезных нежелательных явлений приема каждым пациентом 1200 мг Феназалгина® не зафиксировано. По контрольным анализам крови не выявлено изменений количества эритроцитов, гемоглобина, лейкоцитов, лимфоцитов и моноцитов крови.
Обсуждение
Проведенное исследование выявило значительно выраженные анальгетический и антидизурический эффекты препарата феназопиридина (Феназалгин®) в суммарной 2-суточной дозе 1200 мг при его сочетанном использовании с фосфомицином, в сравнении с примененной терапевтической комбинацией фосфомицина с но-шпой. На рисунке 1 представлена динамика болевого симптомокомплекса, регистрируемого визуальной аналоговой шкалой, в ходе лечения больных острым
неосложненным циститом.
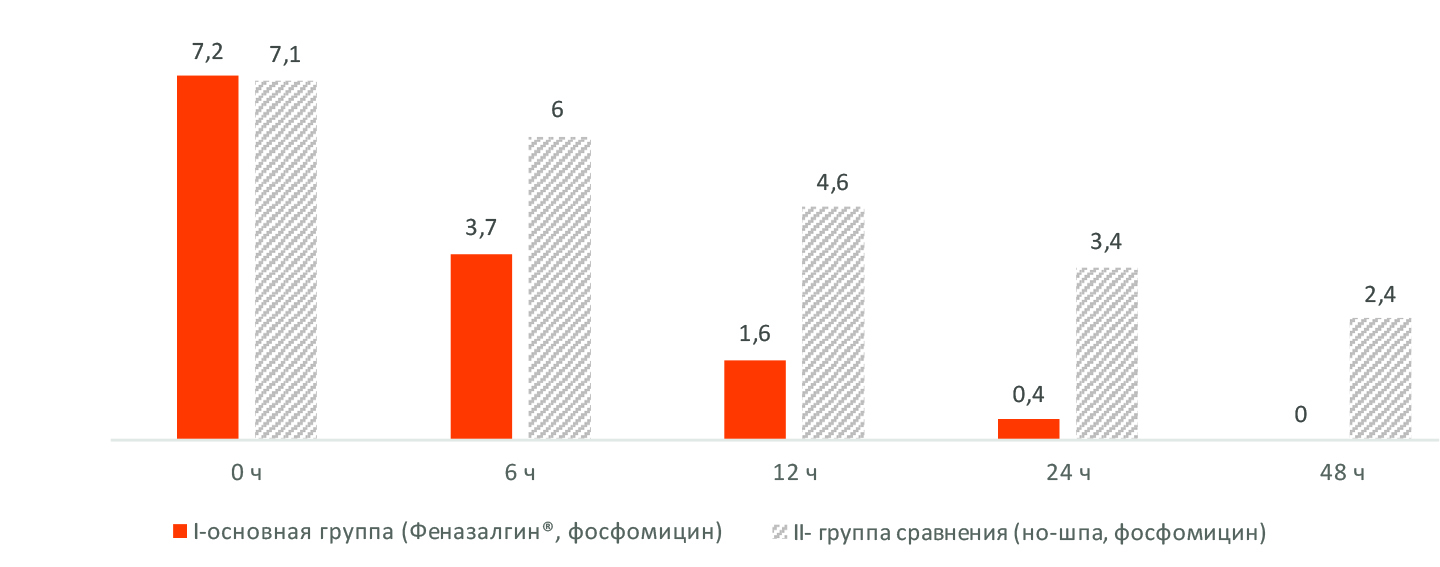
Рис. 1. Динамика болевого симптомокомплекса по визуальной аналоговой шкале, баллы 0 – исходно, далее – часы от начала лечения
Во все сроки наблюдения, от 6 до 48 ч от начала лечения, в 1-й группе, где применялся Феназалгин®, обнаружен выраженный анальгетический эффект, приведший к снижению цифрового показателя боли с исходных 7,2 балла (что характеризуется по шкале как «очень сильная боль») к крайне незначительному уровню боли в 0,4 балла уже через 24 ч и затем – к полному исчезновению боли у всех больных к временной отметке 48 ч от начала использования Феназалгина®. Во все временные промежутки (6, 12, 24, 48 ч) в группе сравнения, где с целью купирования боли применяли но-шпу, болевые ощущения у больных, согласно анкете ВАШ, были значительно сильнее, чем в основной группе.
Показано, что действие феназопиридина не ограничивается уроселективным обезболивающим эффектом, препарат имеет выраженное тормозящее влияние и на симптомы нижних мочевых путей, не связанные с чувством боли, – отчетливо выявляется тормозящее действие феназопиридина на симптомы № 1 шкалы ACSS (учащенное мочеиспускание), № 2 (сильные и неудержимые позывы на мочеиспускание) и № 4 (чувство неполного опорожнения мочевого пузыря). По сравнению с контрольной группой, вышеперечисленные симптомы цистита уменьшались значительнее и быстрее. Представленная на рисунке 2 динамика симптома № 2 шкалы ACSS убедительно подтверждает это.
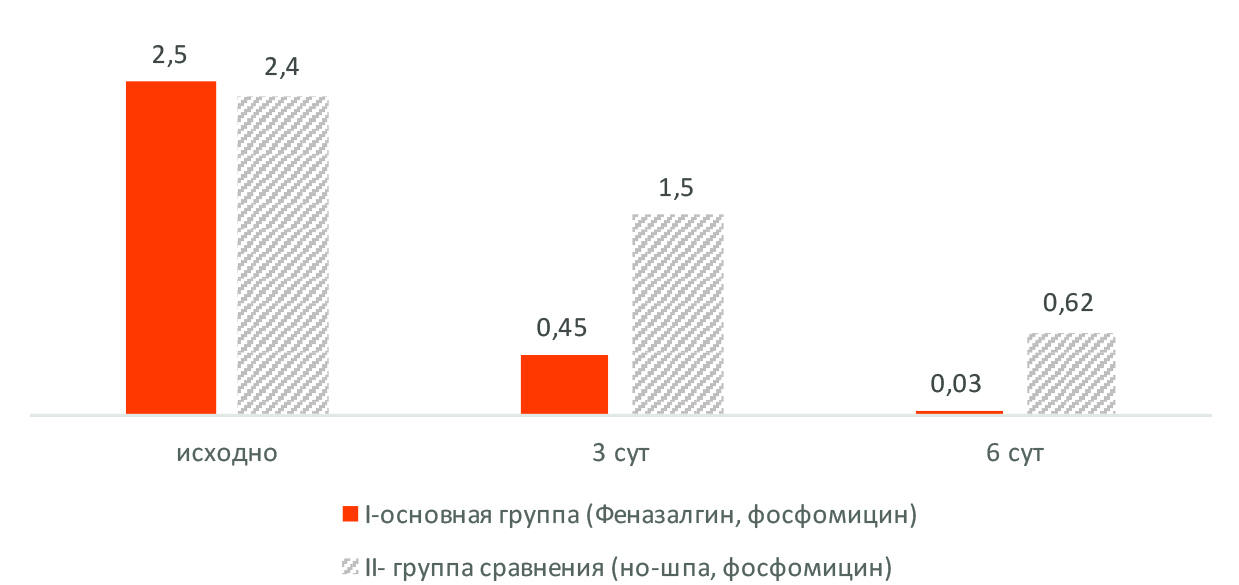
Рис. 2. Динамика симптома №2 шкалы ACSS («сильные и неудержимые позывы на мочеиспускание»), баллы
Доказана высокая клиническая эффективность применения Феназалгина® (в комбинации с антибиотиком фосфомицином) как симптоматического средства при лечении больных острым неосложненным циститом.
Как видно на рисунке 3, сумма баллов характерных симптомов шкалы ACSS в основной группе значительно снижается, как по сравнению с исходным уровнем, так и по сравнению с контрольной группой, где Феназалгин® не использовался. Кривая
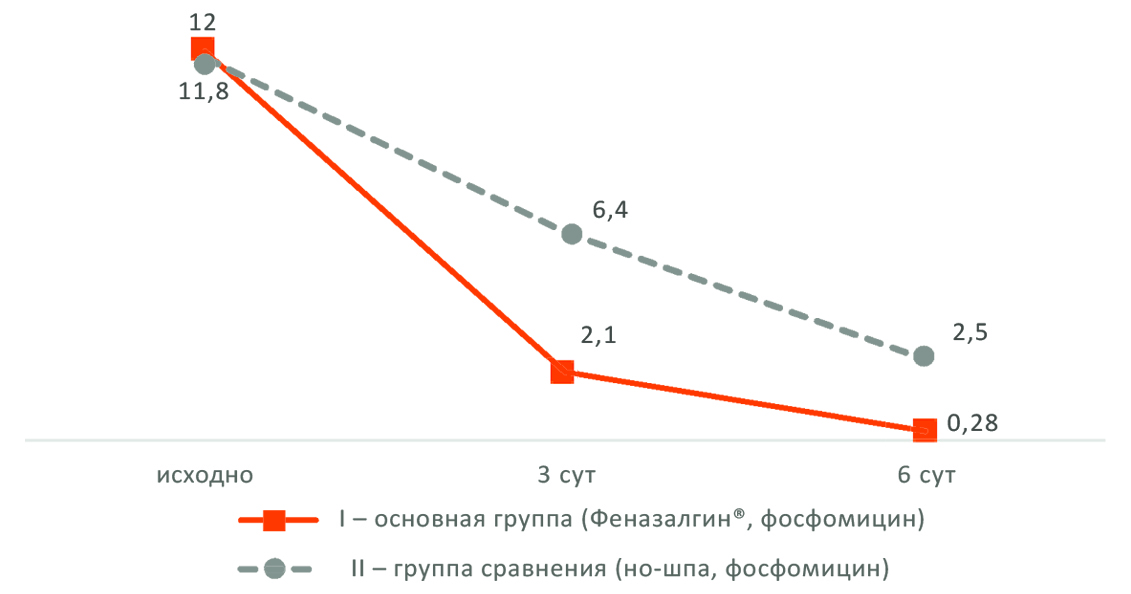
Рис. 3. Динамика баллов характерных симптомов шкалы ACSS (Typical). По оси ординат – сумма баллов, по оси абсцисс – сутки от начала лечения
диаграммы 1-й группы показывает, что особенно выражен темп уменьшения симптоматики в первые 3 суток от начала лечения, когда бактериостатический эффект фосфомицина в полной мере еще не реализован, но больной регулярно принимает Феназалгин®, оказывающий эффект.
Выводы
Таким образом, исследование пермских урологов показало, что антибактериальное лечение острого неосложненного цистита фосфомицином целесообразно дополнять препаратом Феназалгин®, обладающим анальгетическим и антидизурическим эффектом.
Добавление к стандартному лечению фосфомицином Феназалгина®, помимо уже указанных положительных эффектов, позволяет в более ранние сроки добиться исчезновения лейкоцитурии, то есть более быстрыми темпами санировать мочевые пути, достигнуть более благоприятного самочувствия больных в ходе лечения (что подтверждено рубрикой Dynamics шкалы ACSS), значительно уменьшить сроки временной нетрудоспособности.
Таким образом, следует признать, что в начале XXI столетия в мире наблюдается подлинный ренессанс феназопиридина – средства, синтезированного и впервые примененного в медицине более века назад. Комбинация антибиотика первой линии фосфомицина трометамол и уроанальгетика Феназалгина® улучшает результаты лечения острого неосложненного цистита у женщин, имеет клиническую эффективность (выздоровление) 97,4% и бактериологическую эффективность 96,9%, значительно быстрее и эффективнее ликвидирует боль и другие симптомы заболевания, на 30,1% сокращает сроки временной нетрудоспособности.
ЛИТЕРАТУРА / REFERENCES
- Grigoryan L, Zoorob R, Wang H, Trautner BW. Low Concordance With Guidelines for Treatment of Acute Cystitis in Primary Care. Open Forum Infect Dis. 2015; 2 (4): 159. Doi: 10.1093/ofid/ofv 159.
- Foxman B. The epidemiology of urinary tract infection. Nat Rev Urol 2010; 7: 653-660.
- Zaitsev A.V., Kasyan G.R., Spivak L.G. Cystitis. Urologiia. 2017; 1 (1): 34-44. Russian (Зайцев А.В., Касян Г.Р., Спивак Л.Г. Цистит. Урология. 2017; 1 (Приложение 1): 34-44).
- Perepanova T.S., Kozlov R.S., Sinyakova L.A. et al. Antimicrobial therapy and prevention of kidney, urinary tract and male genital infections. Federal`nye klinicheskie rekomendacii. M., 2020. 110 s. Russian (Перепанова Т.С.,Козлов Р.С., Синякова Л.А. и др. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Федеральные клинические рекомендации. М., 2020. 110 с.).
- Kyungtae Ko, Won Ki Lee, Cheol Young Oh. Is A Combination of Antibiotics and Non-Steroidal Anti-Inflammatory Drugs More Beneficial Than Antibiotic Monotherapy for the Treatment of Female Acute Uncomplicated Cystitis? Female Urology. 2018; 15 (06): 365-369. Doi: 10.22037/uj. v0i0. 3716.
- Davidov M.I. Bunova N.E. Comparative assessment of Canephron N and ciprofloxacin as monotherapy of acute uncomplicated cystitis in women. Urologiia. 2018; 4: 24-32. Russian (Давидов М.И., Бунова Н.Е. Сравнительная оценка монотерапии препаратами Канефрон Н и ципрофлоксацин острого неосложненного цистита у женщин. Урология. 2018; 4: 24-32). Doi: https://dx.doi.org/10.18565/urology.2018.4.24.32.
- Kulkarni SK. Antispasmodics – A new perspective. JAMA India 2001; 4 (8): 119-121.
- Zelenitsky SA., Zhanel GG. Phenazopyridine in urinary tract infections. Ann Pharmacother. 1996; 30 (7-8): 866-888.
- Vinarov AZ., Spivak LG. Current opportunities of symptomatic therapy for dysuria. Urologiia. 2019; 2: 97-102. Russian (Винаров А.З., Спивак Л.Г. Современные возможности симптоматической терапии дизурии. Урология. 2019; 2: 97-102). https://dx.doi.org/10.18565/urology.2019.2.97-102.
- Kirwin TJ., Lowsley AS., Menning J. The effect of Pyridium in certain urogenital infections. Am J Surg 1943; 62: 330-335.
- Wander HJ., Pascoe DJ. Phenylazopyridine hydrochloride poisoning. Report of case and review of literature. Am J Dis Child 1965; 110: 105-107.
- Trickett PC. Ancillary use of phenazopyridine (Pyridium) in urinary tract infections. CUIT Ther Res 1970; 12: 441-445.
- Pergialiotis V., Arnos P., Mavros MN., Pitsouni E, Athanasiou S, Falagas ME. Urinary tract analgesics for the treatment of patients with acute cystitis: where is the clinical evidence? Expert Rev Anti Infect Ther 2012; 10 (8): 875-879. Doi: 10.1586/eri. 12.72
- Alidjanov JF., Abdufattaev UA., Makhsudov SA., Pilatz A., Akilov FA., Naber KG., Wagenlehner FM. New self-reporting questionnaire to assess urinary tract infections and differential diagnosis: acute cystitis symptom score. Urol Int. 2014; 92 (2): 230 – 6. Doi: 10.1159/000356177. Epub 2014 Jan 23.
- Tsukanov A.Yu., Makushin D.G., Mirzakadiev A.A., Zolotov I.A. Influence of phenazopyridine on the well-being of patients during and after cystoscopy. Urologiia. 2020; 4: 50-54. Russian (Цуканов А.Ю., Макушин Д.Г., Мирзакадиев А.А., Золотов И.А. Влияние феназопиридина на самочувствие пациенток во время и после цистоскопии. Урология. 2020; 4: 50-54). Doi: https://dx.doi.org/10.18565/urology.2020.4.50-54.
- Aizawa N, Wyndaele JJ. Effects of phenazopyridine on rat bladder primary afferent activity, and comparison with lidocaine and acetaminophen. Neurourol. Urodynam 2010; 29 (8): 1445-1450. Doi: 10.1002/nau.20886.
- Thomas BH., Whitehouse LW., Solomonraj G, Paul CJ. Excretion of phenazopyridine and its metabolites in the urine of humans, rats, mice and guinea pigs. J Pharm Sci 1990; 79 (4): 321-325.
- Deepalatha C, Deshpande NA comparative study of phenazopyridine (pyridium) and cystone as short-term analgesic in uncomplicated urinary tract infection. Int J Pharm Sci 2011; 3 (2): 224-226.
- Petrov S.B., Slesarevskaya M.N., Chibirov K.H., Topuzov M.E., Kagan O.F., Voronova E.N. Efficiency and safety of phenazopyridine for treatment of uncomplicated urinary tract infection: result of multi-center, randomized, placebo-controlled, clinical study. Urologiia 2020; 3: 15-21. Russian (Петров С.Б., Слесаревская М.Н., Чибиров К.Х., Топузов М.Э., Каган О.Ф., Воронова Е.Н. Эффективность и безопасность феназопиридина в лечении неосложненной инфекции нижних мочевыводящих путей: результаты многоцентрового рандомизированного плацебо-контролируемого клинического исследования. Урология 2020; 3: 15-21). Doi: https://dx.doi.org/10.18565/urology.2020.3.15-21.
Материал подготовлен Шадеркиной В.А.









Комментарии