А.И. Горелов 1, 5 , А.С. Симбирцев 2 , Д.А. Журавский 1 , А.А. Горелова 3, 4
1ФГБОУ ВО «Санкт-Петербургский государственный университет», Санкт-Петербург;
2ФГУП «Государственный научно-исследовательский институт особо чистых биопрепаратов» ФМБА России, Санкт-Петербург;
3ФГБУ «Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии» Минздрава России, Санкт-Петербург;
4ФСПб ГБУЗ «Клиническая больница Святителя Луки», Санкт-Петербург; 5СПБ ГБУЗ «Городская Покровская больница», Санкт-Петербург
Введение
Рак мочевого пузыря (РМП) — пятое по распространенности онкологическое заболевание в США, на его долю приходится 74 000 новых случаев в год (4,5 % от всех новообразований), смертность составляет 16 000 в год. 75 % от числа всех случаев РМП приходится на неинвазивную форму, стандартом лечения которой является трансуретральная резекция (ТУР) стенки мочевого пузыря с адъювантной внутрипузырной терапией. У пациентов с высоким риском (T1, G3, CIS) единственный способ снижения частоты рецидивирования и прогрессирования представлен внутрипузырной БЦЖ-терапией [1]. Устойчивость к БЦЖ-терапии, токсичность, а также нехватка самих вакцин заставляет искать альтернативные агенты иммунотерапии РМП. Эта потребность вскоре может быть решена путем применения ингибиторов контрольных точек в качестве терапевтического подхода. Контрольные точки (checkpoints) препятствуют работе лимфоцитов и других клеток иммунной системы, что приводит к неконтролируемой пролиферации злокачественных клеток. Различные белки и рецепторы, такие как PD-1 (programmed cell death protein-1), PD-L1 (programmed death ligand-1), а также CTLA4 (cytotoxic T-lymphocyte associated protein-4), наиболее интересны для разработки методов лечения РМП. Уже имеются несколько утвержденных препаратов, ингибиторов PD-1, PD-L1, которые используют для лечения меланомы, немелкоклеточного рака легких (НМКРЛ), почечно-клеточного рака (ПКР) и др. В данном обзоре приводятся последние данные применения препаратов — ингибиторов PD-L1, PD-1 в качестве терапевтического агента рака мочевого пузыря.
Материалы и методы
Нами проведен расширенный поиск в MEDLINE/ Pubmed и Embase оригинальных статей, тезисов конференций, обзоров литературы на английском языке, опубликованных в период с 2015 по 2018 г., при помощи ключевых слов: БЦЖ-устойчивый РМП, PD-1, PD-L1, B7-H1, CD274, туберкулез, гранулема.
Результаты
Рождение иммунотерапии
В 1892 г. William B. Coley опубликовал сообщение о регрессии неоперабельной опухоли у молодой девушки с поверхностной стрептококковой инфекцией [2]. Он предположил наличие иммунного ответа против злокачественных клеток. W.B. Coley является пионером в иммунотерапии онкологических заболеваний. Он впервые стал использовать инъекции различных антигенов, названных «токсинами Колея», пациентам с нерезектабельными карциномами в надежде стимулировать иммунный ответ против опухоли. Впервые возможную связь между микобактериальной инфекцией и развитием противоопухолевого иммунитета обнаружил и описал Raymond Pearl [3]. Исследуя аутопсийный материал, он обнаружил, что пациенты, умершие от рака, редко имели туберкулез, в свою очередь, пациенты, страдающие туберкулезом, никогда не умирали от онкологического заболевания. Lloyd Old позже продемонстрировал, что у мышей, вакцинированных аттенуированной вакциной Mycobacterium bovis, имелся возможный противоопухолевый иммунитет [4]. Подобные эксперименты позволили начать клиническое применение иммунотерапии (БЦЖ-терапии) меланомы и в последующем РМП [5].
БЦЖ-терапия немышечно-инвазивного рака мочевого пузыря
В 1970-х гг. Alvaro Morales описал внутрипузырное применение вакцины БЦЖ при немышечно-инвазивном раке мочевого пузыря (НМИРМП) и отметил снижение рецидива у 7 из 10 пациентов [6]. В последующем БЦЖ-терапия стала стандартом лечения НМИРМП высокого риска, следующая за ТУР. Недавний метаанализ рандомизированных исследований продемонстрировал преимущество применения БЦЖ-терапии по сравнению с Митомицином С (снижение риска развития рецидива на 32 %) [7].
Точный механизм действия БЦЖ неизвестен. Возможно, он заключается в активации врожденного иммунитета, усилении синтеза цитокинов и цитотоксичности макрофагов. Приобретенный иммунный ответ включает в себя антитело-опосредованную иммунную реакцию и клеточный ответ с участием Т-лимфоцитов. Несмотря на успех БЦЖ-терапии, у 30 % пациентов развивается устойчивость к вакцине. У БЦЖ-нечувствительных пациентов «золотым стандартом» является радикальная цистэктомия. В последние годы возникла проблема нехватки в достаточном количестве агентов для создания вакцины. Вследствие этих сложностей существует необходимость поиска высокочувствительной терапии РМП, снижающей риски развития рецидива и прогрессии заболевания.
Механизмы опухолевой защиты
Иммунная система играет решающую роль в определении и контроле пролиферации опухолевых клеток. Опухолевые клетки способны вырабатывать различные механизмы защиты и уклонения от иммунного ответа. Например, меланома может влиять на экспрессию адгезивных молекул, что обусловливает снижение миграции эффекторных клеток к опухоли [8]. Опухоль также способна вырабатывать устойчивость к T-клеточному иммунному ответу. Меланома, рак молочной железы и шейки матки вырабатывают ингибитор сериновой протеазы, которая отвечает за апоптоз опухолевых клеток [9].
Ингибиторы контрольных точек
Был изучен альтернативный механизм взаимодействия иммунной системы и опухолевых клеток. Ингибиторы контрольных точек играют важную роль в устойчивой работе T-клеточного иммунного ответа. Одним из примеров таких ингибиторов является цитотоксический Т-лимфоцитассоциированный протеин (CTLA-4). CTLA-4 экспрессируется на Т-клетках, CTLA-4 конкурирует с рецептором CD28 за лиганд семейства B7 (B7-1 и B7-2). Однажды связавшись с лигандом B7, активированный комплекс CTLA-4 понижает Т-клеточную активность. Моноклональное антитело, направленное против CTLA-4, ипилимумаб, блокирует взаимодействие между CTLA-4 и его лигандом B7-2, демонстрируя противоопухолевую активность у пациентов с III и IV стадиями меланомы [10].
Белок PD-1
Активация PD-1 (CD279) схожа с механизмом CTLA-4, включая развитие каскада, который снижает иммунный ответ и аутоиммунную реакцию [11]. Путь активации состоит из рецептора PD-1 и его двух лигандов: PD-1 лиганд 1 (PD-L1, B7-H1, CD274) и PD-1 лиганд 2 (PD-L2, B7-DC, CD273). PD-L1 индуцируется с помощью антигенпредставляющих клеток (АПК), включающих T-лимфоциты, NK (натуральные киллеры), стволовые клетки, а также различные негемопоэтические клетки [12]. PD-L2 экспрессируется меньшей популяцией клеток, его экспрессия индуцируется при определенных условиях и все еще не до конца изучена.
PD-L1 и PD-L2 связывают рецептор PD-1, который экспрессируется на активированных T-лимфоцитах, а также АПК (макрофаги, дендритные клетки, B-лимфоциты) [13, 14]. PD-L1 взаимодействует с рецептором PD-1 на Т-лимфоците, что приводит к фосфорилированию иммунорецепторов в центральном домене PD-1. После этого фосфатазы SHP-1, SHP-2 взаимодействуют с киназным рецептором Т-лимфоцита, снижая продукцию цитокинов, активацию Т-лимфоцитов, а также таргетный лизис клеток (рис. 1) [15].
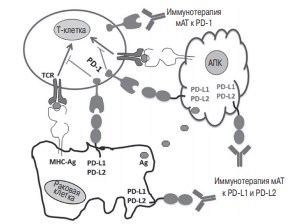
Рис. 1. Путь активации PD-1 [17]. Примечание: мАТ – моноклональные антитела, АПК – антигенпредставляющая клетка
Этот физиологический механизм может быть использован вирусами или злокачественными клетками с целью ухода от иммунного ответа, блокировка этого механизма может иметь терапевтическую цель [16].
Главный комплекс гистосовместимости (ГКГС, англ. MHC) экспрессируется на опухолевой клетке, АПК и другие иммунные клетки представляют антиген T-лимфоцитам. Последующая активация Т-клеточного рецепторного комплекса приводит к экспрессии PD-1 на поверхности Т-лимфоцита. PD-L1 и PD-L2 опухолевых клеток и АПК взаимодействуют с рецепторами PD-1, что приводит к супрессии иммунного ответа. Антитело-опосредованная блокада взаимодействия PD-1/PD-L1 может усилить иммунный ответ.
Эволюция иммунотерапии рака мочевого пузыря
Живая, аттенуированная вакцина БЦЖ (Bacillus Calmette-Guérin) представляет собой первый метод иммунотерапии рака мочевого пузыря и является стандартом лечения НМИРМП начиная с 1990 г. Современная иммунотерапия направлена на ингибиторы контрольных путей, которые препятствуют работе лимфоцитов и других клеток иммунной системы, что приводит к неконтролируемой пролиферации злокачественных клеток.
Различные белки и рецепторы, такие как PD-1 (programmed cell death protein-1), PD-L1 (programmed death ligand-1), а также CTLA4 (cytotoxic T-lymphocyte associated protein-4), наиболее интересны для разработки методов лечения РМП. Уже имеются несколько утвержденных препаратов, ингибиторов PD-1, PD-L1, которые применяются для лечения меланомы, НМКРЛ, ПКР и др. В данном обзоре представлены последние данные применения препаратов — ингибиторов PD-L1, PD-1 в качестве терапии РМП. Ингибиторы контрольных путей — эффективная альтернатива для пациентов, которым не показана платиносодержащая терапия. Уровень экспрессии PD-L1 ассоциирован с тяжестью течения РМП, а также с ответом на таргетную терапию. Было показано, что опухоль, экспрессирующая PD-L1 на опухолевых клетках, чаще была низкодифференцированной, у пациентов чаще возникал рецидив после операции, и они имели более низкую выживаемость [18]. Также высокий уровень экспрессии ассоциирован с устойчивостью к БЦЖ-терапии [19]. Последние исследования не определили различий в уровне экспрессии PD-L1 при инвазивных и неинвазивных формах РМП. Уровень экспрессии PD-L1 на мононуклеарных клетках иммунной системы предсказывает общую выживаемость у пациентов с отдаленными метастазами, которые получали химиотерапию. Иммунотерапия РМП показала свою эффективность из-за наличия активного иммунного ответа, опосредованного Т-лимфоцитами [20]. Ингибиторы контрольных путей применяются для лечения злокачественных заболеваний с 2012 г., однако первый доклад об эффективности их применения с целью лечения мышечно-инвазивного рака мочевого пузыря (МИРМП) был опубликован лишь в 2014 г. [21]. На сегодняшний день интерес к иммунотерапии РМП возрастает. Результаты последних исследований представлены в табл. 1 [22].
Таблица 1. Результаты недавних исследований ингибиторов PD-1/PD-L1 у пациентов с раком мочевого пузыря [22]
| Препарат | Название исследования | Фаза исследо вания | Доза препа рата | Факторы включения | Количество пациентов | Общий ответ на терапию (%) | Побочные эффекты |
| Атезолизумаб | IMvigor210 | 2 | 1200 мг в/в каждые 3 нед. | Неоперабельные, после терапии платиной, местнораспространенная/метастатическая уротели-альная карцинома | 310 | 16 | Слабость (31 %). тошнота (14 %) |
| Ниволумаб | CheckMate 032 | 1/2 | 3 мг/кг в/в каждые 2 нед. | Метастатическая уроте-лиальная карцинома после платиносодержащей терапии | 78 | 24 (у пациентов с экспрессией PD-L1 > 1 %) | Повышение уровня липазы (5,1 %), амилазы (3.8 %). слабость (2.6 %), уменьшение нейтрофилов (2.6 %) |
| Пембролизумаб | KEYNOTE-045 | 3 | 200 мг каждые 3 нед. | Метастатическая уротелиальная карцинома, ранее подвергавшаяся терапии | 542 | 21 | Зуд (20 %). слабость (14 %), тошнота (11 %). диарея (9 %) |
| Дурвалумаб | 1/2 | 10 мг/кг каждые 2 нед. | Неоперабельный/ метастатический рак мочевого пузыря | 61 | 31 (общий ответ), 46(при экспрессии PD-L1). 0 (при отсутствии экспрессии PD-L1) | Слабосгь (13%). тошнота (10 %). диарея (8 %) | |
| Авслумаб | JAVELIN Solid Tumor | lb | 10 мг/кг в/в каждые 2 нед. | Метастатическая уроте-лиальная карцинома | 129 | 17 (общий от-вег), 50 (при экспрессии PD-L1) | Реакции,связанные с ин-фузией (23 %). слабость (15 %) |
Атезолизумаб
Атезолизумаб (MPDL3280A, atezolizumab) является первым ингибитором PD-L1, показавшим эффективность в отношении РМП [23]. Данное моноклональное антитело было одобрено FDA в мае 2016 г., ожидается одобрение препарата в Европе. Изначально атезолизумаб исследовался в качестве терапии НМКРЛ, был одобрен в 2016 г. На сегодняшний день не завершены испытания в отношении ПКР, меланомы и триплетнегативного рака молочной железы.
Рандомизированное клиническое исследование IMvigor 210 (NCT02108652) (2-я фаза), включающее неоперабельных пациентов (n = 310) с местным или распространенным рецидивом уротелиальной карциномы, послужило основой для одобрения атезолизумаба FDA. Данное исследование показало, что 16 % пациентов отвечали на терапию (objective response rate, ORR), у 28 % из ORR имели 5 % уровень экспрессии PD-L1 иммунными клетками через 1,5 года наблюдения [24, 25]. Одногодичная общая выживаемость пациентов с 5 % экспрессией PD-L1 иммунными клетками составила 50 %, что на 16 % выше, чем в общей популяции [24, 25].
Другое исследование демонстрирует эффективность и безопасность атезолизумаба. В исследование включено 68 пациентов с метастатическим уротелиальным раком, из которых 93 % получали цисплатин. После 6-недельного наблюдения 50 % респондентов с высоким уровнем экспрессии PD-L1 (91,7 %) имели ответ на лечение. Атезолизумаб показал свою эффективность у отобранных пациентов по сравнению с другой спасательной терапией [26].
На основании этих и других клинических испытаний атезолизумаб был одобрен FDA в качестве лекарственного средства рецидивирующего или метастатического уротелиального рака у пациентов с прогрессией после химиотерапии препаратами платины.
Ниволумаб
Ниволумаб представляет собой моноклональное антитело белка PD-1, считается первым в мире примененным ингибитором PD-1. В 2014 г. в Японии впервые использовали ниволумаб с целью лечения нерезектабельной меланомы. Данное лекарственное средство было в скором порядке одобрено FDA, в США применяется для лечения метастатической меланомы с декабря 2014 г., НМКРЛ с марта 2015 г., ПКР с ноября 2015 г., лимфомы Ходжкина с мая 2016 г., чешуеклеточного рака головы и шеи с ноября 2016 г. Ниволумаб с недавнего времени (2017) используется при прогрессировании уротелиальной карциномы (через год после первой линии платиносодержащей терапии) [27].
Недавнее нерандоминизированное исследование (фаза 1–2) CheckMate 032 (NCT01928394) ниволумаба (3 мг/гк в/в), который получали пациенты (n = 78) с метастатической уротелиальной карциномой, показало 24 % ORR с уровнем экспрессии PD-L1 1 % на злокачественных клетках, общая выживаемость составила 9,7 месяца [28].
Исследование CheckMate 275 (NCT02387996) по применению ниволумаба у пациентов (n = 265) с метастатической уротелиальной карциномой после первичной терапии продемонстрировало ORR19,6 % из общего числа, 16,1 % у пациентов с низким уровнем экспрессии PD-L1 (< 1 %) и 28,4 % у пациентов с экспрессией PD-L1 более 5 %, средний период наблюдения составил 7 месяцев [29].
Пембролизумаб
Пембролизумаб — моноклональное антитело PD-1 рецептора, было одобрено FDA в сентябре 2014 г. в США, в июле 2015 г. — в Европе для лечения прогрессирования меланомы. В октябре 2015 г. пембролизумаб был одобрен в качестве препарата для лечения НМКРЛ с отдаленными метастазами, в октябре 2016 г. — в качестве первой линии терапии НМКРЛ. В августе 2016 г. был одобрен для лечения чешуеклеточного рака головы и шеи. В феврале 2017 г. появились первые исследования применения пембролизумаба при уротелиальной карциноме в качестве первой линии у пациентов, которым не подходит терапия цисплатином, и в качестве второй линии у пациентов с прогрессией либо после платиносодержащей терапии [30].
Эффективность блокировки комплекса PD-L1/ PD-1 при РМП была изучена в ходе нескольких клинических испытаний. В фазу 1b клинического исследования, которое изучало ингибитор PD-1 — пембролизумаб (Pembro; MK-3475), было включено 33 пациента с рецидивирующим либо распространенным РМП с частотой экспрессии PD-L1 41 % [31]. Наблюдение длилось 11 месяцев, из всех наблюдаемых у 10 % регистрировался полный ответ на терапию, общая выживаемость составила 9,3 месяца. У 61 % отмечались побочные эффекты: общая слабость (n = 6), периферические отеки (n = 4) и тошнота (n = 3).
Другое исследование KEYNOTE-012 (NCT01848834) изучало применение пембролизумаба (10 мг/кг каждые 2 недели) в качестве второй линии у пациентов с прогрессированием уротелиального рака (n = 28). Исследование (фаза 1b) продемонстрировало следующие результаты: за 12-месячный срок наблюдения ORR составил 25 % из числа всех пациентов, 38 % среди PD-L1-позитивных пациентов (> 1 % экспрессии на клетках опухоли) [32]. Самыми частыми побочными эффектами (18 %) были усталость, периферические отеки (12 %) и тошнота (9 %). 15 % пациентов имели 3–5 побочных эффектов, у одного пациента развился рабдомиолиз [33].
Третья фаза рандомизированного клинического исследования KEYNOTE-045 (NCT02256436), в котором сравнивали эффективность пембролизумаба (200 мг каждые 3 недели) с химиотерапией у пациентов с метастатическим уротелиальным раком, показала общую выживаемость 10,3 месяца в группе пембролизумаба и 7,4 месяца при химиотерапии. Эффективность оценивали без учета уровня экспрессии PD-L1 [34]. ORR был также выше в группе пембролизумаба (21,1 против 11,4 %, p = 0,0011).
Перспективы терапии ингибиторами PD-L1/PD-1
В ограниченной серии клинических испытаний ингибиторов PD-L1/PD-1 была продемонстрирована их эффективность в качестве спасательной терапии рефрактерного либо метастатического уротелиального рака. Понимание механизмов взаимодействия рецептора PD-1 и его лиганда поможет выработать подход к лечению рака на более ранних стадиях. Boorjian et al. установили наличие прямой корреляции между уровнем экспрессии гликопротеина B7-H3 при уротелиальной опухоли и белка PD-1. Экспрессия PD-L1, B7-H3 и PD-1 уротелиальной опухолью и метастатической лимфоидной тканью имеет сходство [18]. Если метастатическая опухоль отвечает на системную иммунотерапию, значит, первичная опухоль имеет то же гистологическое строение. При НМИРМП ингибиторы PD-1 могут увеличивать эффективность БЦЖ-терапии. В случае МИРМП ингибиторы могут применяться в качестве более эффективной нео-, адъювантной химиотерапии у определенных пациентов.
PD-L1 как прогностический биомаркер
PD-L1 может применяться в качестве биомаркера при различных опухолях в урологии. Из всех пациентов, подвергшихся радикальной нефрэктомии по поводу ПКР, 24 % показали наличие экспрессии PD-L1 при гистологическом исследовании. У этих пациентов был значимо более высокий риск смерти от ПКР [35]. Экспрессия PD-L1 предвещает низкий ответ на терапию при меланоме, раке яичников, раке легких, однако роль PD-L1 в качестве прогностического фактора РМП остается малоизученной [36].
Из 56 случаев радикальной цистэктомии в 17 % наблюдалась экспрессия PD-L1, что приводило к снижению числа CD8 Т-лимфоцитов [37]. Несмотря на то, что повышенная плотность CD8 T-лимфоцитов увеличивает онкоспецифическую выживаемость, не было найдено взаимосвязи между общей выживаемостью и экспрессией PD-L1 [37]. J. Bellmunt et al. ретроспективно провели исследование 160 гистологических материалов пациентов, подвергшихся ТУР стенки мочевого пузыря либо радикальной цистэктомии. В подгруппе пациентов с метастатическим поражением, получавших терапию препаратами платины (n = 100), экспрессия PD-L1 связана с повышением общей выживаемости (18 месяцев) [38].
Другие исследования демонстрируют различные результаты взаимосвязи уровня экспрессии PD-L1 с клиническим ответом. В когорте пациентов (n = 318), подвергшихся радикальной цистэктомии, уровень экспрессии PD-L1 опухолевыми клетками и Т-лимфоцитами был более 5 %. Уровень экспрессии PD-L1 коррелировал с более высокой стадией заболевания. Экспрессия PD-L1 опухолью предсказывала все виды выживаемости, а не только раковоспецифическую у пациентов после радикальной цистэктомии в случае нераспространенного процесса [18].
Несколько исследований демонстрируют PD-L1 в качестве надежного прогностического биомаркера. Среди пациентов (n = 65) с уротелиальной карциномой, подвергшихся как нефроуретерэктомии, радикальной цистэктомии, так и ТУР, более 12,2 % пациентов с экспрессией PD-L1 были ассоциированы с низкой степенью дифференцировки опухоли и низким уровнем безрецидивной выживаемости [39]. Многомерная регрессионная модель подтвердила, что уровень экспрессии PD-L1 опухолью связан со степенью дифференцировки опухоли [19]. Wang et al. сравнили патологоанатомические образцы опухоли 50 пациентов РМП с 10 контрольными. Они определили, что 10 % уровень экспрессии PD-L1 ассоциирован с низкой дифференцировкой, мышечной инвазией, а также с меньшей общей выживаемостью [40].
Различные и зачастую противоречивые результаты, представленные выше, подтверждают сложность определения взаимосвязи между уровнем экспрессии PD-L1 и клинико-морфологическим ответом.
Заключение
Наступает новая эра иммунотерапии. Открытие ингибиторов контрольных точек в этом веке дает надежду пациентам, которые раньше имели низкие шансы на эффективное лечение, включая пациентов с противопоказаниями к проведению цисплатиносодержащей терапии. Цисплатин известен тем, что он обладает нефро-, ототоксичностью, часто вызывает рвоту [41]. Ингибиторы PD-L1 представляются достаточно надежной альтернативой с безопасным профилем. В данный момент проводятся многочисленные исследования для определения показаний к применению новых методов иммунотерапии.
Критерии оценки должны быть стандартизированы, чтобы избежать неоднозначных результатов в ходе подготовки гистологического препарата и проведения ИГХ-исследования. Есть несколько вопросов, на которые еще предстоит ответить: 1) может ли PD-L1 служить надежным маркером прогрессии опухоли; 2) следует ли применять иммунотерапию у пациентов с отрицательным результатом экспрессии PD-L1; 3) ингибиторы PD-L1 лишь снижают частоту прогрессирования или могут быть применены на ранних стадиях заболевания; 4) какова надежность иммунотерапии; а также 5) целесообразно ли комбинировать CTLA-4- и PD-1-блокаторы в качестве таргетной терапии?
Сегодня уже нет сомнений, что иммунотерапия изменит стандарт лечения рака мочевого пузыря.
Литература
- Sylvester RJ, van der MA, Lamm DL. Intravesical bacillus Calmette-Guerin reduces the risk of progression in patients with superficial bladder cancer: a meta-analysis of the published results of randomized clinical trials. J Urol. 2002;168:1964-1970. doi: 10.1097/00005392-200211000-00016.
- Starnes CO. Coley’s toxins in perspective. Nature 1992; 357(6373):11-12. doi: 10.1038/360023b0.
- Pearl R. Cancer and tuberculosis. Am J Epidem. 1929;9(1):97-159. doi: 10.1093/oxfordjournals.aje.a121646.
- Old LJ, Clarke, DA, Benacerraf B. Effect of Bacillus CalmetteGuérin Infection on Transplanted Tumours in the Mouse. Nature. 1959;184(4682):291-292. doi: 10.1038/184291a0.
- Baker M, Taub R. BCG in malignant melanoma. Lancet. 1973; 301(7812):1117-1118. doi: 10.1016/s0140-6736(73)90423-6.
- Herr HW, Morales A. History of Bacillus Calmette-Guerin and Bladder Cancer: An Immunotherapy Success Story. J Urol. 2008;179(1),53-56. doi: 10.1016/j.juro.2007.08.122.
- MalmströmP, Sylvester R. POD-7.08: Intravesical Mitomycin C Versus Bacillus Calmette-Guérin for Non-muscleInvasive Bladder Cancer: An Individual Patient Data Meta-analysis of Randomized Studies. Urology. 2008;72(5):S57. doi: 10.1016/j.urology.2008.08.161.
- Weishaupt C, Munoz KN, Buzney E, et al. T-Cell Distribution and Adhesion Receptor Expression in Metastatic Melanoma. Clinical Cancer Research. 2007;13(9): 2549-2556. doi: 10.1158/1078- 0432.ccr-06-2450.
- Medema JP, de Jong J, Peltenburg LTC, et al. Blockade of the granzyme B/perforin pathway through overexpression of the serine protease inhibitor PI-9/SPI-6 constitutes a mechanism for immune escape by tumors. Proceedings of the National Academy of Sciences. 2001;98(20):11515-11520. doi: 10.1073/ pnas.201398198.
- Wolchok JD, Neyns B, Linette G, et al. Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, double-blind, multicentre, phase 2, dose-ranging study. Lancet Oncology. 2010;11(2):155-164. doi: 10.1016/s1470-2045(09)70334-1.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer. 2012;12(4):252-264. doi: 10.1038/nrc3239.
- Keir ME, Butte MJ, Freeman G, et al. PD-1 and its Ligands in Tolerance and Immunity. Annual Review of Immunology. 2008;26(1):677-704. doi: 10.1146/annurev.immunol.26.021607.090331.
- Shibahara K, Asano M, Ishida Y, et al. Isolation of a novel mouse gene MA-3 that is induced upon programmed cell death. Gene. 1995;166(2):297-301. doi: 10.1016/0378-1119(95)00607-9.
- Boussiotis VA, Chatterjee P, Li L. Biochemical Signaling of PD-1 on T Cells and Its Functional Implications. The Cancer Journal. 2014;20(4):265-271. doi: 10.1097/ppo.0000000000000059.
- Francisco L, Salinas V, Brown K, et al. PD-L1 Regulates the Development, Maintenance and Function of Induced-regulatory T Cells. Clinical Immunology. 2009;131,S45. doi: 10.1016/j. clim.2009.03.126.
- Ohaegbulam KC, Assal A, Lazar-Molnar E, et al. Human cancer immunotherapy with antibodies to the PD-1 and PD-L1 pathway. Trends in Molecular Medicine. 2015;21(1):24-33. doi: 10.1016/j. molmed.2014.10.009.
- Zhou TC, Sankin AI, Porcelli SA, et al. A review of the PD-1/ PD-L1 checkpoint in bladder cancer: From mediator of immune escape to target for treatment Urologic Oncology: Seminars and Original Investigations. 2017;35(1):14-20. doi: 10.1016/j. urolonc.2016.10.004.
- Boorjian SA, Sheinin Y, Crispen PL, et al. T-Cell Coregulatory Molecule Expression in Urothelial Cell Carcinoma: Clinicopathologic Correlations and Association with Survival. Clinical Cancer Research. 2008;14(15),4800-4808. doi: 10.1158/1078-0432. ccr-08-0731.
- Inman BA, Sebo TJ, Frigola X, et al. PD-L1 (B7-H1) expression by urothelial carcinoma of the bladder and BCG-induced granulomata. Cancer. 2007;109(8):1499-1505. doi: 10.1002/cncr.22588.
- Zibelman M, Ramamurthy C, Plimack ER Emerging role of immunotherapy in urothelial carcinoma – Advanced disease. Urologic Oncology: Seminars and Original Investigations. 2016;34(12):538-547. doi: 10.1016/j.urolonc.2016.10.017.
- Bellmunt J, Petrylak DP, Powles T, et al. Inhibition of PD-L1 by mpdl3280a leads to clinical activity in pts with metastatic urothelial bladder cancer (UBC). Annals of Oncology. 2014;25(Suppl.4):iv280. doi: 10.1093/annonc/mdu337.1.
- Bellmunt J, Powles T, Vogelzang NJ. A review on the evolution of PD-1/PD-L1 immunotherapy for bladder cancer: The future is now. Cancer Treatment Reviews. 2017;54:58-67. doi: 10.1016/j. ctrv.2017.01.007.
- Mann JE Atezolizumab (Tecentriq®). Oncology Times. 2017;39(4):31. doi: 10.1097/01.cot.0000513325.52233.f1.
- Loriot Y, Rosenberg JE, Powles TB, et al. Atezolizumab (atezo) in platinum (plat)-treated locally advanced/metastatic urothelial carcinoma (mUC): Updated OS, safety and biomarkers from the Ph II IMvigor210 study. Annals of Oncology. 2016;27(Suppl.6): doi: 10.1093/annonc/mdw373.11.
- Rosenberg J, Petrylak D, Abidoye O, et al. Atezolizumab in patients (pts) with locally-advanced or metastatic urothelial carcinoma (mUC): Results from a pivotal multicenter phase II study (IMvigor 210). European Journal of Cancer. 2015;51:S720. doi: 10.1016/s0959-8049(16)31942-6.
- Sonpavde G, Sternberg CN, Rosenberg JE, et al. Second-line systemic therapy and emerging drugs for metastatic transitional-cell carcinoma of the urothelium. The Lancet Oncology. 2010;11(9):861-870. doi: 10.1016/s1470-2045(10)70086-3.
- Daskivich TJ, Belldegrun A. Safety, Activity, and Immune Correlates of Anti-PD-1 Antibody in Cancer. European Urology. 2015;67(4):816-817. doi: 10.1016/j.eururo.2014.12.052.
- Sharma P, Callahan MK, Bono P, et al. Nivolumab monotherapy in recurrent metastatic urothelial carcinoma (CheckMate 032): a multicentre, open-label, two-stage, multi-arm, phase 1/2 trial. The Lancet Oncology. 2016;17(11):1590-1598. doi: 10.1016/ s1470-2045(16)30496-x.
- Galsky MD, Retz M, Siefker-Radtke AO, et al Efficacy and safety of nivolumab monotherapy in patients with metastatic urothelial cancer (mUC) who have received prior treatment: Results from the phase II CheckMate 275 study. Annals of Oncology. 2016;27 (suppl.6). doi: 10.1093/annonc/mdw435.24.
- Hamid O, Robert C, Daud A,etal. Safetyand Tumor Responses with Lambrolizumab (Anti-PD-1) in Melanoma. New England Journal of Medicine. 2013;369(2):134-44. doi: 10.1056/nejmoa1305133.
- Plimack ER, Gupta S, Bellmunt J, et al. Phase 1b study of pembrolizumab (pembro;mk-3475) in patients (RTS) with advanced urothelial tract cancer. Annals of Oncology. 2014;25(Suppl.4). doi: 10.1093/annonc/mdu438.24.
- O’Donnell PH, Plimack ER, Bellmunt J, et al. Pembrolizumab (Pembro;MK-3475) for advanced urothelial cancer: Results of a phase IB study. Journal of Clinical Oncology. 2015;33(Suppl.7): 296-296. doi: 10.1200/jco.2015.33.7_suppl.296.
- Gupta S, O’Donnell P, Plimack ER, et al. A phase 1b study of pembrolizumab (Pembro;MK-3475) for advanced urothelial cancer.The Journal of Urology. 2015;193(4):e861-e862. doi: 10.1016/j. juro.2015.02.2473.
- Necchi A, Bellmunt J, De Wit R, et al. Pembrolizumab vs investigator-choice chemotherapy for previously treated advanced urothelial cancer: Phase 3 KEYNOTE-045 study. European Journal of Cancer. 2017;72:S2. doi: 10.1016/s0959-8049(17)30092-8.
- Thompson RH, Leibovich BC, Dong H,etal. Tumor B7-H1 is Associated with Poor Prognosis in Renal Cell Carcinoma Patients with Long Term Follow-Up. The Journal of Urology. 2006;175(4):126. doi: 10.1016/s0022-5347(18)32642-9.
- Tang F, Zheng P. Tumorcellsversus host immunecells: whose PD-L1 contributes to PD-1/PD-L1 blockade mediated cancer immunotherapy? Cell & Bioscience. 2018;8(1). doi: 10.1186/s13578-018-0232-4.
- Faraj SF, Munari E, Guner G, et al. Assessment of Tumoral PD-L1 Expression and Intratumoral CD8+ T Cells in Urothelial Carcinoma. Urology. 2015;85(3):703.e1-703.e6. doi: 10.1016/j. urology.2014.10.020.
- Bellmunt J, Mullane SA, Werner L, et al. Association of PD-L1 expression on tumor-infiltrating mononuclear cells and overall survival in patients with urothelialcarcinoma. Annals of Oncology. 2015;26(4):812-817. doi: 10.1093/annonc/mdv009.
- Nakanishi J, Wada Y, Matsumoto K, et al. Overexpression of B7-H1 (PD-L1) significantly associates with tumor grade and postoperative prognosis in human urothelial cancers. Cancer Immunology, Immunotherapy. 2006;56(8):1173-1182. doi: 10.1007/ s00262-006-0266-z.
- Wang Y, Zhuang Q, Zhou S, et al. Costimulatory molecule B7-H1 on the immune escape of bladder cancer and its clinical significance. Journal of Huazhong University of Science and Technology [Medical Sciences], 2009;29(1):77-79. doi: 10.1007/s11596- 009-0116-2.
- Prestayko AW, D’Aoust JC, Issell BF, et al. Cisplatin (cis-diamminedichloroplatinum II). Cancer Treatment Reviews. 1979;6(1): 17-39. doi: 10.1016/s0305-7372(79)80057-2.
Статья опубликована в журнале "Урологические ведомости" 2018 №2, стр. 64-72









Комментарии