Г.Г. Кривобородов1, 2 , А.П. Ракша1, 3 , Н.С. Ефремов1, 2 , А.Д. Болотов1, 2 , Т.Н. Сотникова1, 3
1ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва;
2Российский геронтологический научно-клинический центр, Москва; 3 ГБУЗ «Городская клиническая больница № 1 им. Н.И. Пирогова Департамента здравоохранения г. Москвы»
Введение
У здоровых мужчин предстательная железа на 70 % состоит из железистых элементов и на 30 % из фиброзно-мышечной стромы. После 40 лет у мужчин начинает развиваться доброкачественная гиперплазия предстательной железы (ДГПЖ). Частота последней составляет более 50 % к 60 годам и 90 % к 85-летнему возрасту [1]. При этом структурные изменения в периуретральной и транзиторной зонах предстательной железы характеризуются гиперплазией стромальной и железистой ткани [2–4]. ДГПЖ вызывает инфравезикальную обструкцию (ИВО), что приводит к нарушению акта мочеиспускания. Обструктивные симптомы нижних мочевыводящих путей (СНМП) при ДГПЖ связаны с так называемыми статическим и динамическим компонентами ИВО. Статический компонент ИВО обусловлен механическим сдавлением простатического отдела уретры гиперплазированной тканью, а динамический компонент — спазмом гладкомышечной ткани пузырно-уретрального сегмента.
Первым вариантом лечения СНМП при ДГПЖ являются α1-адреноблокаторы, которые расслабляют гладкомышечные клетки предстательной железы и шейки мочевого пузыря и уменьшают динамический компонент ИВО. Для снижения статического компонента ИВО используют ингибиторы фермента 5α-редуктазы, который превращает гормон тестостерон в дегидротестостерон. Последний отвечает за рост стромального компонента ДГПЖ. В 1985 г. японскими учеными для описания характера внутрипузырного роста ДГПЖ был предложен ультразвуковой показатель, получивший название интравезикальной простатической протрузии (ИПП) [5]. Дальнейшие исследования продемонстрировали, что мужчины с ИПП 10 мм и более чаще имеют ИВО [6]. Кроме того, мужчины с высокой степенью ИПП в меньшей степени отвечают на консервативную терапию α1-адреноблокаторами [7, 8]. Также не было выявлено достоверного уменьшения размеров ИПП после курса лечения ингибитором 5α-редуктазы (дутастеридом), несмотря на снижение объема предстательной железы [9]. В связи с этим для определения возможных причин недостаточной эффективности медикаментозной терапии СНМП при размерах ИПП 10 мм и более представляется целесообразным морфологическое исследование ткани предстательной железы.
Цель исследования — выявление и оценка особенностей морфологического строения зоны ИПП у мужчин с ДГПЖ.
Материалы и методы
Образцы ткани для морфологического исследования забирали при трансуретральной резекции по поводу ДГПЖ у 30 больных в период с 2015 по 2017 г. Ранее терапия СНМП у них включала только α1-адреноблокаторы. До операции всем больным проводили стандартное урологическое обследование согласно принятым клиническим рекомендациям Российского общества урологов [10]. Оно включало: лабораторные анализы, анкетирование (I-PSS), ультразвуковое исследование мочевыводящих путей с определением величины ИПП и урофлоуметрию. По результатам обследования у всех 30 больных установлена клиническая форма ДГПЖ, требующая выполнения оперативного вмешательства. На основании величины ИПП все больные были разделены на две группы. Первую группу составили 12 больных с ИПП менее 10 мм, а вторую группу — 18 мужчин с ИПП 10 мм и более. Во время трансуретральной резекции ДГПЖ для морфологического исследования получали кусочки ткани зоны ИПП. Последнюю определяли как вдающийся в области шейки мочевого пузыря участок предстательной железы, расположенный на 6 часах условного циферблата. Для светооптического изучения гистологические препараты окрашивали гематоксилином и эозином и по Ван-Гизону. Световую микроскопию и денситоморфометрию проводили с помощью телевизионного анализатора изображения МЕКОС-Ц2 и программного обеспечения МЕКОС-ВА. Патоморфологическое исследование включило оценку стромального и железистого компонентов, а также фиброзной ткани и мышечных волокон стромы из зоны ИПП. Статистическую обработку квантифицированных результатов гистохимического исследования микропрепаратов выполняли путем вычисления средних значений показателей, стандартного отклонения, минимальных и максимальных значений при подтверждении нормального распределения. Различия между группами оценивались с использованием t-критерия Стьюдента. Достоверным считались значения р < 0,05.
Результаты
Среднее значение возраста мужчин первой группы составило 69,5 ± 7,7 года (от 54 до 81 года). Во второй группе этот показатель был равен 70 ± 9,5 года (от 56 до 90 лет). Средние значения объема предстательной железы и величины ИПП у больных первой группы составили 65,3 ± 19,4 см3 (от 36,6 до 98 см3 ) и 6,3 ± 2,1 мм (от 2,5 до 9,1 мм) соответственно. У больных второй группы средние значения вышеуказанных показателей составили 74,6 ± 19,6 см3 (от 46,3 до 107 см3 ) и 15,4 ± 4,9 мм (от 10,3 до 28 мм) (табл. 1).
По результатам морфологического исследования (после окрашивания гематоксилином и эозином) образцов ткани предстательной железы получены следующие результаты: в первой группе доля стромального компонента в зоне ИПП составила 96,0 ± 1,5 % (от 90 до 100 %), во второй группе доля стромального компонента в зоне ИПП оказалась равной 77,5 ± 11,0 % (от 25 до 100 %) (рис. 1). Доля железистого компонента в группе с ИПП менее 10 мм составила 4,0 ± 1,5 % (от 0 до 10 %), в группе с ИПП 10 мм и более — 22,5 ± 11,0 % (от 0 до 75 %). Статистическая обработка полученных данных свидетельствует о значимых различиях показателей доли стромального и доли железистого компонентов в зоне ИПП между группами (p = 0,044).
При окрашивании образцов ткани предстательной железы по Ван-Гизону был проведен анализ распределения мышечных и фиброзных элементов стромы. У больных первой группы доля мышечного компонента стромы в зоне ИПП составила 65,5 ± 16,9 % (от 1 до 90 %), а у больных второй группы — 56,7 ± 16,4 % (от 30 до 90 %) (табл. 2, рис. 2). Различия между долями мышечного компонента стромы оказались статистически недостоверными (p = 0,45).
Обсуждение
СНМП у мужчин могут быть вызваны ИВО, возникающей постепенно по мере увеличения предстательной железы вследствие ее доброкачественной гиперплазии. Как известно, ДГПЖ развивается в периуретральных и транзиторных зонах предстательной железы и представляет собой эпителиальную (железистую) и стромальную пролиферацию вследствие нарушения запрограммированной клеточной гибели [11]. ДГПЖ требует наличия тестикулярных андрогенов. В клетках предстательной железы стероидный фермент 5α-редуктаза, локализованный на ядерной мембране, превращает тестостерон в дигидротестостерон. Последний затем связывается со специфическими участками ДНК, что приводит к увеличению транскрипции андрогензависимых генов и, как следствие, к повышению синтеза белков [12]. Существуют два типа фермента 5α-редуктазы, расположенных на разных генах [13]. Первый тип фермента является экстрапростатическим и определяется преимущественно в коже и печени. Второй тип фермента является, напротив, преимущественно простатическим, хотя также может определяться в экстрапростатических тканях. Именно 2-й тип фермента играет ключевую роль в процессе роста и развития как самой предстательной железы, так и ее доброкачественной гиперплазии в дальнейшем [14]. Иммуногистохимические исследования указывают на преимущественно стромальную экспрессию 2-го типа фермента 5α-редуктазы [15]. Таким образом, стромальные клетки имеют определяющее значение в андрогензависимом росте предстательной железы. J. McNeal на основании морфологических исследований показал, что на ранних стадиях развития ДГПЖ в периуретральной зоне преобладает стромальный компонент. Существует точка зрения, что по мере роста ДГПЖ уменьшается доля стромальной ткани, а содержание железистого компонента увеличивается, причем эти изменения у каждого конкретного больного происходят в различных соотношениях. Полученные данные очень важны для выбора правильной тактики лечения СНМП вследствие ДГПЖ.
Таблица 1. Средние значения возраста, объема предстательной железы и интравезикальной простатической протрузии у больных доброкачественной гиперплазией предстательной железы
| Показатель | ИПП менее 10 мм (и = 12) | ИПП 10 мм и более (и = 18) |
| Возраст, лет | 69,5 ± 7.7 (от 54 до 81) | 70 ± 9,5 (от 56 до 90) |
| Объем предстательной железы, см3 | 65,3 ± 19,4 (от 36,6 до 98) | 74,6 ± 19,6 (от 46,3 до 107) |
| ИПП, мм | 6,3 ± 2,1 (от 2,5 до 9,1) | 15,4 ± 4,9 * (от 10,3 до 28) |
Примечание: достоверные различия при р < 0,05
Таблица 2. Морфологические показатели в зоне интравезикальной простатической протрузии у больных доброкачественной гиперплазией предстательной железы
| Показатель | ИПП менее 10 мм (л = 12) | ИПП 10 мм и более (л = 18) |
| Стромальный компонент в зоне ИПП, % | 96.0 ± 1.5 (от 90 до 100) | 77,5 ± 11.0 ‘ (от 25 до 100) |
| Железистый компонент в зоне ИПП, % | 4,0 ± 1,5 (от 0 до 10) | 22,5 ± 11,0 ‘ (отО до 75) |
| Мышечный компонент стромы в зоне ИПП. % | 65,5 ± 16,9 (от 1 до 90) | 56,7 ± 16,4 (от 30 до 90) |
Примечание: достоверные различия при р < 0,05
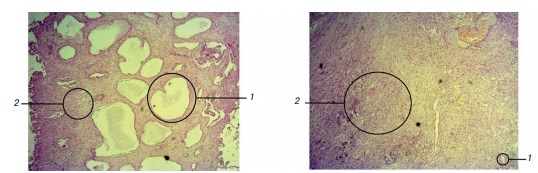
Рис. 1. Морфологическая картина доброкачественной гиперплазии предстательной железы в зоне интравезикальной простатической протрузии: а — преобладание железистого компонента; б — преобладание стромального компонента. 1 — железы, 2 — строма (окраска гематоксилином и эозином, увеличение ×40)
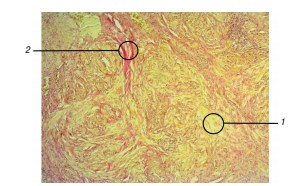
Рис. 2. Морфологическая картина стромы в зоне интравезикальной простатической протрузии при окрашивании по Ван-Гизону (увеличение ×40): 1 — фиброзные волокна (окрашены в желтый цвет), 2 — мышечные волокна (окрашены в красный цвет)
Медикаментозная терапия уроселективными α1-адреноблокаторами, которые устраняют динамический компонент ИВО вследствие расслабления гладкомышечных волокон пузырно-уретрального сегмента, а также ингибиторы 5α-редуктазы, снижающие статический компонент ИВО за счет уменьшения объема аденоматозных узлов, — первый вид лечения СНМП при ДГПЖ. При этом бывает трудно прогнозировать результаты медикаментозного лечения. Существует точка зрения, что эффективность лечения во многом зависит от наличия ИВО и сократительной способности мочевого пузыря. В то же время нельзя не принимать во внимание тот факт, что эффективность медикаментозной терапии во многом может быть предопределена структурными изменениями в ткани ПЖ при ДГПЖ в разные периоды развития. В связи с этим мы предприняли собственное исследование, направленное на изучение гистологических особенностей ДГПЖ. В зависимости от величины ИПП больные были разделены на две группы. Первую группу составили 12 мужчин с показателем ИПП менее 10 мм, а вторую — 18 мужчин с ИПП 10 мм и более. Несмотря на то что пациенты второй группы были старше и имели несколько большее среднее значение объема предстательной железы, статистически достоверно группы больных по этим показателям не различались. По результатам морфологического исследования нами было установлено статистически значимое снижение содержания стромальных элементов в зоне ИПП у больных второй группы. Дальнейший анализ стромального компонента в отношении процентного содержания в нем мышечной и фиброзной ткани не выявил статистически значимых различий. В то же время обращает на себя внимание четкая тенденция снижения доли мышечных волокон в зоне ИПП при ее значениях 10 мм и более. Наши данные согласуются с результатами K. Hirayama et al., которые отметили относительное увеличение железистого и снижение стромального компонентов в образцах резецированной ДГПЖ по мере увеличения ИПП [16]. Необходимо обратить внимание на то, что в этой работе образцы тканей ДГПЖ из зоны ИПП были получены после приема пациентами в течение 6 месяцев ингибиторов 5α-редуктазы. Включенные в настоящее исследование мужчины ранее не принимали ингибиторы 5α-редуктазы, что может объяснять различия в числовых показателях.
На наш взгляд, полученные результаты свидетельствуют об увеличении железистых структур и уменьшении мышечного компонента стромы у больных с ИПП 10 мм и более, а также могут объяснить один из механизмов более низкой эффективности медикаментозного лечения уроселективными α1-адреноблокаторами и ингибиторами 5α-редуктазы. Несомненно, что тенденция к уменьшению доли мышечного компонента стромы у пациентов с ИПП 10 мм и более обусловливает более низкую эффективность медикаментозной терапии уроселективными α1-адреноблокаторами в этой группе пациентов. Однако, вероятнее всего, наибольший вклад в возникновение нарушений мочеиспускания у мужчин с ИПП 10 мм и более вносят анатомические особенности формы внутрипузырного отдела предстательной железы. Существует мнение, что возникновение ИВО на фоне увеличения ДГПЖ во многом зависит от эластичности псевдокапсулы предстательной железы и ее фасциального окружения. При их большой растяжимости увеличение предстательной железы зачастую происходит латерально, при меньшей растяжимости — внутрь мочевого пузыря. Отсутствие фасциального окружения в зоне шейки мочевого пузыря объясняет пролабирование основания предстательной железы и формирование выраженной ИПП. Так, считается, что при больших показателях ИПП внутрипузырный отдел предстательной железы во время мочеиспускания может поддаваться радиальному сдавливанию внутрипузырным давлением. Это приводит к сужению простатического отдела уретры и возникновению эффекта «шарового клапана», лежащего в основе развития ИВО [17].
Стоит сказать о том, что эффективность консервативной терапии при различных показателях ИПП зависит от большого числа факторов, как анатомических и морфологических, так и динамических и функциональных. Нельзя объяснить единым механизмом все возможные нарушения мочеиспускания при ДГПЖ. Однако, описывая отдельные звенья, играющие определенную роль в развитии этих нарушений, можно приблизиться к пониманию общей картины заболевания, что в конечном счете должно привести к улучшению качества лечения мужчин с ДГПЖ.
Выводы
Наше исследование биоптатов участков предстательной железы из зоны интравезикальной простатической протрузии показывает достоверное уменьшение доли стромального компонента при увеличении доли железистого компонента, а также тенденцию к уменьшению мышечного компонента стромы при увеличении показателя интравезикальной простатической протрузии у мужчин с доброкачественной гиперплазией предстательной железы. Данный результат согласуется с клиническими данными о более низкой эффективности терапии α1-адреноблокаторами и неоднозначными данными относительно возможности уменьшения интравезикальной простатической протрузии на фоне лечения ингибиторами 5α-редуктазы у мужчин с показателем интравезикальной простатической протрузии 10 мм и более.
Литература
1. Berry SJ, Coffey DS, Walsh PC, Ewing LL. The development of human benign prostatic hyperplasia with age. J Urol. 1984;132(3):474-479. doi: 10.1016/s0022-5347(17)49698-4.
2. McNeal JE. Origin and evolution of benign prostatic enlargement. Invest Urol. 1978;15(4):340-345 (https://www.ncbi.nlm.nih.gov/ pubmed/75197).
3. McNeal J. Pathology of benign prostatic hyperplasia. Insight into etiology. Urol Clin North Am. 1990;17(3):477-486.
4. Roehrborn CG. Pathology of benign prostatic hyperplasia. Int J Impot Res. 2008;20(Suppl. 3): S11-S18. doi: 10.1038/ijir.2008.55.
5. Ohnuki T, Kurokawa K, Katoh N, et al. Transrectal longitudinal ultrasonography of the prostate byelectroniclinearscanning. Hinyokika Kiyo. 1987;33(9):1385-1388 (In Japanese).
6. Кривобородов Г.Г., Ефремов Н.С., Болотов А.Д. Ультразвуковые показатели предстательной железы, мочевого пузыря и данные урофлоуметрии в диагностике инфравезикальной обструкции у мужчин с доброкачественной гиперплазией предстательной железы // Урология. – 2017. – № 5. – C. 9–14. [Krivoborodov GG, Efremov NS, Bolotov AD. Ultrasound indicators of the prostate, urinary bladder and uroflowmetry parameters in the diagnosis of infravesical obstruction in men with benign prostatic hyperplasia. Urologiia. 2017;(5):9-14. (In Russ.)]. doi: https://dx.doi.org/10.18565/urology.2017.5.9-14.
7. Kalkanli A, Tandogdu Z, Aydin M, et al. Intravesical Prostatic Protrusion: A Potential Marker of Alpha-blocker Treatment Success in Patients With Benign Prostatic Enlargement. Urology. 2016;88:161-165. doi: 10.1016/j.urology.2015.11.029.
8. Park HY, Lee JY, Park SY, et al. Efficacy of alpha blocker treatment according to the degree of intravesical prostatic protrusion detected by transrectal ultrasonographyin patients with benign prostatic hyperplasia. Korean J Urol. 2012;53(2):92-97. doi: 10.4111/kju.2012.53.2.92.
9. Yoshida T, Kinoshita H, Yoshida K, et al. Intravesical Prostatic Protrusion asa Predicting Factor for the Adverse Clinical Outcome in Patients With Symptomatic Benign Prostatic Enlargement Treated With Dutasteride. Urology. 2016;91:154-157. doi: 10.1016/j. urology.2016.01.009.
10. Урология. Российские клинические рекомендации / Под ред. Ю.Г. Аляева, П.В. Глыбочко, Д.Ю. Пушкаря. – М.: ГЭОТАРМедиа, 2016. – 496 с. [Urologija. Rossijskie klinicheskie rekomendacii. Ed by Ju.G. Aljaev, P.V. Glybochko, D.Ju. Pushkar’. Moscow: GEOTAR-Media; 2016. 496 p. (In Russ.)]
11. Isaacs J. Antagonistic effect of androgen on prostatic cell death. Prostate. 1984;5(5):545-557. doi: 10.1002/pros.2990050510.
12. Andriole G, Bruchovsky N, Chung LW, et al. Dihydrotestosterone and the prostate: the scientific rationale for 5alpha-reductase inhibitors in the treatment of benign prostatic hyperplasia. J Urol. 2004;172(4 Pt 1):1399-1403. doi: 10.1097/01. ju.0000139539.94828.29.
13. Russell DW, Wilson JD. Steroid 5 alpha-reductase: two genes/two enzymes. Ann Rev Biochem. 1994;63(1):25-61. doi: 10.1146/annurev.biochem.63.1.25.
14. Carson C, Rittmaster RR. The role of dihydrotestosterone in benign prostatic hyperplasia. Urology. 2003;61(4 Suppl. 1):2-7. doi: 10.1016/s0090-4295(03)00045-1.
15. Thigpen AE, Silver RI, Guileyardo JM, et al. Tissue distribution and ontogeny of steroid 5 alpha-reductase isozyme expression. J Clin Invest. 1993;92(2):903-910. doi: 10.1172/JCI116665.
16. Hirayama K, Masui K, Hamada A, et al. Evaluation of Intravesical Prostatic Protrusion as a Predictor of Dutasteride-Resistant Lower Urinary Tract Symptoms/Benign Prostatic Enlargement With a High Likelihood of Surgical Intervention. Urology. 2015;86(3):565-569. doi: 10.1016/j.urology.2015.05.021.
17. Zheng J, Pan J, Qin Y, et al. Role for intravesical prostatic protrusion in lower urinary tract symptom: a fluid structural interaction analysis study. BMC Urol. 2015;15(1):86. doi: 10.1186/s12894015-0081-y.
Статья опубликована в журнале "Урологические ведомости". Номер №4/2017 стр. 12-23









Комментарии