Энфортумаб ведотин (EV) – конъюгат антитело-лекарственное средство (ADC), который применяется у пациентов с немышечноинвазивным раком мочевого пузыря (NMIBC): промежуточные результаты исследования фазы 1 (EV-104).
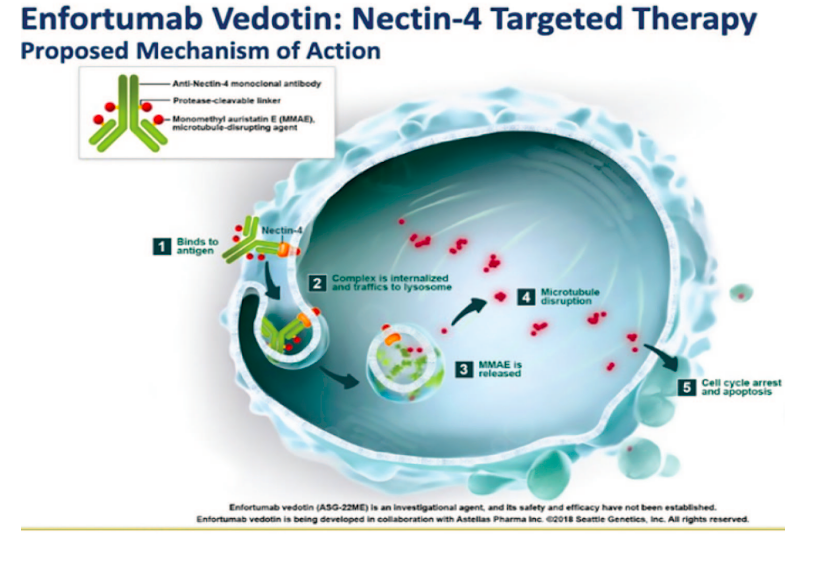
У большинства пациентов с раком мочевого пузыря заболевание не проникает в мышечную ткань.
Для пациентов с опухолями высокого риска стандартом лечения (SOC) является резекция опухоли с последующим внутрипузырным введением Bacillus Calmette-Guerin (BCG). Как только у пациентов возникает рецидив и развивается резистентное к БЦЖ заболевание, SOC представляет собой радикальную цистэктомию (RC), от которой многие пациенты отказываются.
EV представляет собой ADC, направленный на нектин-4, который сильно экспрессируется в опухолях мочевого пузыря. Внутривенный EV продемонстрировал улучшение выживаемости у пациентов с ранее леченными la/mUC. В доклинических моделях с внутрипузырным введением ЭВ хорошо переносился и проявлял противоопухолевую активность.
Исследователи представили первые клинические данные по внутрипузырному введению EV у пациентов с НМИРМЖ.
EV-104 (NCT05014139) представляет собой текущее открытое, многоцентровое исследование фазы 1 внутрипузырного введения EV с эскалацией дозы, оценивающее безопасность, переносимость, фармакокинетику и противоопухолевую активность внутрипузырного EV у пациентов с БЦЖ высокого риска – невосприимчивый NMIBC с карциномой in situ (CIS) с папиллярным заболеванием или без него, которые не подходят или отказываются от радикальной цистэктомии.
Фаза повышения дозы направлена на определение MTD или рекомендуемой дозы внутрипузырного EV при следующих уровнях доз: 125 мг, 250 мг, 500 мг и 750 мг.
Пациенты получали внутрипузырно EV еженедельно в течение 6 недель в фазе индукции, а затем 9 ежемесячных поддерживающих доз.
Предварительные данные по безопасности, фармакокинетике и эффективности для доз 125 мг и 250 мг представлены в этом реферате.
На момент прекращения сбора данных (1 декабря 2022 г.) 6 пациентов получали внутрипузырный EV в двух дозах:
- 4 пациента в дозе 125 мг завершили 6 индукционных циклов и перешли на поддерживающую терапию;
- 2 пациента в дозе 250 мг получили не менее 3 доз внутрипузырного EV.
Среди 6 пациентов, принимавших разные дозы, не было ни ТРАЭ ≥3 степени, ни СНЯ, связанных с лечением, ни ТРАЭ, приведших к снижению дозы или прекращению лечения. У 4 из 6 пациентов (3 при дозе 125 мг и 1 при дозе 250 мг) наблюдалось ≥1 нежелательное явление, связанное с лечением (TRAE) степени 1 или 2. Наиболее распространенными TRAE были утомляемость (3 из 6) и неотложные позывы к мочеиспусканию (2 из 6). На момент прекращения сбора данных DLT не наблюдалось для 125 мг; период оценки DLT для 250 мг не был завершен.
Из 4 пациентов, получавших 125 мг EV внутрипузырно, 3 достигли полного ответа и продолжили лечение. Четвертый пациент прекратил лечение из-за сохраняющегося заболевания, но остается в исследовании. В дальнейшем будут представлены подробные данные о безопасности и дополнительных данных об эффективности.
Предварительные данные по EV-104 показывают, что внутрипузырный EV хорошо переносится без признаков системного воздействия при дозе 125 мг. Предварительная противоопухолевая активность наблюдалась при дозе 125 мг, при этом 3 из 4 пациентов достигли полного ответа.
Продолжается повышение дозы для определения MTD или рекомендуемой дозы для увеличения дозы. Информация о клинических испытаниях: NCT05014139.
Подготовлено командой Уровеб. © 2023 Американское общество клинической онкологии Опубликовано: Июнь 2023 года https://ascopubs.org/doi/abs/10.1200/JCO.2023.41.16_suppl.4596










Комментарии