На сайте используются файлы cookie для анализа поведения пользователей и повышения качества работы ресурса. Продолжая использование сайта, вы подтверждаете своё согласие на применение cookie в соответствии с нашей политикой.
Согласен- ВКонтакте
- Telegram
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
Ю.В. Лаврищева1 , А.А. Яковенко2
1ФГБУ «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России, Санкт-Петербург
2ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, Санкт-Петербург
ВВЕДЕНИЕ
Саркопения относится к клинически значимым осложнениям длительной терапии хроническим гемодиализом [1] и выступает независимым прогностическим фактором заболеваемости и смертности у гемодиализных пациентов [2]. Высокая клиническая значимость саркопении объясняет необходимость ее своевременной и, что не менее важно, максимально точной диагностики у гемодиализных пациентов. Саркопения у гемодиализных пациентов проявляется изменением мышечной массы тела [3, 4].
В настоящий момент к основным методам оценки мышечной массы тела относят: нейтронный активационный анализ, магнитно-резонансную томографию (МРТ), компьютерную томографию (КТ), двухэнергетическую рентгеновскую абсорбциометрию (ДРА), биоимпедансометрию (БИМ), калиперометрию [5, 6]. Для применения первых трех методов необходима дорогостоящая специализированная аппаратура, подготовленный медицинский персонал, кроме того, подобные исследования занимают значительное время, в связи с чем The European Working Group on Sarcopenia in Older People (EWGSOP) отнесла три этих метода к чисто научным, исследовательским, указав на их крайне низкую возможность использования в клинической практике [7]. Калиперометрия для определения мышечной массы тела гемодиализных пациентов с целью диагностики саркопении также не лишена ряда существенных недостатков [8]. В основе калиперометрии лежит оценка толщины кожно-жировых складок (КЖС) специальным прибором — калипером, который позволяет проводить измерения при стандартно задаваемом давлении 10 г/мм2 с точностью до 0,5 мм. На основании величины КЖС с помощью ряда формул вычисляют объем мышечной массы тела [9]. Гипергидратация, часто встречающаяся у пациентов на гемодиализе, может повлиять на величину КЖС в сторону ее увеличения, что в свою очередь приведет к завышению объема мышечной массы тела по данным калиперометрии.
Отсутствие опыта использования калипера также может привести к значительному искажению данных об объеме мышечной массы тела по данным калиперометрии. Методика биоимпедансометрии позволяет определять объем мышечной ткани пациента за счет разницы удельного сопротивления и диэлектрической проницаемости тканей, органов и жидких сред организма при прохождении электрического тока.
К основным недостаткам метода относят высокую стоимость оборудования и высокую чувствительность к методике проведения измерений. На сегодняшний день многие авторы считают двухэнергетическую рентгеновскую абсорбциометрию так называемым золотым стандартом определения мышечной массы тела человека [10]. Метод ДРА основан на измерении интенсивности пропущенного через ткани потока рентгеновских лучей, которая меняется в зависимости от толщины, плотности и химического состава данной ткани. ДРА первоначально применяли только для оценки минеральной плотности костей, но по мере совершенствования методики стало возможным использовать ДРА и для определения мышечной массы. Лучевая нагрузка при ДРА не превышает таковую при стандартной рентгенографии легких. При этом следует отметить, что на результаты ДРА может значимо повлиять степень выраженности гипергидратации [11, 12].
Цель исследования — провести сравнительный анализ эффективности методов оценки мышечной массы тела у гемодиализных пациентов.
ПАЦИЕНТЫ И МЕТОДЫ
Обследовано 317 пациентов, получающих лечение программным бикарбонатным гемодиализом в 9 гемодиализных центрах в пяти регионах европейской части Российской Федерации в течение 8,2 ± 5,1 года, среди них 171 женщина и 146 мужчин, средний возраст которых составил 57,1 ± 11,3 года. Процедуры гемодиализа проводили на аппаратах «искусственная почка» с использованием воды, подвергнутой глубокой очистке методом обратного осмоса, капиллярных диализаторов площадью 1,7-2,1 м2. Сеансы гемодиализа проводили три раза в неделю по 4-5,5 часа. Критерий включения в исследование: хроническая болезнь почек С5. Критериями исключения были длительность гемодиализной терапии менее 1 года, госпитализация по любому поводу или признаки острого инфекционного процесса в течение последних 3 месяцев, пациенты с сахарным диабетом и онкопатологией, пациенты с диагностированным вирусным гепатитом и ВИЧ. Основным заболеванием, приведшим к терминальной почечной недостаточности, являлся первичный гломерулонефрит (51,6 %) (р < 0,001). Всем пациентам проведено традиционное клинико-лабораторное обследование.
После включения пациентов в исследование при помощи метода Монте-Карло отобрали 80 человек (40 женщин и 40 мужчин), которым была выполнена оценка мышечной массы тела при помощи БИМ с использованием 8-точечного тактильного тетраполярного мультичастотного биоимпедансометра (InBody, Южная Корея) с диапазоном частот 1-1000 кГц, по 10 измерений для каждой из шести частот по каждому из пяти сегментов тела (правая и левая рука, правая и левая нога, туловище); ДРА с использованием двухэнергетического остеоденситометра с узким веерным лучом STRATOS dR (DMS, Франция). Исследование мышечной массы тела производили последовательно двумя методами через 1-2 часа после очередного сеанса гемодиализа.
Статистический анализ полученных данных осуществляли при помощи пакета прикладных программ Statistica 8.0 (StatSoft Inc., США). Применяли общепринятые методы параметрической и непараметрической статистики. Результаты представлены в виде средняя арифметическая ± стандартное отклонение. Для сравнения результатов двух методик определения компонентного состава тела использовали метод Блэнда-Альтмана. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии различий и влияний) принимали равным 0,05.
РЕЗУЛЬТАТЫ
Результаты лабораторного обследования в группе были следующими: анемия легкой степени тяжести (гемоглобин, г/л — 110,0 ± 13,9), нормальный уровень лимфоцитов крови (лимфоциты крови, х109/л — 1,86 ± 0,47), предельно допустимый уровень показателей белкового обмена (общий белок в сыворотке крови, г/л — 67,8 ± 4,7, альбумин в сыворотке крови, г/л — 37,7 ± 3,9, преальбумин, мг/дл — 32,2 ± 1,3), нормальный уровень общего холестерина крови (общий холестерин в сыворотке крови, ммоль/л — 4,68 ± 1,12) и трансферрина крови (трансферрин в сыворотке крови, г/л — 1,94 ± 0,45). Уровень азотемии соответствовал терминальной почечной недостаточности (креатинин сыворотки крови до гемодиализа — 850,8 ± 203,5 мкмоль/л, мочевина сыворотки крови до гемодиализа 22,2 ± 6,3 ммоль/л). Величина показателя Kt/V (1,57 ± 0,14 у. е.) соответствовала представлению об адекватности дозы гемодиализа.
Результаты сравнительной оценки абсолютных значений общей мышечной массы тела, мышечной массы по сегментам тела, полученных по данным ДРА и БИМ, представлены в табл. 1.
Таблица 1. Сравнительная оценка абсолютных значений общей мышечной массы тела, мышечной массы по сегментам тела, полученных по данным двухэнергетической рентгеновской абсорбциометрии и биоимпедансометрии
| Показатель | БИМ | ДРА | ||||
| M ± о | Минимум | Максимум | M ± о | Минимум | Максимум | |
| Общая мышечная масса, кг | 32,24 ± 4,01 | 19,30 | 39,40 | 31,88 ± 3,76 | 18,90 | 40,20 |
| Мышечная масса, левая рука, кг | 2,84 ± 0,66 | 1,90 | 5,20 | 2,88 ± 0,54 | 1,80 | 4,90 |
| Мышечная масса, правая рука, кг | 2,77 ± 0,34 | 1,80 | 4,90 | 2,81 ± 0,55 | 1,70 | 4,70 |
| Мышечная масса, левая нога, кг | 7,17 ± 1,32 | 4,80 | 10,90 | 7,22 ± 1,21 | 4,60 | 11,10 |
| Мышечная масса, правая нога, кг | 7,21 ± 1,78 | 4,90 | 11,10 | 7,31 ± 1,88 | 4,70 | 10,80 |
| Мышечная масса, туловища, кг | 24,11 ± 5,01 | 17,10 | 35,20 | 23,65 ± 4,87 | 16,90 | 34,80 |
С учетом центральных тенденций мышечная масса сегментов тела, а также общая мышечная масса тела, измеренные при помощи БИМ и ДРА, не имели статистически значимых различий.
Результаты определения общей мышечной массы тела, полученные при помощи ДРА и БИМ, сравнили с результатами, полученными при помощи метода Блэнда-Альтмана (результат представленна рис. 1).
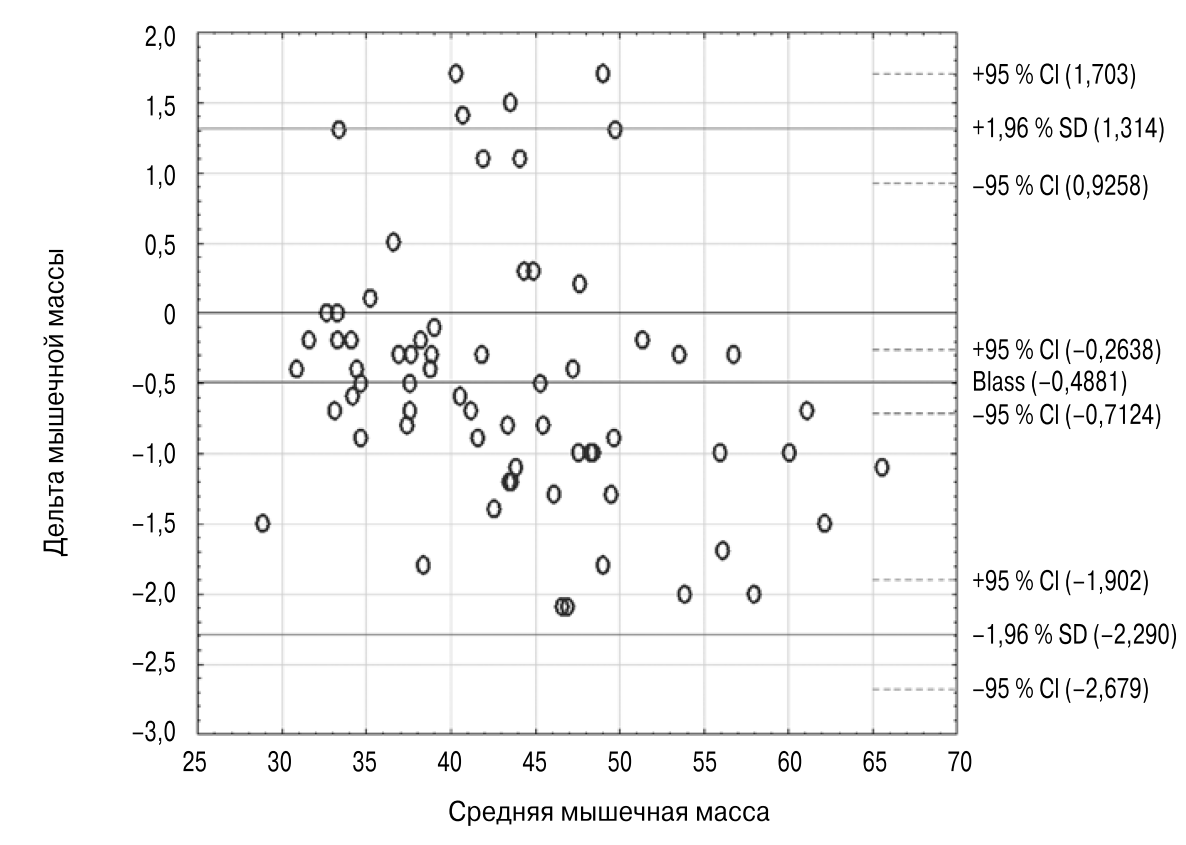
Рис. 1. Сравнительный анализ общей мышечной массы тела, полученной по результатам двухэнергетической рентгеновской абсорбциометрии и биоимпедансометрии
Коэффициент корреляции между показателями составил 0,983, p < 0,001, дельта (M ± о) составила -0,37 ± 0,86 кг, ДИ 95 % — (-0,68)-(-0,31) кг. Таким образом, установлено, что взаимосвязь очень высокая, разница по абсолютным величинам минимальная. Методы высоко сопоставимы.
В табл. 2 представлен сравнительный анализ мышечной массы по каждому из пяти сегментов тела (правая и левая рука, правая и левая нога, туловище), вычисленной при помощи ДРА и БИМ.
Таблица 2. Сравнительный анализ мышечной массы по сегментам тела, вычисленной при помощи двухэнергетической рентгеновской абсорбциометрии и биоимпедансометрии
| Показатель | r | p | Дельта (M ± о) | ДИ 95 % |
| Правая рука | 0,933 | 0,001 | 0,04 ± 0,32 | -0,02 ± 0,06 |
| Левая рука | 0,982 | 0,001 | -0,02 ± 0,24 | -0,08 ± 0,05 |
| Туловище | 0,958 | 0,001 | -0,55 ± 0,76 | (-0,77) — (-0,32) |
| Правая нога | 0,989 | 0,001 | 0,08 ± 0,31 | 0,008-0,213 |
| Левая нога | 0,991 | 0,001 | 0,06 ± 0,29 | 0,038-0,11 |
По каждому из пяти сегментов тела (правая и левая рука, правая и левая нога, туловище) результаты БИМ и ДРА практически совпадали. Средние различия мышечной массы конечностей колебались в пределах от 30 до 90 граммов. Максимальные различия относились к мышечной массе туловища, но и в данном случае разночтения по обеим методикам были невелики и составляли с учетом средней массы тела по группе 77,8 ± 17,7 кг всего лишь 0,8 %.
ОБСУЖДЕНИЕ
По полученным нами данным, ДРА и БИМ в определении общей мышечной массы тела и сегментарной мышечной массы тела (мышечная масса правой и левой руки, правой и левой ноги, туловища) показали высокую сопоставимость, а так как ДРА считается золотым стандартом определения мышечной массы тела, то можно говорить практически об идентичной диагностической значимости БИМ как метода оценки мышечной массы тела у гемодиализных пациентов. При этом следует помнить, что при ДРА всегда производится оценка не только мышечной массы тела, но и сегментарной мышечной массы, что дает возможность рассчитать индекс мышечной массы — один из наиболее важных объективных параметров оценки изменения мышечной массы тела, необходимый для полноценной диагностики саркопении (пресаркопении) [7, 12].
Оценка же индекса мышечной массы посредством БИМ возможна только в случае выполнения исследования на тетраполярном мультичастотном биоимпедансометре, но, вследствие того что стоимость этого оборудования достаточно высока, оно встречается на гемодиализных отделениях крайне редко. Посредством БИМ не удается оценить мышечную массу тела у пациентов с ампутированными конечностями, тогда как у ДРА подобного ограничения нет, также на результаты ДРА не влияет состояние фистульной конечности (отек), тогда как результаты БИМ в этом случае могут значимо искажаться. ДРА, по сравнению с БИМ, обладает возможностью определения величины костной массы, что позволяет косвенно судить о наличии остеопороза, широко распространенного в когорте гемодиализных пациентов.
ВЫВОДЫ
Двухэнергетическая рентгеновская абсорбциометрия не имеет значимых преимуществ по сравнению с тетраполярной мультичастотной биоим- педансометрией при оценке мышечной массы тела у пациентов, получающих лечение программным гемодиализом.
ЛИТЕРАТУРА
1. Kittiskulnam P, Chertow GM, Carrero JJ, et al. Sarcopenia and its individual criteria are associated, in part, with mortality among patients on hemodialysis. Kidney Int. 2017;92(1):238-247. https:// doi.org/10.1016/j.kint.2017.01.024.
2. Giglio J, Kamimura MA, Lamarca F, et al. Association of Sarcopenia with Nutritional Parameters, Quality of Life, Hospitalization, and Mortality Rates of Elderly Patients on Hemodialysis. J Ren Nutr. 2018;28(3):197-207. https://doi.org/10.1053/j. jrn.2017.12.003.
3. Bataille S, Serveaux M, Carreno E, et al. The diagnosis of sarcopenia is mainly driven by muscle mass in hemodialysis patients. Clin Nutr. 2017;36(6):1654-1660. https://doi.org/10.1016/j. clnu.2016.10.016.
4. Messina C, Maffi G, Vitale JA, et al. Diagnostic imaging of osteoporosis and sarcopenia: a narrative review. Quant Imaging Med Surg. 2018;8(1):86-99. https://doi.org/10.21037/qims.2018.01.01.
5. Battaglia Y, Galeano D, Cojocaru E, et al. Muscle-wasting in end stage renal disease in dialysis treatment: a review. G Ital Nefrol. 2016;33(2).
6. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: Report of the European Working Group on Sarcopenia in Older People. Age Ageing. 2010;39(4):412-423. https://doi.org/10.1093/ageing/afq034.
7. Arias-Guillen M, Perez E, Herrera P, et al. Bioimpedance spectroscopy as a practical tool for the early detection and prevention of protein-energy wasting in hemodialysis patients. J Ren Nutr. 2018;28(5):324-332. https://doi.org/10.1053/j.jrn.2018.02.004.
8. Guglielmi G, Ponti F, Agostini M, et al. The role of DXA in sarcopenia. Aging Clin Exp Res. 2016;28(6):1047-1060. https://doi. org/10.1007/s40520-016-0589-3.
9. Popovic V, Zerahn B, Heaf JG. Comparison of dual energy X-ray absorptiometry and bioimpedance in assessing body composition and nutrition in peritoneal dialysis patients. J Ren Nutr. 2017;27(5):355-363. https://doi.org/10.1053/j. jrn.2017.03.003.
10. Kittiskulnam P, Carrero JJ, Chertow GM, et al. Sarcopenia among patients receiving hemodialysis: weighing the evidence. J Cachexia Sarcopenia Muscle. 2017;8(1):57-68. https://doi.org/10.1002/ jcsm.12130.
11. Dehesa-Lopez E, Correa-Rotter R, Olvera-Castillo D, et al. Transcultural adaptation and validation of the Mexican version of the kidney disease questionnaire KDQOL-SF36 version 1.3. Qual Life Res. 2017;26(1):193-198. https://doi.org/10.1007/s11136-016- 1365-8.
12. Cao L, Morley JE. Sarcopenia is recognized as an independent condition by an international classification of disease, tenth revision, clinical modification (ICD-10-CM) Code. J Am Med Dir Assoc. 2016;17(8):675-677. https://doi.org/10.1016/j.jam-da.2016.06.001
- ВКонтакте
- Telegram
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ









Комментарии