С. Х. Аль-Шукри 1, И. А. Корнеев 1, Т. Г. Гиоргобиани 1, М. Н. Агеев 2, Д. Б. Батмаев 1
1 Кафедра урологии Санкт-Петербургского государственного медицинского университета имени акад. И. П. Павлова;
2 Городская поликлиника №56 Фрунзенского района г. Санкт-Петербурга
Рак полового члена — редко встречающееся новообразование с агрессивным злокачественным потенциалом. Возможность применения органосохраняющего лечения при начальных стадиях болезни диктует необходимость раннего выявления и обследования с целью стадирования опухолевого процесса. В статье представлен обзор литературы, посвященной новообразованиям полового члена, на клиническом примере из собственной практики обсуждены современные подходы к диагностике и лечению больных.
Ключевые слова: рак полового члена; оперативное лечение.
Согласно современным представлениям рак полового члена (РПЧ) — это сравнительно редко встречающееся заболевание, которое в индустриально развитых странах наблюдается с частотой менее 1,0 на 100 000 населения и составляет от 0,3 % до 1 % злокачественных новообразований у мужчин. В странах с жарким и влажным климатом оно распространено в значительно большей степени.
Чаще всего злокачественное поражение полового члена диагностируют у мужчин старше 50‑летнего возраста, в подавляющем большинстве случаев оно представляет собой плоскоклеточную карциному. Описаны также базально-клеточные карциномы, меланомы, мезенхимальные опухоли, включая фибросаркому и саркому Капоши. Основными факторами риска, предрасполагающими к развитию рака полового члена, считают несоблюдение правил личной гигиены, застой смегмы в препуциальном мешке и фимоз. РПЧ крайне редко выявляют в странах, где мужчинам вскоре после рождения выполняют обрезание крайней плоти. Доказано, что РПЧ чаще наблюдается у курящих мужчин. К предраковым заболеваниям относят кожный рог, лейкоплакию, ксерозный облитерирующий баланит, а также неопластические процессы, обусловленные вирусом папилломы человека: остроконечные кондиломы и опухоль Бушке-Левинштейна. Нередко развитию плоскоклеточной карциномы полового члена предшествует рак in situ, который описан как болезнь Боуэна и эритроплазия Кейра [1].
В типичном случае плоскоклеточная карцинома полового члена представляет собой папиллярное или изъязвленное образование, располагающееся на головке полового члена или коже крайней плоти. Чаще всего больные сами обращают внимание на его появление, однако весьма часты поздние обращения за квалифицированной медицинской помощью после продолжительных безуспешных попыток самолечения. Нередко у пациентов имеется фимоз, степень выраженности которого во многом определяет их жалобы, клинические проявления и возможность визуальной оценки новообразования. Сужение крайней плоти часто сопровождается баланопоститом и появлением дискомфорта, зуда и выделений из препуциального мешка. Метастазы при раке полового члена в первую очередь поражают паховые лимфатические узлы, увеличение которых при пальпации отмечают у 40–80 % больных. Нередко, однако, лимфаденопатия является лишь следствием воспаления в результате инфицирования. Отдаленные метастазы РПЧ обнаруживают у 1–10 % больных при первичной диагностике опухоли. Чаще всего поражаются легкие, печень, кости и головной мозг. В целом РПЧ относят к агрессивным и быстро прогрессирующим новообразованиям, а пациенты, не получающие лечения, как правило, умирают в течение двух лет [2].
На ранних этапах РПЧ требуется дифференциальная диагностика с предраковыми заболеваниями, сифилисом, язвенным баланитом и баланопоститом. Морфологическую верификацию злокачественного характера опухолевого процесса можно получить при цитологическом исследовании мазков‑отпечатков и материала, полученного при биопсии новообразования. Обнаружение увеличенных лимфатических узлов при подтверждении злокачественного характера опухолевого процесса является показанием к лимфаденэктомии.
В связи с низкой частотой встречаемости рака полового члена и сравнительно небольшим числом посвященных этой проблеме работ российских авторов приводим собственное наблюдение.
Больной Р., 87 лет, поступил в клинику урологии СПБГМУ им акад. И. П. Павлова в плановом порядке по направлению уролога поликлиники с жалобами на боли и уплотнение в головке полового члена, сужение крайней плоти. При сборе анамнеза удалось узнать, что сужение крайней плоти больной наблюдал с детства, оно заметно прогрессировало в течение последних трех лет после развития сахарного диабета и на фоне периодических обострений хронического баланопостита. За несколько месяцев до госпитализации пациент обнаружил язву на головке полового члена, частично прикрытую рубцово‑деформированной крайней плотью. Пытался лечиться самостоятельно, используя тампоны с растворами антисептиков, однако лечение не было эффективным. Последующее появление уплотнения в области поражения головки полового члена стало поводом для обращения к специалисту.
При обследовании наружных половых органов из-за сужения крайней плоти раскрыть препуциальную область и осмотреть головку полового члена не представлялось возможным. У основания головки пальпировали участок выраженного уплотнения около двух сантиметров в диаметре. В паховых областях слева и справа пальпировали одиночные не спаянные с окружающими тканями увеличенные до 1,5–2,0 см лимфатические узлы.
Результаты лабораторных анализов в пределах границ нормальных значений. Больной осмотрен терапевтом, диагностированы компенсированные сопутствующие заболевания: артериальная гипертензия, сахарный диабет 2‑го типа, ожирение 1-й ст. Противопоказаний к хирургическому лечению не выявлено.
В предоперационном периоде выполнено цитологическое исследование мазка-отпечатка из препуциальной области, которое показало наличие воспаления, признаков гипер, диси паракератоза, а также единичных скоплений патологически измененных клеток плоского эпителия, соответствующих интраэпителиальной неоплазии III степени.

Рис. 1. Рассечение препуциального мешка
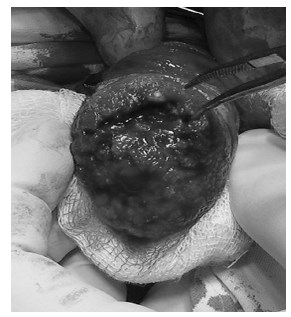
Рис. 2. Головка полового члена, пораженная новообразованием с участками некроза
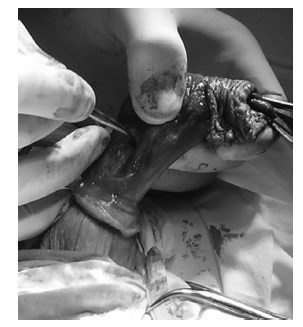
Рис. 3. Пересечение кавернозных тел полового члена. Мобилизация уретры
Предварительный диагноз: рак полового члена Т2 Nх Mх.
При планировании тактики оперативного лечения было решено провести диагностическую циркумцизию и при обнаружении новообразования выполнить резекцию полового члена, пораженного опухолью, в пределах здоровых тканей.
В ходе операции после рассечения препуциального мешка (рис. 1) определялась пораженная новообразованием с участками некроза головка полового члена (рис. 2). Отступив 2 см от края пальпируемой опухоли, были пересечены кожа, фасции полового члена и кавернозные тела (рис. 3).
Уретра мобилизована на 1,5 см дистально и отсечена. Белочные оболочки кавернозных тел ушиты (рис. 4), над ними наложены швы на фасции и кожу, сформировано наружное отверстие мочеиспускательного канала. Операция завершена дренированием мочевого пузыря 2‑ходовым катетером Фолея (рис. 5) и наложением асептической повязки.
Гистологическое исследование удаленной ткани показало наличие высокодифференцированного ороговевающего плоскоклеточного рака с инвазией в толщу собственной дермы и лимфоидной инфильтрацией по периферии и в толще опухоли. Постхирургический гистопатологический диагноз: pТ2 Nх Mх.
Течение послеоперационного периода было осложнено некрозом дистального отдела уретры, протяженностью около 1 см и заживлением этого участка послеоперационной раны вторичным натяжением (рис. 6). Больной был выписан в удовлетворительном состоянии под наблюдение уролога и онкоуролога по месту жительства с рекомендацией завершения заживления операционной раны и повторной госпитализации в онкологическое отделение для выполнения паховой лимфаденэктомии и решения вопроса о необходимости адьювантного лечения.
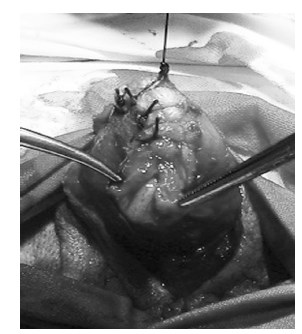
Рис. 4. Сшивание белочных оболочек кавернозных тел
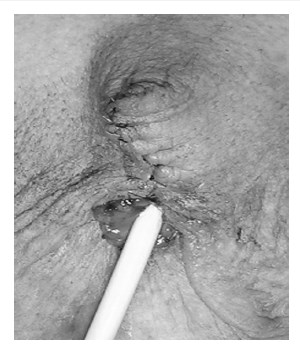
Рис. 5. Операция завершена. Мочевой пузырь дренирован 2-ходовым катетером Фолея
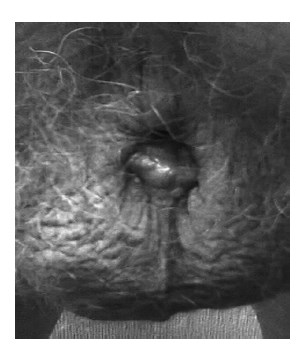
Рис. 6. Послеоперационная рана зажила вторичным натяжением
Представленный случай из практики подтверждает представление о более высокой предрасположенности к развитию рака полового члена мужчин с рубцовыми сужениями крайней плоти и хроническим воспалением в препуциальной области. Согласно опубликованным данным эти факторы риска наблюдают у 25–60 % пациентов [3, 4]. Считается, что фимоз и накопление смегмы поддерживают хронический воспалительный процесс крайней плоти и головки полового члена, который при длительном течении в может привести к метаплазии, анаплазии и в несколько раз повышает риск развития злокачественной опухоли [5, 6, 7]. У оперированного нами пациента при цитологическом исследовании были описаны предраковые изменения эпителия, непосредственно прилежащие к малигнизированному участку ткани. Не исключено, что длительному течению хронического воспаления препуциальной области у него также способствовали нарушения углеводного обмена и наличие сахарного диабета 2‑го типа [2, 4].
Согласно рекомендациям Европейской ассоциации урологов окончательное представление о глубине инвазии рака полового члена может быть получено только по результатам гистологического исследования удаленной в пределах здоровых тканей опухоли. При необходимости уточнению степени местного распространения помогает ультразвуковое исследование, которое может предоставить более точное представление о границах опухоли по сравнению с компьютерной томографией [8]. Точность диагностики глубины поражения мягких тканей полового члена возрастает при использовании МРТ (в том числе и с эндоректальной катушкой) в сочетании с фармакологически индуцированной эрекцией [9].
Наличие пальпируемых лимфоузлов в паховой области у больных раком полового члена является показанием для лимфаденэктомии. Для визуализации оценки распространенности лимфогенного метастазирования можно использовать УЗИ в комбинации с цветной допплерографией и МРТ [10].
При стадиях рака полового члена Tis, Та, и Т1а применяют органосохраняющие методики. Особый интерес представляет микрографическая хирургия Моха, при которой получают тонкие срезы тканей полового члена, производят их срочную гистопатологическую верификацию для определения чистоты хирургического края резекции [11].
При лечении опухоли с глубиной инвазии T1b-T2, как и в рассмотренном нами случае, обычно используются методики удаления новообразования в пределах здоровых тканей, позволяющие сохранить акт мочеиспускания и сексуальную функцию.
При небольших злокачественных опухолях головки полового члена возможно комбинированное лечение лазерным облучением и неоадъювантной химиотерапией винбластином, блеомицином и метотрексатом [12]. 5‑летняя выживаемость при применении дистанционной лучевой терапии составляет 88 %, однако такой подход по сравнению с хирургическим лечением приводит к большей частоте развития рецидивов [13, 14] и нередко сопровождается развитием рубцовых осложнений [15].
Распространенные опухоли стадии T3 и T4 в настоящее время встречаются редко. Основным подходом к лечению таких пациентов является удаление полового члена с выведением наружного отверстия уретры на промежность, паллиативно может быть использована лучевая терапия [16].
Паховая лимфодиссекция является стандартным хирургическим вмешательством как у пациентов с доказанным метастатическим поражением лимфоузлов, так и у пациентов с РПЧ высокого метастатического риска [17, 18]. В последние годы стали применять эндоскопическую паховую лимфодиссекцию с визуализацией операционного поля на видеомониторе. Такой подход эффективен, менее травматичен, сопровождается меньшим количеством осложнений и требует более короткого периода госпитализации [15, 19].
Таким образом, в настоящее время применение современных методов диагностики и лечения больных раком полового члена позволяет оказывать им высокоэффективную медицинскую помощь с минимальным риском развития осложнений. В то же время принципиально важным прогностически значимым фактором является ранняя диагностика, которая напрямую зависит от клинических проявлений этого редко встречающегося заболевания и их интерпретации пациентом.
Список литературы
- Аль-Шукри С. Х., Ткачук В. Н. Опухоли мочеполовых органов. — СПб: Питер. 2000. — 320 с.
- Pow'Sang M. R., Ferreira U., Pow'Sang J. M., Nardi A. C., Destefano V. Epidemiology and natural history of penile cancer // J. Urol. — 2010. — Vol. 76(2, supplement 1). — P. 26.
- Bleeker M. C., Heideman D. A., Snijders P. J., Horenblas S., Dillner J., Meijer C. J. Penile cancer: epidemiology, pathogenesis and prevention. prevention // World J. Urol. — 2009. — Vol. 27, N 2. — P. 141–150.
- Maden C., Sherman K. J., Beckmann A. M. et al. History of circumcision, medical conditions, and sexual activity and risk of penile cancer // J. Nat. Canc. Inst. — 1993. — Vol. 85, N 1. — P. 19–24.
- Bleeker M. C., Heideman D. A., Snijders P. J., Horenblas S., Dillner J., Meijer C. J. Penile cancer: epidemiology, pathogenesis and prevention // World J. Urol. — 2009. — Vol. 27, N 2. — P.141–150.
- Dillner J., Von Krogh G., Horenblas S., Meijer C. J. Etiology of squamous cell carcinoma of the penis // Scand. J. Urol. Nephrol. — 2000. Suppl. 205. — P. 189–193.
- Hellberg D., Valentin J., Eklund T., Nilsson S. Penile cancer: is there an epidemiological role for smoking and sexual behavior? // Br. Med. J. (Clin. Res. Ed.). — 1987. — Vol. 259. — P. 1306–1308.
- Stewart S. B., Leder R. A., Inman B. A. Imaging tumors of the penis and urethra // Urol. Clin. North Am. — 2010. — Vol. 37, N 3. — P. 353–367.
- Petralia G., Villa G., Scardino E. et al. Local staging of penile cancer using magnetic resonance imaging with pharmacologically induced penile erection // Radiol. Med. — 2008. — Vol. 113, N 4. — P. 517–528.
- Crawshaw J. W., Hadway P., Hoffland D. et al. Sentinel lymph node biopsy using dynamic lymphoscintigraphy combined with ultrasound — guided fine needle aspiration in penile carcinoma // Brit. J. Radiol. — 2009. — Vol. 82. — P. 41–48.
- Shindel A. W., Mann M. W., Lev R. Y. et al. Mohs micrographic surgery for penile cancer: management and long — term followup // Journal Urol. — 2007. — Vol. 178. — P. 1980–1985.
- Windahl T., Andersson S. O. Combined laser treatment for penile carcinoma: results after long'term followup // J. Urol. — 2003. — Vol. 169. — P. 2118–2121.
- A., Wylie J. P., Livsey J. E. External'beam radiotherapy in T1'2 N0 penile carcinoma // Clin. Oncol. — 2006. — Vol. 18, N 4. — P. 320–325.
- Crook J. M., Jezioranski J., Grimard L., Esche B., Pond G. Penile brachytherapy: results for 49 patients // Int. J. Radiat. Oncol. Biol. Phys. — 2005. — Vol. 62, N 2. — P. 460–467.
- Rossari J. R., Vora T., Gil T. Advances in penile cancer management // Curr. Opin. Oncol. — 2010. — Vol.22, N 3. — P. 226–235.
- Pizzocaro G., Algaba F., Horenblas S. et al. EAU penile cancer guidelines 2009 // Eur. Urol. — 2010. — Vol. 57. — P. 1002–1012.
- Spiess P. E., Hernandez M. S., Pettaway C. A. Contemporary inguinal lymph node dissection: minimizing complications // World Journal Urol. — 2009. — Vol. 2, N 2. — P. 205–212.
- Bonner J. A., Harari P. M., Giralt J. et al. Radiotherapy plus cetuximab for squamous'cell carcinoma of the head and neck // New Eng. J. Med. — 2006. — Vol. 354, N 6. — P. 567–578.
- Heyns C. F., Fleshner N., Sangar V., Schlenker B., Yuvaraja T. B., Van Poppel H. Management of the lymph nodes in penile cancer // Urology. — 2010. — Vol. 76, N 2, suppl.1. P. 43–57.









Комментарии