Хламидийная инфекция (Chlamydia trachomatis) в урологии
Автор обзора: Шадеркина В.А., уролог, CEO Uroweb.ru
План обзора:
- 1. Введение. Chlamydia trachomatis в урологии
- 2. Современная диагностика: методы, материалы для забора и локализация
- 3. Фармакотерапия неосложненного хламидиоза
- 4. Урологические осложнения C. trachomatis у мужчин
- 5. Рецидивы, партнеры и последующее наблюдение
- 6. Скрининг бессимптомных гетеросексуальных мужчин
- 7. Выводы
- 8. Литература
1. Введение. Chlamydia trachomatis в урологии.
1.1. Эпидемиология и актуальность
Инфекция, вызываемая Chlamydia trachomatis (C. trachomatis) является одной из самых распространенных бактериальных инфекций, передающихся половым путем, в мире, с примерно 129 миллионами новых случаев в год [1, 2]. В Соединенных Штатах это наиболее часто регистрируемая бактериальная инфекция, что создает значительную и постоянную нагрузку на клиническую практику, в том числе урологическую. Общий уровень урогенитальной инфекции среди женщин в США в два раза выше, чем у мужчин в США, при этом более высокая распространенность у женщин в возрасте 15-24 лет и более высокая заболеваемость среди мужчин в возрасте от 20 до 24 лет [3]. Глобальная распространенность и высокая частота передачи делают C. trachomatis центральной проблемой общественного здравоохранения и клинической медицины.
1.2. Мало- и асимптоматическое течение
Ключевой клинической проблемой, определяющей стратегию диагностики и ведения пациентов, является преимущественно бессимптомное или малосимптомное течение инфекции [4]. По разным оценкам, более 50%–70% случаев у мужчин и женщин не имеют выраженных клинических проявлений [2].
Это создает фундаментальную проблему для практикующего уролога. Врач редко сталкивается с манифестной формой первичного хламидийного уретрита. Гораздо чаще урологическая практика имеет дело с отдаленными последствиями недиагностированной и нелеченной бессимптомной инфекции. К таким последствиям относятся:
- Острый эпидидимит и эпидидимо-орхит (наиболее частая причина острой мошоночной боли у молодых мужчин) [5].
- Хронический простатит / синдром хронической тазовой боли (ХП/СХТБ) [6].
- Мужское бесплодие, часто связанное с обструктивными процессами в придатке яичка [7].
Таким образом, для уролога C. trachomatis — это не столько «классическая ИППП» с уретральными выделениями, сколько «скрытый» этиологический фактор в структуре сложных урологических и андрологических диагнозов. Это требует постоянного высокого индекса клинического подозрения, даже при отсутствии у пациента уретрита в анамнезе.
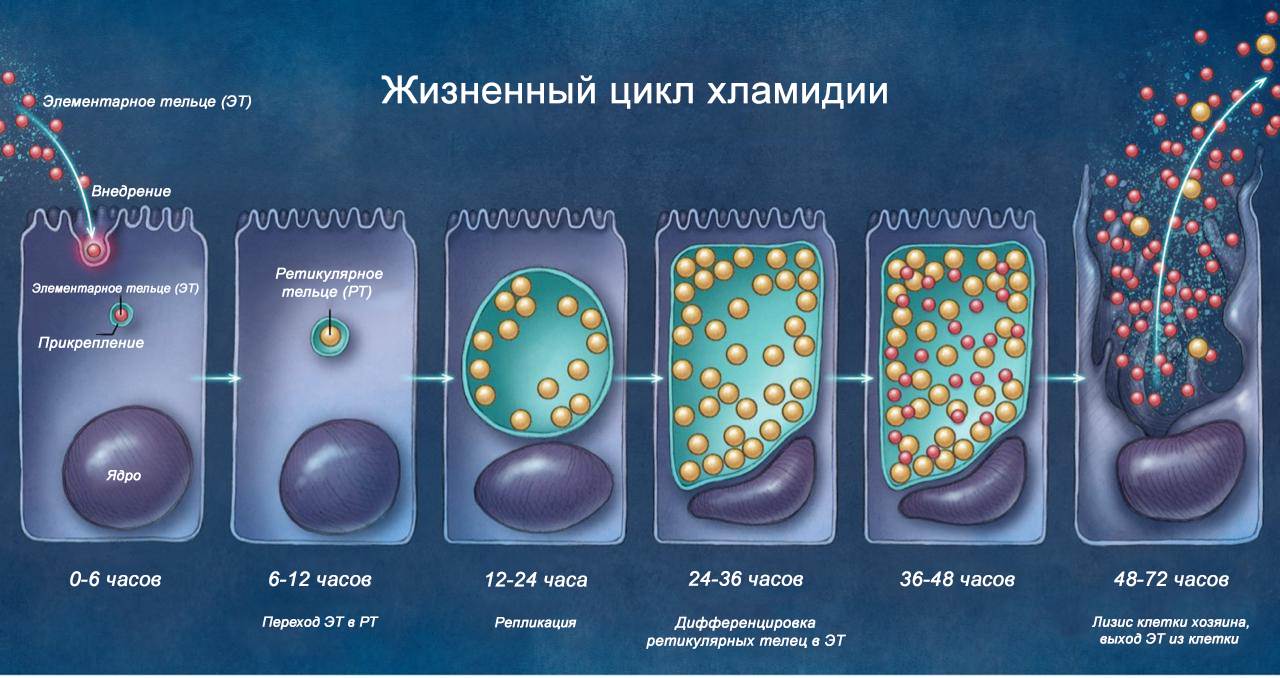
1.3. Позиции профессиональных организаций
Настоящий анализ базируется исключительно на данных доказательной медицины (EBM), в первую очередь на клинических руководствах высшего уровня и метаанализах. К ним относятся рекомендации Центров по контролю и профилактике заболеваний США (CDC), Международного союза по борьбе с инфекциями, передаваемыми половым путем (IUSTI), и актуальные клинические рекомендации Министерства здравоохранения Российской Федерации [4, 8, 9].
Важно отметить, что ведущие мировые урологические ассоциации — Американская урологическая ассоциация (AUA) и Европейская ассоциация урологов (EAU) — де-факто делегируют разработку детальных протоколов по ИППП профильным организациям. AUA не имеет собственных отдельных клинических рекомендаций по лечению хламидиоза [10]. EAU рассматривает C. trachomatis в основном в контексте специфических урологических инфекций, например, острого эпидидимита, но не в качестве отдельного всеобъемлющего руководства по ИППП [11].
Следовательно, руководства CDC и IUSTI являются основным источником данных c доказанной эффективностью и де-факто стандартом оказания помощи для урологических пациентов с хламидийной инфекцией во всем мире.
2. Современная диагностика: методы, материал для забора и локализация
2.1. «Золотой стандарт»
Современная диагностика C. trachomatis имеет один «золотой стандарт» – методы амплификации нуклеиновых кислот (NAAT). NAAT (ПЦР или другие методы) демонстрируют наивысшую чувствительность и специфичность и являются единственным рекомендуемым методом для определения урогенитальной и экстрагенитальной инфекции [12].
Европейское руководство IUSTI (2025) отдельно подчеркивает, что для диагностики должны использоваться только валидированные NAAT [12]. Не-NAAT тесты, включая экспресс-тесты в месте оказания помощи, не основанные на NAAT, имеют существенно более низкую чувствительность и не рекомендуются для использования в клинической практике в Европе [12].
2.2. Выбор диагностического материала у мужчин
Для мужчин руководства четко определяют иерархию диагностических образцов:
- Предпочтительный образец – первая порция мочи [12]. Это неинвазивный, удобный для пациента и высокоточный метод. Руководство IUSTI (2025) уточняет технические детали для максимальной чувствительности: сбор первых 15–20 мл мочи, при этом желательно, чтобы с момента последнего мочеиспускания прошло более 1 часа.
- Альтернативный образец – уретральный мазок. Используется в ситуациях, когда сбор мочи невозможен или при специфических клинических показаниях (например, для микроскопии при симптоматическом уретрите) [3].
Приоритет первой порции мочи над уретральным мазком — это не только вопрос комфорта пациента. Устранение болезненной и инвазивной процедуры (взятие мазка из уретры) является ключевой стратегией повышения комплаентности к тестированию. Это критически важно для скрининга и диагностики у бессимптомных мужчин или мужчин с низкой мотивацией к обследованию.
2.3. Клиническая значимость экстрагенитальных локусов
Урологическая практика, сфокусированная на урогенитальном тракте, исторически недооценивала роль экстрагенитальных (ЭГ) локусов — прямой кишки и глотки. Современные данные полностью изменили этот взгляд и, как следствие, привели к смене терапевтических протоколов.
- ЭГ-инфекции C. trachomatis в подавляющем большинстве случаев (70-90% и более) протекают бессимптомно [12].
- Распространенность у мужчин, практикующих секс с мужчинами (МСМ) распространенность ректальной инфекции высока и достигает около 9% [12].
- У женщин с подтвержденной урогенитальной (вагинальной/цервикальной) хламидийной инфекцией ректальная инфекция обнаруживается ко-инфекцией примерно в 70% случаев [12].
Ключевое открытие, изменившее клиническую практику – наличие ректальной инфекции у женщин не коррелирует с анамнезом анального секса [4]. Это означает, что ректальный локус инфицируется, вероятно, путем аутоинокуляции (контаминация из влагалища).
Этот скрытый ректальный резервуар служит источником для персистенции инфекции, аутоинокуляции и реинфекции урогенитального тракта после, казалось бы, успешного лечения [12]. Именно неспособность стандартных схем терапии (азитромицина) уничтожать инфекцию из ректального локуса послужила главной причиной глобального пересмотра всех клинических рекомендаций.
3. Фармакотерапия неосложненного хламидиоза
3.1. Эволюция рекомендаций: от азитромицина к доксициклину
В течение почти двух десятилетий азитромицин 1 г перорально однократно был терапией первой линии. Его преимущество заключалось в 100% комплаентности (прием одной дозы под наблюдением врача). Однако накопленные данные о фармакокинетической неэффективности в ректальном локусе и, как следствие, высоком уровне неудач лечения, привели к глобальному сдвигу парадигмы.
3.2. Текущие международные и российские рекомендации (2021-2025 гг)
На сегодняшний день ведущие международные и российские руководства синхронизировались, сместив азитромицин с позиции препарата первого выбора.
-
CDC (США, 2021):
- Рекомендуемый режим: доксициклин 100 мг перорально 2 раза в день, 7 дней [4].
- Альтернативные режимы: азитромицин 1 г перорально однократно ИЛИ левофлоксацин 500 мг перорально 1 раз в день, 7 дней [4].
- IUSTI (Европа, 2025):
- Рекомендуемый режим: IUSTI рекомендует лечить все инфекции C. trachomatis доксициклином как препаратом первой линии, однозначно предпочитая его однократной дозе азитромицина [12].
- Минздрав РФ (вступили в силу с 01.01.2025):
- Рекомендуемые режимы: для инфекций нижних отделов мочеполовой системы у взрослых рекомендованы (как равнозначные опции): доксициклин (100 мг 2 р/д, 7 дней) ИЛИ миноциклин (100 мг 2 р/д, 7 дней) ИЛИ офлоксацин (400 мг 2 р/д, 7 дней) [9].
Российские рекомендации 2025 года, таким образом, полностью соответствуют международному тренду на использование доксициклина в качестве первой линии. Однако они также ставят в один ряд с ним фторхинолоны (офлоксацин), которые CDC (2021) относит к альтернативным режимам. Это дает российскому урологу более широкий, хотя и менее директивный, выбор терапии первой линии.
Таблица 1. Сравнительный анализ клинических рекомендаций (2021-2025) по лечению неосложненного хламидиоза у взрослых
|
Организация / Руководство |
Препарат(ы) Первой Линии (Рекомендуемые) |
Альтернативные Препараты |
Ключевые Примечания |
|
CDC (США, 2021) |
|
|
Доксициклин стал препаратом выбора из-за более высокой эффективности при ректальных инфекциях. |
|
IUSTI (Европа, 2025) |
|
|
Доксициклин предпочтителен Азитромицину для всех локализаций инфекции. |
|
Минздрав РФ (2025) |
|
|
Российские рекомендации ставят фторхинолоны (офлоксацин) в один ряд с тетрациклинами в первой линии. |
3.3. Причины смены парадигмы
Смена парадигмы основана на убедительных данных (РКИ и метаанализах), продемонстрировавших более высокую частоту неудач лечения при использовании азитромицина.
Урогенитальная инфекция у мужчин
Кокрановский обзор (2018), включивший 14 РКИ (2715 участников), показал, что риск микробиологической неудачи (сохранение NAAT-позитивности) при лечении мужчин азитромицином был значительно выше по сравнению с доксициклином [13]. Эти данные послужили одним из ключевых оснований для пересмотра рекомендаций CDC [4].
Самой весомой причиной изменения парадигмы стало появление новых данных о ректальном локусе.
- РКИ у МСМ (2021). Рандомизированное контролируемое исследование, сравнивающее два режима для лечения ректальной C. trachomatis у МСМ, показало:
- Микробиологическое излечение (доксициклин): 100% (70 из 70 пациентов)
- Микробиологическое излечение (азитромицин): 74% (48 из 65 пациентов)
- Абсолютная разница в эффективности составила 26% [14].
- Метаанализ (Chen et al., 2021). Систематический обзор и метаанализ, сравнивающий два препарата для лечения ректального хламидиоза, показал, что доксициклин имеет значительно более высокий уровень микробиологического излечения. При анализе только РКИ, преимущество доксициклина было еще более выраженным [15].
- Исследование FemCure (у женщин, 2019). Это знаковое исследование идеально иллюстрирует проблему. Исследователи сравнивали эффективность двух препаратов у женщин с ко-инфекцией (вагинальной и ректальной):
- При вагинальной инфекции эффективность была почти идентичной (азитромицин 93,5% по сравнению с доксициклином 95,4%) [16].
- При ректальной инфекции (у тех же женщин) эффективность резко различалась (азитромицин 78.5% в сравнении с доксициклином 95,5%). Разница составила 17,0% [16].
Вывод для практики. Азитромицин не потерпел неудачу как препарат для лечения изолированной урогенитальной инфекции. Он потерпел неудачу как препарат для лечения ректальной инфекции. Поскольку у 70% женщин и значительной части мужчин имеется сопутствующая, клинически недиагностируемая (бессимптомная) ректальная инфекция, назначение азитромицина стало клинически неоправданным риском.
Клинические рекомендации (CDC, IUSTI) выбрали единственно верный подход на основе доказательной медицины – рекомендовать доксициклин (7 дней) всем пациентам, так как он надежно эрадицирует инфекцию во всех потенциальных локусах.
3.4. Вопрос антибиотикорезистентности.
Важно, что практикующий врач должен четко разделять понятия «неудача лечения» и «антибиотикорезистентность».
- Резистентность. На сегодняшний день стабильная, естественная, клинически значимая резистентность C. trachomatis к макролидам или тетрациклинам не документирована в мировой практике [17]. Описаны лишь единичные, казуистические случаи [18].
- Неудача лечения. Высокая частота неудач при лечении азитромицином (до 15-22% в некоторых исследованиях) связана не с микробиологической резистентностью возбудителя, а с фармакокинетической неэффективностью препарата в ректальном локусе или, что еще чаще, с реинфекцией от нелеченного партнера [14, 19, 20].
Вывод для практики. Пациент с «рецидивом» после азитромицина не нуждается в «более сильном» или «резервном» антибиотике.
Он нуждается в:
- назначении «правильного» препарата, эффективного в локусе прямой кишки (доксициклин)
- обязательном лечении его половых партнеров.
4. Урологические осложнения C. trachomatis у мужчин
Для уролога C. trachomatis представляет интерес в первую очередь как этиологический агент специфических урологических заболеваний.
4.1. Острый эпидидимит и эпидидимоорхит
- C. trachomatis (наряду с N. gonorrhoeae) является ведущей причиной острого эпидидимита у сексуально активных мужчин, особенно в возрасте до 35 лет [11]. Это наиболее частая причина острой мошоночной боли в амбулаторной практике [5].
-
Лечение хламидийного эпидидимита (CDC 2021) отличается от лечения неосложненного уретрита. Терапия эскалируется и удлиняется.
- Схема А (Наиболее вероятная причина — ИППП):
- Цефтриаксон 500 мг в/м однократно (для эмпирического прикрытия N. gonorrhoeae)
- ПЛЮС доксициклин 100 мг перорально 2 раза в день на 10 дней [21].
- Схема Б (Пациент МСМ, практикующий анальный секс; вероятны ИППП + кишечные патогены):
- Цефтриаксон 500 мг ВМ однократно
- ПЛЮС левофлоксацин 500 мг перорально 1 раз в день на 10 дней [21].
- Схема А (Наиболее вероятная причина — ИППП):
Вывод для практики. Назначение 7-дневного курса монотерапии доксициклином при установленном диагнозе «острый эпидидимит» (даже при подтвержденной хламидийной этиологии) является ошибкой и нарушением действующих рекомендаций. Терапия должна длиться 10 дней и, в большинстве случаев, включать Цефтриаксон для эмпирического «перекрытия» гонореи, которую невозможно надежно исключить в момент назначения лечения.
4.2. Хронический простатит (ХП/СХТБ)
Роль C. trachomatis в этиологии ХП/СХТБ (CP/CPPS) остается предметом многолетних дискуссий [22]. Однако недавние исследования предоставляют важные данные для уролога.
Исследование (2020), опубликованное в Central European Journal of Urology, изучало мужчин с диагнозом ХП. ДНК C. trachomatis была обнаружена в ткани простаты (биоптаты или материал ТУРП) у 10,8% (7/65) пациентов [23].
Критически важное наблюдение этого исследования: у всех семи пациентов с положительным NAAT в ткани простаты, NAAT-тесты из уретры были отрицательными [23].
Вывод для практики. Отрицательный NAAT-тест мочи или уретрального мазка не исключает хламидийную этиологию хронического простатита. Инфекция может персистировать изолированно в ткани предстательной железы. Это делает стандартную диагностику малоэффективной и часто превращает диагноз в diagnosis ex juvantibus. Уролог должен рассматривать возможность пробной, и, вероятно, пролонгированной, терапии тетрациклинами или фторхинолонами у пациентов с ХП/СХТБ, имеющих факторы риска ИППП, даже при отрицательных стандартных NAAT-тестах.
4.3. Мужское бесплодие
Связь C. trachomatis с мужским бесплодием установлена и подтверждена недавним систематическим обзором и метаанализом [7]. C. trachomatis признан фактором риска нарушения мужской фертильности [3].
Наиболее актуальные данные касаются механизма этого нарушения. Исследование (2022) бесплодных мужчин в Китае показало [24]:
- Инфекция C. trachomatis не была связана с ухудшением подвижности, морфологии или активности акрозина сперматозоидов.
- Однако инфекция была достоверно связана с двумя параметрами:
- Гипоспермией (снижение объема эякулята).
- Маркерами воспаления (повышение количества лейкоцитов и уровня эластазы в эякуляте) [24].
Вывод для практики. Влияние C. trachomatis на мужскую фертильность носит, по-видимому, не прямой токсический на сперматозоиды, а опосредованный характер. Воспаление, вызванное хламидиями, например, в придатке яичка, вероятно, приводит к обструкции семявыносящих путей, что и проявляется гипоспермией (снижением объема) и, как следствие, бесплодием [25]. Это чисто урологическая патология, требующая соответствующего подхода.
5. Рецидивы, партнеры и последующее наблюдение
5.1. Феномен «рецидива»
Частота повторных положительных тестов после лечения хламидиоза удручающе высока и достигает 13-26% в течение года [20]. Однако в подавляющем большинстве случаев (более 75%) это не «рецидив» и не «неудача лечения».
Это реинфекция от нелеченного полового партнера (или нового инфицированного партнера) [20]. Истинная неудача лечения, особенно при использовании доксициклина, встречается крайне редко.
5.2. «Test-of-Cure» (TOC – контрольное обследование) против «Retesting» (Повторное тестирование)
Клинические руководства строго разделяют эти два понятия, и их путаница в клинической практике недопустима.
-
TOC (Тест на излеченность или контрольное обследование):
- Тест, проводимый через 3-4 недели после окончания лечения, чтобы убедиться в эрадикации.
- Не рекомендуется для рутинного неосложненного хламидиоза [4].
- NAAT-тесты настолько чувствительны, что могут определять даже нежизнеспособную (мертвую) ДНК C. trachomatis в течение 3-4 недель после эффективной терапии, приводя к ложноположительным результатам и ненужному повторному лечению.
- Когда контрольное обследование не нужно: беременность (из-за высоких рисков для плода) [26] и лечение лимфогранулемы венерической (LGV) (требует 21-дневного курса) [27].
- Повторное тестирование для выявления реинфекции:
- Тест, проводимый через 3 месяца после лечения (или при следующем визите пациента в течение 12 месяцев) [4].
- Настоятельно рекомендуется всем пациентам (мужчинам и женщинам) [4].
Вывод для практики. Цель теста через 3 месяца — не проверка эффективности антибиотика, а выявление реинфекции. Пациента необходимо консультировать соответствующим образом: «…Мы проводим этот тест не для того, чтобы проверить, сработало ли лекарство, а для того, чтобы проверить, не заразились ли вы снова…». Это смещает фокус пациента с «плохого лекарства» на «важность лечения партнера».
5.3. Ведение половых партнеров
Успех лечения хламидиоза зависит от прерывания цепи передачи.
- Пациентам рекомендуется воздерживаться от половых контактов до завершения 7-дневного курса лечения (или в течение 7 дней после однократной дозы азитромицина) и до тех пор, пока все их половые партнеры (за последние 60 дней) не будут также пролечены [4].
- «Ускоренная» партнерская терапия
- «Ускоренная» партнерская терапия — это клиническая практика, при которой пациенту предоставляется рецепт на пероральные медикаменты для его/ее полового партнера без предварительного медицинского осмотра этого партнера [28].
- «Ускоренная» партнерская терапия является важной и эффективной стратегией. CDC рекомендует врачам рутинно предлагать эту методику пациентам с хламидиозом, если нет 100% уверенности, что все партнеры своевременно обратятся за лечением [28].
- Доказано, что «ускоренная» партнерская терапия снижает частоту реинфекции у индексного пациента на 20-25% [20].
- Режимы «ускоренной» партнерской терапии для хламидиоза: доксициклин 100 мг 2 р/д, 7 дней ИЛИ азитромицин 1 г однократно [29].
Вывод для практики. «Ускоренная» партнерская терапия — это прагматичный отход от догмы «не лечить без осмотра» ради достижения цели прерывания цепи передачи. В этом контексте азитромицин 1 г сохраняет свою важную роль. Несмотря на то, что доксициклин является препаратом выбора для пациента, азитромицин 1 г остается равнозначной и часто предпочтительной опцией терапии для партнера [29]. Для немотивированного партнера, которого врач не видит, 100% комплаентность однократной дозы азитромицина может перевесить 97% эффективность 7-дневного курса доксициклина, который этот партнер с высокой вероятностью не завершит.
6. Скрининг бессимптомных гетеросексуальных мужчин
В отличие от стратегии скрининга женщин, в отношении мужчин консенсус всех сообществ однозначен.
- Позиция USPSTF (США, 2021). Рабочая группа по превентивным мерам США заключает, что текущих доказательств недостаточно для оценки баланса пользы и вреда скрининга хламидиоза у сексуально активных мужчин (Grade I) [30].
- Позиция EAU (Европа, 2025). В руководстве EAU по урологическим инфекциям (2025) цитируется крупное когортное исследование, которое не показало пользы от скрининга мужчин на C. trachomatis в отношении снижения риска развития эпидидимита [11].
- Позиция IUSTI (Европа, 2025). Руководство обсуждает «отсутствие доказательств и ограниченную ценность широкого скрининга в бессимптомных популяциях» [12].
- Позиция CDC (США, 2021). CDC не рекомендует рутинный скрининг мужчин. Он лишь «допускается к рассмотрению» в клиниках с высокой распространенностью (например, клиники ИППП, пенитенциарные учреждения) [4].
Вывод для практики. Вся глобальная стратегия общественного здравоохранения по борьбе с хламидиозом построена на скрининге женщин, особенно в возрасте <25 лет, где доказано, что скрининг снижает риск развития воспалительных заболеваний органов малого таза (ВЗОМТ) [4]. Рутинный скрининг бессимптомных гетеросексуальных мужчин в общей популяции, в том числе в рутинной урологической практике, не рекомендуется и не поддерживается доказательной медициной.
7. Выводы
- Приоритет доксициклина. Доксициклин (100 мг 2 р/д, 7 дней) — новый международный стандарт и препарат выбора для лечения неосложненного хламидиоза всех локусов. Он демонстрирует значительно более высокую эффективность по сравнению с азитромицином в эрадикации бессимптомной ректальной инфекции — частого резервуара и причины неудач лечения.
- Диагностика — NAAT мочи. Золотой стандарт диагностики у мужчин — NAAT «первой порции» мочи. При этом отрицательный NAAT мочи или уретрального мазка не исключает изолированную персистенцию C. trachomatis в ткани предстательной железы, что важно учитывать при ведении пациентов с ХП/СХТБ.
- Лечение осложнений — эскалация. Урологические осложнения лечатся по отдельным протоколам. Острый хламидийный эпидидимит требует удлиненного (10 дней) курса доксициклина и эмпирического добавления цефтриаксона (для «перекрытия» N. gonorrhoeae).
- Управление партнерами — ключ к успеху. Большинство «рецидивов» — это реинфекции от нелеченных партнеров. Лечение партнеров, включая использование «ускоренной» партнерской терапии, является критическим фактором успеха терапии.
- Наблюдение — 3 месяца. Контрольное обследование через 3-4 недели рутинно не рекомендуется (риск ложноположительных NAAT). Обязательно повторное исследование через 3 месяца для выявления реинфекции.
8. Литература
- Newman, L., Rowley, J., Vander Hoorn, S., Wijesooriya, N. S., Unemo, M., Low, N., et al. (2015). Global estimates of the prevalence and incidence of four curable sexually transmitted infections in 2012 based on systematic review and global reporting. PloS One 10 (12), e0143304–e0143304. doi: 10.1371/journal.pone.0143304
- Rodrigues R, Marques L, Vieira-Baptista P, Sousa C, Vale N. Therapeutic Options for Chlamydia trachomatis Infection: Present and Future. Antibiotics (Basel). 2022 Nov 16;11(11):1634. doi: 10.3390/antibiotics11111634. PMID: 36421278; PMCID: PMC9686482.
- Mohseni M, Sung S, Takov V. Chlamydia. [Updated 2023 Aug 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK537286/
- Chlamydial Infections - STI Treatment Guidelines, Sexually Transmitted Infections Treatment Guidelines, 2021, https://www.cdc.gov/std/treatment-guidelines/chlamydia.htm
- Bonner M, Sheele JM, Cantillo-Campos S, Elkins JM. A Descriptive Analysis of Men Diagnosed With Epididymitis, Orchitis, or Both in the Emergency Department. Cureus. 2021 Jun 21;13(6):e15800. doi: 10.7759/cureus.15800. PMID: 34306868; PMCID: PMC8294204.
- Pendegast HJ, Leslie SW, Rosario DJ. Chronic Prostatitis and Chronic Pelvic Pain Syndrome in Men. [Updated 2024 Jan 11]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK599550/
- Rodrigues R, Sousa C, Barros A, Vale N. Chlamydia trachomatis: From Urogenital Infections to the Pathway of Infertility. Genes (Basel). 2025 Feb 7;16(2):205. doi: 10.3390/genes16020205. PMID: 40004534; PMCID: PMC11855039.
- White JA, Dukers-Muijrers NH, Hoebe CJ, Kenyon CR, DC Ross J, Unemo M. 2025 European guideline on the management of Chlamydia trachomatis infections. International Journal of STD & AIDS. 2025;36(6):434-449. doi:10.1177/09564624251323678
- Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов», Общероссийская общественная организация «Российское общество акушеров-гинекологов». Клинические рекомендации. Хламидийная инфекция. https://edu.rosminzdrav.ru/news/novosti/news/khlamidiinaja-infekcija-pojavilis-novye-klinicheskie-rek/
- Guidelines – American Urological Association, https://www.auanet.org/guidelines-and-quality/guidelines
- EAU Guidelines on Urological Infections https://d56bochluxqnz.cloudfront.net/documents/full-guideline/EAU-Guidelines-on-Urological-infections-2025_2025-05-24-110339_pxmf.pdf
- 2025 European guideline on the management of Chlamydia trachomatis infections. John A White, Nicole HTM Dukers-Muijrers, Christian JPA Hoebe, Chris R Kenyon, Jonathan DC Ross, Magnus Unemo. https://iusti.org/wp-content/uploads/2025/03/white-et-al-2025-2025-european-guideline-on-the-management-of-chlamydia-trachomatis-infections.pdf
- Páez-Canro C, Alzate JP, González LM, Rubio-Romero JA, Lethaby A, Gaitán HG. Antibiotics for treating urogenital Chlamydia trachomatis infection in men and non-pregnant women. Cochrane Database Syst Rev. 2019 Jan 25;1(1):CD010871. doi: 10.1002/14651858.CD010871.pub2. PMID: 30682211; PMCID: PMC6353232.
- Dombrowski JC, Wierzbicki MR, Newman LM, Powell JA, Miller A, Dithmer D, Soge OO, Mayer KH. Doxycycline Versus Azithromycin for the Treatment of Rectal Chlamydia in Men Who Have Sex With Men: A Randomized Controlled Trial. Clin Infect Dis. 2021 Sep 7;73(5):824-831. doi: 10.1093/cid/ciab153. PMID: 33606009; PMCID: PMC8571563.
- Chen LF, Wang TC, Chen FL, Hsu SC, Hsu CW, Bai CH, Hsu YP. Efficacy of doxycycline versus azithromycin for the treatment of rectal chlamydia: a systematic review and meta-analysis. J Antimicrob Chemother. 2021 Nov 12;76(12):3103-3110. doi: 10.1093/jac/dkab335. PMID: 34529798.
- Dukers-Muijrers NHTM, Wolffs PFG, De Vries H, Götz HM, Heijman T, Bruisten S, Eppings L, Hogewoning A, Steenbakkers M, Lucchesi M, Schim van der Loeff MF, Hoebe CJPA. Treatment Effectiveness of Azithromycin and Doxycycline in Uncomplicated Rectal and Vaginal Chlamydia trachomatis Infections in Women: A Multicenter Observational Study (FemCure). Clin Infect Dis. 2019 Nov 13;69(11):1946-1954. doi: 10.1093/cid/ciz050. PMID: 30689759; PMCID: PMC6853690.
- Sandoz KM, Rockey DD. Antibiotic resistance in Chlamydiae. Future Microbiol. 2010 Sep;5(9):1427-42. doi: 10.2217/fmb.10.96. PMID: 20860486; PMCID: PMC3075073.
- Jyoti Somani, Vinod B. Bhullar, Kimberly A. Workowski, Carol E. Farshy, Carolyn M. Black, Multiple Drug-Resistant Chlamydia trachomatis Associated with Clinical Treatment Failure, The Journal of Infectious Diseases, Volume 181, Issue 4, April 2000, Pages 1421–1427, https://doi.org/10.1086/315372
- Kissinger PJ, White S, Manhart LE, Schwebke J, Taylor SN, Mena L, Khosropour CM, Wilcox L, Schmidt N, Martin DH. Azithromycin Treatment Failure for Chlamydia trachomatis Among Heterosexual Men With Nongonococcal Urethritis. Sex Transm Dis. 2016 Oct;43(10):599-602. doi: 10.1097/OLQ.0000000000000489. PMID: 27631353; PMCID: PMC5033507.
- Marrazzo J, Suchland R. Recent advances in understanding and managing Chlamydia trachomatis infections. F1000Prime Rep. 2014 Dec 1;6:120. doi: 10.12703/P6-120. PMID: 25580274; PMCID: PMC4251420.
- https://www.cdc.gov/std/treatment-guidelines/wall-chart.pdf
- Nickel JC. Chronic epididymitis: a practical approach to understanding and managing a difficult urologic enigma. Rev Urol. 2003 Fall;5(4):209-15. PMID: 16985840; PMCID: PMC1553215.
- Bielecki R, Ostaszewska-Puchalska I, Zdrodowska-Stefanow B, Baltaziak M, Skawrońska M, Sokołowska M. The presence of Chlamydia trachomatis infection in men with chronic prostatitis. Cent European J Urol. 2020;73(3):362-368. doi: 10.5173/ceju.2020.0040. Epub 2020 Sep 15. PMID: 33133666; PMCID: PMC7587489.
- Zhou H, Wu S, Tang X, Zhou G, Yuan J, Li Q, Chen Y, Xu X, Sun X, Zhu D, Luo Y. Chlamydia trachomatis infection in the genital tract is associated with inflammation and hypospermia in the infertile male of China. Asian J Androl. 2022 Jan-Feb;24(1):56-61. doi: 10.4103/aja.aja_54_21. PMID: 34145079; PMCID: PMC8788609.
- Paira DA, Olmedo JJ, Olivera C, Tissera AD, Molina RI, Rivero VE, Motrich RD, Saka HA. Chronic epididymitis due to Chlamydia trachomatis LGV-L2 in an HIV-negative heterosexual patient: a case report. Front Public Health. 2023 May 9;11:1129166. doi: 10.3389/fpubh.2023.1129166. PMID: 37228719; PMCID: PMC10203518.
- https://www.cdc.gov/std/treatment-guidelines/screening-recommendations.htm
- Yonke N, Aragón M, Phillips JK. Chlamydial and Gonococcal Infections: Screening, Diagnosis, and Treatment. Am Fam Physician. 2022 Apr 1;105(4):388-396. PMID: 35426632.
- https://www.cdc.gov/sti/hcp/clinical-guidance/expedited-partner-therapy.html
- https://www.hivguidelines.org/guideline/sti-ept/
- https://www.uspreventiveservicestaskforce.org/uspstf/recommendation/chlamydia-and-gonorrhea-screening







 Скачать
Скачать












Комментарии