А.И. Неймарк1, М.А. Тачалов2, Б.А. Неймарк1, Е.В. Гамеева3, В.П. Левин1
1 Кафедра урологии и андрологии с курсами специализированной хирургии ФГБОУ ВО Алтайский государственный медицинский университет Росздрава, г. Барнаул
2 Отделенческая клиническая больница на ст. Барнаул ОАО «РЖД». Урологическое отделение, г. Барнаул
3 МНИОИ им. П.А.Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России, г.Москва
Тенденция к увеличению продолжительности жизни населения в развитых странах, современные диагностические технологии и результат работы скрининговых программ по ранней выявляемости злокачественных новообразований, являются основными причинами прогрессивного прироста уровня заболеваемости раком предстательной железы (РПЖ) в индустриально развитых странах, в том числе и России, с достижением уровня заболеваемости более 30 на 100 тыс. мужского населения [1,2].
В настоящее время проблема выбора метода лечения локализованного РПЖ у пациентов, которым противопоказаны радикальные методы, является актуальной.
Одним из методов малоинвазивной хирургии РПЖ, обладающей эффективностью и безопасностью, стал высокоинтенсивный сфокусированный ультразвук (High Intensity Focused Ultrasound). Метод НIFU-терапии в лечении РПЖ используется на протяжении более 15 лет. Существует множество публикаций, в которых анализируется радикальность данного метода, его эффективность и безопасность, показания к применению [3-10].
В литературе недостаточно данных по изучению эффективности комбинации HIFU и андрогенной депривации, недостаточно изучены методы контроля эффективности лечения с помощью лазерной доплеровской флоуметрии (ЛДФ) и цветного доплеровского картирования (ЦДК).
Последние годы в урологии отмечается пристальный интерес специалистов к рентгенэндоваскулярным методам лечения урологических заболеваний. Метод рентгенэндоваскулярной эмболизации артерий предстательной железы (ПЖ) при доброкачественной гиперплазии ПЖ (ДГПЖ) стал эффективным, улучшающим качество жизни и безопасным методом лечения у пациентов, которым не показано хирургическое лечение [11-13].
Впервые эффективность методики химиоэмболизации (ХЭ) при раке мочевого пузыря, раке почки и РПЖ продемонстрировали японские ученые [14]. Развитие интервенционной хирургии позволило разработать и внедрить различные схемы ХЭ при злокачественных опухолях печени, поджелудочной железы, почки и мочевого пузыря и в онкогинекологии [15-20].
Отсутствие в отечественной и зарубежной литературе сведений об эффективности комбинации HIFU-терапии и андрогенной депривации, результатах ХЭ при локализованном РПЖ и состоянии микроциркуляции и гемодинамики ПЖ после HIFU-терапии и ХЭ явилось основанием для проведения данной исследовательской работы.
Цель исследования – cравнить результаты различных методов лечения локализованного РПЖ у пациентов, которым не показаны радикальные методы.
МАТЕРИАЛЫ И МЕТОДЫ
Работа основана на анализе данных лечения 145 пациентов с локализованным РПЖ, которым проведены малоинвазивные методы лечения. Все пациенты были разделены на 3 группы, согласно проведенному методу лечения. I группа: 66 (45,5%) пациентов с локализованным РПЖ, которым проведена HIFU-терапия. II группа: 42 (28,9%) пациента локализованным РПЖ, им выполнена HIFU-терапия с последующим (адъювантным) назначением гормональной терапии в режиме максимальной андрогенной блокады в течении 6-ти месяцев. III группа: 37 (25,5%) пациентов с локализованным РПЖ, которым проведена суперселективная рентгенэндоваскулярная химиоэмболизация.
В нашем исследовании объем ПЖ являлся основным критерием выбора исследуемой группы. Пациентам с объемом ПЖ менее 40 см3 применялась только HIFU – терапия. Адъювантная андрогенная депривация проводилась после проведения HIFU – терапии у пациентов с объемом ПЖ от 40 до 60 см3 . ХЭ выполнялась пациентам с объемом ПЖ более 60 см3 . Средний объем ПЖ в группе ХЭ составил 72,8,4±2,3 см3 , в группе HIFU и HIFU+ ГТ средний объем ПЖ составил 34,3± 1,6 и 51,1±1,9 см3 , соответственно.
Обследование пациентов, вошедших в исследование, начиналось с подробного осмотра, выяснения анамнеза жизни, сопутствующей патологии. Все пациенты консультированы терапевтом или другими смежными специалистами. Диагностика РПЖ, его прогрессирования, выявление осложнений проведенного лечения проводились посредством комплексного обследования, включающего: определение уровня простатического специфического антигена (ПСА), пальцевое ректальное исследование, трансректальное ультразвуковое исследование (ТРУЗИ) с цветовым допплеровским картированием, магнитно-резонансную томографию органов малого таза с контрастированием, урофлоуметрию, сцинтиграфию скелета. Проводилось анкетирование по шкале IPSS.
Исследование уровня ПСА в сыворотке крови определяли с помощью системы ARCHITECT i. Всем пациентам ТРУЗИ проводилось на аппарате Acuson «S 2000» (Siemens, Германия) c использованием внутриполостного конвексного датчика (с частотами 4-8 МГц). Уродинамическое исследование проводилось на аппарате «Laborie Delphis IP», США и включало в себя проведение урофлоуметрии. Основным критерием, характеризующий качество мочеиспускания, был выбран Qmax.
Для оценки микроциркуляции в ПЖ методом ЛДФ использовался аппарат «ЛАКК-02» (НПП «ЛАЗМА», Россия).
Всем пациентам перед HIFU, выполнялась трансуретральная резекция предстательной железы (ТУР ПЖ). HIFU-терапия выполнялась на аппарате «Ablatherm» (EDAP TMS S.A., ВОЛЬ-ан-Велин, Франция). Внутрисосудистые диагностические и лечебные вмешательства выполняли в условиях рентгенооперационной на ангиографическом комплексе Innova 4100IQ GENERAL ELECTRIC (США).
Химиопрепаратом для проведения процедуры ХЭ служил веро-митомицин в дозировке 20 мг. В качестве источника транспортировки химиопрепарата применялись микросферы HepaSphere™ (Гепасферы).
В работе использованы различные методы статистической обработки в зависимости от типа случайных величин и поставленной задачи исследования.
Для оценки типа распределения признаков использовали показатели эксцесса и асимметрии, характеризующие форму кривой распределения. Распределение считали нормальным при значении данных показателей от -2 до 2.
Значения непрерывных величин представлены в виде M±m,где M – выборочное среднее арифметическое и m – стандартная ошибка среднего.
В случаях нормального распределения, а также равенства выборочных дисперсий, для сравнения выборок использовали t-критерийСтьюдента. Равенство выборочных дисперсий оценивали по F-критерию Фишера. Для сравнения связанных выборок использовали парный t-критерий Стьюдента.
В случае распределений, не соответствующих нормальному закону, а также при неравенстве дисперсий, использовали непараметрические U-критерий Манна- Уитни (для независимых выборок) и T-критерий Вилкоксона (для связанных выборок).
Уровень статистической значимости при проверке нулевой гипотезы принимали соответствующий р<0,05. Во всех случаях использовали двусторонние варианты критериев. При сравнении нескольких групп между собой использовали поправку Бонферрони на множественность сравнений.
Оценка актуариальной одно- и трехлетней выживаемости производилась по методу Каплана – Майера.
Обработку и графическое представление данных проводили с помощью компьютерных программ Statistica 10 и Excel 2007.
РЕЗУЛЬТАТЫ
При анализе показателя уровня ПСА, как основного параметра эффективности лечения, отмечается его значительное снижение после проведенного лечения, во всех исследуемых группах (рис. 1).
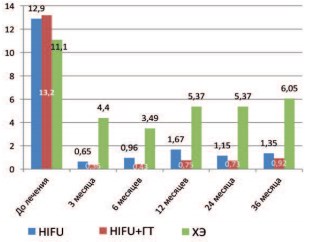
Рис. 1. Динамика уровня ПСА в различных группах после лечения
При сравнительном анализе показателей уровня ПСА в группах отмечается, что данный показатель достоверно ниже в группах пациентов, получивших HIFU терапию (I и II группы), в сравнении с группой пациентов, перенесших ХЭ. Наименьшие значения уровня ПСА отмечено во II группе (больные получали гормональную терапию в адъювантом режиме). Показатели ПСА в I и II группах достоверно не отличаются в течение первого месяца после HIFU-терапии, но уже к 3 месяцу и при дальнейшем наблюдении, уровень ПСА достоверно (р<0,001) ниже в группе пациентов, получавших гормональную терапию в адъювантом режиме. Уровень ПСА в группе ХЭ достоверно снижаются уже через 1 месяц после лечения и данная тенденция сохранялась на весь период наблюдения (рис. 2).
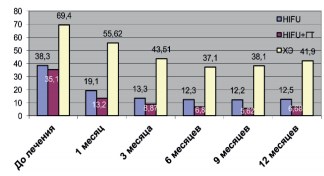
Рис. 2. Динамика объема ПЖ в различных группах после лечения
Анализ показателя объема ПЖ в группах показал, что значительное уменьшение объема ПЖ после лечения происходило во всех исследуемых группах. Максимальное снижение объема ПЖ наблюдалось в группе пациентов, перенесших HIFU в сочетании с гормональной терапией. При сравнении объема ПЖ в группах следует, что применение гормональной терапии в адъювантном режиме, достоверно уменьшает объем ПЖ, в сравнении с группой пациентов, перенесших только HIFU терапию. Сравнение влияния на объем ПЖ двух методов лечения локализованного РПЖ показало, значительное уменьшение объема ПЖ достигается с применением HIFU терапии по сравнению методом ХЭ.
Уменьшение размеров ПЖ сопровождалось уменьшением выраженности инфравезикальной обструкции и уменьшением симптомов нарушения функции нижних мочевых путей (рис. 3, 4).
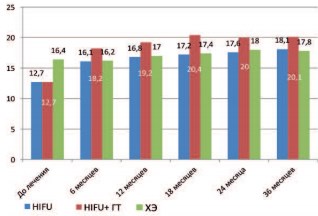
Рис. 3. Динамика максимальной скорости мочеиспускания в различных группах после лечения
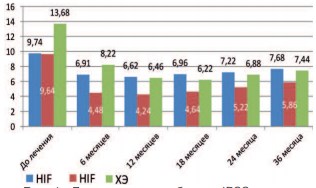
Рис. 4. Динамика суммы баллов IPSS в различных группах после лечения
По результатам проведения урофлоуметрии до лечения и в дальнейшем каждые 6 месяцев, отмечено, что показатель максимальной скорости мочеиспускания (Qmax) увеличивается во всех группах через 6 месяцев после лечения и сохраняется на всем протяжении периода наблюдения. Статистически значимое (р<0,001) увеличение показателя Qmax отмечено в группе HIFU+ГТ в сравнении с другими исследуемыми группами. Статистически значимых различий показателя Qmax в группах HIFU и ХЭ не выявлено. При оценке выраженности СНМП отмечено, что заметное улучшение симптоматики, сопровождающееся значимым снижением суммарного балла IPSS, происходит уже через 6 месяцев после лечения во всех исследуемых группах. Снижение суммарного балла IPSS до лечения и после лечения были достоверными во всех группах (р<0,001), наибольшее снижение этого показателя отмечено в группе больных, получавших антиандрогенную депривацию (р<0,001) и не было статистически достоверным (р=0,101) в группах HIFU и ХЭ после лечения.
При сравнении показателей безрецидивной выживаемости следует, что применение антиандрогенной депривации после HIFU – терапии, не влияет на вероятность рецидивирования в течение 1-го года и достоверно увеличивает безрицидивный период с 68 (в группе HIFU) до 88% (в группе HIFU в сочетании с антиандрогенной депривациейв течение трех лет после HIFU-терапии.
Сравнительный анализ общей выживаемости в исследуемых группах показал высокую эффективность HIFU-терапии и химиоэмболизации в лечении локализованного РПЖ. Показатели однолетней общей выживаемости в исследуемых группах были одинаковыми и составили 100%. Показатели трехлетней общей выживаемости оказались лучше в группе HIFU в сочетании гормональной терапией. При сравнении общей выживаемости в группах отмечено, что результат сравнения группы HIFU+ГТ и группы ХЭ был достоверный (р=0,022). Показатель достоверности в группах HIFU и HIFU+ГТ, составил 0,381. Показатель достоверности в группах HIFU и ХЭ, составил 0,089. Применение гормональной терапии после HIFU, достоверно улучшает результаты трехлетней безрецидивной выживаемости с 68 до 88%. Показатель общей 3-летней выживаемости был достоверно выше в группе HIFU+ГТ (100%) по сравнению с группой ХЭ (82%).
Основными параметрами исследования микроциркуляции в ПЖ методом ЛДФ в нашей работе стали сл. показатели: статистически усредненный показатель микроциркуляции (ПМ); показатель, отражающий поток эритроцитов, среднеквадратичное отклонение (СКО); коэффицент вариации (КВ) (Kv= у/M x 100%) – соотношение между перфузией ткани и величиной ее изменчивости.
Показатели микроциркуляции в группах HIFU и HIFU+ГТ достоверно не отличались. Аналогичные показатели в группе ХЭ были достоверно выше, что связано с большим объемом ПЖ. При исследовании таких показателей микроциркуляции, как ПМ и СКО до лечения достоверно выявлена прямая корреляционная связь с объемом ПЖ. Чем больше объем ПЖ, тем выше данные показатели. Коэффициент корреляции (r) в группе HIFU составил 0,80 для ПМ и 0,75 – для СКО. Аналогичный показатель в группе HIFU+ГТ составил 0,83 и 0,60. В группе ХЭ коэффициент корреляции для ПМ – 0,85 и СКО – 0,70.
При изучении показателя ПМ отмечено достоверное (р<0,001) снижение данного показателя уже через 3 месяца после лечения во всех исследуемых группах. За весь период наблюдения данный показатель оставался стабильным. При сравнении показателя ПМ между группами получены следующие результаты: наименьшее значение ПМ наблюдалось в группе HIFU+ГТ; в группе ХЭ данный показатель был выше по сравнению с группами, перенесших HIFU (рис. 5).
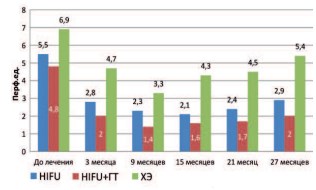
Рис. 5. Динамика показателя микроциркуляции в исследуемых группах после лечения
При изучении параметра СКО отмечено достоверное (р<0,001) снижение данного показателя уже через 3 месяца после лечения, во всех исследуемых группах. Наименьшее значение СКО наблюдалось в группе HIFU+ГТ (рис. 6).
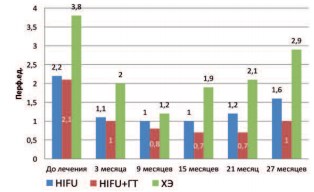
Рис. 6. Динамика среднеквадратичного отклонения в исследуемых группах после лечения
При изучении параметра КВ отмечено достоверное снижение данного показателя уже через 3месяца после лечения, во всех исследуемых группах. В группах HIFU+ГТ и ХЭ показатель достоверности (р) составил < 0,001, а в группе HIFU – 0,012. (рис. 7)
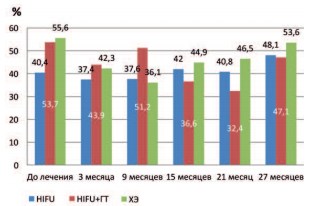
Рис. 7. Динамика коэффициента вариации в исследуемых группах после лечения
Исследование состояния микроциркуляции в ПЖ у больных с локализованным РПЖ продемонстрировало наличие характерных изменений. Применение HIFU-терапии и рентгенэндоваскулярной химиоэмболизации достоверно уменьшает микрокровоток в ПЖ, что является критерием эффективности лечения. Применение гормональной терапии в адъювантом режиме после HIFU достоверно уменьшает показатели микроциркуляции по сравнению с HIFU- терапией.
При исследовании микроциркуляции в ПЖ после HIFU-терапии, отмечена прямая корреляционная связь увеличения основных параметров микроциркуляции с рецидивом заболевания.
Так как зависимая переменная атрибутивная (принадлежность к подгруппе с рецидивом или без него), то корреляцию между ней и независимыми количественными переменными (показатели микроциркуляции) можно отразить только путем проверки значимости различий между подгруппами. Такую «корреляцию» лучше называть просто зависимостью, так как собственно коэффициент корреляции здесь не рассчитывается. Так как разные показатели микроциркуляции имеют различную размерность, то масштабы их графического представления в абсолютных единицах по вертикальной оси тоже будут различаться. Поэтому все показатели были нормированы в процентах – все их значения были сведены к процентной шкале. За 100% были приняты средние значения показателей микроциркуляции в подгруппах с рецидивами, а относительно них были рассчитаны средние значения в процентах для подгрупп без рецидивов.
Зависимость развития рецидивов после HIFU от показателей микроциркуляции в ПЖ отображена на рисунках 8 и 9.
Как следует из рисунков, в группах пациентов, перенесших HIFU, прослеживается четкая закономерность развития рецидива. В подгруппе пациентов с рецидивами показатели микроциркуляции после лечения не изменялись как в группе HIFU, так и в группе HIFU+ГТ.
Одним из методов, используемых нами, для оценки состояния кровообращения в предстательной железе являлся метод цветового допплеровского картирования при проведении трансректального ультразвукового исследования, при котором проводилось определение количественных характеристик допплеровского спектра.
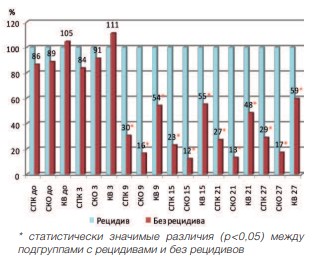
Рис. 8. Зависимость показателей микроциркуляции от развития рецидива в группе HIFU
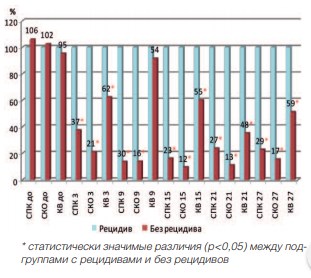
Рис. 9. Зависимость показателей микроциркуляции от развития рецидива в группе HIFU+ГТ
Исследование пиковой линейной скорости (ПЛС), т.е. наибольшей линейной скоростью движения крови в сосуде в момент систолы, показало, что данный показатель достоверно уменьшается через 3 месяца после лечения во всех группах (р<0,001). При последующем наблюдение данный показатель остается относительно стабильным во всех исследуемых группах. При сравнении ПЛС отмечено, что наименьшее значение данного показателя наблюдалось в группе HIFU+ГТ (рис. 10).
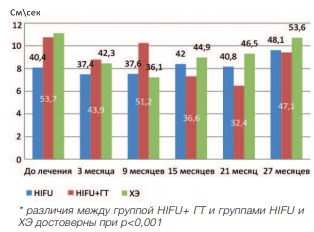
Рис. 10. Динамика пиковой линейной скорости в группах
Исследование средней линейной скорости (СЛС) показало, что данный показатель достоверно уменьшается через 3 месяца после лечения во всех группах (р<0,001) (рис. 11)
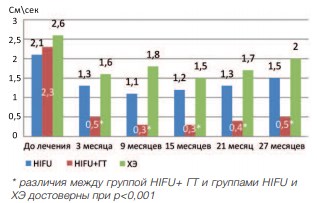
Рис. 11. Динамика средней линейной скорости в группах
При последующем наблюдении данный показатель остается относительно стабильным во всех исследуемых группах. При сравнении СЛС в исследуемых группах отмечено, что наименьшее значение данного показателя наблюдалось в группе HIFU+ГТ.
Исследование показателя объемной скорости кровотока (ОСК), который характеризует количество крови, проходящее через поперечное сечение сосуда за 1 минуту, показало, что данный показатель достоверно уменьшается через 3 месяца после лечения во всех группах (р<0,001). При последующем наблюдение данный показатель остается относительно стабильным во всех исследуемых группах. При сравнении ОСК в исследуемых группах отмечено, что наименьшее значение данного показателя наблюдалось в группе HIFU+ГТ (рис. 12).
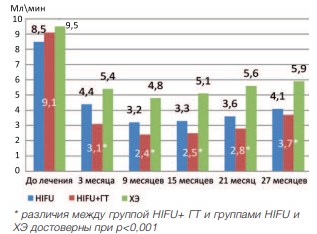
Рис. 12. Динамика объемной скорости кровотока в группах
Пульсовой индекс (ПИ) и индекс резистентности (ИР) так же достоверно уменьшается через 3 месяца после лечения во всех группах (р<0,001). При последующем наблюдении данный показатель остается относительно стабильным во всех исследуемых группах. При сравнении ПИ отмечено, что наименьшее значение данного показателя наблюдалось в группе HIFU+ГТ (рис. 13,14).
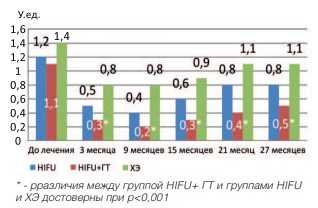
Рис. 13. Динамика пульсового индекса в группах
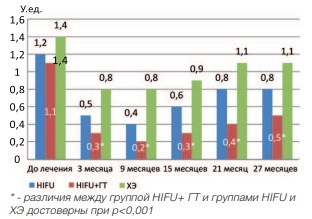
Рис. 14. Динамика индекса резистентности в группах
Применение HIFU-терапии и ХЭ, достоверно снижает показатель объемной плотности сосудистого сплетения во всех исследуемых группах после лечения (р<0,05) (табл. 1).
Таблица 1. Динамика объемной плотности сосудистого сплетения в группах
| 3 месяца | 9 месяцев | 15 месяцев | 21 месяцев | 27 месяцев | р | |
|---|---|---|---|---|---|---|
| HIFU(1) | 0,35±0,17 (периферия) 0 (центр) | 0,44±0,17 (периферия) 0 (центр) | 0,48±0,12 (периферия) 0,1±0,03 (центр) | 0,89±0,18 (периферия) 0,1±0,06 (центр) | 0,92±0,17 (периферия) 0,1±0,07 (центр) | р1-2<0,05 |
| HIFU+ГТ(2) | 0,14±0,07 (периферия) 0 (центр) | 0,16±0,09 (периферия) 0 (центр) | 0,21±0,11 (периферия) 0 (центр) | 0,24±0,06 (периферия) 0 (центр) | 0,44±0,17 (периферия) 0 (центр) | р2-3<0,001 |
| ХЭ(3) | 1,22±0,13 (периферия) 0,2±0,03 (центр) | 1,84±0,12 (периферия) 0,3±0,05 (центр) | 1,88±0,17 (периферия) 0,3±0,07 (центр) | 1,99±0,18 (периферия) 0,3±0,03 (центр) | 2,1±0,07 (периферия) 0,4±0,09 (центр) | р1-2<0,05 |
Проведение статистического анализа показателей ЦДК после лечения в группах пациентов, перенесших HIFU-терапию, подтвердило наличие корреляционной зависимости увеличенияпоказателей ЦДК от развития рецидива заболевания. Коэффициент корреляции в этом случае равен г=0,89 (р<0,001). Сравнение показателей ЦДК после HIFU-терапии у пациентов с рецидивом заболевания и пациентов без рецидива, представлено на рисунках 15 и 16.
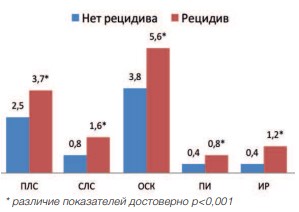
Рис. 15. Показатели ЦДК через 3 месяца после HIFU
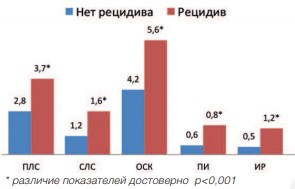
Рис. 16. Показатели ЦДК через 12 месяцев после HIFU
Наше исследование демонстрирует, что улучшение микроциркуляции в ПЖ сопряжено с высоким риском рецидивирования. Как следует из рисунков 15 и 16, пациенты, у которых через 1 год выявлен рецидив, имели увеличение показателей ЦДК уже через 3 месяца после лечения. В дальнейшем данные показатели прогрессивно увеличивались.
При проведении лечения локализованного РПЖ методом HIFU терапии и HIFU с последующим назначением андрогенной депривации нами оценивался профиль безопасности как во время самой процедуры HIFU, так и на всем протяжении наблюдения. Нами выполнена оценка качества лечения у 108 пациента с РПЖ, которым выполнена HIFU-терапия. Осложнений и нежелательных реакций во время самой процедуры HIFU мы не наблюдали.
Осложнения, связанные с HIFU терапией представлены в таблице 2.
Таблица 2. Осложнения HIFU-терапии в I и II группах
| Осложнение | HIFU | HIFU+ГТ | ||
|---|---|---|---|---|
| Абс | % | Абс | % | |
| Задержка мочи | 11 | 16,6 | 7 | 16,6 |
| Воспаление ВМП | 5 | 7,5 | 3 | 7,1 |
| Воспаление НМП | 14 | 21,2 | 10 | 23,8 |
| Орхоэпидидимит | 3 | 4,5 | 4 | 9,5 |
| Недержание I ст. | 11 | 16,6 | 7 | 16,6 |
| Недержание II ст | 4 | 6,0 | 2 | 4,7 |
| Стриктура уретры | 14* | 21,2 | 3* | 7,1 |
| ЭД | 24# | 36,3 | 22# | 52,3 |
При анализе осложнений в I и II группах отмечено отсутствие различий в развитии ранних осложнений и достоверное снижение частоты стриктур уретры при назначении адъювантной андрогенной депривации, которые мы наблюдали в сроки от 3 до 6 месяцев. Так же следует отметить, что в группе получавших гормональную терапию, прогрессивно увеличивалась частота эректильной дисфункции (ЭД) в сроки от 1 до 6 месяцев.
Известно, что при правильном соблюдении выполнения методики химиоэмболизации и использования микрокатетеров для суперселективной катетеризации побочные явления и осложнения возникают редко. Как правило, они связаны с частичным некрозом опухоли и ишемическими изменениями в соседних органах, кровоснабжающихся от артерий, подвергавшихся эмболизации. При этом, чем меньше диаметр частиц, использованных для эмболизации, тем большее число осложнений следует ожидать. Постэмболизационный синдром, включающий в себя боль внизу живота, повышение температуры тела и симптомы интоксикации, продолжается, как правило, не более 2-3 суток. Большинство наших больных в послеоперационном периоде отмечали боль внизу живота и промежности различной интенсивности, некоторые – повышение температуры, тошноту и рвоту, которые купировались, как правило, в течение первых суток при соответствующем лечении. Инфекционных осложнений, связанных с проникновением микроорганизмов в очаг некроза, не наблюдалось. Мы наблюдали одно ишемическое осложнение, связанное с недостаточным кровоснабжением соседних органов. А именно, ишемию и частичный некроз головки полового члена. Осложнения после проведения ХЭ у больных РПЖ, представлены в таблице 3.
Таблица 3. Осложнения у пациентов с РПЖ после проведения ХЭ
| Осложнение | Абс | % |
|---|---|---|
| Болевой синдром | 18 | 48,6 |
| Гипертермия | 8 | 21,6 |
| Лейкоцитоз, ускорение СОЭ | 6 | 16,2 |
| Гематома в области пункции бедренной артерии | 2 | 5,4 |
| Тошнота и рвота | 5 | 13,5 |
| Нарушение кровоснабжения соседних oрганов | 1 | 2,7 |
Все осложнения, которые мы наблюдали после проведения химиоэмболизации, развивались в первые сутки после процедуры и их длительность не превышала 7-14 дней.
ОБСУЖДЕНИЕ
Пациенты с локализованным РПЖ не подлежащие по тем или иным причинам радикальному хирургическому лечению надеются на качественное и эффективное лечение. В последнее время все больше внимание уделяется фокальным методам лечения РПЖ. Одним из методов фокальной терапии, обеспечивающим радикальность лечения и минимальное количество осложнений является высокоинтенсивная сфокусированная ультразвуковая абляция – HIFU. В нашем исследовании показано улучшение результатов лечения пациентов с локализованным РПЖ, перенесших HIFU – терапию, с помощью назначения андрогенной депривации в адъювантном режиме. Проведенное исследование показало, что применение андрогенной депривации в течение 6 месяцев после HIFU, позволяет достичь наибольшего снижения уровня ПСА и положительно влияет на симптомы заболевания. Комбинированное применение HIFU и ГТ существенно снижает клинические проявления болезни и улучшает качество жизни пациентов с РПЖ пролеченных методом HIFU – терапии, снижая выраженность инфравезикальной обструкции (по данным урофлоуметрии и оценке по шкале IPSS), способствует уменьшению объема ПЖ по сравнению с пациентами, перенесших только HIFU.
Возникновение методики химиоэмболизации было бы невозможно без использования всей совокупности научных и клинических исследований, проводившихся учеными на протяжении столетий в области других методик. По сути химиоэмболизация в ее современном виде возникла на основе опыта внутрисосудистых исследований, интервенционной радиологии, системной химиотерапии и эмболотерапии
Разработка метода внутриартериальной регионарной химиотерапии проводилась еще в 70-е годы XX столетия [21]. Показаниями к ней стали считать наличие, местно-распространенных опухолей, рецидивов в зоне первичной опухоли или региональных лимфатических узлах, а также единичные отдаленные метастазы, выявленные после хирургического лечения
Популярность метода ХЭ обусловливается малой травматичностью, а также низкой частотой осложнений. Однако для получения максимального эффекта от химиоэмболизации необходимо учитывать такие показатели как тип опухоли, ее происхождение, локализацию, чувствительность пораженной ткани к химиопрепаратам, а также тип и количество эмболизирующего носителя препарата.
Химиоэмболизация при РПЖ является довольно новым и эффективным методом лечения, расширяющими возможности медицинской помощи различным группам пациентов. Опыт химиоэмболизации при РПЖ показал эффективность и безопасность ее применения у пациентов, не подлежащих радикальному лечению.
ЗАКЛЮЧЕНИЕ
Применение малоинвазивных методов лечения локализованного РПЖ, таких как HIFU-терапия и химиоэмболизация, имеют высокие показатели как безрецидивной, так и общей выживаемости. Так, однолетняя безрецидивная выживаемость составила 95% в группе HIFU и 93% в группе HIFU+ГТ; трехлетняя безрецидивная выживаемость составила 68% в группе HIFU и 88% в группе HIFU+ГТ. Общая выживаемость в течение первого года после лечения составила 100% во всех исследуемых группах. Трехлетняя общая выживаемость составила 82% в группе ХЭ; 100% – в группе HIFU + ГТ и 97% – в группе HIFU.
Использование гормональной терапии после HIFU, достоверно улучшает результаты трехлетней безрецивной выживаемости с 68 до 88%. Показатель общей трехлетней выживаемости был достоверно выше в группе HIFU+ГТ по сравнению с группой ХЭ. Оптимизация метода HIFU-терапии путем добавления в программу лечения адъювантного курса андрогенной депривации позволяет улучшить онкологические и функциональные результаты лечения РПЖ.
Метод рентгенэндоваскулярной химиоэмболизации в лечении локализованного РПЖ позволяет достоверно снизить уровень ПСА с 11,1±1,0 (до лечения) до 5,42±0,24 (через 12 месяцев); значительно уменьшить объем ПЖ с 69,4±2,3 до 41,1±1,2; улучшить функциональные результаты за счет значимого увеличения максимальной скорости мочеиспускания с 12,2±0,3 до 19,8± 0,4 и снижением суммарного балла IPSS с 13,68±0,81 до 4,02±0,1. Онкологическая выживаемость при использовании данного метода составила 100% в течение первого года и 82% – в течение трех лет.
Применение HIFU-терапии и рентгенэндоваскулярной химиоэмболизации достоверно уменьшает микрокровоток в ПЖ, что является критерием эффективности лечения. Применение гормональной терапии после HIFU в адъювантном режиме достоверно уменьшает показатели микроциркуляции, по сравнению с HIFU- терапией. При исследовании микроциркуляции в ПЖ с помощью ЛДФ и ЦДК, после HIFU-терапии отмечена прямая корреляционная связь увеличения основных параметров микроциркуляции с возникновением рецидива заболевания.
ЛИТЕРАТУРА
- Каприн А. Д., Старинский В. В., Петрова Г. В., 2014. Состояние онкологической помощи населению России в 2013 году. М., 2014. С. 18
- Bolla M, Collette L, Blank L, Warde P, Dubois JB, Mirimanoff RO, et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002;360(9327):103-6.
- Beerlage HP, van Leenders GJ, Oosterhof GO, Witjes JA, Ruijter ET, van de Kaa CA, et al. High-intensity focused ultrasound followed after one to two weeks by radical retropubic prostatectomy: Results of a prospective study / H.P. Prostate 1999;39(1):41-46.
- Chaussy C, Thuroff S, Zimmermann R. Localized prostate cancer treated by transrectal high intensity focused ultrasound (HIFU). Outcome of 150 patients after 3 years. J Urol 1999;161:331.
- Chaussy C, Thuroff S. The status of high-intensity focused ultrasound in the treatment of localized prostate cancer and the impact of acombined resection. Curr Urol Rep 2003;4(3):248-252.
- Poissonnier L, Chapelon JY, Rouvière O, Curiel L, Bouvier R, Martin X, Dubernard JM, et al. Control of prostate cancer by transrectal HIFU in 227 patients. Eur Urol 2007;51(2):381- 387. doi 10.1016/j.eururo.2006.04.012.
- Фомкин Р. Н., Воронина Е. С., Попков В. М., Маслякова Г. Н., Блюмберг Б. И.Трехлетние результатылечения локализованного рака простатывысокоинтенсивнымсфокусированным. Урология 2014;(1):37-43.
- Ganzer R, Fritsche HM, Brandtner A, Bründl J, Koch D, Wieland WF, et al. Fourteen-year oncological and functional outcomes of high-intensity focused ultrasound in localized prostate. BJU Int 2013;112(3):322-329. doi: 10.1111/j.1464-410X.2012.11715.x.
- Crouzet S,Chapelon JY, Rouvière O, Mege-Lechevallier F,Colombel M, Tonoli-Catez H, et al. Whole-gland ablation of localized prostate cancerwith high-intensity focused ultrasound: oncologic outcomes and morbidity in 1002 patients. Eur Urol 2014;65(5):907-914. doi: 10.1016/j.eururo.2013.04.039.
- Лумпов И. С., Амосов А. В., Крупинов Г. Е., Безруков Е. А., Обухов А. А., Воробьев А. А .Фокальное лечение больных раком предстательной железыфокусированным высокоинтенсивным ультразвуком (HIFU). Медицинский вестник Башкортостана 2015;10(3):157-159.
- Яковец Е. А., Неймарк А. И.,Карпенко А. А.,Яковец Я. В.Эмболизация артерий предстательной железы в лечении больных аденомой предстательной железы с высоким хирургическим. Андрология и генитальная хирургия 2010;(1):38-43.
- Carnevale FC, Motta Leal Filho JM, AntunesAA, Cerri LM, Baroni RH, MarcelinoAZ, et al. Quality of life and symptoms relief support prostatic artery embolization for patients with acute urinary retention due to benign prostatic hyperplasia. JVIR 2012;23(3):4. doi: https://doi.org/10.1016/j.jvir.2011.12.036
- Pisco JM, Rio Tinto H, Campos Pinheiro L, Bilhim T, Duarte M, Fernandes L, et al. Embolisation of prostatic arteries as treatment of moderate to severe lower urinary symptoms (LUTS)secondary to benign hyperplasia:results ofshort- and mid-term follow-up. EurRadiol – 2013;23(9):2573-2574. doi: 10.1007/s00330-012-2714-9.
- Sato K, Kato T. Arterial chemoembolization using microencapsulated anticancer drugs. Gan To Kagaku Ryoho 1990;17(6):1105-1110.
- Гранов А. М. Центральный научно-исследовательский рентгенорадиологический институт Минздрава России сегодня. Приоритетные направления научных исследований. Новые технологии в медицинской радиологии: материалынаучной конференции. СПб., 2001. С. 12-14.
- Маковецкая К. Н., Сиротинкин Н. В., Карелин М. И., Гранов А. М. Патент 2073529. Российская Федерация, МПК A61L31/00. Композиция для эмболизации кровеносных сосудов /заявл. 19.05.95; опубл. 20.02.97. URL: http://www.freepatent.ru/patents/2073529.
- Анисимов В. Н.,Карелин М. И.,Таразов П. Г. Применение рентгеноэндоваскулярных вмешательств при лечении рака мочевого пузыря. Вестник. рентгенологии 1994;(1):43-45.
- Карелин М.И. Эндоваскулярная хирургия при кровоточащем раке мочевого пузыря: автореф. дис. ...к.м.н. СПб., 1992. 25 с.
- Суворова Ю. В., Таразов П. Г. Артериальная эмболизация при опухолях матки и мочевого пузыря, осложненных кровотечением. Паллиативная медицина и реабилитация 1999;(2):79-80.
- Yu L, Tan GS, Xiang XH, Guo WB, Li HP, Huang YH, et al. Comparison of uterine artery chemoembolization and internal iliac arterial infusion chemotherapy forthe combining treatment for women with locally advanced cervical cancer. Ai Zheng 2009;28(4):402-407.
- Гаспарян С. А., Островерхов Г. Е., Трапезников Н.Н. Региональная длительная внуриартериальная химиотерапия злокачественных опухолей. М.: Медицина, 1979. 208 c.
Статья опубликована в журнале"Экспериментальная и клиническая урология" №2 2018, стр. 20-27









Комментарии