Усупбаев А.Ч., Кабаев Б.А., Иманкулова А.С., Садырбеков Н.Ж., Кожомкулова К.А., Кравцов А.А.
Сведения об авторах:
- Усупбаев А.Ч. – д.м.н., профессор, заведующий кафедрой урологии и андрологии до- и последипломного обучения Кыргызской государственной медицинской академии им. И.К. Ахунбаева, usupbaevakylbek@rambler.ru
- Кабаев Б.А. – аспирант Кыргызского государственного медицинского института переподготовки и повышения квалификации; kabaevb-13@mail.ru
- Иманкулова А.С. – к.м.н., заведующая отделом управления качеством медицинской помощи Национального госпиталя Министерства здравоохранения Кыргызской Республики, urology.kg@gmail.com
- Садырбеков Н.Ж. – д.м.н., заведующий отделением общей урологии Национального госпиталя Министерства здравоохранения Кыргызской Республики, urology.kg@gmail.com
- Кожомкулова К.А. – врач отделения общей урологии Национального госпиталя Министерства здравоохранения Кыргызской Республики, urology.kg@gmail.com
- Кравцов А.А. – к.м.н. – руководитель Республиканского научно-практического центра инфекционного контроля при Научно-производственном объединении «Профилактическая медицина» Министерства здравоохранения Кыргызской Республики, urology.kg@gmail.com
Одной из актуальных проблем современной урологии и нефрологии являются инфекции мочевых путей (ИМП), и в особенности осложненная инфекция верхних мочевых путей (ОИВМП), возникающая на фоне нарушения оттока мочи любой этиологии – анатомических или структурных аномалий мочевой системы, сопутствующих хронических заболеваний (сахарный диабет, иммунодефицит, трансплантация почки и т.д.) [1-4]. В развитии осложненной инфекции мочевых путей (осложненного пиелонефрита) играют роль такие факторы, как камни любого отдела мочевых путей, новообразования, стриктуры лоханочно-мочеточникового сегмента и мочеточника, пузырно-мочеточниковый рефлюкс и др., инородные тела (уретральные и мочеточниковые катетеры и стенты, дренажи), предшествующие операции на почках и мочевыводящих путях или длительное нахождение в лечебном учреждении [4,5-7].
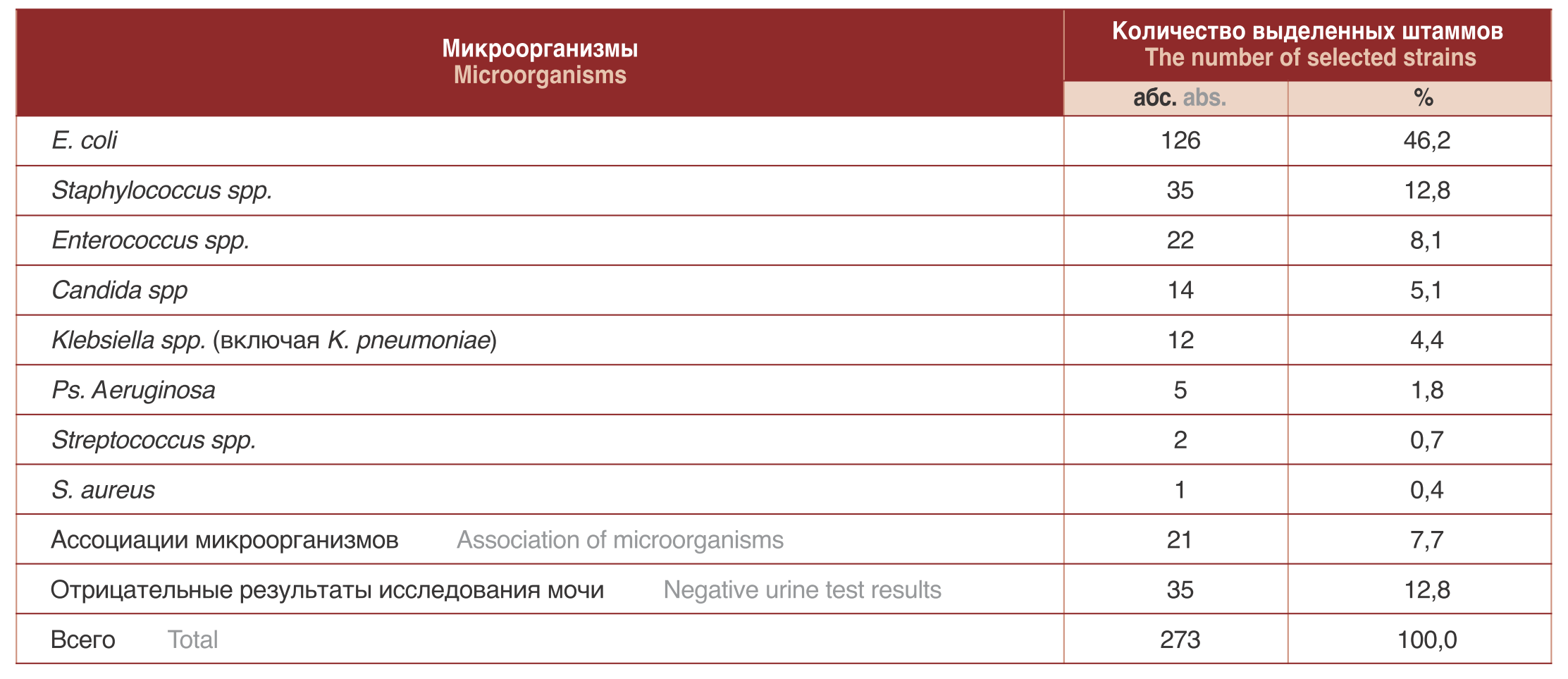
Этиология ОИВМП характеризуется мультифакторностью, а основными возбудителями ее являются: E.coli (75–95%), Staphylococcus saprophyticus (5–10%), Enterobacteriaceae (кроме E.coli), реже Proteus mirabilis, Klebsiella pneumonia, Pseudomonas aeruginosa, а также другие коагулазоотрицательные стафилококки и грибы [1-4]. Лечение ОИВМП, как правило, начинают с эмпирического назначения противомикробных препаратов. Однако для того, чтобы начать противомикробную терапию необходимо полностью исключить и устранить окклюзию верхних мочевыводящих путей. Одним из грозных осложнений ОИВМП является уросепсис, который по данным N.M. Dreger и соавт. составляет 9-31% всех случаев сепсиса в Германии, со смертностью, равной 20-40%. Считается, что в связи со старением населения, смертность от уросепсиса будет расти [8].
При назначении антимикробной терапии при ОИВМП необходимо четко понимать, что антибиотики – это уникальный тип лекарственных средств, который имеет одну важную особенность – снижения клинической эффективности в течение определенного периода времени после начала применения, вследствие формирования устойчивости у возбудителей [9]. Резистентность к антимикробным препаратам может развиваться в результате естественного отбора посредством мутаций самих бактерий и выработки у них факторов защиты (продукция БЛРС – продукция беталактамаз расширенного спектра) и/или вследствие нерационального выбора антимикробного препарата. В настоящее время во всем мире устойчивость микробных агентов к антибактериальным препаратам принимает опасные масштабы и в ряде стран воздвигнута в ряд проблемы национального уровня [2,4,10].
Проблема антибиотикорезистентности в здравоохранении, и в урологии в частности, имеет несколько аспектов. Медицинский аспект связан с тем, что распространение резистентных микроорганизмов в стационарах приводит к ряду неблагоприятных для пациентов и системы здравоохранения последствий – увеличению сроков госпитализации и последующей реабилитации, повышению летальности, возрастанию затрат на лечение. Последний факт обуславливает внимание к экономическому аспекту, который требует применения резервных антибиотиков, стоимость которых выше традиционно используемых для лечения инфекций, вызванных чувствительными микроорганизмами. Социальный аспект заключается в росте заболеваемости, увеличении сроков нетрудоспособности лиц молодого и среднего возрастов, необходимостью дополнительного использования дорогостоящих препаратов на различных этапах лечения [4,5,9,10].
Всемирная организация здравоохранения (ВОЗ) для борьбы с резистентностью к антимикробным препаратам рекомендует организацию и рутинное проведение постоянного надзора в организациях здравоохранения [2,3,6,7,9,11,12]. На практике проведение такого рода надзора подразумевает использование микробиологических данных в конкретных регионах и в конкретном лечебном учреждении, получаемых на регулярной основе и направленных на выявление возбудителей инфекций у пациентов и определение чувствительности к антибиотикам.
Основной целью таких исследований является выявление приобретенной устойчивости к антимикробным препаратам, для решения двух основных задач – обоснование назначения оптимальной индивидуальной антимикробной терапии для конкретного больного и обоснование эмпирической антимикробной терапии для отдельных нозологических форм инфекционных болезней на основании данных надзора за антибиотикорезистентностью. Основной целью проведенного нами исследования являлось определение этиологической структуры возбудителей при осложненной инфекции верхних мочевых путей и их чувствительности к антимикробным препаратам для корректировки локальных протоколов их эмпирического назначения и в дальнейшем для снижения формирования антибиотикорезистентности.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование, которое по дизайну являлось ретроспективным описательным, проводилось на базе Республиканского научного центра урологии Национального госпиталя при Министерстве здравоохранения Кыргызской Республики (РНЦУ НГ МЗ КР) в период с октября 2017 по март 2018 года. Данное исследование является начальным этапом внедрения в практику НГ МЗ КР системы надзора за антибиотикорезистентностью. Объектом исследования были данные бактериологических исследований мочи, взятых до начала противомикробной терапии у 273 пациентов с ОИВМП, получавших консервативную противомикробную терапию в отделениях урологического профиля НГ МЗ КР. Данные были получены из сформированной в НГ МЗ КР в программе WHONET базы данных по резистентности возбудителей инфекций к антимикробным препаратам у пациентов РНЦУ НГ МЗ КР.
Выделение бактерий и определение их чувствительности диско-диффузионным методом проводилось в аккредитованной бактериологической лаборатории Департамента профилактики заболеваний и Государственного санитарно-эпидемиологического надзора Кыргызской Республики. На всех пациентов, участвующих в исследовании, заполнялись индивидуальные регистрационные карты, в которых была отражена необходимая клиническая информация. Для анализа полученных цифровых данных, использовали стандартные статистические методы [13].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В результате проведенного исследования нами было выявлено, что из 273 вошедших в исследование пациентов с ОИВМП, преобладали пациентки женского пола (84,9%), их средний возраст которых составлял 38,1 лет. Пациентов мужского пола было 15,1%, средний возраст составлял 39,4 лет. Проведенный анализ факторов, способствующих развитию осложненной инфекции мочевых путей у 273 пациентов показал, что преобладающим фактором являлась обструкция мочевыводящей системы (МВС), на втором месте было наличие у пациентов постоянного стента/катетера, на третьем месте – хирургические вмешательства на органах ВМП в анамнезе (табл. 1). Нами было выявлено, что 85,3% (233/273) пациентам, с диагнозом осложненной инфекции мочевых путей, назначалась противомикробная терапия до их поступления в РНЦУ НГ МЗ КР, так как они находились на амбулаторном или стационарном лечении в других медицинских учреждениях. Рациональность выбранной тактики оценить не удалось.
При сборе анамнеза в момент поступления врачи РНЦУ НГ МЗ КР выясняли, какие антимикробные препараты получали пациенты. В ходе опроса было выявлено, что наиболее часто пациентам назначали β-лактамные антибиотики (55 пациентов получали – цефтриаксон, 27 – ампициллин, 23 – цефазолин, 19 – цефтриаксон/сульбактам), 59 пациентов получали нитрофурантоин и 19 пациентов получали гентамицин, а 31 утверждали, что получали антибиотики, однако затруднились ответить, какие именно (рис. 1). При этом как видно из рисунка 1, наиболее часто (41,6%) в рутинной практике, как в стационарах, так и в поликлиниках назначались антибиотики из группы цефалоспоринов, которые при нерациональном их использовании наиболее часто приводят к формированию резистентности у условно-патогенных бактерий собственной флоры пациента, в основном являющихся возбудителями инфекций ВМП.
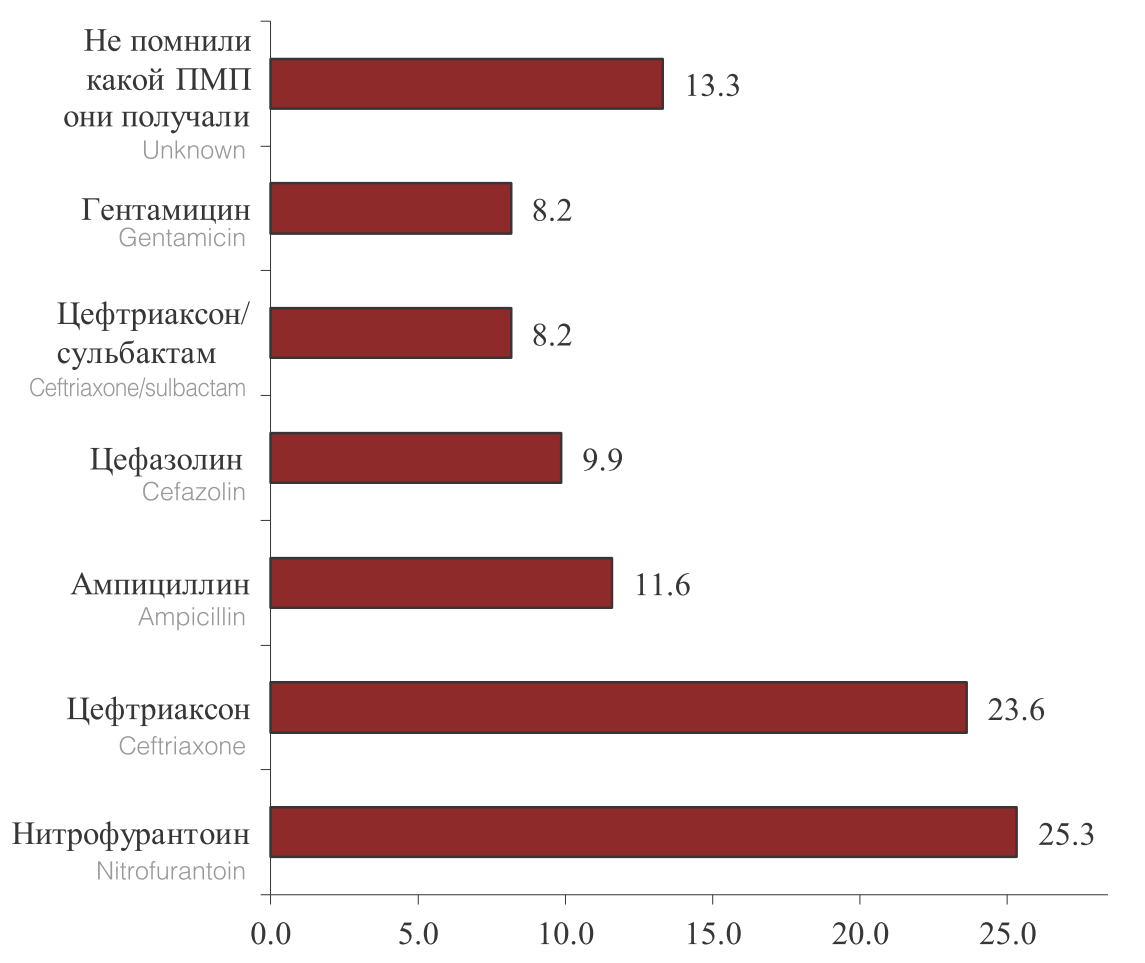
Рис. 1. Структура назначаемых ПМП, пациентам с ВОП до их поступления в РНЦУ НГ МЗ КР
Fig. 1. The structure of prescribed PMP for patients with GP before they are admitted to the RSCU NG MH KR
Таблица 1. Частота осложнений и факторов, способствующих развитию ВОП у исследуемых пациентов
Table 1. The influence of preoperative bacteriuria on the development of SSVR in the postoperative period

Далее нами были проанализированы данные бактериологического исследования мочи. В результате было выявлено, что наиболее часто из мочи пациентов с осложненной инфекцией верхних мочевых путей выделялись бактерии семейства Enterobacteriaceae 50,5% (138/273), на втором месте – 22,0% (60/273) находились грамположительные кокки (стафилококки, стрептококки и энтерококки), в 14,7% (40/273) выделялись синегнойная палочка – Pseudomonas aeruginosa, грибы рода Candida или ассоциации микроорганизмов, а в 12,8% (35/273) случаев микроорганизмы не были выделены. Таким образом, в этиологической структуре возбудителей ОИВМП лидирующее место занимала E. сoli, что согласуется с мировыми литературными данными [1,7]. Затем в этиологической структуре преобладали Staphylococcus spp. и Enterococcus spp.
Менее значимыми являлись грибы рода Candida и Klebsiella spp. Реже выделись Ps. aeruginosa, Streptococcus spp. и S. aureus (табл. 2). Нами был проведен анализ чувствительности к антибиотикам этиологически значимых возбудителей ОИВМП. В результате проведенного анализа чувствительности бактерий семейства Еnterobacteriaceae, как основных возбудителей, было выявлено, что наибольшую чувствительность выделенные штаммы E. coli проявляли к фосфомицину, меропенему и имипенему, и в меньшей степени к амикацину. При этом чувствительность к эртапенему, гентамицину и ципрофлоксацину была низкой и варьировала от 46,3% до 66,0%. Наименьшую чувствительность выделенные штаммы E. coli проявляли к βлактамным антибиотикам, таким, как ампициллин, цефтазидим, цефепим, амоксициллин/клавулоновая кислота и цефотаксим (рис. 2). Выявленная низкая чувствительность штаммов E. coli к β-лактамным антибиотикам обусловлена тем, что 61,1% (77/126) выделенных штаммов являлись продуцентами β-лактамаз расширенного спектра (БЛРС).
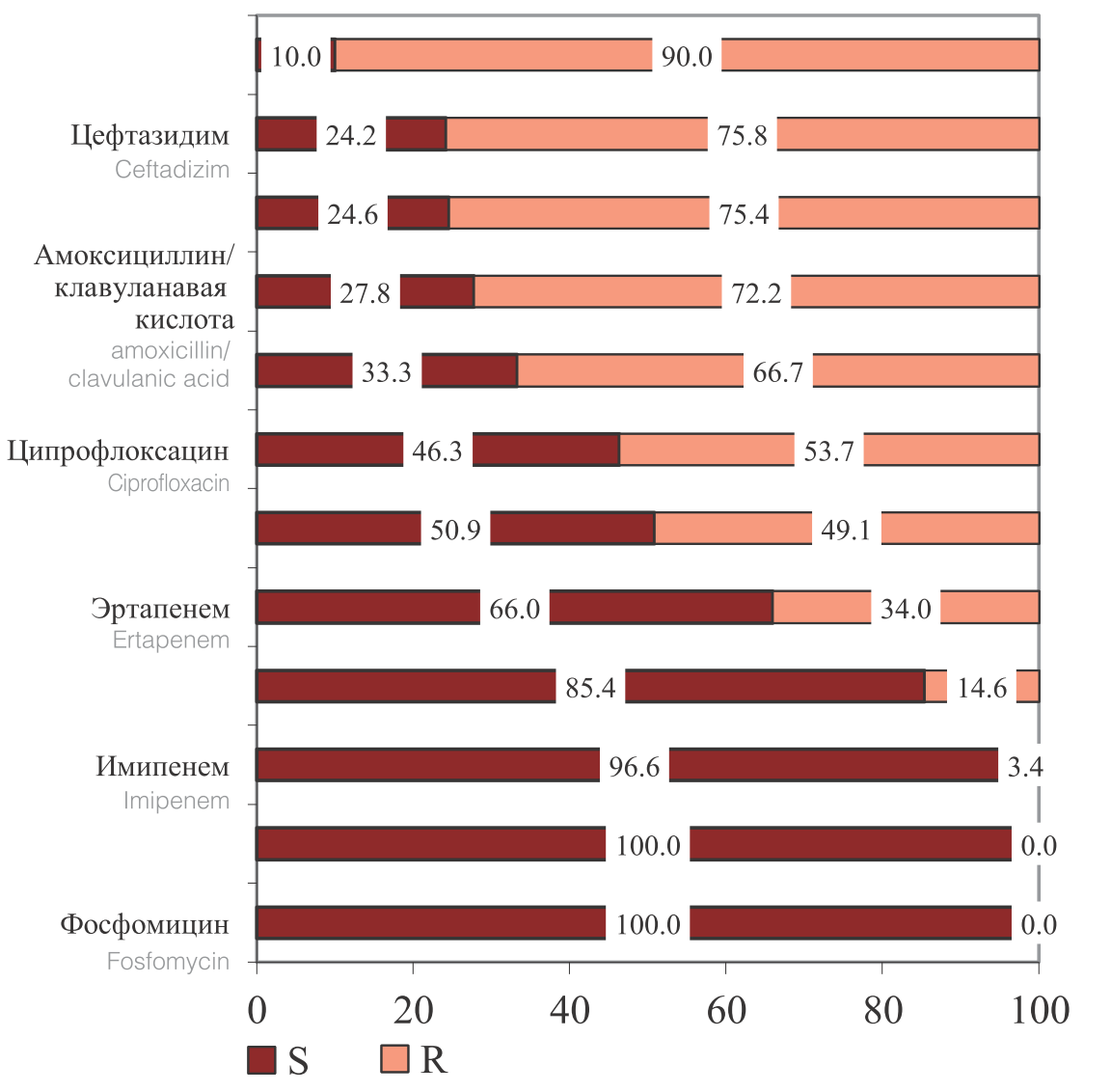
Рис. 2. Чувствительность и резистентность к ПМП выделенных штаммов E. coli (n=126)
Fig. 2. Sensitivity and risistance to PMP of isolated strains of E. coli (n = 126)
Таблица 2. Этиологическая структура возбудителей ОИВМП
Table 2. Etiological structure of pathogens of complicated infection of urinary tract infection
Штаммы Klebsiella spp., включая K. Pneumoniae, наибольшую чувствительность проявляли к меропенему и имипенему. В меньшей степени были чувствительны к амикацину, эртапенему,гентамицину и ципрофлоксацину. Аналогично штаммам кишечной палочки, выделенные Klebsiella spp. наименьшую чувствительность проявляли к β-лактамным антибиотикам, таким как ампициллин, цефепим, цефтазидим и амоксициллин/клавулановая (рис. 3). При этом 16,7% (2/12) выделенных штаммов Klebsiella spp. продуцировали β-лактамазы расширенного спектра (БЛРС).
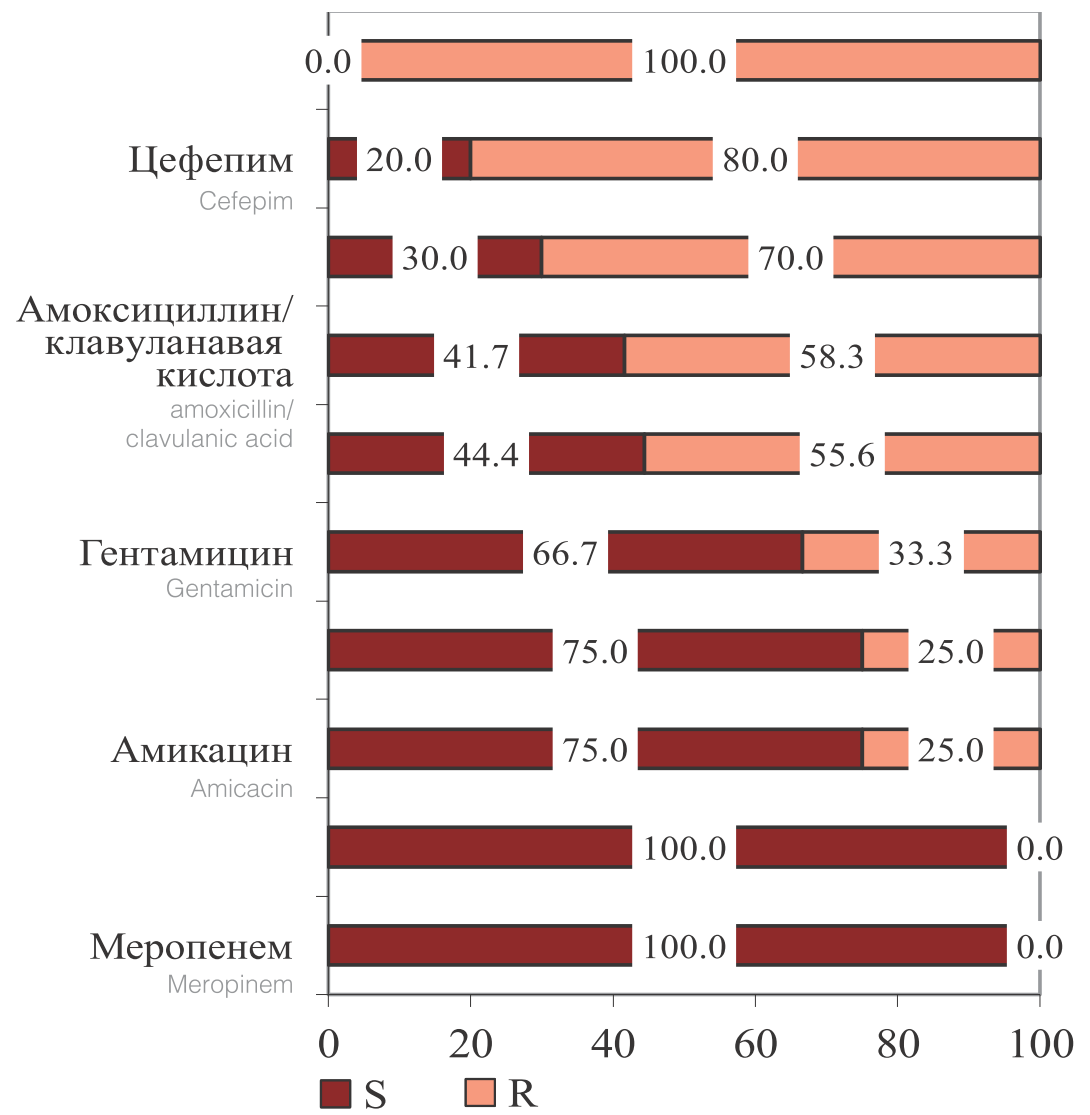
Рис. 3. Чувствительность и резистентность к ПМП выделенных штаммов Klebsiella spp. (n=12)
Fig. 3. Sensitivity and risistance to PMP of isolated strains of Klebsiella spp. (n = 12)
Анализ чувствительности к антибиотикам грамположительных кокков, показал, что наибольшую чувствительность выделенные штаммы Staphylococcus spp. проявляли к меропенему, имипенему, и амоксициллину в комбинации с клавулановой кислотой. В меньшей степени штаммы Staphylococcus spp. проявляли чувствительность к клиндамицину, гентамицину, триметоприму и амикацину. Наименьшую чувствительность они проявляли к цефокситину и эритромицину (рис. 4).

Рис. 4. Чувствительность и резистентность к ПМП выделенных штаммов Staphylococcus spp. (n=35)
Fig. 4. Sensitivity and risistance to PMP of isolated strains of Staphylococcus spp. (n = 35)
Выделенные Enterococcus spp. наибольшую чувствительность проявляли к гентамицину, тигециклинну и ванкомцину. При этом вызывает настороженность, что 4,8% штаммов Enterococcus spp. проявляли устойчивость к ванкомицину. Наименьшую чувствительность выделенные Enterococcus spp. проявляли к имипенему, норфлоксацину, ампициллину и триметоприму (рис. 5).
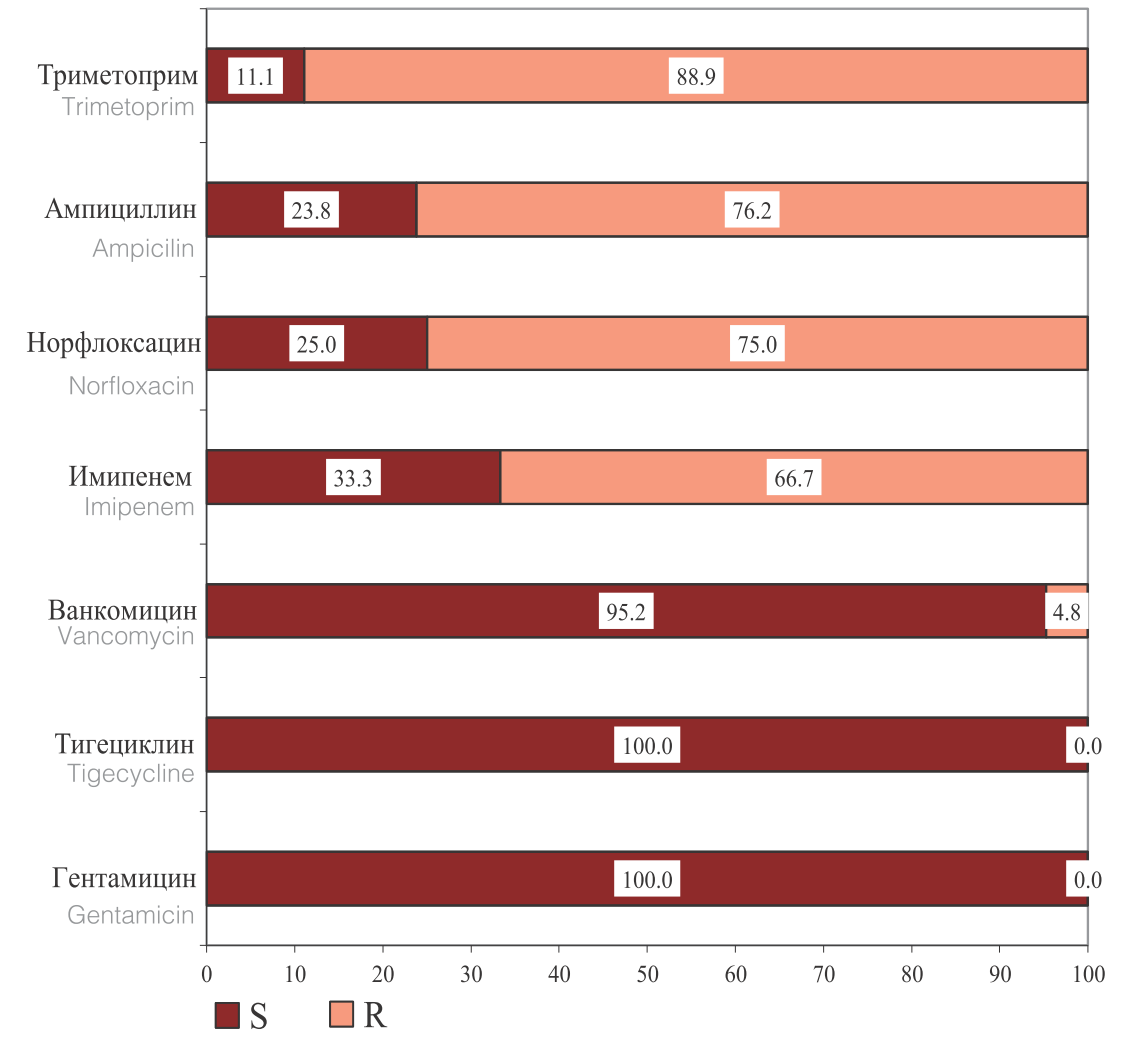
Рис. 5. Чувствительность и резистентность к ПМП выделенных штаммов Enterococcusspp. (n=22)
Fig. 5. Sensitivity and risistance to PMP of isolated Enterococcusspp strains. (n = 22)
Таким образом, проведенное ретроспективное исследование показало, что основными выделяемыми возбудителями при остром осложненном пиелонефрите являлись E. сoli, Staphylococcus spp. и Enterococcus spp. Практически все пациенты до поступления в РНЦУ НГ МЗ КР получали противомикробную терапию, которую в основном (53,3%) проводили β-лактамными антибиотиками, которая не была расценена как рациональная, на что указывает высокий уровень антибиотикорезистентности, выявленный у основных возбудителей ОИВМП, а также выявленная продукция штаммами семейства Еnterobacteriaceae БЛРС.
ВЫВОДЫ
Опираясь на полученные данные, можно предположить, что для эмпирической противомикробной терапии ОИВМП, в РНЦУ НГ МЗКР возможно использованиефосфомицина, а также карбапенемов (меропенеми имипенем). При этом необходимо с осторожностью использовать данную группу антимикробных препаратов, так как она является резервной и применяется для лечения тяжелых случаев инфекционно-воспалительных заболеваний. Для получения более точных данных, о формировании списка препаратов выбора и резерва, необходимо продолжать проводимыймониторинг резистентности к антимикробным препаратам с ведением компьютерной базы WHONET. В связи с выявленным высоким уровнем распространения среди штаммов Еnterobacteriaceae продуцентов БЛРС, в отделениях РНЦУ НГ МЗ КР необходимо строгое соблюдение мер инфекционного контроля, направленных на снижение нозокомиального распространения плазмид-противомикробной резистентности. Такими мерами могут считаться:
- Изоляция пациентов при выявлении у них инфекции, возбудитель которой является продуцентом БЛРС;
- При оказании медицинской помощи данным пациентам, медицинский персонал должен соблюдать контактные меры предосторожности (антисептика рук, перчатки, индивидуальные для пациента стетоскопы, дезинфекция приборов и поверхность с которыми контактировал пациент и др.);
- Использовать специализированные экспресстесты для выявления БЛРС в биологических жидкостях для скрининга штаммов продуцентов БЛРС и определения тактики стартовой эмпирической противомикробной терапии
ЛИТЕРАТУРА
- Перепанова Т.С., Козлов Р.С., Руднов В.А., Синякова Л.А. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Федеральные клинические рекомендации. М.: ООО «Примапринт», 2017. 72 с. [Perepanova TS, Kozlov RS, Rudnov V.A., Sinyakova L.A. Antimicrobial therapy and prevention of infections of the kidneys, urinary tract and male genital organs. Federal guidelines. M.: Prima-Print LLC, 2017.72 p.(In Russian)].
- Кулмагамбетов И.Р., Сарсенбаева С.С., Рамазанова Ш.Х., Есимова Н.К. Современные подходы к контролю и сдерживанию антибиотикорезистентности в мире. Международный журнал прикладных и фундаментальных исследований 2015; (9-1): 54-59. [Kulmagambetov I.R., Sarsenbayeva S.S., Ramazanova SH.KH., Yesimova N.K. Сurrent approach to the control and containment of antimicrobial resistance in the world. Mezhdunarodnyy zhurnal prikladnykh i fundamental'nykh issledovaniy = International Journal of Applied and Basic Research 2015;(9-1): 54-59. (In Russian)].
- Рафальский В.В., Страчунский Л.С., Кречикова О.И., Эйдельштейн И.А., Ахметова Л.И., Бабкин П.А., и др. Резистентность возбудителей амбулаторных инфекций мочевыводящих путей по данным многоцентровых микробиологических исследований UTIAP-I и UTIAP-II. Урология 2004;(2):1-5. [Rafal'skiy V.V., Strachunskiy L.S., Krechikova O.I., Eydel'shteyn I.A., Akhmetova L.I., Babkin P.A., i dr. Resistance of causative agents of ambulatory urinary tract infections according to multicenter data microbiological studies of UTIAP-I and UTIAP-II. Urologiya = Urology 2004;(2):1-5.
- Урология. Российские клинические рекомендации [под ред. Аляева Б.Г., Глыбочко П.В., Пушкаря Д.Ю.]. М., Медфорум, 2017. С 475-488. [Urology. Russian clinical guidelines [ed. Alyaev B.G., Glybochko P.V., Pushkar D.Yu.]. M., Medforum, 2017. P. 475-488. (In Russian)]
- Zhanel GG, Hisanaga TL, Laing NM, DeCorby MR, Nichol KA, Palatnik LP, et al. Antibiotic resistance in outpatient urinary isolates: final results from the North American Urinary Tract Infection Collaborative Alliance (NAUTICA). Int J Antimicrob Agents 2005;26(5):380-8. doi: 10.1016/j.ijantimicag.2005.08.003
- Lohr J.W., Gowda A., Nzerue Ch.M. Pyelonephritis chronic. 2005. URL: http: // WWW: emedicine. medscape.com/article/245464-overview (дата обращения: 04.11.2015).
- Schaeffer AJ. Infection of urinary tract. In book Campbell’s Urology. 2016. Vol. 1, P.239.
- Dreger NM1, Degener S, Ahmad-Nejad P, Wöbker G, Roth S. Urosepsis-Etiology, Diagnosis, and Treatment. Dtsch Arztebl Int. 2015 Dec 4;112(49):837-47; doi: 10.3238/arztebl.2015.0837.
- Яковлев С.В. Стратегия применения антибиотиков в стационаре. Клиническая антибиотикотерапия 2001;(5-6):3-10. [Yakovlev S.V. The strategy of using antibiotics in a hospital. Klinicheskaya antibiotikoterapiya = Clinical antibiotic therapy 2001; (5-6):3-10. (In Russian)].
- Зуева Л.П., Колосовская Е.Н. Обоснование необходимости мониторинга за антибиотикорезистентностью микроорганизмов. Terra Medica Nova 2006;(3):62-6. [Zuyeva L.P., Kolosovskaya Ye.N. Justification of the need for monitoring the antibiotic resistance of microorganisms. Terra Medica Nova 2006; (3): 62-6. (In Russian)].
- Tisher CC. Renal pathology with clinical and functional correlations. [Ed. Tisher C. Craig MD, Brenner BM.]. Lippicott Company, Philadelphia, 1994.
- Antimicrobial resistance: global report on surveillance 2014 https://www.who.int/mediacentre/news/releases/2014/amr-report/ru/
- Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: Медиа Сфера, 2002. 312 с. [Rebrova O.Yu. Statistical analysis of medical data. Application of the STATISTICA application package. M .: Media Sphere, 2002.312 p. (In Russian)].
Статья опубликована в журнале "Экспериментальная и клиническая урология" №3 2019, стр. 185-190









Комментарии