Мусатов О.В., Зурнаджан С.А., Коханов А.В.
Разрывы почки занимают по частоте третье место при закрытой абдоминальной травме в современной хирургии [1, 2] и первое-второе место среди всех видов травм мочеполовой системы [3, 4]. Поэтому их лечение с проведением органосохраняющих операций является актуальной проблемой для хирургов и урологов [5].
В хирургии почки применяется серозно-мышечный лоскут желудка на сосудистой ножке для ее реваскуляризации [6, 7] и укрытия ран [8, 9]. Такой аутотрансплантат используется в реконструктивной урологии для пластики мочевого пузыря [10-12], его сфинктера [13, 14], лоханки [15], мочеточника [16] и уретры [17].
Известно, что повреждение тканей, в том числе и после оперативного вмешательства, сопровождается развитием неспецифической гиперферментемии [18, 19], в том числе за счет повышения в крови активности индикаторных ферментов цитолиза. Это происходит в результате общей реакции организма на травму, сопровождающейся нарушением процессов окислительного фосфорилирования в ряде тканей и органов, изменением проницаемости клеточных мембран и выходом ферментов в кровяное русло. Следовательно, ферменты цитолитического синдрома – аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), гаммаглютамилтранспептидаза (ГГТП) и печеночная лактатдегидрогеназа (ЛДГ-П) могут быть использованы как индикаторы степени травматизации органа после оперативного вмешательства.
Учитывая вышеизложенное, целью работы явилось исследование ферментов сыворотки крови, характеризующих выраженность цитолиза, после органосохраняющих и радикальных операций на почке при ее механической травме. Ис-ходя из цели, поставлены следующие задачи:
- Изучение динамики активности ферментов АЛТ, АСТ, ГГТП и ЛДГ-П в сыворотке крови экспериментальных животных после нефрэктомии.
- Изучение динамики активности этих же ферментов в сыворотке крови экспериментальных животных после аутопластики смоделированной раны почки большим сальником или серозномышечным лоскутом из большой кривизны желудка на сосудистой ножке.
- Изучение зависимости активности вышеназванных ферментов и трендов гиперферментемии от материала и способа используемого аутотрансплантата и радикальности проведенной операции.
МАТЕРИАЛ И МЕТОДЫ
Работа выполнена на 89 кроликах породы «Шиншилла» выведенных на кроликоферме «Астрахань-МИАКРО», которые процессе эксперимента содержались в условиях вивария с соблюдением международных принципов Хельсинкской декларации о гуманном отношении к животным. В группе опыта (45 кроликов) под наркозом из большой кривизны желудка на сосудистой ножке (левая желудочносальниковая артерия) выкраивался серозно-мышечный лоскут с захватом подслизистого слоя. У них же моделировались рвано-ушибленные раны на наружном крае левой почки без проникновения в систему полостей, которые укрывались вышеназванным аутотрансплантатом и прошивались двойным восьмиобразным швом [20]. В группе контроля проводилась фиксация к ране левой почки (17 кроликов) большого сальника аналогичным швом, 17-ти животным после моделирования аналогичной раны выполнена левосторонняя трансабдоми-нальная нефрэктомия. У 10 интактных кроликов и у прооперированных животных на 1, 3, 5, 7, 14, 21, 30, 60, 90, 120, 150, 180 и 360 сутки из ушной вены забиралась кровь, отделялась центрифугированием сыворотка, которая хранилась до исследования при температуре минус 20ºС. Активность АЛТ, АСТ, ГГТП и ЛДГ-П определяли на биохимическом анализаторе «Microlab» с использованием стандартных наборов («Vitalab», Нидерланды) в соответствии с рекомендациями производителя.
Полученные результаты подвергались статистической обработке с вычислением средних величин и их ошибок (М ± m), достоверными считались различия при р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты исследования активности изучаемых ферментов в крови экспериментальных животных после аутопластики раны почки серозно-мышечным лоскутом желудка (СМЛЖ), большим сальником (Сальн.), нефрэктомии (Н/Э), а также интактных кроликов (Инт.) представлены в таблице 1.
Активность АЛТ после гастронефропластики достигает пиковых значений только в течение первых 14 суток, а, начиная с 21-х суток, имеет тенденцию к резкому снижению, достоверно не отличаясь от значений, полученных у интакт-ных кроликов к 150-м суткам. В группе оментонефропластики повышенные значения АЛТ сохраняются на протяжении всего периода наблюдения, причем (рис.1), наблюдается вторая волна активности фермента, начиная с 90-го по 180-й дни. После нефрэктомии наблюдались наиболее высокие показатели активности АЛТ по сравнению с группами органосохраняющих операций (СМЛЖ и Сальн.) на 3-5-е сутки после операции, с плавным снижением и нормализацией активности АЛТ лишь к 360-м суткам (рис.1).
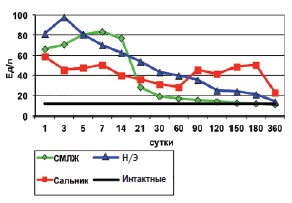
Рис. 1. Динамика аланинаминотрансферазы после операций на почке (М)
Динамика АСТ после исследуемых операций имеет картину, аналогичную АЛТ (рис.2). При этом обращает на себя внимание, что максимальная активность обоих индикаторных ферментов при органосохраняющих пластических операциях в отличие от нефрэктомии смещается на 5-14-е сутки, с дальнейшим паде-нием активности фермента после аутопластики раны почки СМЛЖ и второй волной активности фермента АСТ после аутопластики большим сальником.
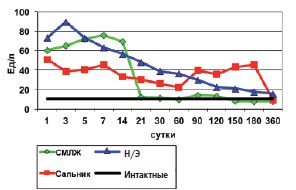
Рис. 2. Динамика аспартатаминотрансферазы после операций на почке (М)
Анализ динамики сывороточной ГГТП (рис.3)показывает, что максимальные значения активности данного фермента во всех группах оперированных кроликов приходятся на 3-и и 5-е сутки как реакция на инициацию процессов репаративной регенерации [21]. Далее имело место постепенное снижение ГГТП во всех трех исследуемых группах. Достоверно повышенные уровни фермента по сравнению с интактными кроликами сохраняются до двух недель после аутопластики раны почки СМЛЖ, до трех недель – после оментонефропластики и до 30 дней – после нефрэктомии (табл.1). Следовательно, динамика снижения активности ГГТП пропорциональна степени травматичности каждой из операций и обратно пропорциональна продуктивности воспалительнорепаративного процесса поврежденной паренхимы в месте операции.
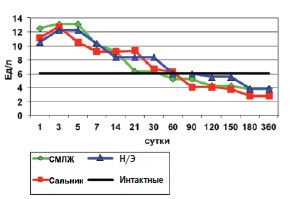
Рис. 3. Динамика гамма-глютамилтранспептидазы после операций на почке (М)
Таблица 1. Изменение активности исследуемых ферментов в крови у экспериментальных животных в различные сроки после операций на почке
| № пп |
Срок, (сут.) |
АЛТ (M ± m, Ед/л) | АСТ (M ± m, Ед/л) | ||||
|---|---|---|---|---|---|---|---|
| СМЛЖ (n=45) |
Сальн. (n=17) |
Н/Э (n=17) |
СМЛЖ (n=45) | Сальн. (n=17) |
Н/Э (n=17) |
||
| 1 | 1 | 66,1±0,97* |
58,1±1,10* |
81,4±0,72* | 60,3±0,68* | 51,0±1,41* | 73,0±1,04* |
| 2 | 3 | 70,7±0,44* | 45,3±0,76 | 97,3±0,62* | 64,8±0,59* | 38,8±0,95* | 89,0±0,7 |
| 3 | 5 | 80,5±0,51* | 47,1±0,80 | 80,4±0,84* | 72,0±1,14* | 40,7±0,75* | 72,6±1,15 |
| 4 | 7 | 83,2±0,98* | 50,3±0,30* | 69,6±0,94* | 75,46±0,9* | 45,4±0,74* | 62,9±1,08* |
| 5 | 14 | 76,8±0,76* | 39,5±0,45* | 62,0±0,86* | 69,1±0,42* | 33,4±1,0* | 56,4±0,73 |
| 6 | 21 | 28,2±0,92* | 35,8±0,53 | 53,6±0,63* | 12,3±0,99 | 30,4±0,62* | 48,0±0,72 |
| 7 | 30 | 19,3±0,67* | 31,2±0,86* | 43,0±0,87* | 11,12±0,4 | 26,2±1,03* | 38,6±0,64* |
| 8 | 60 | 16,9±0,56* | 28,3±0,78* | 39,8±0,45* | 9,62±0,2 | 22,1±0,99* | 36,2±0,53* |
| 9 | 90 | 15,5±0,77* | 45,6±0,80* | 35,5±0,72* | 14,18±0,2* | 39,7±0,48* | 29,7±0,71* |
| 10 | 120 | 14,0±0,42* | 41,0±0,57* | 24,9±0,92* | 13,3±0,95* | 35,8±0,93* | 22,3±1,08* |
| 11 | 150 | 12,5±0,62 | 48,5±0,93* | 24,1±1,66* | 8,08±0,19 | 43,1± 0,99* | 20,9±0,59* |
| 12 | 180 | 12,0±0,46 | 50,2±0,56* | 21,2±1,6* | 7,94±0,21 | 45,6±0,89* | 17,4±0,08* |
| 13 | 360 | 10,9±0,40 | 22,4±1,23 | 14,1±0,44* | 7,76±0,22 | 9,32±0,77 | 15,7±0,67* |
| 14 | Инт. (n=10) |
11,6 ± 0,60 | 9,99 ± 0,92 | ||||
| № пп |
Срок, (сут.) |
ГГТП (M ± m, Ед/л) | ЛДГ-П (M ± m, Ед/л) | ||||
|---|---|---|---|---|---|---|---|
| СМЛЖ (n=45) |
Сальн. (n=17) |
Н/Э (n=17) |
СМЛЖ (n=45) |
Сальн. (n=17) |
Н/Э (n=17) |
||
| 1 | 1 | 12,5±1,29* | 11,1±1,21* | 10,5±0,97* | 368,4±32,21* | 350,8±26,94* | 502,4±42,72* |
| 2 | 3 | 13,1±0,97* | 12,7±1,02* | 12,2±1,16* | 470,0±37,25* | 262,4±33,57* | 633,6±60,45* |
| 3 | 5 | 13,1±1,03* | 10,5±0,96* | 12,2±1,22* | 495,6±44,30* | 291,6±27,85* | 485,4±31,15* |
| 4 | 7 | 10,1±1,43* | 9,17±1,26* | 10,3±1,16* | 492,8±49,42* | 306,8±23,36* | 450,8±35,36* |
| 5 | 14 | 9,2±0,95* | 9,2±0,80 | 8,3±0,54 | 463,4±42,67* | 240,2±17,62* | 374,4±29,34* |
| 6 | 21 | 6,3±0,73* | 9,3±0,91* | 8,3±0,65* | 439,6±37,62* | 210,2±20,14 | 350,4±31,12* |
| 7 | 30 | 6,3±0,68* | 6,6±0,84* | 8,3±0,62* | 358,8±32,34* | 194,4 ±19,27 | 303,2±24,70* |
| 8 | 60 | 5,2±0,52 | 6,2±0,75* | 6,0±0,68* | 273,8±22,84* | 161,8 ±13,89 | 267,6±20,94* |
| 9 | 90 | 5,2±0,59 | 4,1±0,44 | 6,0±0,63* | 201,4±19,32 | 274,2±25,24* | 239,4±14,93 |
| 10 | 120 | 4,2±0,51 | 4,1±0,41 | 5,5±0,66 | 184,8±17,74 | 238,6±14,11* | 216,8±15,07 |
| 11 | 150 | 4,2±0,52 | 3,7 ±0,53 | 5,5±0,68 | 184,8±17,74 | 278,8±14,61* | 205,8± 14,21 |
| 12 | 180 | 3,8±0,56 | 2,8±0,42 | 3,8±0,57 | 184,8±17,74 | 225,6±19,67 | 191,2±14,05 |
| 13 | 360 | 3,8±0,54 | 2,8±0,43 | 3,8±0,55 | 184,8±17,74 | 193,0±14,53 | 191,2±14,05 |
| 14 | Инт. (n=10) |
3,9 ± 0,71 | 192,8±8,35 | ||||
* – различия статистически достоверны с кроликами интактной группы при р < 0,05
Анализируя динамику активности печеночной лактатдегидрогеназы после различных оперативных вмешательств на почке обращают на себя внимание общие с аминотранферазами (АЛТ и АСТ) тенденции: та же двугорбая кривая в опытной группе животных после оментонефропластики, растянутый до трехчетырех недель пик гиперферментемии в группе гастронефропластики, острый пик и плавное снижение активности ЛДГ после нефрэктомии (рис.4).
Повторное повышение активности ЛДГ-П и аминотрансфераз в группе после оментонефропластики в период с 90-х по 150-е сутки на наш взгляд, является следствием установленной нами ранее [21] хронизации воспаления регенерирующей паренхимы почки под сальником.
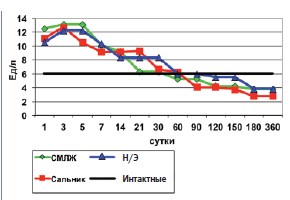
Рис. 4. Динамика печеночной лактатдегидрогеназы после операций на почке (М)
ЗАКЛЮЧЕНИЕ
Установлено повышение активности четырех изученных ферментов в сыворотке крови при всех оперативных вмешательствах на почке. Исследована связь гиперферментемии с характером оперативного вмешательства и показано, что мониторинг активности индикаторных ферментов в сыворотке крови может отражать степень травматично-сти различных оперативных вмешательств на почке. После аутопластики раны почки желудочным лоскутом нормализация активности трансаминаз происходит раньше, чем в группах оментонефропластики и нефрэктомии. При применении сальника в качестве пластического материала выявлено повышение активности всех исследованных ферментов кроме ГГТП в отдаленном периоде. Описанные различия в группе органосохраняющих операций происходят вследствие продуктивного течения воспалительно-репаративного процесса в ране почки под желудочным лоскутом и с тенденцией к хронизации с соединительнотканными разрастаниями – под сальником [21], последнее чревато развитием почечной гипертензии.
В пользу проведения органосохраняющих операций свидетельствует менее выраженная активность всех четырех индикаторных ферментов в ранние сроки после аутопластических операций, по сравнению с группой, подвергшейся нефрэктомии. Это происходит, как мы полагаем, по причине большей травматизации почечного ложа при нефрэктомии по сравнению с органосохраняющими операциями.
ЛИТЕРАТУРА
1. Mani NB, Kim L. The role of interventional radiology in urologic tract trauma. // Semin Intervent Radiol. 2011. Vol.28, N 4. P. 415-423.
2. Klimek PM, Lutz T, Stranzinger E, Zachariou Z, Kessler U, Berger S. Handlebar in-juries in children. // Pediatr Surg Int. 2013. Vol. 29, N 3. P. 269-273.
3. Aragona F, Pepe P, Patanè D, Malfa P, D'Arrigo L, Pennisi M. Management of se-vere blunt renal trauma in adult patients: a 10-year retrospective review from an emergency hospital. // BJU Int. 2012. Vol.110, N 5. P.744-748.
4. Büyükcam F, Sen J, Akpinar S, Zengin Y, Calik M, Odabaş O. Acil servise basvuran travmali olgularda Urogenital yaralanmalarin degerlendirilmesi. // Ulus Travma Acil Cerrahi Derg. 2012. Vol.18, N 2. P. 133-140.
5. Yeung LL, Brandes SB. Contemporary management of renal trauma: differences between urologists and trauma surgeons // J Trauma Acute Care Surg. 2012. Vol.72, N 1. P.68-75.
6. Вальтер В.Г., Пролиско С.В. Использование серозномышечного лоскута желудка для реваскуляризации почки // Вестн хир им. Грекова. 1969. Т.102, N 4. С. 34-37.
7. Беляков А.П. Сравнительная оценка эффективности некоторых методов периферической реваскуляризации почки: Автореф. дисс. …канд. мед. наук. Иваново. 1975. 24 с.
8. Зурнаджьянц В.А. Использование сегмента большой кривизны желудка в пла-стической хирургии // Вестн хир им. Грекова. 1987. Т.138, N 6. С.94-96.
9. Одишелашвили Г.Д. Гемостаз при повреждениях печени, селезенки, почек и поджелудочной железы: Автореф. дисс. …д-ра мед.наук. М. 1996. 33 с.
10. Шухер Б.И. Пластика мочевого пузыря изолированным сегментом большой кривизны желудка на сосудистой ножке: Дисс. …канд. мед. наук. Астрахань. 1973. 147 с.
11. Kispal Z, Balogh D, Erdei O, Kehl D, Juhasz Z, Vastyan AM, Farkas A, Pinter AB, Vajda P. Complications after bladder augmentation or substitution in children: a prospective study of 86 patients. // BJU Int. 2011. Vol.108, N 2. P.282-289.
12. Zhang Y, Liu G, Kropp BP. Re-epithelialization of demucosalized stomach patch with tissue-engineered urothelial mucosa combined with Botox A in bladder augmentation. // BJU Int. 2012. Vol.110, N 2, Pt. B. P. 106-112.
13. Ganesan GS, Ngyen DN, Adams MS, King SJ, Rink RS, Burns MW, Mitchell ME. Lower urinary reconstruction using stomach and the artificial sphincter. // J Urol. 1993. Vol.149, N 5. P.1107-1109.
14. Aprikian AG, Guan Z, Nielson K, Kiruluta G. Gastric muscularis as a urinary sphincter. // Urol. 1994. Vol. 43, N 2. P. 267-272.
15. Donnelan SM, Ryan AG, Bolton DM. Gastric patch pyeloplasty: development of an animal model to produce upper tract urinary acidification for treated struvite urinary calculi. // J Urol. 2001. Vol. 166, N 2. P. 684-687.
16. Fiorelli C, Selli C, Nicita G, Turini D. Experimental ureteral replacement with a vascularized gastric tubule. // Eur Urol. 1979. Vol. 5, N 4. P. 278-280.
17. Kamei Y, Aoyama H, Yokoo K, Fujii K, Kondo C, Sato T, Onishi S. Composite gastric and omental pedicle flap for urethral and scrotal reconstruction after Fournier’s gangrene. // Ann Plast Surg. 1994. Vol. 33, N 5. P. 565-568.
18. Вилкинсон Д. Принципы и методы диагностической энзимологии. М. 1981.С. 357-422.
19. Маршал Д. Клиническая биохимия. СПб. 2000. С. 90-108.
20. Вальтер В.Г., Зурнаджьянц В.А., Одишелашвили Г.Д. Способ ушивания размозженных и скальпированных ран печени: Патент 2007133 РФ № 4920768; заявл. 21.03.91; опубл. 15.02.94. Бюл. № 3.С.17.
21. Мусатов О.В., Зурнаджан С.А., Богатырева О.Е. Сравнительная количественная оценка фиброзной ткани в ранах печени, селезенки и почки в зависимости от способа их аутопластики в эксперименте // Анн пласт реконструкт и эстет хир. 2009. N 3. С. 89-94.
Мусатов О.В., Коханов А.В., Зурнаджан С.А.









Комментарии