Сипливый Г.В., Сипливая Л.Е., Кукурека А.В.
При инфекционной патологии и, в частности, при необструктивном гематогенном пиелонефрите широко используются химиотерапевтические препараты, обладающие мощным бактериостатическим и бактерицидным действием и достаточно широким антимикробным действием [1, 2]. Клинические наблюдения последних десятилетий свидетельствуют о значительном снижении эффективности антибиотиков [3]. Снижение токсичности и повышение эффективности химиотерапевтических препаратов возможно обусловлено селективным действием фармакологических средств на определенные клетки и органы [4]. Направленный транспорт лекарственных средств в охваченную патологическим процессом зону позволяет, наряду с созданием в ней высоких концентравводимого препарата максимально, уменьшить нежелательные реакции организма на медикаментозное воздействие, снизить терапевтическую дозу препарата и кратность введения [5].
Для достижения поставленной цели применяют микроконтейнеры, в качестве которых могут выступать липосомы, капсулы из человеческого альбумина, магнитные микросферы или аутоклетки крови [6]. Однако большинство известных носителей имеют ограничения по диапазону и количеству лекарств, которые они могут связывать, а также обладают токсичностью и иммуногенностью. Наиболее выгодным с точки зрения биологической совместимости считаются системы доставки, в которых используются собственные клетки организма. Реализация идеи направленного транспорта лекарств идет использования эритроцитов, лейкоцитов, тромбоцитов в качестве контейнеров для доставки лекарственных средств [7, 8, 9].
Цель работы – сравнительная оценка эффективности свободных и клеточных (эритроцитарных и лейкоцитарных) форм аминогликозидов и фторхинолонов при экспериментальном пиелонефрите.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проведены на крысах Вистар массой 180-200 г. Все животные содержались в одинаковых условиях на обычном пищевом режиме. Для получения статистически достоверных результатов группы формировали из 9 животных. В контрольные и опытные группы входили животные одного возраста. Разброс в группах по исходной массе не превышал ± 10%. Все исследования проводили в одно и то же время суток с 8.00 до 12.00 с соблюдением принципов, изложенных в Конвенции по защите позвоночных животных, используемых для экспериментальных и других целей (г. Страсбург, Франция, 1986).
Токсическое поражение почек, осложненное инфицированием (пиелонефрит), моделировали путем однократного внутрижелудочного введения ртути дихлорида в дозе 2 мг/кг и внутрибрюшинной инъекции предварительно оттитрованных доз суточной агаровой культуры Staphylococcus aureus, содержащих 1×108 микробных тел в 0,5 мл раствора. О состоянии выделительной функции почек судили по концентрации мочевины и креатинина в крови [10]. Активность ферментов в почках и количество клеток крови оценивали по методике В.В. Меньшикова [10]. В ходе приготовления гистологических препаратов использовалась окраска гематоксилином и эозином, при этом цитоплазма клеток окрашивалась в розовый цвет, ядра – в фиолетовый.
Для включения аминогликозидов или фторхинолонов в строму эритроцитов использовали метод гипоосмотического гемолиза, позволяющий ввести максимально возможное количество препаратов [11, 12]. Для получения аллогенных эритроцитов использовали 3 мл крови. После оседания эритроцитов удаляли плазму вместе с лейкоцитарной пленкой. Эритроциты крыс, выделенные из 3 мл крови, дважды отмывали изотоническим раствором натрия хлорида путем центрифугирования при 500 g в течение 5 мин. при 4°С. К осадку эритроцитов добавляли семикратный объем охлажденной до 0°С воды очищенной и центрифугировали при 1500 g в течение 25 мин. К полученной строме приливали пятикратный объем аминогликозида или фторхинолона, растворенного в охлажденной до 5°С очищенной воде. Концентрация препарата в инкубационной среде соответствовала их разовым дозам в пересчете на крысу. Взвесь инкубировали в течение 20 мин. при 4°С, затем добавляли 1/10 объема 10% натрия хлорида для восстановления целостности стромы и инкубировали в течение 30 мин. при 37°С. После включения препаратов в стромальные сферы последние дважды отмывали изотоническим раствором натрия хлорида, затем осаждали при 1500 g в течение 10 мин. (эритроцитарная форма).
Для получения суспензии лейкоцитов гепаринизированную кровь (25 ЕД/мл крови) смешивали с 3% желатином (0,1 мг/мл) и выдерживали 15-20 мин. при 37°С. После оседания эритроцитов слой плазмы, обогащенный лейкоцитами, переносили в силиконизированные пробирки. Клетки осаждали центрифугированием в течение 10 мин. при 1500 g. Количество клеток подсчитывали под микроскопом в камере Горяева. Для включения антибиотиков или фторхинолонов в лейкоцитарный носители (ЛН) использовали методику С.В. Лохвицкого [7]. В соответствии с методикой лейкоциты после выделения инкубировали с аминогликозидами или фторхинолонами в разовой дозе в течение 20 мин. при комнатной температуре и периодическом встряхивании (лейкоцитарная форма). Для повышения связывания антибиотиков или фторхинолонов лейкоцитами в инкубационную среду добавляли 0,5 мл 1% раствора АТФ [7].
Определение аминогликозидов в биоматериале проводили спектрофотометрической методикой [13]. Для определения фторхинолонов также была использована спектрофотометрическая методика [14].
В работе использовались: амикацин – раствор для инъекций, ампулы (500 мг – 2 мл), Болгария, Pharmachin Holding EAD Spharma; гентамицин – раствор для инъекций, ампулы (80 мг – 2 мл), Индия, Agio Pharmaceuticals Ltd; офлоксацин (офло) – раствор для инфузий 0,2% (200 мг – 100 мл), флаконы, Индия, Unique Pharmaceutical Laboratories; ципрофлоксацин 1% раствор в ампулах по 10 мл или раствор для инъекций 0,2% (200 мг – 100 мл), флаконы, Индия, Wockhardt Ltd.
Препараты и их клеточные формы вводили внутривенно, при этом использовали аллогенный перенос клеток. Используемые дозы препаратов соответствовали рекомендованным терапевтическим дозам, пересчитанным с учетом соотношения поверхности тела биологического объекта и его массы по общепринятой формуле межвидового переноса доз с применением коэффициента пересчета в зависимости от массы тела. Антибиотики вводили в хвостовую вену, без наркоза. Крысу помещали в специально сконструированную установку. Стеклянная коническая конструкция позволяла фиксировать крысу, при этом хвост находился вне установки. Перед введением препаратов хвост разогревали обработкой водой с повышенной температурой и этанолом. Для прокола хрящевого панциря использовали тонкую иглу и желательно инсулиновый шприц.
Статистическую обработку результатов исследования проводили путем вычисления средних арифметических изучаемых показателей (M) и их стандартных ошибок (m). Существенность различий средних величин оценивали по критериям Стьюдента и Вилкоксона-МаннаУитни [15, 16].
РЕЗУЛЬТАТЫ
Для отработки лабораторной технологии получения эритроцитарных форм антибактериальных препаратов изучены особенности включения гентамицина, амикацина, ципрофлоксацина и офлоксацина в эритроцитарные носители (ЭН) здоровых животных и животных с пиелонефритом. С этой целью ЭН здоровых крыс и крыс с пиелонефритом инкубировали с растворами препаратов в следующей концентрации: гентамицина 2 и 4 мг/мл (0,2%; 0,4%) и амикацина 12 и 24 мг/мл (1,2%; 2,4%), а фторхинолонов 3 и 6 мг/мл (0,3%; 0,6%) в течение 10, 30, и 60 минут при 40С. В начале инкубацию проводили с меньшей концентрацией, а затем концентрацию препаратов в инкубационной жидкости увеличивали в два раза. Устойчивость ЭН на десорбцию и выделение препаратов из ЭН определяли путем двукратного предварительного отмывания и инкубации их в аутологичной плазме при 370С в течение 30 минут.
Было установлено, что в ЭН здоровых доноров включается гентамицина 22,4% и 20,2% амикацина, а в ЭН крыс с пиелонефритом 20,1% и 18,2% для гентамицина и амикацина, соответственно (табл. 1). Определено, что в ЭН здоровых крыс включается 17,9% ципрофлоксацина и 16,4% офлоксацина, а в ЭН животных с пиелонефритом 14,5% и 12,3%, соответственно (табл. 1).
Таблица 1. Включение антибиотиков аминогликозидов или фторхинолонов в ЭН
| Препарат | Включение в ЭН, % | |
|---|---|---|
| Здоровые крысы | Крысы с пиелонефритом | |
| 1. Гентамицин | 22,4±2,4 | 20,1±1,3 |
| 2. Амикацин | 20,2±2,5 | 18,2±1,2 |
| 3. Ципрофлоксацин | 17,9±1,3*1,2 | 14,5±0,9*1,2 |
| 4. Офлоксацин | 16,4±0,4*1,2 | 12,3±0,9*1,2 |
Примечание. * и цифра рядом в этой и последующих таблицах указывают на достоверность различий между группами (p≤0,05)
Доказано, что антибиотики аминогликозиды и фторхинолоны в большей степени включаются в ЭН здоровых доноров. Полученные результаты свидетельствовали о более высоком включении антибиотиков аминогликозидов в ЭН животных с пиелонефритом в сравнении с фторхинолонами.
Изучены особенности включения антибиотиков аминогликозидов или фторхинолонов в лейкоцитарные носители здоровых животных и животных с пиелонефритом.
С этой целью, выделенные из крови лейкоциты инкубировали с растворами препаратов в концентрации: гентамицина 2 и 4 мг/мл (0,2%; 0,4%), амикацина 12 и 24 мг/мл (1,2%; 2,4%), фторхинолонов 3 мг/мл и 6 мг/мл (0,3% и 0,6%) в течение 10, 20 и 60 минут при комнатной температуре (200С). Вначале инкубацию проводили с меньшей концентрацией, а затем концентрацию препаратов увеличивали в 2 раза. Устойчивость ЛН на десорбцию и выделение антибиотиков определяли путем двукратного предварительного отмывания и инкубации их в аутологичной плазме при 370 С в течении 30 минут. Отмечено более высокое включение препаратов в ЛН здоровых животных. Установлено, что введение АТФ в инкубационную среду повышает включение антибиотиков аминогликозидов и фторхинолонов в ЛН здоровых крыс (табл. 2). Инкубации с АТФ также способствует повышению включения антибиотиков аминогликозидов или фторхинолонов в ЛН крыс с пиелонефритом. Показано, что в присутствии АТФ препараты практически в одинаковом процентном соотношении включаются в ЛН как здоровых животных, так и животных с пиелонефритом (табл. 2).
Таблица 2. Включение антибиотиков аминогликозидов или фторхинолонов в ЛН
| Препарат | Включение в ЛН, % | |
|---|---|---|
| Здоровые крысы | Крысы с пиелонефритом | |
| 1. Гентамицин | 18,3 ± 1,8 | 12,6 ± 1,2 |
| 2. Гентамицин+АТФ | 28,3 ± 2,8*1 | 25,4 ± 2,6*1 |
| 3. Амикацин | 19,1 ± 1,7 | 13,2 ± 1,4 |
| 4. Амикацин+АТФ | 27,4 ± 2,7*3 | 26,1 ± 2,5*3 |
| 5. Ципрофлоксацин | 12,6 ± 1,2 | 9,8 ± 0,8 |
| 6. Ципрофлоксацин+АТФ | 24,8 ± 2,2*5 | 22,6 ± 2,3*5 |
| 7. Офлоксацин | 13,4 ± 1,4 | 10,2 ± 0,9 |
| 8. Офлоксацин+АТФ | 27,2 ± 2,6*7 | 25,8 ± 2,4*7 |
Изучение процессов десорбции аминогликозидов и фторхинолонов из ЭН и ЛН в плазму крови показало их достаточную устойчивость и тем самым подтвердило возможность использования эритроцитов и лейкоцитов для направленного транспорта антибактериальных препаратов.
Использование различных технологий введения лекарственных средств изменяет их фармакокинетику. При введении свободных антибиотиков отмечена их высокая пиковая концентрация в крови через один час, а через три часа концентрация антибиотика резко снижалась (табл. 3).
Таблица 3. Распределение антибиотиков аминогликозидов и фторхинолонов, включенных в клеточные носители в организме
| Условия опыта | Время в часах |
Количество препарата | |
|---|---|---|---|
| Кровь (мкг/мл) | Почки (мкг/г) | ||
| 1. Введение гентамицина | 1 | 5,26±0,18 | не определяется |
| 3 | не определяется | 3,12±0,3 | |
| 2. Введение офлоксацина | 1 | 6,16±0,29 | не определяется |
| 3 | не определяется | 3,46±0,4 | |
| 3. Введение гентамицина включенного в ЭН | 1 | 0,63±0,06 | 4,98±0,4 |
| 3 | 0,48±0,04 | 4,24±0,4 | |
| 4. Введение офлоксацина включенного в ЭН | 1 | 0,56±0,04 | 5,21±0,5 |
| 3 | 0,39±0,03 | 4,99±0,5 | |
| 5. Введение гентамицина включенного в ЛН | 1 | 0,45±0,01 | 4,99±0,5 |
| 3 | не определяется | 4,17±0,4 | |
| 6. Введение офлоксацина включенного в ЛН | 1 | 0,38±0,02 | 6,23±0,6 |
| 3 | не определяется | 5,98±0,5 | |
При введении гентамицина и офлоксацина, включенных в ЭН и ЛН, в крови через один час концентрация антибиотиков была незначительна. Концентрация препаратов в почечной ткани при введении их в ЭН была выше в 1,4 для гентамицина и в 1,5 раза – для офлоксацина, а введенных в ЛН была, соответственно, в 1,7 – для гентамицина и 1,9 раза – для офлоксацина выше, чем при введении свободных препаратов. Содержание препаратов в почечной ткани оставалось высоким в течение 24 ч (время наблюдения) и снижалось постепенно (табл. 3).
Важным условием применения клеточных форм антибактериальных препаратов являются их стабильность, сроки и условия хранения. Пригодность свободных ЭН и ЛН определяли по способности включать антибактериальные препараты, а ЭН и ЛН с включенными антибиотиками – по способности сохранять терапевтическую концентрацию лекарственных средств. В результате было установлено, что свободные ЭН и ЛН сохраняют способность включать антибактериальные препараты в течение 10 дней в условиях хранения при 5°С, а клеточные носители с включенными препаратами хранятся двух-трех суток.
Для выяснения эффективности антибактериальной терапии пиелонефрита методом направленного транспорта с использованием клеточных форм антибактериальных препаратов необходимо было создать его экспериментальную модель.
Нами выбрано введение ртути дихлорида и микробного агента.
Установлено, что введение ртути дихлорида совместно с микробным агентом вызывало развитие пиелонефрита, подтверждающееся клиническими показателями: гипертермия, снижение веса на 18%, нарушение выделительной функции почек (табл. 4). Анализ выделительной функции почек показал резкое повышение уровня в крови мочевины в 2,1 раза и креатинина в 3,2 раза, появление лейкоцитов и белка в моче (табл. 5).
Таблица 4. Изменение температуры и массы тела у животных с необструктивным пиелонефритом
| Группа | Температура тела (oС) | Масса тела (г) |
|---|---|---|
| 1. Контроль (здоровые крысы) | 41,5±0,5 | 153,4±11,8 |
| 2. Введение ртути дихлорида и стафилококка | 43,8±0,4 | 125,2±10,3 |
Таблица 5. Уровень мочевины и креатинина у животных с необструктивным пиелонефритом
| Группа | Мочевина, моль/л | Креатинин, моль/л |
|---|---|---|
| 1. Контроль (здоровые крысы) | 132,4±13,2 | 153,4±11,8 |
| 2. Введение ртути дихлорида и стафилококка | 278,2±27,1*1 | 125,2±10,3 |
Установлены изменения лейкоцитарной формулы – увеличение количества лейкоцитов на 35%, уменьшение количества лимфоцитов – на 24% и повышение количества нейтрофилов крови на 23%. В почках отмечено снижение активности сукцинатдегидрогеназы (СДГ) в 1,9 раза, глютаматдегидрогеназы (ГДГ) в 2,1 раза, щелочной фосфатазы (ЩФ) в 2,3 раза, на фоне высокой активности лактатдегидрогеназы (ЛДГ). Анализ патологических изменений в мозговом слое почек показал очаговые некрозы и очаговые скопления лейкоцитов (рис. 1).
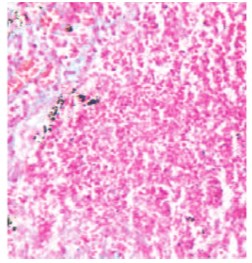
Рис. 1. Морфологические изменения в препаратах почек при пиелонефрите. Окраска гематоксилином и эозином. Увеличение х400
Полученные результаты свидетельствовали о развитии инфекционного воспалительного процесса в почках, весьма близкого к естественной картине пиелонефрита.
Для сравнительной оценки эффективности свободных и клеточных форм антибиотиков аминогликозидов и фторхинолонов при экспериментальном пиелонефрите использовали внутривенное введение разовых доз препаратов, пересчитанных по общепринятой методике на крысу. При этом температуру тела определяли один раз в сутки в одно и тоже время (9-10 ч) до ее полной нормализации и последующие два дня, выделительную функцию почек и массу тела определяли на четвертый и последующие дни. Лабораторные показатели определяли во всех группах на 10 сутки после развития пиелонефрита.
Установлено, что пятикратное введение животным с пиелонефритом гентамицина в дозе 2 мг/кг, амикацина в дозе 12 мг/кг ципрофлоксацина и офлоксацина в дозах 3 мг/кг нормализовало температуру тела на 10-12 сутки, выделительную функцию почек – на 12-14 сутки, при этом вес животных достоверно не изменялся. На 10 сутки в крови количество лейкоцитов было повышено в среднем на 10-12%, количество лимфоцитов снижено на 89%, количество нейтрофилов не изменялось, уменьшался, но не нормализовался дисбаланс активности ферментов в почках.
В отличие от этого однократное введение крысам с пиелонефритом эритроцитарных или лейкоцитарных форм антибактериальных препаратов в разовых дозах нормализовало температуру тела на 7-8 или 5-6 сутки, выделительную функцию почек на 8-9 или 5-6 сутки соответственно, на 10 сутки отмечена полная нормализация количества лейкоцитов, лимфоцитов, нейтрофилов в крови, активности ферментов в почках.
ОБСУЖДЕНИЕ
Нами разработана лабораторная технология получения эритроцитарных и лейкоцитарных форм антибиотиков аминогликозидов и фторхиноонов, включающая выделение ЭН и ЛН, получение стандартизованных по количеству действующего вещества клеточных форм антибактериальных препаратов.
Установлены особенности включения отдельных представителей антибиотиков – аминогликозидов и фторхинолонов в эритроцитарные носители здоровых животных и крыс с пиелонефритом. Показано, что более высокое включение аминогликозидов и фторхинолонов происходит при использовании ЭН здоровых крыс. При использовании эритроцитарных носителей крыс с пиелонефритом наибольший процент включения отмечен при инкубации с антибиотиками аминогликозидами. Установлена достаточная устойчивость эритроцитарных носителей с включенными химиопрепаратами, что позволяет их использовать в качестве контейнеров для направленного транспорта антибиотиков аминогликозидов в органы и, в частности, в почки. При применении в качестве векторов для направленного транспорта в организм химиопрепаратов лейкоцитарных носителей установлена более высокая иммобилизация препаратов в лейкоцитарные носители здоровых доноров. Изучение процессов десорбции аминогликозидов и фторхинолонов из ЛН в плазму крови показало их достаточную устойчивость, и подтвердило возможность использования лейкоцитов в качестве векторов для направленного транспорта антибактериальных препаратов. Введение в инкубационную среду АТФ, по-видимому, за счет изменения микровязкости мембран клеток, увеличивает включение препаратов не только в лейкоцитарные носители здоровых доноров, но и лейкоцитарные носители крыс с пиелонефритом. Изучение фармакокинетики показало, что введение иммобилизованных в клеточные носители антибиотиков аминогликозидов или фторхинолонов увеличивает их содержание в почках в 1,5-1,8 раза, в крови концентрация препарата была незначительна.
Общеизвестно, что инфекционный воспалительный процесс в почках возникает при попадании микробного агента на фоне нарушения уроили гемодинамики почек [17].
Экспериментальный пиелонефрит моделировали введением токсического и микробного агентов: ртути дихлорида и стафилококка. Развитие экспериментального пиелонефрита подтверждалось клиническими показателями (гипертермия, снижение веса, нарушение выделительной активности), изменение лейкоцитарной формулы, появлением в почках микроабсцессов из скопления лейкоцитов, разбалансированием активности почечных ферментов. Механизм развития пиелонефрита в выбранной модели, по-видимому, можно объяснить нарушением внутрипочечного кровотока, который возникает за счет повреждающего действия на почечную ткань (ртути дихлорид), что приводит к фиксации микроорганизмов в почках. Оценка эффективности свободных и клеточных форм антибактериальных препаратов при экспериментальном пиелонефрите показало, что введение эритроцитарных и лейкоцитарных форм, в соответствующих их системному введению дозах, оказывало более существенный фармакологический эффект, что выражалось в более ранней нормализации (5-7 сутки) клинических, лабораторных, гематологических и морфологических показателей.
ВЫВОДЫ
1. Экспериментальное моделирование пиелонефрита подтверждено развитием клинических, лабораторных, гематологических признаков воспалительного процесса в почках, снижением в почках активности СДГ, ГДГ, ЩФ в 1,9–2,3 раза на фоне высокой активности ЛДГ.
2. Системное введение гентамицина (2 мг/кг), амикацина (12 мг/кг), ципрофлоксацина (3 мг/кг) и офлоксацина (3 мг/кг) 1 раз в сутки курсом 5 дней после моделирования пиелонефрита нормализовало температуру тела, выделительную функцию, гематологические показатели, активность ферментов в почках и морфологическую картину к 10–12 суткам наблюдения.
3. Однократное введение эритроцитарных и лейкоцитарных форм антибактериальных препаратов в дозах, соответствующих их системному однократному введению, оказывало более существенный фармакологический эффект по сравнению с традиционным способом, что выражалось в более ранней нормализации (на 5–7 сутки) клинических, лабораторных, морфологических показателей.
ЛИТЕРАТУРА
1. Зубков М.Н. Практическое руководство по клинической микробиологии и антимикробной терапии для врачей стационарной помощи. М.: МГУП. 2002. 272 с.
2. Рафальский В.В. Обоснование выбора антимикробных препаратов при амбулаторных инфекциях мочевыводящих путей: автореф. дис. ... д-ра мед. наук. Смоленск. 2004. 36 c.
3. Неймарк А.И., Гаткин М.Я. Использование криопреципитата в комплексном лечении острого гнойного пиелонефрита. Урология 2005;(4):42-48.
4. Неймарк А.И., Симашкевич А.В. Комплексное лечение больных острым пиелонефритом. В кн.: Современные принципы диагностики, профилактики и лечения инфекционно-воспалительных заболеваний почек, мочевыводящих путей и половых органов. М. 2007. С.88-91.
5. Кузменко В.В., Золотухин О.В., Аносова Ю.А. Антибактериальная терапия моделированного острого гнойного пиелонефрита у экспериментальных животных. Вестн. Воронежского гос. ун-та. Сер. Химия. Биология. Фармация 2009;(1):.53-57.
6. Аносова Ю.А. Направленный транспорт антибиотиков в лечении острого гнойного пиелонефрита у экспериментальных животных: автореф. дис… канд. мед наук. СПб. 2010.
7. Лохвицкий С.В. Направленный транспорт антибиотиков при лечении больных диабетической гнойной остеоартропатией. Сахарный диабет 1999;3(4):1-5.
8. Шевцова О.М., Денисова О.И. Применение плазмафереза в сочетании с экстракорпоральной инкубацией эритроцитарной массы с антибактериальными препаратами. В кн.: Труды 9-ой конференции Московского общества гемафереза. М. 2001. С.11.
9. Бельских А.Н., Потапчук В.Б. Совместное применение антибиотиков и экстракорпоральных методов детоксикации в гнойно-септической хирургии. В кн.: Сб. тр. 9-го ежегод. Санкт-Петербургского нефрологического семинара. СПб. ТНА. 2001. С.101-102.
10. Меньшиков В.В., Делекторская Л.Н., Золотницкая Р.П., Андреева З.М., Анкирская А.С., Балаховский И.С., и др. Лабораторные методы исследования в клинике: Справочник. М. Медицина. 1987. 368 с.
11. Генинг Т.П., Колкер И.И., Жумадилов Ж.Ш. Использование форменных элементов крови для направленной доставки химиотерапевтических и диагностических препаратов в очаг поражения. Антибиотики и химиотерапия 1988;33(11):867-870.
12. Жумадилов Ж.Ш., Макаренкова Р.В. Особенности включения некоторых антибиотиков в эритроцитарные тени – систему целенаправленной доставки химиотерапевтических препаратов. Антибиотики и химиотерапия 1990;35(11):54-56.
13. Кукурека А.В. Спектрофотометрическое определение лекарственных средств из группы аминогликозидных антибиотиков: автореф. дис… канд. фарм. наук. Курск. 2000. 18 c.
14. Карлов П.М. Исследование соединений групп фторхинолонов, иммобилизированных на различных носителях: автореф. дис… канд. фарм. наук. Курск. 2009, 23 c.
15. Гублер Е.В. Вычислительные методы анализа и распознавания патологических процессов. Л. Медицина. 1978. 294 с.
16. Лакин Г.Ф. Биометрия. М. Высшая школа. 1980. 293 с.
17. Есилевский Ю.М. Патогенез пиелонефрита. МЕДпресс-информ. 2007. 368 с.









Комментарии