Кирпатовский В.И., Чочуев О.С., Голованов С.А., Дрожжева В.В., Кудрявцева Л.В., Фролова Е.В., Казаченко А.В.
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из наиболее распространенных урологических заболеваний мужчин пожилого возраста. При этом эпидемиологические исследования показывают, что частота развития этого заболевания существенно возрастает у больных с избыточным весом, при наличии диабета и сердечно-сосудистых заболеваний [1-3]. Также показано возрастание частоты развития ДГПЖ и других заболевания органов мочеполовой системы у больных с метаболическим синдромом (МС), который характеризуется сочетанием в различных комбинациях таких неблагоприятных факторов, как абдоминальное ожирение, артериальная гипертония, атеросклероз, нарушение липидного обмена, инсулинорезистентность, андрогенный дефицит [4-7]. При этом у этих мужчин не только выше средняя степень увеличения предстательной железы (ПЖ) при диагностике заболевания по сравнению с популяцией больных без МС того же возраста, но и выше скорость увеличения железы при динамическом наблюдении (1,92 см3 по сравнению с 1,23 см3 в год) [8,9].Также показано, что чем больше компонентов МС имеется у пациента (то есть, чем выраженнее метаболические расстройства), тем в большей степени увеличивается объем ПЖ и степень вызываемой ею инфравезикальной обструкции [10,11].
Наряду с формированием ДГПЖ у больных с МС развиваются нарушения мочеиспускания, характерные для этого заболевания, однако, эти расстройства хуже поддаются медикаментозной коррекции а-адрено-блокаторами по сравнению с пациентами без МС [8,12,13], в связи с чем у них чаще наблюдается прогрессирование расстройств мочеиспускания, несмотря на проводимое лечение, что приводит к необходимости хирургического лечения [9].
Такие особенности клинического течения ДГПЖ у больных с МС предопределяются наличием особенностей патогенеза этого заболевания. Основными патогенетическими факторами, ведущими к формированию ДГПЖ и сопутствующих расстройств мочеиспускания, считаются нарушение баланса половых гормонов, развитие хронической ишемии тазовых органов, нарушение углеводного и липидного обмена, что ведет к формированию низкоинтенсивной хронической воспалительной реакции, стимулирующей пролиферацию эпителиальных и стромальных клеток ПЖ и нарушению функции детрузора [14-18]. Однако вопрос о роли этих факторов при наличии МС практически не изучен.
Изучению этого вопроса посвящено данное экспериментальное исследование.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты были проведены на 20 белых беспородных половозрелых крысах-самцах массой 90-320 г. У 10 животных моделировали МС, а 10 крыс служили контролем.
Для моделирования МС 10 крыс содержали в течение трех месяцев на высококалорийной диете, обогащенной углеводами и жирами, что достигалось добавлением к стандартному комбикорму маргарина в весовых соотношения 20 г маргарина + 80 г комбикорма (содержание маргарина 20%) и добавлением в питьевую воду фруктозы до концентрации 20%. Крысы контрольной серии содержались на стандартном рационе.
Формирование МС подтверждали измерением массы тела животного, а также биохимическим исследованием крови и мочи с определением концентраций мочевины, креатинина, глюкозы, холестерина и его фракций, триглицеридов, а также активности ряда ферментов (трансаминаз - АЛТ, АСТ, щелочной фосфатазы - ЩФ, лактатдегидрогеназы - ЛДГ, гамма-глутамил-транспептидазы - ГГТ, холинэстеразы - ХЭ). Биохимические исследования проводили на автоматическом анализаторе “ADVIA-2000”. Учитывая суточный диурез, рассчитывали суточную экскрецию изучаемых показателей, а также клубочковую фильтрацию и канальцевую реабсорбцию натрия и кальция.
Проводили также определение уровня половых гормонов (тестостерона, дигидротестостерона, эстрадиола) в крови и в ткани ПЖ, а также уровня инсулина в крови. Концентрацию гормонов в крови определяли иммунохемилюминесцентным методом на иммуно-химическом анализаторе Access 2 (“Beckman Coulter”). Для определения их концентрации в ткани ПЖ готовили гомогенат в соотношении ткань: физиологический раствор 1:10, центрифугировали его при 3000 об/мин в течение 5 мин, после чего отбирали супернатант, который хранили до момента исследования при температуре -80оС. Концентрацию гормонов в супернатанте определяли иммуноферментным методом (“DRG Instrument-GmbH”) на анализаторе Artemis K101 HTRF Microplate Reader (“Berthold Technologies GmbH&Co KG”). Тканевую концентрацию гормонов пересчитывали на 1 г ткани.
Развитие ДГПЖ у крыс с МС подтверждали измерением массы ПЖ и ее гистологическим исследованием с окрашиванием препаратов гематоксилином и эозином.
Состояние кровоснабжения ПЖ и мочевого пузыря (МП) и функциональное состояние МП определяли методом высокочувствительной импедансометрии с использованием разработанного совместно с НПФ «Биола» комплекса аппаратуры и анализа частотного спектра малых колебаний импеданса по Фурье, в сочетании с регистрацией внутрипузырного давления при выполнении инфузионной цистометрии [19]. Показателем состояния кровоснабжение органов служили значения пика, регистрируемого на частоте сердцебиений, называемого кардиальным пиком С1, а о состоянии МП судили по величине внутрипузырного давления в начале инфузионной цистометрии и при начале мочеиспускания, а также по амплитуде его колебаний в накопительную фазу.
Статистическую обработку цифровых данных проводили по методу Стьюдента с использованием программ Statistica 10 и Excel-2007. Усредненные данные выражали в виде средних значений и ошибки средней (M±m), достоверными считали различия при p<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
После 3-месячного содержания крыс на высококалорийной диете их масса возрастала с 309±9 г до 392±16 г, тогда как в контрольной серии масса животных возросла незначительно- с 296±9 до 311±8 г (различия между группами достоверны при p<0,01).
Биохимическое исследование крови и мочи выявило метаболические изменения, типичные для МС. В крови отмечали достоверное возрастание концентрации глюкозы, соотношение холестерина, липопротеидов высокой и низкой плотности, уровня триглицеридов, а также мочевой кислоты (табл. 1). При этом ухудшались показатели функционального состояния почек (мочевина, креатинин), хотя и не выходили за пределы нормальных значений.
Таблица 1. Биохимические параметры крови крыс
| Параметры | Интактные крысы | МС |
|---|---|---|
| Мочевина (мМ/л) | 5,1 ±0,2 | 6,9±0,2* |
| Креатинин (мкМ/л) | 56±2 | 71 ±3* |
| Мочевая к-та (мМ/л) | 0,06±0,01 | 0,12±0,02* |
| Общий билирубин (мМ/л) | 11,7 ±0,4 | 12,5±0,3 |
| АСТ (МЕ/л) | 112±7 | 124±8 |
| АЛТ (МЕ/л) | 62±5 | 65±3 |
| ЩФ (МЕ/л) | 316±25 | 267±11 |
| ЛДГ (МЕ/л) | 1288±133 | 1441±167 |
| Глюкоза (мМ/л) | 6,02±0,12 | 7,63±0,14** |
| Общий холестерин (мМ/л) | 1,96±0,09 | 1,82±0,08 |
| ЛПНП (мМ/л) | 0,32±0,02 | 0,36±0,04 |
| ЛПВП (мМ/л) | 0,51 ±0,03 | 0,44±0,02 |
| ЛПНП/ЛПВП | 0,63±0,02 | 0,82±0,02** |
| Триглицериды (мМ/л) | 0,37±0,03 | 1,01 ±0,19*** |
*p<0,05; **p<0,01; ***p<0,001
В анализах мочи при двукратном увеличении диуреза также выявляли соответствующие изменения - глюкозурию, протеинурию, увеличение суточной экскреции электролитов, мочевой кислоты и внутриклеточных ферментов (табл. 2). Об ухудшении функционального состояния почек свидетельствовали достоверное снижение клиренса креатинина и канальцевой реабсорбции натрия.
Таблица 2. Биохимические параметры мочи крыс
| Параметры | Интактные крысы | МС |
|---|---|---|
| Диурез (мл/сутки) | 13±2 | 27±2** |
| Мочевина (мМ/сут.) | 8,7±1,1 | 9,5+0,6 |
| Креатинин (мкМ/сут.) | 0,09+0,01 | 0,16+0,07* |
| №+(мэкв/сут.) | 0,44+0,02 | 0,57+0,01** |
| Са2+(мэкв/сут.) | 0,04+0,004 | 0,05+0,006* |
| P2+(мэкв/сут.) | 0,37+0,04 | 0,71+0,02** |
| Мочевая к-та (мМ/сут.) | 0,015+0,002 | 0,031 +0,001** |
| АСТ (МЕ/сут.) | 0,68+0,05 | 1,14+0,48* |
| АЛТ (МЕ/сут.) | 0,21+0,04 | 0,38+0,03* |
| ЩФ (МЕ/сут.) | 1,35+0,28 | 3,72+0,26** |
| ГГТ (МЕ/сут.) | 6,31+0,98 | 9,22+0,51* |
| ЛДГ (МЕ/сут.) | 0,32+0,08 | 0,91+0,14* |
| Глюкоза (мМ/сут.) | 0,009+0,001 | 0,018+0,001** |
| Белок (мг/сут.) | 8,18+0,78 | 16,99+1,29*** |
| Клиренс креатинина (мл/мин/кг) | 4,68+0,37 | 3,45+0,21* |
| Реабсорбция натрия(%) | 99,87+0,03 | 99,69+0,03* |
Таким образом, в опытной группе крыс удалось смоделировать биохимические изменения, характерные для МС.
Определение массы ПЖ у этих животных выявило ее достоверное увеличение по сравнению с нормой: 0,86±0,03 г у контрольных крыс и 1,58±0,06 г у крыс с МС (p<0,001). Гистологические исследование ПЖ крыс с МС выявило картину железистой гиперплазии с очагами низкой ПИН, сочетающуюся с очагами атрофии ацинусов. При этом гиперплазированные участки значительно преобладали. Отмечали также умеренное разрастание стромы железы, что позволяло отнести выявленную картину к железистостромальной форме ДГПЖ (рис. 1А).
При гистологическом исследовании МП выявляли гипертрофию мышечного слоя разной степени (от умеренной до выраженной) (рис. 1Б), что являлось косвенным признаком затруднения мочеиспускания у этих животных.
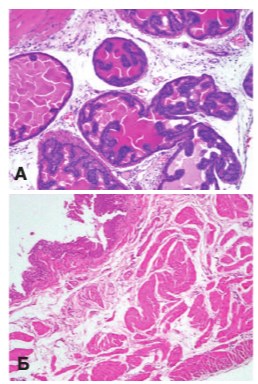
Рис. 1. Гистологическая картина предстательной железы (А) (Ув. 200х) и мочевого пузыря (Б) (Ув. 100х) крыс с МС. Окраска гематоксилином и эозином.
При этом, как показало исследование функционального состояния МП, на фоне умеренно выраженной обструкции появляются признаки гиперактивности детрузора (табл. 3). Если в опорожненном мочевом пузыре внутрипузырное давление у крыс обеих серий было одинаковым, то при максимальном его наполнения в процессе инфузионной цистометрии, при котором начинается мочеиспускание, оно превысило 40 см H20 у 6 из 10 крыс с МС, чего не наблюдали в контрольной серии. В результате средние значения детрузорного давления (Pdet) при мочеиспускании у крыс с МС оказались достоверно выше, чем у контрольных крыс (p<0,05). Эти данные в сочетании с гистологически выявленной гипертрофией детрузора свидетельствуют о наличии у этих крыс инфравезикальной обструкции. При этом отмечали достоверное возрастание амплитуды колебаний внутрипу-зырного давления в процессе инфузионной цистометрии, что указывало на развитие гиперактивности детрузора.
Таблица 3. Параметры инфузионной цистометрии
| Исследуемые параметры | Интактные крысы | Крысы с МС | ||
|---|---|---|---|---|
| До начала инфузии | Максимальное наполнение мочевого пузыря | До начала инфузии | Максимальное наполнение мочевого пузыря | |
| Среднее Pdet (см. вод. ст.) | 4+1 | 33+1 | 4+1 | 38+1* |
| APdet (см. вод. ст.) | 01.апр | 03.апр | 02.май | 7-12* |
*p<0,05
Таким образом, у крыс с МС формируется доброкачественная гиперплазия предстательной железы и развивается дисфункция мочевого пузыря по типу гиперактивности детрузора.
Дальнейшие исследования были направлены на выявление механизма этих изменений. С этой целью мы исследовали состояние кровоснабжения МП и ПЖ крыс с МС и их гормональный фон.
Исследование состояния кровоснабжения выявило достоверное ухудшение микроциркуляции обоих органов как в опорожненном МП, так и при его максимальном наполнении. Если у интактных крыс переполнение МП вело к интенсификации кровотока как в этом органе, так и в ПЖ, то у крыс с МС на фоне исходно более низких значений кардиального пика при переполнении МП оно увеличивалось незначительно (в МП) или практически не менялись (в ПЖ) (табл. 4).
Таблица 4. Состояние кровоснабжения мочевого пузыря и предстательной железы при разной степени наполнения мочевого пузыря
| Исследуемые параметры |
Интактные крысы | Крысы с МС | ||
|---|---|---|---|---|
| До начала инфузии | Максимальное наполнение мочевого пузыря | До начала инфузии | Максимальное наполнение мочевого пузыря | |
| Пик С1 мочевого пузыря (мОм) | 64+5 | 119+8 | 19+1*** | 28+3*** |
| Пик С1 предстательной железы (мОм) | 45+3 | 70+5 | 21 + 1*** | 18+1*** |
***p<0,001
То есть, у крыс с МС происходит ухудшение кровоснабжения тазовых органов, что может вести к их хронической ишемии и являться одной из причин усиления пролиферации клеток ПЖ и развития дисфункции МП.
Важным патогенетическим фактором развития ДГПЖ считается усиление андрогенных воздействий на ПЖ. В тоже время, у больных с МС часто выявляют наличие андрогенного дефицита и обусловленных им сексуальных расстройств, что может рассматриваться как определенное противоречие [20].
Наши исследования показали, что у крыс с МС в крови происходит достоверное снижение уровня как тестостерона, так и дигидротестостерона, однако, в ткани ПЖ уровень этих гормонов достоверно повышается (табл. 5). Тканевая концентрация тестостерона возросла почти в 2 раза, а дигидротестостерона - более чем в 3 раза. Уровень эстрадиола в крови у крыс с МС достоверно снизился, тогда как в ткани ПЖ его концентрация была ниже порога определения.
Таблица 5. Гормональный фон крыс с МС в сравнении с интактными крысами
| Группы | Тестостерон | Дигидротестостерон | Эстрадиол | Инсулин | |||
|---|---|---|---|---|---|---|---|
| Кровь (г/мл) | Ткань ПЖ (пмоль/г) | Кровь (г/мл) | Ткань ПЖ (пг/г) | Кровь (г/мл) | Ткань ПЖ (пг/г) | в крови (мкЕд/мл) | |
| Контроль | 3,86±0,72 | 2,54±0,16 | 538±51 89±4 | 24±2 | <10 0,06±0,02 | ||
| МС | 1,53±0,09* | 4,38±0,04*** | 423±12* | 298±9*** | 13±2* | <10 | 0,14±0,02* |
*p<0,05; **p<0,01; ***p<0,001
Примечание: <10 пг/г – ниже порога определения
Полученные результаты свидетельствуют, что уменьшение концентрации андрогенов в крови не может свидетельствовать об уменьшении андрогенных влияний на ПЖ, поскольку их тканевая концентрация, особенно дигидротестостерона, возрастает, что может стимулировать пролиферацию эпителия ПЖ. Соотношение андрогенов и эстрогенов также играет существенное значение в реализации гормональных эффектов. Эстрогены могут являться в определенной степени антагонистом андрогенов по их влиянию на половые органы. В наших опытах снижение уровня эстрадиола в крови крыс с МС оказалось более выраженным, чем уменьшение концентрации андрогенов, в частности дигидротестостерона. Если в норме отношение дигидротестостерон/эстрадиол составило 22,4, то у крыс с МС оно возросло до 32,5, что указывало на преобладание андрогенных влияний, в том числе на пролиферацию эпителия желез предстательной железы.
Мощным стимулятором пролиферации является инсулин. Уровень этого гормона у крыс с МС достоверно возрастал (табл. 5), что в сочетании с развитием у них гипергликемии и глюкозурии свидетельствует о развитии инсулинорезистентности у этих животных. Этот фактор также может играть существенную роль в формировании ДГПЖ при развитии МС.
Таким образом, развитие ДГПЖ при МС могут вызывать по крайне мере 3 фактора - хроническая ишемия, усиление тканевых андрогенных воздействий и гиперинсулинемия.
Причиной ухудшения кровоснабжения тазовых органов может быть развитие артериальной гипертонии и атеросклероза магистральных артерий, а также развитие так называемой эндотелиальной дисфункции, приводящей к усилению вазоконстрикторных влияний, что часто наблюдается у больных с МС [14,21,22]. В наших исследованиях мы не могли проверить значимость этого фактора. Другим моментом может быть снижение концентрации тестостерона в крови. Этот гормон обладает прямыми вазодилататорными свойствами [23,24] и снижение его концентрации в крови может повышать тонус артериол, снабжающих тазовые органы. Косвенным подтверждением этого являют данные исследований, свидетельствующих, что терапия тестостероном кроликов с МС уменьшает признаки тканевой гипоксии и выраженность склерозирования ПЖ [25]. К такому же результату приводила терапия кроликов с МС ингибитором ФДЭ-5 тадалафилом, снижающим тонус сосудов половых органов [26].
Развитие хронической ишемии может, с одной стороны, стимулировать пролиферацию клеточных элементов стромы ПЖ, поскольку известно, что длительная гипоксия органа ведет к его склерозированию, что показано в том числе и в отношении МП и ПЖ [27]. С другой стороны, ишемия может являться причиной повышения активности 5а-редукта-зы, переводящей тестостерон в биологически более активный дигидротестостерон, поскольку кофактором этого фермента является NADPH, концентрация которого при ишемии возрастает. Действие основных ингибиторов 5а-редуктазы (финастерида, дутастерида) основано как раз на связывании NADPH-ферментного комплекса, что и блокирует трансформацию тестостерона в дигидротестостерон [28].
Таким образом, хроническая ишемия может способствовать пролиферации как стромы, так и эпителия ацинусов, что мы наблюдали в наших опытах.
Механизм возрастания концентрации андрогенов в ткани ПЖ на фоне снижения их концентрации в крови крыс с МС остается неясным, но возможно, он также связан с обменными изменениями (замедлением их метаболизации), вызываемыми тканевой гипоксией.
Гиперинсулинемия при развитии МС признается не менее важным фактором, вызывающим формирование ДГПЖ, чем действие андрогенов, особенно в условиях андрогенного дефицита, имеющегося у ряда этих больных [29,30]. Помимо прямого митогенного действия инсулин может стимулировать пролиферацию клеток ПЖ опосредовано через другие метаболиты. Показано, что гиперинсулинемия стимулирует синтез инсулиноподобного фактора роста в печени, являющегося митогеном с антиапоптотическим действием, который также ведет к увеличению размеров ПЖ [31,32]. Также имеются данные, что инсулин может усиливать пролиферативное действие тестостерона на ПЖ, так как у кастрированных крыс индукция МС с гиперинсулинемией не вызывает гиперплазии железы [29]. Развитие инсулинорезистентности у больных с метаболическим синдромом ведет к увеличению симпатической активности в гипоталамусе (предположительно связанной с нарушением метаболизма глюкозы), вызывающей активацию а-адренорецепторов автономной нервной системы органов, в том числе ПЖ и МП, что способствует увеличению массы ПЖ и развитию симптомов нижних мочевых путей [33,34].
ЗАКЛЮЧЕНИЕ
В патогенезе развития ДГПЖ при МС играет роль повышение тканевой концентрации андрогенов (тестостерона и дигидротестостерона), происходящее даже на фоне сниженной концентрации этих гормонов в крови, при снижении уровня эстрогенов, а также хроническая ишемия тазовых органов, развивающаяся, вероятно, вследствие эндотелиальной дисфункции, и гиперинсулинемия, возникающая как следствие инсулинорезистентности. Развивающаяся при этом дисфункция мочеиспускания, проявляющаяся в виде гиперактивности детрузора, обусловлена преимущественно хронической ишемией мочевого пузыря.
ЛИТЕРАТУРА
1. Fleshner NE, Bhindi B. Metabolic syndrome and diabetes for the urologist. Can Urol Assoc J 2014; 8(7-8 Suppl 5):159-161. doi: 10.5489/cuaj.2314.
2. Russo GI, Castelli T, Privitera S, Fragala E, Favilla V, Reale G, et al. Increase of Framingham cardiovascular disease risk score is associated with severity of lower urinary tract symptoms. BJU Int 2015 116(5):791-6. doi: 10.1111/bju.13053
3. La Vignera S Condorelli RA, Di Mauro M, Lo Presti D, Mongioi LM, Russo G, Calogero AE. Reproductive function in male patients with type 1 diabetes mellitus. Andrology. 2015;3(6):1082-7. doi: 10.1111/andr.12097.
4. Zou C, Gong D, Fang N, Fan Y. Meta-analysis of metabolic syndrome and benign prostatic hyperplasia in Chinese patients. World J Urol 2016; 34(2):281-289 doi: 10.1007/ s00345-015-1626-0
5. Yin Z, Yang JR, Rao JM, Song W Zhou KQ. Association between benign prostatic hyperplasia, body mass index, and metabolic syndrome in Chinese men. // Asian J Androl 2015;17(5):826-830. doi: 10.4103/1008-682X.148081.
6. Pan JG, Liu M, Zhou X. Relationship between lower urinary tract symptoms and metabolic syndrome in a Chinese male population. J Endocrinol Invest 2014;37(4):339-44. doi: 10.1007/s40618-013-0018-9.
7. Gacci M, Corona G, Vignozzi L, Salvi M, Serni S, De Nunzio C, et al. Metabolic syndrome and benign prostatic enlargement: a systematic review and meta-analysis. BJU Int 2015;115(1):24-31. doi: 10.1111/bju.12728.
8. Cyrus A, Kabir A, Goodarzi D, Talaei A, Moradi A, Rafiee M, et al. Impact of metabolic syndrome on response to medical treatment of benign prostatic hyperplasia. Korean J Urol 2014; 55(12) :814-20. doi: 10.4111/kju.2014.55.12.814.
9. Kwon H, Kang HC, Lee JH. Relationship between predictors of the risk of clinical progression of benign prostatic hyperplasia and metabolic syndrome in men with moderate to severe lower urinary tract symptoms. Urology 2013; 81(6):1325-9. doi:10.1016/ j.urology.2013.01.042.
10. Park YW, Kim SB, Kwon H, Kang HC, Cho K, Lee KI, et al. The relationship between lower urinary tract symptoms/benign prostatic hyperplasia and the number of components of metabolic syndrome. Urology 2013;82(3):674-9. doi: 10.1016/j.urology.2013.03.047.
11. Byun HK, Sung YH, Kim W, Jung JH, Song JM, Chung HC. Relationships between Prostate-Specific Antigen, Prostate Volume, and Components of Metabolic Syndrome in Healthy Korean Men. Korean J Urol 2012;53(11):774-8. doi: 10.4111/kju.2012.53.11.774.
12. Lee YC, Liu CC, Juan YS, Wu WJ, Li WM, Yeh HC, et al. The impact of metabolic syndrome on the responsiveness to a1-blocker in men with BPH/LUTS. Int J Clin Pract 2013;67(4):356-62. doi: 10.1111/ijcp.12086.
13. Cao B, Sun HB, Su JH, Shen MS, Cao ZG, Jia RP, Liu J. Correlation between metabolic syndrome and clinical progression in patients with benign prostatic hyperplasia. Zhonghua Yi Xue Za Zhi 2010;90(40):2823-5.
14. Тюзиков ИА., Мартов А.Г., Греков ЕА. Влияние компонентов метаболического синдрома и гормональных нарушений в патогенезе заболеваний предстательной железы. Экспериментальная и клиническая урология 2012; (3): 39-47.
15. McLaren ID, Jerde TJ, Bushman W. Role of interleukins, IGF and stem cells in BPH. Differentiation 2011;82(4-5):237-43. doi: 10.1016/j.diff.2011.06.001.
16. Vignozzi L, Gacci M, Cellai I, Santi R, Corona G, Morelli A,et al. Fat boosts, while androgen receptor activation counteracts, BPH-associated prostate inflammation. Prostate 2013;73(8):789-800. doi: 10.1002/pros.22623.
17. Gacci M, Vignozzi L, Sebastianelli A, Salvi M, Giannessi C, De Nunzio C, et al. Metabolic syndrome and lower urinary tract symptoms: the role of inflammation. Prostate Cancer Prostatic Dis 2013;16(1):101-6. doi: 10.1038/pcan.2012.44.
18. Azadzoi K.M., Chen B.G., Radisavljevic Z.M., Siroku M.B. Molecular reactions and ultrastructural damage in the chronically ischemic bladder. J. Urol 2011;186 (5): 21152122.
19. Мудрая И.С., Ибрагимов А.Р, Кирпатовский В.И., Ревенко С.В., Несторов А.В., Гаврилов И.Ю. Оценка функционального состояния мочевого пузыря крыс методов Фурье-импедансной цистометрии. Экспериментальная и клиническая урология 2010; (3): 21-27.
20. Corona G, Vignozzi L, Rastrelli G, Lotti F, Cipriani S, Maggi M. Benign prostatic hyperplasia: a new metabolic disease of the aging male and its correlation with sexual dysfunctions. Int J Endocrinol 2014;2014:329456. doi: 10.1155/2014/329456.
21. Campia U, Tesauro M, Cardillo C. Human obesity and endothelium-dependent responsiveness. Br J Pharmacol 2012 ; 165(3):561-73. doi: 10.1111/j.1476-5381.2011.01661x.
22. Chen IH, Tsai YS, Tong YC. Correlations among cardiovascular risk factors, prostate blood flow, and prostate volume in patients with clinical benign prostatic hyperplasia. Urology 2012;79(2):409-414.
23. Shibata Y, Kashiwagi B, Ono Y, Fukabori Y, Suzuki K, Honma S, Yamanaka H. The evaluation of rat prostate blood flow using a laser speckle flowmetry: a comparative study using the microsphere method in castrated and androgen-replenished rats. Urol Res 2004;32(1);44-48.
24. Navarro-Dorado J, Orensanz LM, Recio P, Bustamante S, Benedito S, Martinez AC,et al. Mechanisms involved in testosterone-induced vasodilatation in pig prostatic small arteries. Life Sci 2008;83(15-16):569-573.
25. Vignozzi L, Morelli A, Sarchielli E, Comeglio P, Filippi S, et al. Testosterone protects from metabolic syndrome-associated prostate inflammation: an experimental study in rabbit. J Endocrinol 2012;212(1):71-84. doi: 10.1530/JOE-11-0289
26. Morelli A, Comeglio P, Filippi S, Sarchielli E, Vignozzi L, Maneschi E, et al. Mechanism of action of phosphodiesterase type 5 inhibition in metabolic syndrome-associated prostate alterations: an experimental study in the rabbit. Prostate 2013;73(4):428-41. doi: 10.1002/pros.22584.
27. Azadzoi KM, Radisavljevic ZM, Golabek T, Yalla SV Siroky MB. Oxidative modification of mitochondrial integrity and nerve fiber density in the ischemic overactive bladder. J Urol 2010;183(1):362-369. doi: 10.1016/j.juro.2009.08.103
28. Azzouni F, Godoy A, Li Y, Mohler J. The 5 alpha-reductase isozyme family: a review of basic biology and their role in human diseases. Adv Urol 2012;2012:530121. doi: 10.1155/2012/530121.
29. Vikram A, Jena G, Ramarao P. Insulin-resistance and benign prostatic hyperplasia: the connection. Eur J Pharmacol 2010; 641(2-3):75-81. doi: 10.1016/j.ejphar.2010.05.042.
30. Balhara B, Burkart A, Topcu V, Lee YK, Cowan C, Kahn CR, Patti ME. Severe insulin resistance alters metabolism in mesenchymal progenitor cells. Endocrinology 2015;156(6):2039-48. doi: 10.1210/en.2014-1403.
31. Wang Z, Olumi AF. Diabetes, growth hormone-insulin-like growth factor pathways and association to benign prostatic hyperplasia. Differentiation 2011;82(4-5):261-71. doi: 10.1016/j.diff.2011.04.004.
32. Ceylan C, Serel A, Doluoglu OG, Armagan A, Yiiksel S. Prostatic fluid free insulin-like growth factor-1 in relation to benign prostatic hyperplasia: a controlled study. Urol J 2014;10(4):1067-71.
33. Ozden C., Ozdal O.I., Urgancioglu G., Koyuncu H. Gokkaya A., Memis A. The TOn'elation between metabolic syndrome and prostatic growth in patients with benign prostatic hyperplasia. Eur Urol 2007; 51 (1):199-203.
34. Mc Vary K.T., Rademaker A., Lloyd G.L., Gann P. Autonomic nervous system overactivity in men with lower urinary tract symptoms secondary to benign prostatic hyperplasia. J Urol, 2005;174(4, Pt.1): 1327-1433.









Комментарии