Журнал "Экспериментальная и клиническая урология" Выпуск №2 за 2015 год
Гарилевич Б.А., Кирпатовский В.И., Кудрявцев Ю.В., Синюхин В.Н.
Лечение хронического бактериального простатита требует длительной терапии антибиотиками в высоких дозах, причем, как правило, одного курса антибиотика оказывается недостаточно и возникает необходимость в дополнительных курсах терапии антибактериальными препаратами других фармакологических групп. Одной из причин этого является низкая проницаемость ткани предстательной железы (ПЖ) для антибиотиков. При длительно текущем хроническом воспалении ПЖ происходит прогрессирующее склерозирование ее ткани и обеднение сосудистого русла, что еще больше ухудшает доставку антибиотиков к очагу воспаления и уменьшает эффективность антибиотикотерапии.
История применения ударных волн в медицине насчитывает более 30 лет. За этот период из разрушительного орудия для дробления мочевых камней метод эволюционировал в гибкий и эффективный инструмент, позволяющий, наряду с литотрипсией, оказывать и стимулирующее влияние на внутренние органы и ткани. В ранее проведенных исследованиях было показано, что низкоинтенсивное дистанционное ударно-волновое воздействие на органы мочеполовой системы оказывает выраженное стимулирующее влияние на метаболические процессы в почке и других органах, повышая эффективность клеточных компенсаторно-приспособительных реакций, что увеличивает резистентность органов к действию повреждающих факторов [1]. Уникальные биологические свойства ударных волн низкой интенсивности позволили нам впервые применить их для воздействия на ПЖ у больных хроническим простатитом, повысив эффективность лечения этого заболевания [2].
В литературе имеются отдельные публикации, свидетельствующие, что низкоинтенсивное ударноволновое воздействие оказывает терапевтическое действие на больных с хроническим простатитом и синдромом хронической тазовой боли, уменьшая выраженность болевого синдрома и расстройств мочеиспускания [3]. Имеются также данные о стимуляции регенерации поврежденных тканей при этом виде воздействия, однако механизм его действия остается неясным [4-6].
Для выяснения механизмов терапевтического действия низкоинтенсивной ударноволновой терапии в комплексном лечении хронического бактериального простатита мы провели экспериментальное исследование на крысах по изучению влияния этого воздействия на состояние микроциркуляции в органе, активность ряда ферментов, участвующих в энергообеспечении клеточных метаболических процессов, а также на биодоступность антибиотиков для ткани ПЖ.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальное исследование было проведено на 32 половозрелых самцах белых беспородных крыс массой 260-300 г.
В первой части исследования (18 крыс) мы оценивали влияние ударно-волнового воздействия на морфометрические параметры интрапростатических кровеносных сосудов, а также на активность ферментов, характеризующих активность цикла Кребса – сукцинат-дегидрогеназы (СДГ), и активность пентозофосфатного пути окисления – глюкозо-6-фосфат дегидрогеназы (Г-6-ФДГ). Оба эти пути окисления являются основными путями аэробного синтеза АТФ, необходимого клеткам для метаболических процессов, причем, пентозомонофосфатный путь является резервным, активирующимся при возрастании потребностей клеток в АТФ.
В этих опытах наркотизированных крыс (внутрибрюшинное введение тиопентала натрия в дозе 60 мг/кг) подвергали ударно-волновому воздействию на аппарате для ударно-волновой терапии “АУВТ Румелит” (производство РФ) на область ПЖ в следующем режиме: амплитуда давления импульсов – 50 бар, число импульсов – 1000 импульсов. Через 2 часа, 1, 7, 14, 21 и 60 суток (по 2-3 крысы на каждый срок) вскрывали брюшную полость и выделяли боковые доли ПЖ, которые у крыс вместе с большей частью мочевого пузыря (за исключением шейки) находится в брюшной полости.
Боковые доли ПЖ удаляли для гистологического исследования с морфометрией сосудов при окраске срезов гематоксилином и эозином, а также для гистохимического исследования активности СДГ и Г6Ф-ДГ. Количественные параметры, характеризующие состояние интрапростатических сосудов определяли на установке “MOP-Videoplan” (США) с использованием специальной компьютерной программы. Активность ферментов выражали в процентах превышения активности ферментов по отношению к их активности в интактной ПЖ, не подвергавшейся ударноволновому воздействию.
Таблица 1. Режимы ударно-волнового воздействия на область ПЖ крыс
| Режим | Амплитуда давления |
Количество импульсов |
|---|---|---|
| 1 | 50 бар | 1500 |
| 2 | 100 бар | 500 |
| 3 | 100 бар | 1000 |
| 4 | 100 бар | 1500 |
| 5 | 300 бар | 1000 |
| 6 | 300 бар | 1500 |
Таблица 2. Влияние низкоинтенсивного ударно-волнового воздействия на активность СДГ и Г6Ф-ДГ в ткани предстательной железы
| Фермент | 1 сутки | 7 суток | 14 суток | 21 сутки | 60 суток |
|---|---|---|---|---|---|
| СДГ | +16,3% | +21,7% | +56,1% | +67,2% | +32,1% |
| Г6Ф-ДГ | +18,5% | +31,2% | +97,2% | +161,2% | + 73,9% |
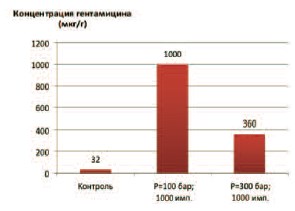
Рис. 1. Влияние разных режимов ударно-волнового воздействия на концентрацию гентамицина в ткани предстательной железы
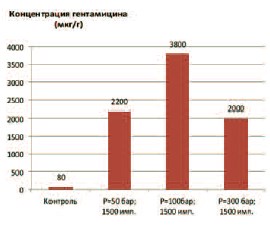
Рис. 2. Влияние амплитуды давления ударно-волнового импульса на концентрацию гентамицина в ткани предстательной железы
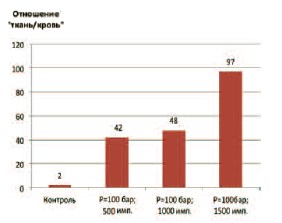
Рис. 3. Соотношение концентрации гентамицина в крови и ткани ПЖ при разных режимах ударно-волнового воздействия
Во второй части исследования для определения влияния низкоинтенсивного ударно-волнового воздействия на биодоступность антибиотика для ткани ПЖ 14 крыс вводили в наркоз внутрибрюшинным введением тиопентала натрия в дозе 60 мг/кг. Через 5 минут после наступления наркоза внутрибрюшинно вводили гентамицин в дозе 15 мг/кг, а еще через 5 минут проводили ударноволновое воздействие на область ПЖ в различных режимах (табл. 1).
Каждому режиму воздействия подвергались по две крысы, а два животных служили контролем (они не подвергались ударно-волновому воздействию).
Через два часа после окончания ударно-волновой терапии вскрывали брюшную полость наркотизированных крыс, брали пробу крови из нижней полой вены для определения концентрации гентамицина в крови. Затем удаляли ПЖ, взвешивали ее на торсионных весах и готовили из нее гомогенат в физиологическом растворе в соотношении ткань/раствор 1:10. Гомогенат центрифугировали при 3000 об/мин в течение 10 минут, супернатант использовали для определения тканевой концентрации гентамицина. Выбор гентамицина в качестве тестового маркера биодоступности антибиотиков для ПЖ был связан с его исходно низкой проницаемостью в ткань этого органа, а также с молекулярнй структурой, позволяющей его идентифицировать в биологических объектах методом ВЭЖХ-МС. Концентрацию препарата в крови выражали в мкг/мл, а в ПЖ – в мкг/г ткани.
Статистическую обработку цифровых данных проводили с использованием критерия t Стьюдента.
РЕЗУЛЬТАТЫ
Результаты исследований показали, что после ударно-волнового воздействия уже через два часа происходила дилатация интраорганных сосудов ПЖ, что свидетельствовало об усилении микроциркуляции. Средний диаметр артериол возрастал с 10,5±0,2 мкм до 11,8±0,3 мкм (p< 0,05), а капилляров – с 7,2±0,1 до 7,8±0,1 мкм (p< 0,05). Подобные изменения сохранялись через одни сутки после ударно-волнового воздействия, а в более поздние сроки возвращались к исходным значениям.
Вслед за активизацией микроциркуляции в ПЖ возрастала активность ферментов цикла Кребса и пентозомонофосфатного шунта в клетках эпителия простатических желез (табл. 2). Активность СДГ прогрессивно увеличивалась в течение 3-х недель: на 21,7% через одну неделю и на 67,2% – через три недели, после чего начиналось ее снижение, а Г-6-ФДГ – на 31,2% и 161,2% через одну и три недели соответственно.
Результаты этого исследования показали, что низкоинтенсивное ударно-волновое воздействие на область ПЖ в исследованном режиме даже после одного сеанса вызывает интенсификацию микроциркуляции в органе с последующей длительной активацией аэробного клеточного метаболизма, проявляющейся в повышении активности ферментов цикла Кребса и пентозо-монофосфатного шунта. При этом активность Г-6-ФДГ возрастала в большей степени, чем активность СДГ, что свидетельствовало о более выраженной активации резервного пути аэробного синтеза АТФ – пентозомонофосфатного пути, что характерно для активации адаптационных процессов. Это позволило нам предположить, что подобные изменения микроциркуляции и клеточного метаболизма могут благоприятно влиять на доставку антибиотика с кровью в орган-мишень, а именно, в предстательную железу.
Это предположение мы проверили в опытах с введением крысам гентамицина с последующим ударно-волновым воздействием на область предстательной железы. Результаты исследования показали, что при всех режимах воздействия через два часа тканевая концентрация гентамицина в ПЖ значительно возрастала, превышая ее концентрацию в контрольных опытах (без ударно-волнового воздействия) в 10-300 раз в зависимости от выбранного режима. При сравнении влияния разной мощности импульса при одинаковом их количестве (1000 импульсов) оказалось, что наибольшая проницаемость ткани ПЖ для гентамицина достигалась при мощности импульса 100 бар (рис. 1). Концентрация антибиотика повышалась с 32 до 2000 мкг/г ткани.
Увеличение амплитуды ударной волны до 300 бар сопровождалось меньшим увеличением проницаемости ткани ПЖ для антибиотика.
При воздействии ударно-волновых импульсов с амплитудой давления в 100 бар и увеличении количества импульсов до 1500 за сеанс, проницаемость ПЖ для гентамицина еще больше возрастала (рис. 2), способствуя его накоплению в ткани железы до 3800 мкг/г ткани. Более слабые или более сильные импульсы оказывали менее значительный эффект.
С учетом того, что накопление фармакологического препарата в ткани любого органа зависит не только от физико-химических характеристик его ткани и состояния кровоснабжения, но и от концентрации препарата в крови, мы рассчитали соотношение концентраций гентамицина в крови и ткани ПЖ для наиболее оптимальных условий воздействия (при амплитуде давления ударной волны в 100 бар и количестве импульсов от 500 до 1500). Оказалось, что это отношение прогрессивно возрастало с увеличением количества импульсов, и было максимальным в опытах, где использовали 1500 импульсов за сеанс (рис. 3).
Таким образом, низкоинтенсивное ударно-волновое воздействие на предстательную железу способствует улучшению накопления антибиотика в ткани железы за счет стимуляции микроциркуляции и активации клеточного метаболизма. Наиболее оптимальным режимом ударно-волновой терапии является амплитуда ударно-волнового импульса в 100 бар при количестве импульсов 1500 за сеанс. Мы изучили этот эффект на примере одного антибиотика – гентамицина, но полагаем, что наши выводы будут справедливы и для других антибактериальных препаратов, а возможно и для других фармакологических средств, учитывая неспецифический характер ударно-волнового воздействия.
ЗАКЛЮЧЕНИЕ
Низкоинтенсивная ударно-волновая терапия с разработанными нами параметрами способствует повышению концентрации антибактериальных препаратов в ткани предстательной железы за счет интенсификации интраорганного кровообращения в сочетании с активацией клеточного метаболизма и за счет этого повышает эффективность лечения хронического бактериального простатита.
ЛИТЕРАТУРА
1. Гарилевич Б.А., Захаров В.Н., Кудрявцев Ю.В., Кирпатовский В.И. Способ стимуляции метаболических процессов в тканях. // Патент РФ на изобретение № 2076641. Бюл. 1997. N 10.
2. Гарилевич Б.А., Ротов А.Е., Олефир Ю.В. Первый опыт применения ударно-волновой терапии при лечении больных хроническим простатитом. // Вопросы курортологии физиотерапии и лечебной физкультуры. 2007. N 3. С.43-45.
3. Guo Q, Hong M, Wang ZP. Extracorporeal shok wave therapy for chronic pelvic pain syndome: an update. // Zhonghua Nan Ke Xue. 2014. Vol. 20. N 8. P. 747-750.
4. Butterworth PA, Walsh TP, Pennisi YD, Chesne AD, Schmitz C, Nancarrow SA. The effectiveness of for the treatment of lower limb ulceration: a systematic review. // J Foot Ankle Res. 2015 Vol. 8. N 3. doi: 10.11.86/ s13047-014-0059-0.
5. Visco V, Vilpiani MC, Torrisi MR, Ferretti A, Pavan A, Vetrano M. Experimental studes on the biological effects of extracorporeal shok wave therapy on tendon models. A review of the literature. // Muscless Ligaments Tendons J. 2014. Vol. 4. N 3. P 357-361.
6. Dymarek R, Halski T, Ptaszkovski K, Slupska L, Rosinczuk J, Taradaj J. Extracorporeal shok wave therapy as an adjunct wound treatment: a systematic review of the literature. // Ostomy Wound Manage. 2014. Vol. 60, N 7. P. 26-39.









Комментарии