Д.В. Перлин1,2, В.П. Зипунников1,2, И.Н. Дымков1,2, А.О. Шманев1
1 ФГБОУ ВО «Волгоградский государственный медицинский университет» МЗ РФ; Волгоград, Россия
2 ГБУЗ «Волгоградский областной уронефрологический центр»; Волжский, Россия
Введение
Рак предстательной железы (РПЖ) — одно из наиболее часто встречающихся злокачественных новообразований у мужчин среднего и пожилого возрастов. Лапароскопическая радикальная простатэктомия (ЛРП) и позадилонная радикальная простатэктомия (ПРП) доказали свою высокую эффективность в лечении локализованного рака предстательной железы. Онкологические результаты лапароскопических операций не идентичны таковым после выполнения открытых операций [1-5]. Онкологические результаты экстраперитонеальной эндоскопической радикальной простатэктомии (ЭЭРП), не уступают результатам трансперитонеальной лапароскопической простатэктомии. При этом ретроперитонеоскопический метод включает в себя положительные качества позадилонного доступа, избегая риска повреждения органов брюшной полости, в то же время сохраняя все преимущества малоинвазивных эндоскопических вмешательств [4, 6]. Дальнейшие исследования доказали положительное влияние применения нервосберегающих методик на восстановление эректильной функции. Кроме того, рядом экспериментальных и клинических исследователей было показано значение пубопростатических связок для стабилизации положения уретры, фиксации шейки мочевого пузыря, улучшения континентной функции и, соответственно, качества жизни после операции [6, 7].
Совершенствование эндоскопической видеотехники, повышение разрешающей способности современных методов визуализации привели к постепенной эволюции многих анатомических понятий, в том числе внесли ряд уточнений в топографическую анатомию фасций и сосудисто-нервных пучков. На основании этих новых данных был, разработал метод интрафасциальной экстраперитонеоскопической простатэктомии [6].
Цель исследования
Оценить функциональные результаты интрафасциальной эндоскопической экстраперитонеальной радикальной простатэктомии.
Материалы и методы
В период с января 2010 по декабрь 2016 гг. в нашей клинике было выполнено 68 интрафасциальных эндоскопических экстраперитонеальных радикальных простатэктомий.
Описание применяемой методики
Положение пациента на спине в положении Транделенбурга с умеренным переразгибанием в пояснице. Через инфраумбиликальный разрез длиной около 2 см несколько латеральнее срединной линии живота выполняли тупую диссекцию тканей позади заднего листка влагалища прямой мышцы живота. По созданному ходу вводили баллонный троакар для диссекции и, раздували под контролем лапароскопа баллон, формируя преперитонеальное рабочее пространство. Последовательно вводили еще четыре троакара два – 12 мм и два – 5 мм) под контролем лапароскопа (рис. 1). При введении двух средних троакаров соблюдали особую осторожность для предотвращения ранения эпигастральных сосудов.
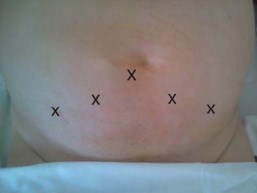
Рисунок 1. Схема расположения портов
На первом этапе визуализировали основные анатомические ориентиры: симфиз, лонные кости, Куперовы связки, семенной канатик, наружные подвздошные сосуды. После удаления окружающей жировой клетчатки, четко определяются передняя поверхность предстательной железы, мочевого пузыря и эндопельвикальная фасция.
Важное отличие интрафасциальной простатэктомии от других нервосберегающих методов состоит в том, что эндопельвикальную фасцию не рассекают латеральнее предстательной железы и не лигируют дорсальное венозное сплетение в самом начале операции.
Идентификацию шейки мочевого пузыря производили путем пальпации баллона при подтягивании уретрального катетера. Диссекцию шейки выполняли с 12 часов условного циферблата, постепенно продвигаясь в латеральном направлении до 10 и 2-х часов, соответственно, выделяя границу между простатой и мочевым пузырем. При этом визуализация продольных мышечных волокон шейки пузыря позволяет значительно облегчить определение границы (рис. 2).
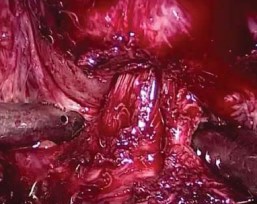
Рисунок 2. Выделение шейки мочевого пузыря
Выполняли два билатеральных разреза перипростатической фасции начиная от шейки мочевого пузыря в направлении к апексу простаты, при этом пубопростатические связки оставались латеральнее (рис. 3). При этом достаточно легко визуализировать гладкую блестящую поверхность капсулы железы. Преимущественно тупым путем отделяли простату от покрывающего ее листка фасции в латеральных направлениях. В результате все фасциальные образования, находящиеся латеральнее предстательной железы, включая эндопельвикальную фасцию и пубопростатические связки, оставляли интактными.
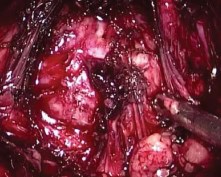
Рисунок 3. Интрафасциальная диссекция предстательной железы
Рассекали спереди шейку мочевого пузыря, ориентируясь на уретральный катетер. Разрез продолжали до 9-ти и 3-х часов условного циферблата часов. Натягивая уретральный катетер в направлении лонного сочленения, ассистент обеспечивал необходимую экспозицию тканей. Острым путем продолжали отделять в латеральном направлении предстательную железу от шейки пузыря. Острым и тупым путём мобилизовали перипростатическую фасцию, отодвигая её латерально в обе стороны, пересекая при этом мелкие ветви сосудисто-нервного пучка, идущие к предстательной железе. Далее рассекали заднюю полуокружность шейки мочевого пузыря.
Продолжая диссекцию тканей в дорсальном направлении, мобилизовали острым и тупым путем семенные пузырьки и протоки (рис. 4). При выделении пузырьков соблюдали особую осторожность, чтобы не повредить ветви тазового сплетения и сосудисто-нервный пучок, близко прилегающие к их верхушке. Для гемостаза в этой зоне использовали титановые клипсы. Затем отсепаровывали фасцию Денонвилье от капсулы простаты. При этом тракция за семенные пузырьки облегчает визуализацию фасции. В отличие от других описанных «нервосберегающих» методик, фасцию Денонвилье не иссекали, а преимущественно тупым путем отделяли от предстательной железы. Диссекцию тканей продолжали по направлению к апексу железы, придерживаясь срединной линии, чтобы избежать повреждения сосудисто-нервного пучка. Разделение тканей облегчается за счёт давления газа и большого увеличения видеоизображения.
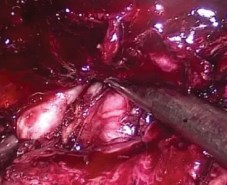
Рисунок 4. Мобилизация семенных пузырьков и протоков
Блестящая поверхность железы чётко определяется медиально и латерально. Поднимая семенные пузырьки и протоки вентрально, ассистент обеспечивает хорошую экспозицию простатических ножек. Последние клипировали и пересекали непосредственно у капсулы железы последовательно мелкими частями во избежание механического повреждения сосудисто-нервного пучка. После пересечения ножек, простату отделяли преимущественно тупым путем от оставшегося участка перипростатической фасции в области апекса. С этой целью ассистент осуществлял тракцию железы в контрлатеральном направлении. Таким образом, простата на этом этапе полностью отделена от окружающей фасции, ножек, сосудисто-нервного пучка, мочевого пузыря.
Следующим шагом лигировали дорсальное венозное сплетение. С этой целью слегка распрямленную иглу окружностью ½ с нитью викрил 2/0 проводили по направлению слева направо между дорсальным венозным комплексом и уретрой (рис. 5), формировали 8-образный шов и затягивали интракорпорально.
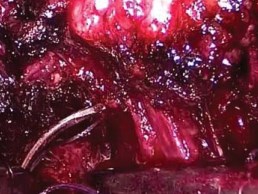
Рисунок 5. Прошивание дорсального венозного комплекса
Далее острым путём отделяли апекс простаты от наружного сфинктера и уретры. Для этого пересекали сплетение Санторини и визуализировали границу между апексом простаты и уретрой с наружным сфинктером. Затем тщательно небольшими порциями отсекали волокна сфинктера по направлению снаружи внутрь с обеих сторон. Стенку уретры пересекали как можно ближе к предстательной железе, сохраняя максимальную длину уретры (рис. 6). После рассечения передней стенки, ассистент, подтягивая дистальный конец уретрального катетера, улучшал экспозицию боковых и задней поверхностей апикальной части железы и уретры. Простату полностью отсекали от уретры и помещали в пластиковый контейнер (рис.7). Контейнер частично выводили через отверстие от левого латерального троакара наружу. Канюлю порта вновь проводили в предбрюшинное пространство, тем самым фиксируя контейнер.

Рисунок 6. Пересечение уретры
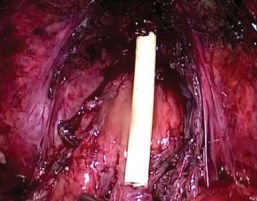
Рисунок 7. Сохранённые пубопростатические связки, фасция Денонвилье и сосудисто-нервные пучки
Везикоуретральный анастомоз формировали при помощи отдельных узловых швов Викрил 2/0 на игле 5/8, а также двух связанных между собой монофиламентных нитей 2/0 на игле 5/8, непрерывным швом в обе стороны. Первый шов выполняли на 11 часах условного циферблата, прошивание стенки мочевого пузыря по направлению «снаружи-внутрь», уретру прошивали по направлению «изнутри-наружу» (рис. 8). После завершения дорсальной части анастомоза в мочевой пузырь проводили катетер, который одновременно являлся проводником для наложения остальных швов. Затем ушивали переднюю полуокружность анастомоза. Дренаж проводили через отверстие от 5-мм порта в правой подвздошной области. Контейнер с удаленной предстательной железой удаляли через расширенное отверстие от 12-мм порта.
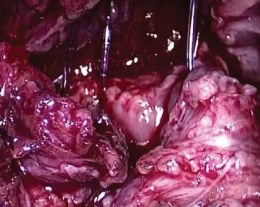
Рисунок 8. Формирование задней полуокружности уретроцистоанастомоза непрерывным
Критериями отбора пациентов для выполнения интрафасциальной нервосберегающей эндоскопической экстраперитонеальной радикальной простатэктомии (ИЭЭРП) были максимальное значение баллов по Глисону 7 (по данным предоперационной биопсии), клиническая стадия Т1с/Т2, уровень простат-специфического антигена (ПСА) менее 10 нг/мл. Некоторым пациентам ИЭЭРП была выполнена по настоятельному пожеланию, несмотря на более высокий предоперационный уровень ПСА. Тазовую лимфаденэктомию выполняли с целью стадирования во всех случаях.
До- и послеоперационную оценку континенции и эректильной функции проводили с использованием международных опросников: International Continence Society questionnaire и International Index of Erectile Function. Послеоперационное обследование проводили через 3, 6 и 12 месяцев.
Результаты
Нервосберегающая интрафасциальная эндоскопическая экстраперитонеальная простатэктомия (нсИЭЭРП) была выполнена у 68 пациентов. На пятый послеоперационный день выполняли цистографию. При отсутствии экстравазации уретральный катетер удаляли. Периоперативные данные пациентов указаны в таблице 1. Конверсий не было, гемотрансфузии потребовались у 4 (5,9 %) пациентов.
Таблица 1. Общая характеристика пациентов и результатов оперативного лечения
| Количество пациентов | 68 |
| Уровень ПСА перед операцией, нг/мл | 11,3 (2,8-21,2) |
| Объем кровопотери, мл | 320 (280-1500) |
| Количество гемотрансфузий | 4 (5,9%) |
| Частота конверсий | 0 |
| Продолжительность катетеризации, дни | 9 (5-25) |
| Размер простаты, см3 | 67 (25-120) |
Ранние хирургические осложнения были отмечены у восьми пациентов. У семерых из них наблюдалась несостоятельность пузырно-уретрального анастомоза, которая была устранена путём увеличения продолжительности дренирования пузыря катетеромдо 12-15 дней. У 1 пациента развилась тампонада мочевого пузыря, потребовавшая выполнения пункционной эпицистостомии. Дренаж мочевого пузыря удалён через шесть дней.
Континенцией считали отсутствие необходимости в прокладках. Эпизодические подтекания мочи (1-2 прокладки) в течение дня при нормальной активности, включая ходьбу, классифицировали как минимальное стрессовое недержание (табл. 2). В ближайшем периоде (3 месяца после операции) 48 (72 %) пациентов были полностью континентны, у 14 (20 %) отмечена минимальная степень стрессовой инконтиненции, 8 (8 %) использовали более 2 прокладок в день. Через 12 месяцев после операции 60 (88,2 %) пациентов полностью удерживали мочу, 8 (11,7 %) использовали 1-2 прокладки в день.
Таблица 2. Результаты лечения: оценка функции удержания мочи в послеоперационном периоде
| Период после операции | Полное удержание | 1-2 прокладки в день | Более 2 прокладок в день |
| 3 месяца | 48 (70,5%) | 14 (20,5%) | 6 (8,8%) |
| 6 месяцев | 57 (83,8%) | 6 (9,5%) | 5 (3,4%) |
| 12 месяцев | 60 (88,2%) | 8 (11,7%) | 0 |
Таблица 3. Послеоперационная характеристика пациентов согласно TNM-стадированию и индексу по шкале Глисона
| Стадия | Кол-во пациентов | Индекс по шкале Глисона | ||||||
| 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
| pT2a | 3 | 3 | 4 | 4 | ||||
| pT2b | 4 | 7 | 4 | |||||
| pT2c | 55 | 25 | 7 | 4 | ||||
| pT3a | 3 | 4 | 3 | |||||
| pT3b | 3 | 3 | ||||||
Эрекции, достаточные для интроитуса с использованием или без ингибиторов ФДЭ5, отмечены через 12 месяцев после билатеральной нсИЭЭРП у 16 из 19 пациентов, сохранявших сексуальную функцию до операции.
Гистологические результаты представлены в таблице 3. Позитивного хирургического края отмечено не было, биохимический рецидив развился у 2 пациентов (табл. 4).
Таблица 4. Онкологические результаты
| Отдалённые МТС и локальные рецидивы | 0 |
| Биохимический рецидив | 2 (2,9%) |
| Положительный хирургический край | 0 |
| «+» лимфатические узлы | 6 (8,8%) |
Обсуждение
В 1982 г. на трупном материале в работе Walsh P.C. было описано расположение кавернозных нервных пучков, заключенных, по мнению авторов, между двумя листками латеральной тазовой фасции, составляющими латеральный листок фасции леваторов и медиальный листок простатической фасции [8]. Последующие исследования показали, что нервные волокна, задействованные в нервосберегающей радикальной простатэктомии, распространены гораздо более широко, и не ограничены одним лишь сосудисто-нервным пучком. Основываясь на опыте, приобретенном при выполнении роботических простатэктомий, Menon M. с соавторами выявили, что сосудисто-нервный пучок локализуется между листками перипростатической фасции и передним листком фасции Денонвилье, формирующими тоннель треугольной формы. Авторы предположили, что перипростатическую фасцию нужно рассекать спереди и параллельно сосудисто-нервному пучку для достижения нервосбережения [9]. В 2004 г. Costello A.J. с соавторами показали, что в состав сосудисто-нервных пучков входят, как кавернозные нервы, так и нервные волокна, иннервирующие леваторы, предстательную железу и прямую кишку [10]. Kiyoshima K. с соавторами доказали, что сосудисто-нервный пучок проходит по заднелатеральной поверхности простаты у 48 % пациентов. У остальных 52 % пациентов сосудисто-нервный пучок широко распределяется по всей латеральной поверхности железы, без какой-либо определенной локализации. [11]. В течение последних лет отмечается рост числа публикаций о влиянии сбережения нервных пучков, располагающихся по переднелатеральной поверхности простаты на сохранение сексуальной функции и удержаниемочи в раннем послеоперационном периоде [12, 13]. В своей работе Stolzenburg J.U. придерживается гипотезы, что единая тазовая фасция покрывает простату и мочевой пузырь. Эта фасция прикрепляется к лонной кости и формирует пубопростатические связки [14]. Основная идея интрафасциальной нервосберегающей методики состоит в выполнении диссекции тканей как можно ближе к капсуле предстательной железы при сохранении связок и нервных волокон. На основании большого количества исследований подтверждена роль нервосбережения при восстановлении континенции и эректильной функции [2, 3, 15, 16].
По нашим данным через 3 месяца после операции у 48 из 68 (70 %) пациентов отмечено полное удержание мочи. Более 2-х прокладок в день использовали 6 (8 %) пациентов. Через 12 месяцев полное удержание мочи отмечено у 88,2 % пациентов, достигших этого периода наблюдения. При этом никто из пациентов не использовал более 2-х прокладок в день. Полученные нами результаты вполне согласуются с наблюдениями больших групп пациентов другими авторами [15-17]. Stolzenburg J.U. с соавторами наблюдали восстановление континенции в 71,7 %, 81,4 % и 94,7 % случаев к 3, 6 и 12 месяцу, соответственно, при использовании ИЭЭРП. В случае билатерального нервосбережения полное удержание мочи отмечено в 79,5 %, 87,3 % и 96,6 % пациентов соответственно. Восстановление эректильной функции достигнуто к 12 месяцам у 84,9 % пациентов до 55 лет при билатеральном нервосбережении [12]. Оценка восстановления эректильной функции в приводимой нами серии затруднена небольшим числом пациентов, сохранивших эректильную функцию к моменту операции. Тем не менее, у 14 из 18 этих пациентов через 12 месяцев после ИЭЭРП отмечена удовлетворительная эректильная функция.
Несмотря на то, что данное исследование посвящено в основном функциональным результатам (ИЭЭРП), при оценке методов лечения локализованного рака предстательной железы нельзя не затронуть аспектов онкологической безопасности. Основным контингентом для выполнения ИЭЭРП принято считать пациентов групп невысокого риска при стадии Т1-Т2. При исследовании онкологической безопасности в работе Potdevin L. с соавторами [18] было показано, что у пациентов со стадией заболевания pT3 выполнение интрафасциальной нервосберегающей простатэктомии приводит к более высокому риску выявления положительного хирургического края. Тем не менее, по данным Shikanov S. с соавторами [19], билатеральное нервосбережение не сопровождается повышением риска положительного края у пациентов с раком предстательной железы невысокого риска. При этом выполнение билатерального нервосбережения сопровождается ранним восстановлением эректильной функции и функции удержания мочи [17].
В приведенной нами серии у десяти пациентов после операции поставлена стадия рТ 3, у семнадцати – индекс Глисона повышен до 8 и более. Тем не менее, ни в одном случае не было обнаружено положительного хирургического края. Биохимический рецидив, пока не сопровождающийся другими клиническими проявлениями, отмечен у двух пациентов (3 %) через 11 месяцев после операции. Хорошая визуализация простатической капсулы, достигаемая за счёт чёткой интрафасциальной диссекции, а также благодаря использованию современных видеокамер высокого разрешения позволяют выявлять участки возможной экстракапсулярной инвазии. При этом у четырнадцати пациентов мы выполнили одностороннее иссечение прилежащего фасциального листка, в том числе у девяти — сосудистого-нервного пучка. При этом выделение железы выполняли интрафасциально. Такое комбинирование методик в ряде случаев с нашей точки зрения позволяют использовать наиболее функциональную интрафасциальную диссекцию без компромисса с онкологической безопасностью.
Заключение
Интрафасциальная эндоскопическая экстраперитонеальная радикальная простатэктомия сопровождается хорошими функциональными и благоприятными онкологическими результатами у пациентов с локализованным раком предстательной железы Т1с-2.
ЛИТЕРАТУРА
- Rassweiler J, Schulze M, Teber D, Seemann O, Frede T. Laparoscopic radical prostatectomy: functional and oncological outcomes. Curr Opin Urol. 2004;14(2):75-82. doi: 10.1097/00042307-200403000-00005
- Anastasiadis AG, Salomon L, Katz R, Hoznek A, Chopin D, Abbou CC. Radical retropubic versus laparoscopic prostatectomy: a prospective comparison of functional outcome. Urology. 2003;62(2):292-7. doi: 10.1016/s0090- 4295(03)00352-2
- Barré C. Open radical retropubic prostatectomy. Eur Urol. 2007;52(1):71-80. doi: 10.1016/j.eururo.2006.11.057
- Бормотин А.В., Рева И.А., Дьяков В.В., Берников А.Н., Пушкарь Д.Ю. Качество жизни пациентов старше 70 лет, перенесших радикальное оперативное лечение по поводу рака предстательной железы. Онкоурология. 2014;10(1):58-63. doi:10.17650/1726-9776-2014- 10-1-58-63
- Алексеев Б.Я., Нюшко К.М., Воробьев Н.В., Калпинский А.С., Головащенко М.П., Франк Г.А., Андреева Ю.Ю. Частота И Локализация метастазов в лимфатических узлах при выполнении радикальной простатэктомии и расширенной тазовой лимфаденэктомии у больных раком предстательной железы. Онкоурология. 2012;8(1):77-81. doi:10.17650/1726-9776-2012- 8-1-77-81
- Stolzenburg JU, Do M, Pfeiff er H, König F, Aedtner B, Dorschner W.The endoscopic extraperitoneal radical prostatectomy (EERPE): technique and initial experience. World J Urol. 2002;20(1):48-55. doi: 10.1007/s00345- 002-0265-4
- Stolzenburg JU, Schwalenberg T, Horn LC, Neuhaus J, Constantinides C, Liatsikos EN. Anatomical landmarks of radical prostatecomy. Eur Urol. 2007;51(3):629-39. doi: 10.1016/j.eururo.2006.11.012
- Walsh PC, Donker PJ. Impotence following radical prostatectomy: insight into etiology and prevention. J Urol. 1982;128(3):492-7. doi: 10.1016/s0022-5347(17)53012-8
- Menon M, Tewari A, Peabody J; VIP Team. Vaƫ kutiInsti- tute prostatectomy: technique. J Urol. 2003;169(6):2289- 92. doi: 10.1097/01.ju.0000067464.53313.dd
- Costello AJ, Brooks M, Cole OJ. Anatomical studies of the neurovascular bundle and cavernosal nerves. BJU Int. 2004;94(7):1071-6. doi: 10.1111/j.1464- 410x.2004.05106.x
- Kiyoshima K, Yokomizo A, Yoshida T, Tomita K, Yonemasu H, Nakamura M, Oda Y, Naito S, Hasegawa Y. Anatomical features of periprostatic tissue and its surroundings: a histological analysis of 79 radical retropubic prostatectomy specimens. Jpn J Clin Oncol. 2004;34(8):463-8. doi: 10.1093/jjco/hyh078
- Stolzenburg JU, Kallidonis P, Do M, Dietel A, Häfner T, Rabenalt R, Sakellaropoulos G, Ganzer R, Paasch U, Horn LC, Liatsikos E.A comparison of outcomes for interfascial and intrafascial nerve-sparing radical prostatectomy. Urology. 2010;76(3):743-8. doi: 10.1016/j.urology.2010.03.089
- van der Poel HG, de Blok W, Joshi N, van Muilekom E. Preservation of lateral prostatic fascia is associated with urine continence after robotic-assisted prostatectomy. Eur Urol. 2009;55(4):892-900. doi: 10.1016/j. eururo.2009.01.021
- Stolzenburg JU, Rabenalt R, Do M, Schwalenberg T, Winkler M, Dietel A, Liatsikos E. Intrafascial nerve-sparing endoscopic extraperitoneal radical prostatectomy. Eur Urol. 2008;53(5):931-40. doi: 10.1016/j. eururo.2007.11.047
- Noldus J, Michl U, Graefen M, Haese A, Hammerer P, Huland H.Patient-reported sexual function after nervesparing radical retropubic prostatectomy. Eur Urol. 2002;42(2):118-24. doi: 10.1016/s0302-2838(02)00219-1
- Kundu SD, Roehl KA, Eggener SE, Antenor JA, Han M, Catalona WJ. Potency, continence and complications in 3,477 consecutive radical retropubic prostatectomies. J Urol. 2004;172(6 Pt 1):2227-31. doi: 10.1097/01. ju.0000145222.94455.73
- Do M, Haefner T, Liatsikos E, Kallidonis P, Hicks J, Dietel A, Horn LC, Rabenalt R, Stolzenburg JU. Endoscopic extraperitoneal radical prostatectomy after previous transurethral resection of prostate: oncologic and functional outcomes of 100 cases. Urology. 2010;75(6):1348-52. doi: 10.1016/j.urology.2009.09.009
- Potdevin L, Ercolani M, Jeong J, Kim IY. Functional and oncologic outcomes comparing interfascial and intrafascial nerve sparing in robot-assisted laparoscopic radical prostatectomies. J Endourol. 2009;23(9):1479-84. doi: 10.1089/end.2009.0369
- Shikanov S, Woo J, Al-Ahmadie H, Katz MH, Zagaja GP, Shalhav AL, Zorn KC. Extrafascial versus interfascial nerve-sparing technique for robot c-assisted laparoscopic prostatectomy: comparison of functional outcomes and positive surgical margins characteristics. Urology. 2009;74(3):611-6. doi: 10.1016/j.urology.2009.01.092
Статья опубликована в журнале "Вестник урологии" №1 2018, стр. 18-26









Комментарии