Журнал "Экспериментальная и клиническая урология" Выпуск №4 за 2014 год
Аполихин О.И., Ефремов Е.А., Мельник Я.И., Красняк С.С.
Исследования последних лет изменили не только взгляд на механизм развития эрекции, но и на этиологию эректильных расстройств. Если раньше доминировала точка зрения на эректильную дисфункцию (ЭД) как на психогенное заболевание, то в настоящее время большинство специалистов среди ее причин на первое место ставят органические факторы, хотя психические воздействия часто усугубляют ее. По данным различных авторов от 70 до 85% всех случаев ЭД связаны первично с органическими причинами. О. Л. Тиктинский и В.В. Михайличенко считают, что 70 % ЭД имеют васкулогенную природу (30% из них артериального происхождения, 30 % — венозного, 40 % — смешанного) [1]. Н. А. Лопаткин также не согласен с рассмотрением психогенных факторов как основной причины эректильных расстройств. По его мнению 70-85 % случаев эректильных расстройств первично связаны с органическими причинами, то есть обусловлены васкулогенными, эндокринными, нейроэндокринными факторами [2].
Наиболее распространенным патогенетическим фактором ЭД является поражение сосудов, причем это поражение всегда носит системный характер. Поэтому выявление сосудистого генеза ЭД может стать поводом для комплексного обследования сердечно-сосудистой системы пациента. И наоборот, пациент с жалобами на нарушение эрекции и имеющий факторы риска возникновения заболеваний сердечно-сосудистой системы (абдоминальное ожирение, сахарный диабет, повышенное артериальное давление) имеет больший риск артериогенной ЭД.
Одним из наиболее авторитетных в этой проблеме специалистов является профессор P. Montorsi из Университета Милана. Он в 2005 году назвал ЭД «верхушкой айсберга» системных сосудистых заболеваний и указал на то, что изолированная ЭД является поводом для дальнейшего обследования пациента, особенно состояния его сердечнососудистой системы [3].
Профессор Р. Montorsi и соавт. показали, что у пациентов с ангиографически доказанной обструктивной ишемической болезнью сердца время начала ЭД предшествовало появлению симптомов этого заболевания. Временной интервал составил 38,8 месяцев (диапазон 1–168 месяцев), при этом ЭД определялась только путем заполнения опросника. Одним из наиболее важных фактов, установленных в ходе данного исследования, является то, что у 40% пациентов ишемическая болезнь сердца дебютировала острым инфарктом миокарда [4].
По другим данным время от появления ЭД до появления первых симптомов ишемической болезни сердца составляет 24 (12-36) месяца [5].
В то время как риск смертности от сердечно-сосудистых заболеваний был выше у мужчин с установленным диагнозом сердечно-сосудистых заболеваний (ССЗ) до диагностирования ЭД, средний интервал времени между проявлением ЭД и сердечно-сосудистой смертью составил 10 лет в возрастной группе 40-69 лет. Несмотря на статистически значимое увеличение риска смерти при установленном диагнозе ССЗ, исследование показало, что только 35% всех случаев смерти у мужчин с ЭД этиологически были связаны с этими заболеваниями , в то время как 65% – не были связаны с ними (смертность от онкологических заболеваний составила 29%) [6].
В крупном когортном исследовании частоты неблагоприятных сердечно-сосудистых событий у пациентов с ЭД было показано, что несмотря на то, что ЭД увеличивает риск будущих подобных сосудистых событий, она не является независимым от возраста предиктором их развития, в отличие от артериальной гипертензии и сахарного диабета [7]. Однако недостатком данного исследования является то, что ЭД определялась только при помощи опросника «Международный индекс эректильной функции» (Intenational Index of Erectile Function (IIEF).
Однако данные о взаимосвязи ЭД и ССЗ порой бывают весьма противоречивы. Так, при сравнении двух групп пациентов высокого риска сердечно-сосудистых заболеваний с ЭД и без таковой на предмет наличия клинически значимого поражения коронарных артерий оказалось, что у пациентов с нарушениями эрекции клинически значимое поражение коронарных артерий встречалось в 87% наблюдений, а у пациентов с нормальной эрекцией в 82% (р=0,552). Кроме того, не было обнаружено статистически значимых различий при анализе поражения отдельно каждой из коронарных артерий или их количества с наличием ЭД (52,5% случаев многососудистого поражения в группе с ЭД по сравнению с 34,2% в контрольной группе, р = 0,076) [8].
По результатам аутопсийного исследования пациентов, коронарный атеросклероз был обнаружен у 87,1% пациентов, в то время как атеросклероз сосудов полового члена только у 12,9%, а поражение глубокой пенильной артерии – у 9,7%. В этом исследовании сахарный диабет был единственным фактором, который ассоциировался с атеросклерозом артерий, кровоснабжающих половой член. Это позволяет задуматься о том, насколько сильно в итоге ЭД связана с поражением коронарных артерий [9].
Кроме того, практически все опубликованные исследования на эту тему определяли наличие ЭД у пациентов только при помощи опросников (чаще всего IIEF-5). При достаточно высокой чувствительности опросники обладают низкой специфичностью. По этой причине в исследования включались пациенты с психогенной, эндокринной, нейрогенной ЭД. В связи с противоречивыми литературными данными возникла необходимость изучения состояния гемодинамики полового члена у пациентов с факторами риска ССЗ с применением инструментальных методов исследования пенильного кровотока, как критерия артериогенной ЭД.
На сегодняшний день основным методом определения сосудистых нарушений у пациентов с ЭД является допплерография сосудов полового члена. Впервые метод оценки артериального кровоснабжения, в том числе и в сосудах полового члена, основанный на использовании эффекта Допплера начал применяться с 1975 года. Предложенный в 1982 R. Virag метод искусственной фармакологической эрекции значительно повысил качество функционального исследования пенильного кровотока [10]. B настоящее время фармакологическая искусственная эрекция с использованием таких вазоактивных агентов как папаверин, фентоламин, простагландины Е1 и их различных комбинаций широко применяется в клинической практике в качестве скринингового теста, позволяя с определенной достоверностью дифференцировать психогенные и органические формы эректильных расстройств [11].
Пульсовая допплерография и спектральный анализ при исследовании эректильной функции были предложены в 1980 году и нашли отражение в работах A. Cliffird и соавт. и D. Velcek и соавт. [12, 13]. С 1984 года распространение получила техника высокочастотной сонографии в комбинации с количественным анализом допплерографического спектра, описанная в работах T.F. Lue и соавт. [14].
Основными количественными показателями допплерографии служат максимальная (пиковая) систолическая скорость (PSV или Vmax) и конечная диастолическая скорость (EDV или Vend). На основе абсолютных показателей по стандартным формулам рассчитываются относительные — индекс резистентности (RI) и пульсационный индекс (РI). Обычно за норму максимальной систолической скорости принимают значения, равные 25 см/с [18]. После фармакологической стимуляции наибольшее для данного пациента значение достигается обычно в течение 5—10 мин.
Анализ характера, степени выраженности и продолжительности фармакологической эрекции и параметров, регистрируемых при этом ультразвуковым допплеровским сканированием , часто при выполнении исследования позволяет не только зафиксировать факт сосудистых нарушений, тем самым дифференцировать психогенную и органическую ЭД, но и отличить артериальную недостаточность полового члена от веногенной [19].
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включались совершеннолетние мужчины с жалобами на нарушение эрекции. Всего в исследование был включен 481 мужчина в возрасте от 18 до 75 лет. Средний возраст составил 40,2±12,8 лет (95% ДИ: 39,1-41,4 года).
Всем пациентам было проведено комплексное исследование эректильной функции, которое включало в себя: осмотр врачом-урологом, стандартизированный опрос с использованием анкет IIEF, Ageing male scale – (AMS), биохимический анализ крови, анализ крови на тестостерон, допплерография сосудов полового члена с фармакологической пробой, Rigi-scan мониторинг пенильных тумесценций в режиме реального времени, а также оценка системной эндотелиальной функции путем постокклюзионного измерения периферического артериального тонуса.
Статистический анализ полученных данных проводился после ретроспективного разделения исследуемой популяции на группы высокого и низкого риска ССЗ. За критерий высокого риска принималось наличие как минимум одного из нижеследующих состояний:
- Абдоминальное ожирение;
- Артериальная гипертензия;
- Наличие сахарного диабета 1 или 2 типа в анамнезе;
- Возраст старше 40 лет.
Также проводилось исследований корреляции между параметрами гемодинамики полового члена и антропометрическими показателями в общей группе.
ОПИСАНИЕ МЕТОДИКИ ФАРМАКОДОППЛЕРОГРАФИИ СОСУДОВ ПОЛОВОГО ЧЛЕНА
Дуплексное и триплексное допплеровское сканирование сосудов полового члена производилось на аппарате «Accuson»-128, «Siemens» 270 A. Использовали датчики 7,5 МГЦ, 8 МГЦ, 10 МГЦ.
В качестве препаратов выбора для создания фармакологической эрекции, оптимально подходящих для интракавернозного введения с целью диагностики, мы использовали препараты группы простагландинов Е1 (каверджект, эдекс). Доза препарата составляла 10 мкг. При ультразвуковой допплерографии, прежде всего, оценивалась скорость и характер кровотока в пенильных артериях, а также характер изменений кровотока после введения фармакологических стимуляторов эрекции.
В горизонтальном положении больного производилось последовательное билатеральное лоцирование дорзальных и глубоких пенильных артерий. Угол сканирования составлял от 45 до 60º. Для лоцирования дорзальных артерий датчик устанавливался на дорзальной поверхности полового члена латерально от средней линии у основания полового члена и в области венечной борозды. При лоцировании кавернозных артерий датчик устанавливался латеральнее спонгиозного тела уретры.
Регистрация допплерографических параметров производилась билатерально на протяжении всего сосуда посегментарно. Исследование артериальной фазы начинали с фазы тумесценции (ER1 – ER2-3) – фазы усиления артериального притока к половому члену и продолжали на протяжении всего цикла развития эрекции до ригидной фазы (ER4, ER5).
Качество фармакологического ответа оценивался по шестибальной шкале Junemann с использованием графического анализа. Использование данной шкалы патогенетически обосновано, так как более подробно отражает фазы развития эрекции.
Шкала Junemann
- ER0 – отсутствие ответа;
- ER1 – незначительная тумесценция (увеличение длины полового члена);
- ER2 – неполная тумесценция (увеличение диаметра полового члена);
- ER3 – полная тумесценция (увеличение диаметра при максимально возможной длине недостаточное для осуществления полноценного коитуса);
- ER4 – полуригидное состояние полового члена;
- ER5 – полноценная эрекция.
Начиная со степени ER4 возможно осуществление интромиссии и проведение коитуса.
Ультразвуковая допплерография при этом способна показать следующее:
- гемодинамику в половом члене в состоянии покоя;
- наличие дефицита притока артериальной крови к кавернозным телам в процессе возникновения эрекции;
- наличие патологического венозного дренажа.
На протяжении исследования оценивались качественные и количественные (абсолютные и относительные) параметры. Из абсолютных количественных значений использовали пиковую систолическую скорость, конечную диастолическую скорость, среднюю скорость кровотока. Из относительных – индекс резистентности (RI) и пульсационный индекс (РI), рассчитываемые по общепринятым формулам: RI = (Vmax – Vend)/Vmax, где Vmax – максимальная систолическая скорость кровотока, Vend – конечная диастолическая скорость кровотока. РI = (Vmax – Vmin)/Vmean, где Vmax – максимальная скорость кровотока, Vmin – минимальная скорость кровотока, Vmean – средняя скорость кровотока (усредненная по времени максимальная скорость).
Для допплерографического спектра пенильной артерии в норме характерно:
- Градиент прироста максимальной систолической скорости кровотока в два и более раза для дорзальных артерий;
- Градиент прироста максимальной систолической скорости кровотока в три и более раза для глубоких пенильных артерий;
- Отсутствие диастолического кровотока в расслабленную фазу;
- Высокочастотный диастолический кровоток в фазу тумесценции с регрессом при развитии полуригидного состояния;
- Фазовые изменения допплерографических параметров в процессе перехода полового члена из расслабленного состояния в состояние эрекции;
- Динамическое изменение индекса сопротивления с максимальными значениями равными единице в фазу расслабления и в фазу полноценной эрекции.
Определение допплерографических показателей кровотока в половом члене проводилось также после внутрикавернозного введения вазоактивного препарата. Основным признаком артериогенной ЭД являлось снижение пиковой систолической скорости менее 25 см/с. Оценивалось максимальное значение пиковой систолической скорости, которое не всегда регистрируется в первые 5-10 мин исследования. Для веногенных нарушений характерна конечная диастолическая скорость больше 5 см/с при адекватном артериальном притоке, индекс резистентности менее 0,85; пульсационный индекс менее 3.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В отечественной и зарубежной литературе для определения наличия и тяжести ЭД чаще всего применяется шкала IIEF-5, поэтому для нас было крайне важным выяснить, позволяет ли шкала IIEF-5 судить о характере кровотока в сосудах полового члена. При анализе всей обследуемой популяции выяснилось, что максимальная систолическая скорость кровотока в кавернозных артериях не коррелирует с тяжестью ЭД, определяемой по шкале IIEF-5 (рис. 1). Таким образом, широко применяемая анкета IIEF-5 не позволяет определить характер нарушения эрекции и тяжесть поражения сосудов.
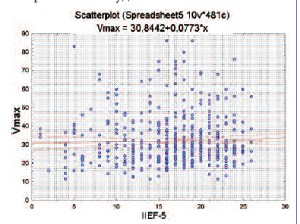
Рис. 1. Корреляция между количеством баллов по шкале IIEF-5 и Vmax в кавернозных артериях по данным допплерографии.
В качестве одного из диагностических критериев, позволяющих предположить органический характер ЭД уже на этапе сбора жалоб, используется длительность анамнеза эректильных нарушений. При сопоставлении гемодинамических характеристик с давностью возникновения ЭД нами была выявлена тенденция к снижению пиковой систолической скорости кровотока в пенильных артериях при увеличении давности ЭД (r=-0,068) (рис. 2). В нашем исследовании было выявлено, что при увеличении давности ЭД действительно уменьшается количество баллов по шкале IIEF-5, однако это не увеличивает вероятность сосудистого генеза ЭД.
При анализе зависимости пенильной гемодинамики от выраженности отдельных факторов риска сердечно-сосудистых заболеваний была выявлена статистически значимая корреляция между окружностью живота и пиковой систолической скоростью кровотока (r=-0,22, p< 0,001) (рис. 3).
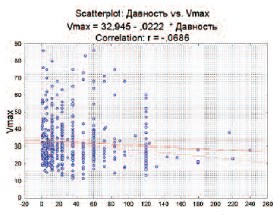
Рис. 2. Корреляция между давностью ЭД (в месяцах) и Vmax в кавернозных артериях по данным допплерографии
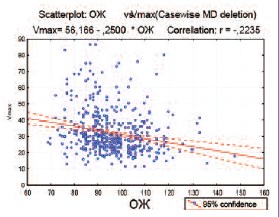
Рис. 3. Корреляция между окружностью живота (в см) и Vmax в кавернозных артериях в исследуемой популяции по данным доплерографии
В группу пациентов с высоким риском сердечно-сосудистых заболеваний попали 269 человек. При сравнении тяжести ЭД по шкале IIEF-5 и допплерографических характеристик пенильного кровотока было выявлено статистически достоверное отличие только в показателях Vmax (рис. 4– 6).
Оказалось, что в группе больных с высоким риском сердечно-сосудистых заболеваний выраженность ЭД, оцененная по опроснику IIEF практически не позволяет спрогнозировать тяжесть нарушения кровотока в сосудах полового члена (рис. 7).
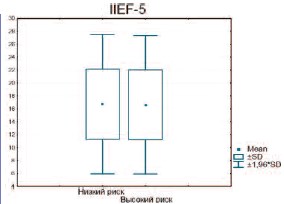
Рис. 4. Сравнение количества баллов по шкале IIEF-5 у пациентов с низким и высоким риском сердечно-сосудистых заболеваний
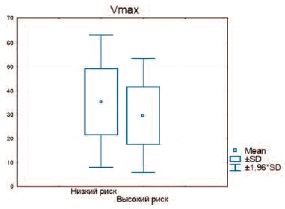
Рис. 5. Сравнение Vmax в пенильных артериях у пациентов с низким и высоким риском сердечно-сосудистых заболеваний
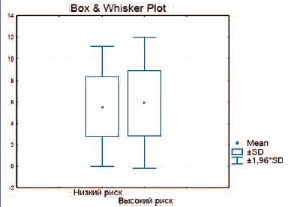
Рис. 6. Сравнение Vend в пенильных артериях у пациентов с низким и высоким риском сердечнососудистых заболеваний
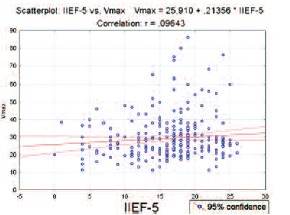
Рис. 7. Корреляция между количеством баллов по шкале IIEF-5 и Vmax в кавернозных артериях в группе пациентов с высоким риском сердечнососудистых заболеваний
Анамнез сердечно-сосудистых заболеваний в ряде наблюдений тоже не позволял с уверенностью предполагать артериогенный характер нарушений эрекции. Так, у пациентов с ранее установленным диагнозом артериальной гипертензии нет достоверных отличий в характере кровотока в кавернозных артериях по сравнению с пациентами с нормальным артериальным давлением (рис. 8).
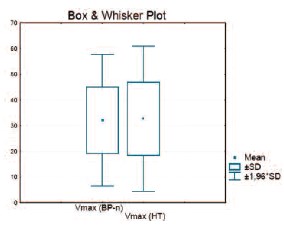
Рис. 8. Сравнение Vmax в кавернозных артериях с риском сердечно-сосудистых заболеваний у пациентов с нормальным артериальным давлением и с артериальной гипертензией в анамнезе.
Наличие сахарного диабета в анамнезе, наоборот, является независимым фактором риска ухудшения притока по артериям, кровоснабжающим кавернозные тела полового члена (рис. 9).
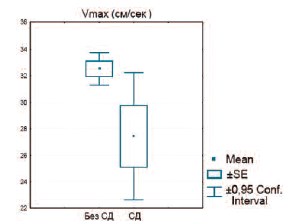
Рис. 9. Сравнение Vmax в пенильных артериях у пациентов с сахарным диабетом и его отсутствием (р=0.022)
Также отмечается тенденция к снижению Vend в пенильных артериях у мужчин с сахарным диабетом по сравнению с мужчинами с нормальным углеводным обменом (рис. 10) (р=0,067).
Пиковая систолическая скорость кровотока у пациентов с нормальным уровнем тестостерона и у мужчин с пониженным уровнем тестостерона статистически не различалось (рис. 11).
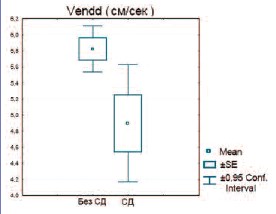
Рис. 10. Сравнение Vend в пенильных артериях у пациентов с сахарным диабетом и его отсутствием (p=0,067)
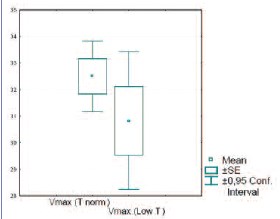
Рис. 11. Сравнение Vmax в пенильных артериях у пациентов с нормальным и пониженным уровнем тестостерона (р=0,25)
В некоторых источниках [21 – 23] утверждается, что веноокклюзивная ЭД может быть связана со снижением уровня тестостерона. Результаты нашего исследования показали, что Vmax по глубоким дорзальным венам у пациентов с нормальным и пониженным уровнем тестостерона не отличается (рис. 12)
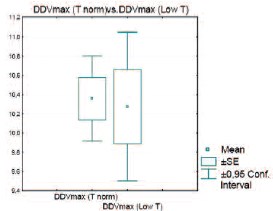
Рис. 12. Сравнение Vmax по глубоким дорзальным венам у пациентов с нормальным и пониженным уровнем тестостерона (р=0,82)
Несмотря на то, что сегодня, к сожалению, существуют трудности стандартизации при интерпретации допплерографических показателей, которые бывают связаны с различной разрешающей способностью ультразвуковых аппаратов, методологическими особенностями, выбором исследуемых параметров, а также с психогенным угнетением у пациентов с лабильной нервной системой, ультразвуковая допплерография сосудов полового члена является основным методом определения кровотока в артериях полового члена, обеспечивающих возникновение и поддержание эрекции. Уникальность методики ультразвуковой допплерографии в том, что часто в процессе одного исследования удается провести не только топическую диагностику, но и провести дифференциальную диагностику состояния сосудистой системы полового члена.
ЗАКЛЮЧЕНИЕ
В большинстве случаев поражения сосудов человеческого организма носят системный характер, поэтому логичным представляется, что у пациентов с наличием сердечно-сосудистых заболеваний в анамнезе или соответствующих факторов риска нарушения пенильной гемодинамики (в частности, артериальный приток) будут весьма выраженными. Однако, результаты проведенного нами исследования показывают, что это далеко не всегда так.
Некоторые факторы риска ССЗ, например, ожирение, действительно коррелируют с нарушением пенильной гемодинамики. Абдоминальное ожирение является независимым фактором риска сердечнососудистых и эндокринных заболеваний, а также артериогенной ЭД. Избыточное отложения жира на передней брюшной стенке приводит к снижению уровня тестостерона, и как следствие к проблемам с эрекцией.
Среди изученных заболеваний, характеризующихся поражением сосудов, только сахарный диабет оказался статистически значимым предиктором снижения артериального притока по кавернозным артериям.
ЛИТЕРАТУРА
1. Тиктинский О.Л., Михайличенко В.В. Андрология. 1999. С. 109–223.
2. Импотенция // Руководство по урологии. [Под ред. Лопаткина Н.А.] М.: Медицина, 1998. Т. 3. С. 602-621.
3. Montorsi P, Montorsi F, Schulman CC. Is erectile dysfunction the “tip of the iceberg” of a systemic vascular disorder? // Eur Urol, 2003. Vol 44, N 3. P. 352-354.
4. Montorsi F, Briganti A, Salonia A, Rigatti P, Margonato A, Macchi A, Galli S, Ravagnani PM, Montorsi P. Erectile dysfunction prevalence,time of onset and association with risk factors in 300 consecutive patients with acute chest pain and angiographically documented coronary artery disease. // Eur Urol. 2003. Vol. 44, N 3. P. 360–365
5. Montorsi P, Ravagnani PM, Galli S, Rotatori F, Veglia F, Briganti A, Salonia A, Dehò F, Rigatti P, Montorsi F, Fiorentini C. Association between erectile dysfunction and coronary artery disease. Role of coronary clinical presentation and extent of coronary vessels involvement: the COBRA trial. // Eur Heart J. 2006. Vol. 27, N 22. P. 2632-2639.
6. Chew KK, Gibson N, Sanfilippo F, Stuckey B, Bremner A. Cardiovascular mortality in men with erectile dysfunction: increased risk but not inevitable. // J Sex Med. 2011. Vol. 8, N 6. P. 1761-1771.
7. Ponholzer A, Gutjahr G, Temml C, Madersbacher S. Is erectile dysfunction a predictor of cardiovascular events or stroke? A prospective study using a validated questionnaire. // Int J ImpotRes. 2010. Vol.22, N 1. P. 25-29, 2010.
8. Garcia-Cruz E, Bonet A, Asiain I, Luque P, Freixa R, Alcaraz A. Relationship between erectile dysfunction and coronary anatomy in patients with ischemic heart disease debut. // Eur Urol Suppl. 2013. Vol. 12, N 1. P. 208.
9. Ponholzer A, Stopfer J, Bayer G, Susani M, Steinbacher F, Herbst F, Schramek P, Madersbacher S, Maresch J. Is Penile Atherosclerosis the Link Between Erectile Dysfunction and Cardiovascular Risk? An Autopsy Study. // Int J Impot Res. 2012. Vol. 24, N 4. P. 137-140.
10. Virag R.. Intracavernous injections for erectile failure. // Lancet, 1982. Vol. 320, N 8304. P. 938.
11. Ковалев В.А. Диагностика и лечение эректильной дисфункции: Автореф. дисс. … д-ра . мед. наук. М. 2001. 37 с.
12. Clifford A, Toppo JN. Role of penile color doppler in the evaluation of erectile dysfunction. // Indian J Radiol Imag. 2006. Vol.16. P..891-896
13. Velcek D, Sniderman KW, Vaughan ED Jr, Sos TA, Muecke EC. Penile flow index utilizing a Doppler pulse wave analysis to identify penile vascular insufficiency // J Urol. 1980. Vol. 123, N 5. P. 669-673.
14. Lue TF, Hricak H, Marich KW, Tanagho EA Vasculogenic impotence evaluated by high-resolution ultrasonography and pulsed Doppler spectrum analysis. // Radiology. 1985. Vol. 155, N 3. P. 777-781.
15. Королева С.В. Допплерография полового члена в диагностике эректильной дисфункции: АВтореф. дисс. … канд. мед.наук. М., 1997. 29 с.;
16. Коган М.И., Крупин В.Н., Шахов Б.Е. Артериальные факторы в механизме эрекции полового члена. // Урология и нефрология. 1995. N 2. C. 37–41.;
17. Montorsi F, Guazzoni G, Barbieri L, Galli L, Rigatti P, Pizzini G, Miani A. The effect of intracorporeal injection plus genital and audiovisual sexual stimulation versus second injection on penile color Doppler sonography parameters. // J Urol. 1996. Vol. 155, N 2. P. 536-540.
18. Wilkins CJ, Sriprasad S, Sidhu PS. Colour Doppler ultrasound of the penis. // Clin Radiol. 2003. Vol. 58, N 7. P. 514-523
19. McMahon CG. Correlation of penile duplex ultrasonography, PBI, DICC and angiography in the diagnosis of impotence. // Int J Impot Res. 1998. Vol. 10, N 3. P. 153-158.
20. Porst H. Manual der Impotenz. UNI-MED Verlag AG, 2000. 544 p.
21. Traish AM, Guay AT. Are androgens critical for penile erections in humans? Examining the clinical and preclinical evidence. // J Sex Med. 2006. Vol. 3, N 3. P. 382–404.
22. Traish AM, Goldstein I, Kim NN. Testosterone and erectile function: from basic research to a new clinical paradigm for managing men with androgen insufficiency and erectile dysfunction. // Eur Urol. 2007. Vol. 52, N 1. P. 54–70.
23. Rogers RS, Graziottin TM, Lin CM, Kan YW, Lue T. Intracavernosal vascular endothelial growth factor (VEGF) injection and adeno-assoicated virus-mediated VEGF gene therapy prevent and reverse venogenic erectile dysfunction in rats. // Int J Impot Res. 2003. Vol. 15, N 1. P. 26–37.









Комментарии