Журнал "Экспериментальная и клиническая урология" Выпуск №3 за 2015 год
Шкодкин С.В., Шевцов Ю.Н., Идашкин Ю.Б., Любушкин А.В., Паричук А.С.
Отсутствие эффекта от химиолучевой, таргетной и иммунотерапии на первичную опухоль почки определяет приоритет хирургического подхода для лечения этой категории пациентов [1, 2]. Несомненно, повсеместное применение таких лучевых методов визуализации как ультразвуковое исследование (УЗИ), спиральная компьютерная томография (СКТ) и магнитно-резонансная томография (МРТ) увеличило выявляемость опухолей почки небольших размеров, что в свою очередь позволяет выполнять органсохраняющие вмешательства [2-4]. В урологическом сообществе не прошли поверки модели скрининга рака почки и, являясь зачастую бессимптомным, местнораспространенный рак почки продолжает выявляться в 15-26% случаев [1, 2, 5, 6].
Хирургия «больших» опухолей почки сопряжена с рядом технических трудностей, а именно: нарушение анатомии вследствии дислокации прилежащих органов, сосудистая инвазия и развитие коллатерального кровотока, вовлечение в опухолевый процесс печени, поджелудочной железы, селезенки [5,7,8]. Нефрэктомия у таких пациентов требует выполнения резекции смежных органов, тромбэктомии и сосудистой реконструкции. В литературе отсутствует единая позиция по вопросам показаний к протезированию абдоминального отдела нижней полой вены и используемому материалу [7-10].
Представляем клиническое наблюдение: пациентка З., 62 лет, госпитализирована с жалобами на увеличение живота, потерю веса, слабость, которые прогрессируют в течение 1,5 лет. В анамнезе инфаркт миокарда три года назад, страдает гипертонической болезнью. Объективно пониженного питания, вес 71 кг, индекс массы тела – 27,7. Живот увеличен за счет ограниченно подвижного опухолевидного образования 55х30 см, располагающегося от мечевидного отростка до лона (рис. 1а). Печень, селезенка и отделы ЖКТ не пальпировались, перистальтика выслушивалась в левом мезогастрии. На передней брюшной стенке определялись расширенные вены – голова медузы (caput Medusae) (рис. 1а), отмечались отеки голеней. Показатели гемограммы не выходили за границы референтных значений; отмечен рост трансаминаз и щелочной фосфатазы, микрогематурия (до 10 эритроцитов в п/з). При ультразвуковом исследовании все отделы брюшной полости были заняты описанной опухолью, правая почка не дифференцировалась, печень визуализировалась фрагментарно, отсутствовала четкая граница с печенью, признаков венозной инвазии не выявлено. По данным спиральной компьютерной томографии (СКГ) с болюсным усилением в ангиографическом режиме данная опухоль исходила из правой почки, инвазировала в сегменты SVI и SVII печени, нижняя полая вена дислоцирована влево от срединной линии, проходима (рис. 1 б-г). По результатам СКТ грудной клетки и МРТ мозга у больной не выявлено диссеминированного опухолевого процесса.
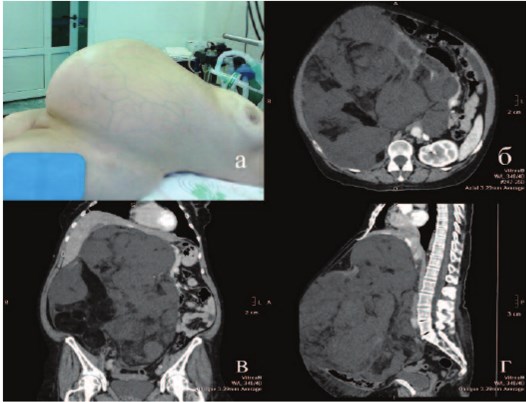
Рис.1. Пациентка перед операцией, визуализируется подкожная венозная сеть (а), дооперационная СКТ (б-г)
цесса. По поводу гигантской опухоли правой почки Т4N0M0, стадия IV, пациентка была оперирована. Из тотальной срединной лапаратомии (рис. 2а) мобилизованы верхний и нижний полюса (рис. 2б), передняя и задняя поверхности опухоли, ободочная и 12перстная кишка смещены (рис. 2в), инвазия в печень отсутствовала, почечная артерия перевязана по задней поверхности. При манипуляциях в области ворот почки отмечен аномальный ход венозных сосудов, развилось кровотечение, потребовавшее форсированного наложения венозных зажимов и удаления опухоли. Удалена опухоль 17,1 кг. При ревизии операционной раны выявлен дефект 10 см ренального отдела нижней полой вены. Проксимальный и дистальный ее концы и левая почечная вена перевязаны.
При осмотре макропрепарата отмечено, что указанные вены уходят в опухоль, просвет полностью комплемирован. При перевязке коротких печеночных и поясничных вен мобилизированы 5 см нижней полой и 3 см левой почечной вены, лигатуры сняты. Вена протезирована сосудистым протезом «Vascutek Gelsoft» диаметром 22 мм, анастомозы прошиты проленом 30 (рис. 2 г). Время венозной ишемии составило 40 минут. В послеоперационном периоде не отмечено нарушений функции почек, уровень креатинина составил 79,5 мкмоль/л, мочевины – 4,95 моль/л.
Морфологически опухоль представляла собой липосаркому, вторичного поражения лимфатических узлов выявлено не было (рис. 3 а-г).
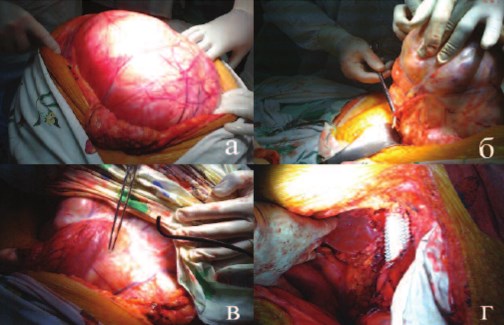
Рис. 2 а-г. Этапы нефрэктомии (пояснения в тексте)
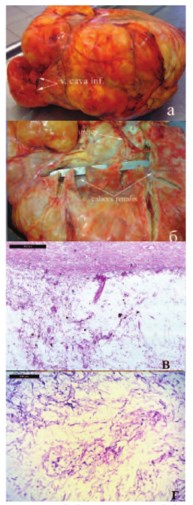
Рис. 3. Макро(а,б) и микроскопический (в,г) вид опухоли. Окраска гематоксилин и эозин
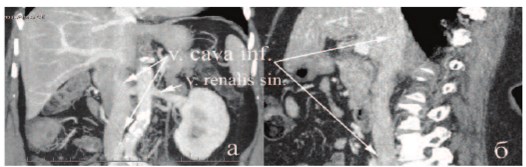
Рис. 4. СКТ (а,б) брюшной полости пациентки через 2 года после операции
Пациентка, находясь под наблюдением онколога, получила 2 курса адъювантной лучевой терапии СОД 64 Грей.
Последний осмотр через 2 года после операции не выявил тромбоза сосудистого протеза, локального и системного рецидива как по данным ультразвукового исследования, так и спиральной компьютерной томографии (рис. 4 а, б). Пациентка прибавила в весе, и весит 85 кг, индекс массы тела – 33,2, отклонений в гемограмме и по биохимическим показателям не выявлено. Пациентка социально адаптирована, продолжает трудовую деятельность.
ОБСУЖДЕНИЕ
На дооперационном этапе мы предполагали, что основные хирургические проблемы будут связаны с аномальными и добавочными венозными магистралями, поэтому уделили большое значение ультразвуковой и рентгеновской анатомии, исключив тромбоз. Ретроспективно анализируя данные УЗИ и спиральной компьютерной томографии, приходится констатировать, что за нижнюю полую была принята дилатированная непарная вена, при этом ввиду полной компрессии опухолью кровоток по нижней полой вене отсутствовал. Целесообразность протезирования в данном случае дискутабельна т.к. развитая коллатеральная сеть предупредила развитие канальцевого некроза при 40 минутной венозной ишемии. К позитивной стороне протезирования стоит отнести купирование клинических признаков синдрома нижней полой вены. У больной отсутствовали расширенная венозная сеть на передней брюшной стенке, варикоз вен нижних конечностей и отечный синдром.
ЗАКЛЮЧЕНИЕ
В виду объективных причин «большие» опухоли почки изменяют привычную анатомию, что требует детального анализа на предоперационном этапе. Протезирование нижней полой вены, обеспечивает хорошие функциональные результаты.
ЛИТЕРАТУРА
1. Онкоурология (национальное руководство). [Под редакцией В.И. Чиссова, Б.Я. Алексеева, И.Г. Русакова]. М.,Геотар-Медиа, 2012. 674 с.
2. Алексеев Б.Я., Волкова М.И., Воробьев Н.В. Опухоли почечной паренхимы Клиническая онкоурология [Под ред. Б.П. Матвеева]. М., 2011. С. 11-236.
3. Ghandour RA, Danzig MR, McKiernan JM. Renal cell carcinoma: risks and benefits of nephronsparing surgery for T1 tumors. // Adv Chronic Kidney Dis. 2015. Vol. 22, N 4. P. 258-265.
4. Volpe A, Blute ML, Ficarra V, Gill IS, Kutikov A, Porpiglia F, Rogers C, Touijer KA, Van Poppel H, Thompson RH. Renal ischemia and function after partial nephrectomy: a collaborative review of the literature. // Eur Urol. 2015. Vol. 68, N 1. P. 61-74.
5. Psutka SP, Boorjian SA, Thompson RH, Schmit GD, Schmitz JJ, Bower TC, Stewart SB, Lohse CM, Cheville JC, Leibovich BC. Clinical and radiographic predictors of the need for inferior vena cava resection during nephrectomy for patients with renal cell carcinoma and cavaltumour thrombus. // BJU Int. 2015. Vol. 116, N 3. P. 388-396.
6. Calero A, Armstrong PA. Renal cell carcinoma accompanied by venous invasion and inferior vena cava thrombus: classification and operative strategies for the vascular surgeon. // SeminVasc Surg. 2013. Vol. 26, N 4. P. 219-225.
7. Li G, Zhang Z, Xie D, Ye N, Yu D. Surgical resection of recurrent inferior vena cava tumor following radical nephrectomy for renal cell carcinoma. // OncolLett. 2015. Vol. 10, N 1. P. 111-114.
8. Chen X, Li S, Xu Z, Wang K, Fu D, Liu Q, Wang X, Wu B. Clinical and oncological outcomes in chinese patients with renal cell carcinoma and venous tumor thrombus extension. // World J SurgOncol. 2015. Vol. Feb 4;13:14.
9. Martínez-Salamanca JI, Linares E, González J, Bertini R, Carballido JA, Chromecki T, Ciancio G, Daneshmand S, Evans CP, Gontero P, Haferkamp A, Hohenfellner M, Huang WC, Koppie TM, Master VA, Matloob R, McKiernan JM, Mlynarczyk CM, Montorsi F, Nguyen HG, Novara G, Pahernik S, Palou J, Pruthi RS, Ramaswamy K, Faba OR, Russo P, Shariat SF, Spahn M, Terrone C, Tilki D, Vergho D, Wallen EM, Xylinas E, Zigeuner R, Libertino JA. Lessons learned from the International renal cell carcinoma-venous thrombus consortium (IRCC-VTC). // CurrUrol Rep. 2014. Vol. 15, N 5. P. 404.
10. Wachtel H, Gupta M, Bartlett EK, Jackson BM, Kelz RR, Karakousis GC, Fraker DL, Roses RE.Outcomes after resection of leiomyosarcomas of the inferior vena cava: a pooled data analysis of 377 cases. // Surg Onco. 2015. Vol. 24, N 1. P. 21-27.









Комментарии