И.А. Абоян, А.М. Галстян, К.И. Бадьян, С.М. Пакус
Рак предстательной железы (РПЖ) является наиболее часто выявляемым злокачественным новообразованием (ЗНО) в мире среди мужского населения и находится на третьем месте по распространенности среди всех ЗНО в целом. По данным мировой статистики в 2012 году самые высокие показатели заболеваемости РПЖ отмечены в Австралии и Новой Зеландии, самые низкие – в Южной и Центральной Азии, в Европе наиболее высокая частота РПЖ отмечена в Норвегии, самая низкая – в Албании [1,2].
По данным А.Д. Каприна и соавт. распространенность РПЖ в России за период с 2005 – 2015 гг. увеличилась в 3 раза. Из зарегистрированных в 2016 году 38 042 пациентов с диагнозом РПЖ доля больных с опухолевым процессом I стадии составила 11,4%, II стадии – 43,8%; III стадии – 27,4%; IV стадии – 15,9%. В 1,6% случаев стадия заболевания не была установлена. Летальность на первом году с момента установления диагноза составила 8%. Отношение показателей одногодичной летальности и запущенности онкологического процесса при РПЖ в 24 регионах России в 2015 г. равнялось или превышало 0,7 (среднероссийский показатель в 2014 г. 0,53). Индекс накопления контингента больных с РПЖ в России в 2015 г. составил 5,3% в сравнении с 3,8% в 2005 г. [3].
Благодаря широкому внедрению скрининга РПЖ в мире большая часть обнаруживаемых ЗНО предстательной железы (ПЖ) на сегодняшний день являются локальными [4].
В последние годы возросло количество публикаций, подтверждающих, что новые малоинвазивные методы лечения РПЖ позволяют предотвращать прогрессирование заболевания ПЖ и дают меньшее количество осложнений [5-8].
Следует отметить, что цель малоинвазивных стратегий лечения РПЖ, принимая во внимание биологические свойства злокачественных новообразований данной локализации, состоит в предотвращении прогрессирования заболевания, его лечении и контроле, сводя к минимуму побочные эффекты лечения [7,8].
Ультразвуковая аблация (HIFU) ПЖ является методом выбора лечения пациентов локализованным РПЖ и может быть использована также у пациентов, имеющих противопоказания для выполнения радикальной простатэктомии и у пациентов с доказанным местным рецидивом после проведенного ранее лечения. В настоящее время метод HIFU-гемиаблации может быть использован в качестве фокального лечения РПЖ. При этом онкологические результаты в отдаленном периоде сопоставимы с результатами тотальной аблации, а за счет сохранения ткани ПЖ, не подвергшейся ультразвуковой аблации, отмечены лучшие функциональные результаты [9,10].
Фокальная HIFU-гемиаблация РПЖ предполагает локальное прицельное энергетическое воздействие на опухолевый очаг с целью сохранения части ПЖ, не вовлеченной в опухолевый процесс [9]. Целью фокальной терапии РПЖ является выборочное разрушение очага злокачественного новообразования ПЖ с сохранением интактной ткани. Критерии и методы отбора кандидатов для фокальной терапии РПЖ могут варьировать в зависимости от объема образования, подлежащего разрушению, а также группы риска, к которой относится пациент [10, 11].
Группой ученых, учитывая гетерогенность характера РПЖ, объем поражения ПЖ, а также сопоставление уровня ПСА и объема ПЖ, разработано понятие «index lesion», которое является основополагающим при диагностике унифокального и унилатерального поражения, позволяя отобрать больных для выполнения фокального лечения установленного опухолевого очага [12,13].
Метод гемиаблации ПЖ был разработан для воздействия на одну из долей ПЖ при подтвержденном унифокальном, либо унилатеральном поражении с учетом верифицированного «index lesion» [14].
Основным условием эффективности фокальной терапии является обнаружение клинически значимого очага опухоли. Для этого необходимо применение комплекса высокоточных современных методов обнаружения РПЖ как в пораженной, так и в противоположной доле ПЖ, в частности мультипараметрической магнитно-резонансной томографии (МпМРТ) (PIRADS-V2), новых схем выполнения промежностной биопсии ПЖ, гистосканирования и т.д. [15-17].
Таким образом, необходимо отметить, что в настоящее время ультразвуковая гемиаблация ПЖ имеет все возможности внедрения в клиническую практику, однако требуется проведение исследований, направленных на стандартизацию методики проведения данной процедуры, а также последующей оценки онкологических и функциональных результатов, с целью определения места данного метода в стратегии органосохраняющего лечения рака предстательной железы.
Целью работы явилась оценка онкологических и функциональных результатов HIFU-гемиаблации у пациентов с локализованными формами рака предстательной железы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В период с 2011 по 2017 годы в условиях хирургического отделения №1 МБУЗ КДЦ "Здоровье" г. Ростова-на-Дону проводилась HIFUаблация у пациентов с локализованным РПЖ. Лечение проведено 250 пациентам, из них 200 больным выполнено лечение методом HIFU в режиме тотальной аблации (группа тотальной аблации), 50 пациентам лечение проведено в объеме HIFUгемиаблации (группа гемиаблации).
Отбор пациентов для проведения фокальной гемиаблации проводился на основании Руководства Европейской ассоциации урологов 2013 г., согласно которому оптимальным кандидатом для данного вида лечения является пациент с локализованным РПЖ низкого и среднего риска с изолированным унифокальным или унилатеральным поражением. Предпочтение отдается пациентам с ПСА <10 нг/мл, суммой баллов по Глисону <7, клинической стадией РПЖ <Т2b, количеством положительных биоптатов <4 и процентным распространением опухоли <50% в одном биоптате.
К потенциальным кандидатам могут быть отнесены пациенты с РПЖ низкого риска, которым показано активное наблюдение.
Диагноз РПЖ у всех пациентов был подтвержден морфологически после выполнения полифокальной биопсии ПЖ. Пациентам из группы гемиаблации выполнялась промежностная 24-точечная биопсия, при необходимости количество биоптатов ПЖ увеличивалось.
Сравнение медиан в группах проводилось с помощью теста Манна-Уитни и теста Фишера. Различия признавались статистическими значимыми при p<0,05. Расчеты выполнялись в статистической программе R (версия 3,2 R Foundation for Statistical Computing, Vienna, Austria).
Лечение РПЖ с использованием высокоинтенсивного сфокусированного ультразвука проводилось на аппарате для HIFU терапии Sonablate® 500 V5 ТСМ. Нами применялась разработанная в клинике методика гемиаблации РПЖ [18]. Этап планирования проводился с учетом данных предоперационной биопсии ПЖ, результатов Мп-МРТ и заключался в маркировке плана лечения. Диапазон планируемого лечения находился в границах от латерального контура пораженной доли до транзиторной зоны с отступлением от верхушки не менее 5 мм до базальных отделов. Производился интраоперационный контроль состояния капсулы ПЖ с целью оценки динамических изменений ее структуры при проведении лечения. Время аблации зависело от объема пораженной доли ПЖ. При проведении разметки зоны аблации латеральными границами являлись зона простатического отдела уретры и латеральная поверхность предстательной железы. Результат воздействия в каждой точке оценивался с помощью уровня температурной реакции тканей при этом в ходе лечения для достижения максимальной температуры тканей (между 65°C и 100°C) в зоне целевой аблации проводилась коррекция мощности акустического сигнала. Для визуальной оценки эффективности проведенной аблации тканей выполнялись сравнительные контрольные ультразвуковые сканирования ПЖ интактной и «пролеченной» долей ПЖ.
При проведении гемиаблации нами использовались только стандартные циклы лечения. Важным моментом в процессе лечения являлась необходимость контроля за расстоянием от трансдьюсера ультразвукового проба до стенки прямой кишки.
При проведении процедуры гемиаблации использовалось программное обеспечение аппарата Sonablate – TCM (tissue control monitoring), созданное для получения обратной связи и контроля хирургом не только уровня поглощенной энергии, но и определения эффективности аблации. В зависимости от динамики изменяемых параметров производился подбор интервалов аблации. В связи с вариабельностью анатомии ПЖ, риском интраоперационного отека и изменением контура ПЖ в ходе операции нами производился промежуточный контроль положения ПЖ после аблации не более 25% заданного объема ткани.
В связи с отсутствием необходимости выполнения цистостомии, а также быстрой реабилитации пациентов после гемиаблации, выписку больных из стационара производили на 4 день после операции. Основным критерием оценки эффективности операции при послеоперационном мониторинге являлась динамика уровня ПСА. Контроль уровня ПСА осуществлялся каждые 3 месяца после лечения в течение первого года наблюдения, затем один раз в течение 6 месяцев наблюдения.
После проведенного лечения осуществлялся мониторинг функциональных результатов с использованием валидизированных шкал. Использовались следующие шкалы: визуальная аналоговая шкала (VAS), шкала оценки симптомов заболеваний предстательной железы с индексом качества жизни (IIPSS+QL) международный индекс эректильной функции (МИЭФ), а также шкала оценки удовлетворенности пациента перенесенным оперативным вмешательством (EPIC).
Биохимическая прогрессия оценивалась согласно критериямASTROPhoenix (надир ПСА+2 нг/мл). При этом необходимо отметить, что в случае HIFUгемиаблации, при наличии интактной ткани в доле предстательной железы, не подвергающейся воздействию, уровень ПСА не всегда может прогностически свидетельствовать о рецидиве заболевания. В связи с указанным выше, рекомендуем выполнение контрольной промежностной биопсии ПЖ пациенту после гемиаблации при динамическом увеличении уровня ПСА.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При проведении сравнительной возрастной характеристики пациентов значительных расхождений между группами не выявлено. Так, в группе тотальной аблации средний возраст пациентов составил 71,7 лет, в группе гемиаблации – 72,2 года, наибольшее количество больных в обеих группах были в возрасте 7074 лет (рис. 1).
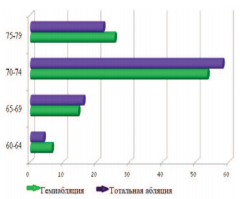

Рис. 1. Распределение пациентов в группах исследования по возрасту в %
При анализе зональной локализации РПЖ нами выявлено, что в обеих группах преобладали пациенты с новообразованиями в периферической зоне органа: 68,5% в группе тотальной аблации и 72% – в группе гемиаблации. Около 20% процентов опухолей у пациентов обеих групп локализовалось в переходной зоне ПЖ. У меньшего количества пациентов очаг поражения диагностирован в центральной зоне ПЖ: у двух (12%) пациентов – в группе тотальной аблации ПЖ и у 4 (8%) – в группе гемиаблации (p>0,05) (рис. 2). Локализация опухоли не являлась критерием для выбора способа лечения.
Нами также проанализировано распределение пациентов, вошедших в группу тотальной абляции ПЖ, по стадиям заболевания согласно классификации TNM: стадия T2сNХM0 диагностирована у 98 (49%) пациентов, стадия T2аNХM0 – у 59 (29,5%), стадия T2bNХM0 у 43 (21,5%) пациентов. В группе пациентов, перенесших фокальную гемиаблацию ПЖ, у 27 (54%) человек диагностирована T2аNХM0 стадия заболевания, у 23 (46%) пациентов – T2bNХ-M0. (табл. 1)
Таблица 1. Распределение пациентов в группах исследования по стадиям заболевания согласно классификации TNM
| TNM | Группа тотальной аблации | Группа фокальной гемиаблации | ||
|---|---|---|---|---|
| Абс. число | % | Абс. число | % | |
| T2аNх-M0 | 59 | 29,5 | 27 | 54 |
| T2bNx-M0 | 43 | 21,5 | 23 | 46 |
| T2cNx-M0 | 98 | 49 | 0 | 0 |
| Всего | 200 | 100 | 50 | 100 |
Основные результаты дооперационного обследования пациентов обеих групп представлены в таблице 2. Группы пациентов имели сопоставимые показатели уровня ПСА, индекса Глисона, G опухоли. Имели место отличия объема ПЖ, очаговости поражения, а также результатов гистосканирования.
Таблица 2. Предоперационные показатели пациентов исследуемых групп
| Показатель | Группа тотальной аблации | Группа фокальной гемиаблации | |
|---|---|---|---|
| Объем предстательной железы (см3 | 28,6 см3 | 42 см3 | |
| Очаговости поражения по данным Мп-МРТ | Унифокальное | 84% | 85% |
| Мультифокальное | 16% | 15% | |
| Индекс Глисона 6 (3+3) | 100% | 100% | |
| Grade 1 (ISUP 2014) | 100% | 100% | |
| Процент поражения в пределах биоптата | 50-80% | 0-50% | |
| Поражение одной доли по данным биопсии | 12% | 100% | |
| Перинеальная инвазия (процент пациентов) | 3% | 0% | |
| Уровень ПСА 0-10 нг/мл | 100% | 100% | |
| Гистосканирование ПЖ | 2 и менее очагов в пределах каждой доли | 19% | 0% |
| 2 и более очагов в пределах одной доли | 81% | 100% | |
Проведена сравнительная оценка онкологических и функциональных результатов, полученных в 2-х группах. Медиана наблюдения составила 3 года. Мониторинг пациентов в исследуемых группах проводился с учетом динамики уровня ПСА, а именно nadir (отмеченного минимального его уровня в динамике). Данный показатель в группе с тотальной аблацией в среднем составил 0,8 нг/мл, в группе гемиаблации – 1,48 нг/мл (p<0,001). Гистологический и биохимический рецидив отмечен у 12% и 28% группе тотальной аблации и 10% и 20% – в группе гемиаблации, соответственно.


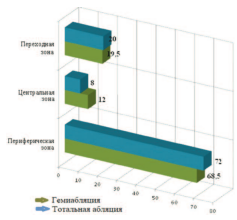
Рис. 2. Распределение пациентов (%) в группах исследования по локализации патологического процесса в различных зонах предстательной железы
Повторная биопсия выполнена всем пациентам в группе гемиаблации, а в группе тотальной аблации пациентам с биохимическим рецидивом согласно критериям Феникс, таких пациентов в группе тотальной аблации было 32 (16%).
В группе гемиаблации проведена оценка функциональных результатов лечения с использованием валидизированных шкал, являющихся субъективными шкалами оценки пациентом удовлетворенности проведенным лечением, комплаэнтности к лечению и адаптации пациента к дооперационным показателям жизни, выраженная в баллах у больных.
В группе пациентов после гемиаблации основные последствия лечения, связанные с неудовлетворенностью оперативным лечением, болевыми ощущениями, дизурическими явлениями и другими ощущениями дискомфорта стабилизируются к 4 неделе послеоперационного наблюдения (рис. 3)
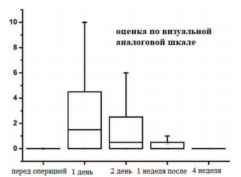
Рис. 3. Показатели шкалы VAS – Международной аналоговой шкалы адаптации пациента после перенесенного оперативного лечения в группе гемиаблации
На рисунке 4 представлены показатели в динамике Международного индекса эректильной функции.
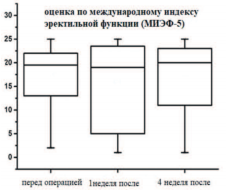
Рис. 4. Оценка в динамике показателей Международного Индекса Эректильной дисфункции (МИЭФ-5), выраженная в баллах в группе гемиаблации
В группе пациентов с гемиаблацией полученные данные показывают, что к 4-й неделе наблюдения показатели, связанные с эректильной функцией, могут достигать дооперационных параметров.
На рисунках 5,6 представлены показатели качества мочеиспускания пациентов в группе гемиаблации в динамике. Согласно оцениваемым шкалам в динамике через 4 недели расстройства мочеиспускания (IPSS), качество жизни (QоL), половой и мочевой функции по шкале (EPIC) у пациентов данной группы стабилизируются на дооперационных показателях.
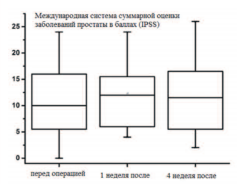
Рис.5. Оценка в динамике показателей, связанных с мочеиспусканием согласно опросника IPSS в группе пациентов с гемиаблацией
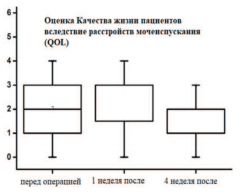
Рис. 6. Оценка в динамике показателей качества жизни пациентов QоL в группе гемиаблации
Оценка функциональных результатов также проводилась по Шкале EPIC, которая характеризует состояние половой функции, проявления дисфункции мочевой системы, выраженные в процентах. Оценка основных показателей функционирования мочевой и половой системы пациентов в группе гемиаблации согласно представленной шкале показывает относительно высокие показатели (80-100%) к 1 году наблюдения (рис. 7).
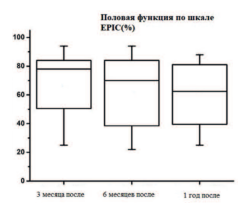
Рис. 7. Оценка показателей половой функции в динамике у пациентов в группе гемиаблации (%)
По данным комплексной оценки представленных ранее функциональных результатов лечения пациентов в группе гемиаблации можно говорить о том, что все пациенты остались удовлетворены проведенным вмешательством. Пациенты группы гемиаблации испытывали в послеоперационном периоде минимальные болевые ощущения, симптомы дизурии и умеренный болевой синдром. При этом эректильная функция у пациентов указанной группы соответствовала дооперационным показателям уже к году после лечения.
Представленные данные оценки функциональных результатов гемиаблации ПЖ и удовлетворенности проведенной операцией, говорят о высоких показателях данного вида вмешательства (рис. 8).
По данным наблюдения надир ПСА пациентов в исследуемых группах отмечен к 3 месяцам наблюдения и составил в первой группе – 0,8 нг/мл, во второй группе – 1,4 нг/мл. В группе пациентов после тотальной аблации биохимический рецидив диагностирован у 28%, в группе гемиаблации – у 20%. Гистологический рецидив заболевания выявлен у 12 % пациентов первой группы, в 10% случаев у пациентов второй группы. Сопоставление онкологичес-ких показателей в обеих группах, HIFU-гемиаблация продемонстрировало сопоставимые результаты.
Таким образом, HIFU-гемиаблация у пациентов с локализованным РПЖ показывает высокие функциональные результаты, снижая сроки реабилитации после оперативного лечения.
ЗАКЛЮЧЕНИЕ
Высокоинтенсивная ультразвуковая гемиаблация у пациентов с локализованным РПЖ при тщательном соблюдении алгоритма обследования и критериев отбора пациентов дает возможность воздействовать только на выявленный опухолевый очаг в ткани железы, позволяя сохранить высокие функциональные результаты лечения. Использование представленной в работе оригинальной методики выполнения гемиаблации позволяет наиболее прецизионно, точно выполнять лечение пораженной ткани ПЖ, оставляя интактной часть ткани железы, не пораженной онкологическим процессом. Гемиаблация у тщательно отобранной группы пациентов с применением HIFU-терапии позволяет сохранять высокие показатели качества мочеиспускания на дооперационных значениях в динамике. Также за счет сохранения сосудисто-нервных пучков в непораженной доле ПЖ у пациентов сохраняются показатели эректильной функции на дооперационных значениях в сравнении с выполненной тотальной аблацией, на фоне сохранения высоких онкологических результатов лечения.
Литература
1. Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer; 2013. URL: http://globocan.iarc.fr(link is external), accessed December 2013.
2. Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J, Rosso S, Coebergh JW, Comber H, et al. Cancer incidence and mortality patterns in Europe: Estimates for 40 countries in 2012. Eur J Cancer 2013;49(6):1374-403. doi: 10.1016/j.ejca.2012.12.027.
3. Каприн А.Д. Старинский В.В. Петрова Г.В. Состояние онкологическойпомощи населению России в 2016 году. М., 2017. 236 c.
4. Patel MP, Schulman A, Shah KP, Anderson JB, Polascik TJ. Engaging the primary care community to encourage appropriate prostate cancer. Ther Adv Urol 2017;10(1):11-16. doi: 10.1177/1756287217735799
5. Ganzer R., Fritsche H.M., Brandtner A. Fourteen-year oncological and functional outcomes of high-intensity focused ultrasound in localized prostate cancer. BJU Int 2013;112:322–329. doi: 10.1111/j.1464-410X.2012.11715.x.
6. Lukka H, Waldron T, Chin J. High-intensity focused ultrasound for prostate cancer: a systematic review. Clin Oncol R Coll Radiol 2011;23:117–127. doi: 10.1016/j.clon.2010.09.002.
7. Ahmed HU, Hindley RG, Dickinson L, Freeman A, Kirkham AP, Sahu M, et al. Focal therapy for localised unifocal and multifocal prostate cancer: a prospective development study. Lancet Oncol 2012;13(6):622-32. doi: 10.1016/ S1470-2045(12)70121-3
. Durand M, Barret E, Galiano M, Rozet F, Sanchez-Salas R, Ahallal Y, et al. Focal cryoablation: a treatment option for unilateral low-risk prostate cancer. BJU Int 2014 Jan;113(1):56-64 . doi: 10.1111/bju.12370.
9. Van Velthoven R, Aoun F, Marcelis Q, Albisinni S, Zanaty M, Lemort M, et al. A prospective clinical trial of HIFU hemiablation for clinically localized prostate cancer. Prostate Cancer Prostatic Dis. 2016;19(1):79-83. doi: 10.1038/pcan.2015.55
10. Taneja SS, Mason M. Candidate selection for prostate cancer focal therapy. J Endourol 2010;24(5):835-41. doi: 10.1089/end.2010.0006.
11. Лумпов И.С., Амосов А.В., Крупинов Г.Е., Чиненов Д.В., Ганжа Т.М., Воробьев А.А. Гемиаблация локализованного рака простаты высокоинтенсивным фокусированным ультразвуком. Медицинский вестник Башкортостана 2017;12(3):97-99
12. Ahmed H.U. The index lesion and the origin of prostate cancer.N Engl J Med 2009;361(17):1704-6. doi: 10.1056/NEJMcibr0905562
13. Huang CC, Deng FM, Kong MX, Ren Q, Melamed J, Zhou M. Re-evaluating the concept of "dominant/index tumor nodule" in multifocal prostate cancer. Virchows Arch 2014;464(5):589-94. doi: 10.1007/s00428-014-1557-y.
14. Eggener S, Salomon G, Scardino PT, De la Rosette J, Polascik TJ, Brewster S.Focal therapy for prostate cancer: possibilities and limitations. Eur Urol 2010;58(1):57-64. doi: 10.1016/j.eururo.2010.03.034.
15. Turpen R, Rosser CJ. Focal therapy for prostate cancer: revolution or evolution. BMC Urol 2009 Apr 23;9:2. doi: 10.1186/1471-2490-9-2.
16. Hale Z, Miyake M, Palacios DA, Rosser CJ. Focal cryosurgical ablation of the prostate: a single institute’s perspective. BMC Urol. 2013;13:2. doi: 10.1186/1471-2490-13-2.
17. Karavitakis M, Ahmed HU, Abel PD, Hazell S, Winkler MH. Tumor focality inprostate cancer: implications for focal therapy. Nat Rev Clin Oncol 2011;8(1):48-55. doi: 10.1038/nrclinonc.2010.190.
18. Абоян И.А., Галстян А.М., Бадьян К.И., Пакус С.М. Способ лечения локализованного рака предстательной железы. Заявка на изобретение №2017146552/14(079560) от 27.12.2017. URL: http://www1.fips.ru/fips_servl/fips_ servlet?DB=RUPAT&DocNumber=2017146552&TypeFile=html









Комментарии