Х.С. Ибишев, Н.Н. Рябенченко, Г.А. Магомедов
ФГБОУ ВО «Ростовский государственный медицинский университет» МЗ РФ; Ростов-на-Дону, Россия
Введение
Инфертильность является одной из сложных и актуальных проблем репродуктологии. Около 15% сексуально активных пар не достигают беременности в течение 1 года и обращаются за лечением бесплодия, а 5% пар остаются бездетными несмотря на использование различных методов лечения. У половины (50%) бездетных пар бесплодие связано с «мужским фактором», проявляющимся отклонениями в параметрах эякулята [1]. Данный факт имеет негативное влияние на качество жизни пациентов и приводит к огромным социально-экономическим затратам [2].
Снижение фертильности у мужчин может быть обусловлено различными факторами: врожденные или приобретенные аномалии мочеполовых органов, опухоли репродуктивных органов, варикоцеле, эндокринные нарушения, генетические заболевания, иммунологические факторы, инфекции мочевых путей и репродуктивных органов [3].
В 30 - 40% случаев не удаётся выявить причинный фактор бесплодия (идиопатическое бесплодие). У пациентов в анамнезе нет заболеваний, нарушающих фертильность, изменений при физикальном исследовании или в гормональных, генетических и биохимических показателях. При этом в анализе эякулята выявляется снижение числа сперматозоидов (олигозооспермия), снижение подвижности сперматозоидов (астенозооспермия) и большое число сперматозоидов с нарушением морфологических характеристик (тератозооспермия). Кроме того, часто данные виды патоспермии наблюдаются одновременно и обозначаются как олигоастенотератозооспермия (ОАТ-синдром) [4].
Развитием новых методов диагностики заболеваний мочевых путей и репродуктивных органов привело к расширению кругозора понимания этиопатогенетических звеньев данного состояния [5]. При этом, возрастает роль инфекционного фактора в развитие как женского, так и мужского бесплодия. Доказана роль бактерий, простейших, внутриклеточных микроорганизмов в генезе многих заболеваний репродуктивной системы, в том числе и бесплодия [6].
Кроме того, в последние годы вирусные инфекции рассматриваются также в качестве возможных деструктивных факторов, которые влияют на мужскую фертильность. Как прямые, так и непрямые эффекты вирусных инфекции человека могут репродуктивные процессы сперматогенеза, включая метаболическую и двигательную активность сперматозоидов [7, 8]. Прямые или опосредованные через аутоиммунные процессы токсические эффекты вирусных инфекций на репродуктивную систему мужчин способствуют различным расстройствам фертильности [9].
В последние годы широко изучается вопрос о причастности папилломавирусной инфекция (ПВИ) в развитии инфертильности [10].
По данным литературы доказана роль ПВИ в генезе онкологических заболеваний мочевых путей и репродуктивных органов, как в мужской, так женской популяции [11, 12]. Кроме того, ПВИ инфекция является высоко распространенным заболеванием передаваемых половым путём и существуют доказательства взаимосвязи ПВИ и развития генитальных бородавок, рецидивирующей инфекции нижних мочевых путей [13, 14]. В последние годы широко изучается вопрос о влиянии ПВИ в развитии инфертильности. И ряд исследований последних лет свидетельствуют о причастности ПВИ развитию инфертильности. [5,13]. Исследования выявили ПВИ в тестикулярной ткани у мужчин с бесплодием, что явилось основанием для предположений о взаимосвязи между ПВИ и нарушенными параметрами эякулята [15]. Эта корреляция была показана в некоторых исследованиях, свидетельствующих о нарушении подвижности сперматозоидов и рН в семенной жидкости и других поражений при наличии ПВИ в эякуляте [7].
Цель исследования: изучить причастность и этиологическую структуру ПВИ у мужчин с бесплодием, сочетающимся с ПВИ.
Материалы и методы
Обследован 71 пациент в возрасте от 22 до 44 лет с патоспермией диагнозом бесплодие, сочетающейся с ПВИ, и отсутствием других факторов риска (рис. 1).
Длительность заболевания до первичного обращения к врачу составила от 3 до 16 лет. Оценка оплодотворяющей способности эякулята проводилась в соответствии с данными и параметрами, рекомендованными ВОЗ (2010) в клинико-диагностической лаборатории. Для идентификации типа вируса использован амплификационный метод ДНК – диагностики (полимеразная цепная реакция – ПЦР). Материалом для исследования служил соскоб эпителия из мочеиспускательного канала и эякулят.
Результаты исследования были обработаны с использованием электронных таблиц MicrosoftExcel из пакета программ MicrosoftOffice 2007. Статистическая обработка данных проводилась с использованием статистического пакета STATISTICA 6.1 (StatSoftInc., США). Проведение расчетов и интерпретация результатов осуществлялись согласно руководству О.Ю. Ребровой. Соответствие распределения признаков закону нормального распределения проводилось с применением критерия Шапиро-Уилка.
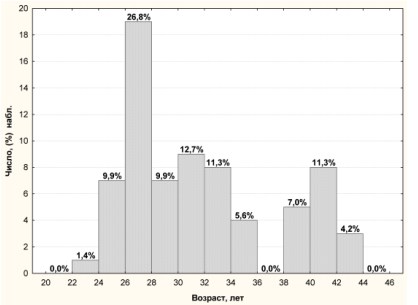
Рисунок 1. Распределение мужчин по возрасту
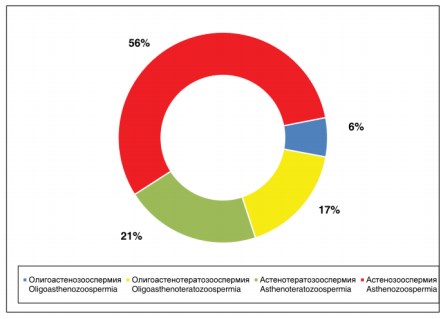
Рисунок 2. Виды патоспермии
Результаты
При анализе эякулята среди различных вариантов патозооспермии, наиболее чаще была выявлена астенозооспермия – 56%, небольшой удельный вес составляла олигоастенозооспермия – 6% (рис. 2).
В этиологической структуре ПВИ в целом доминировали вирусы 16 и 18 типа, которые регистрировались у 60,7% и 54,9% пациентов соответственно. Реже выделяли 33 тип – у 49,3% пациентов, 6 тип – у 28,2% пациентов и 11 тип у – 19,7% пациентов (p<0,05) (рис. 3).
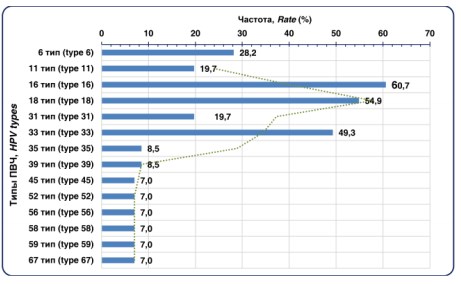
Рисунок 3. Типы ПВИ идентифицированные ПЦР методом диагностики
При ПЦР исследовании эякулята в этиологической структуре ПВИ чаще обнаруживали ассоциации нескольких вирусов (88,7%), реже – моноварианты. Наибольший удельный вес имели сочетания 16 типа ПВИ с 18 (47,9%) или 33 типами (35,2%), а также ассоциации 18 типа с 33 типом ПВИ (рис. 4).
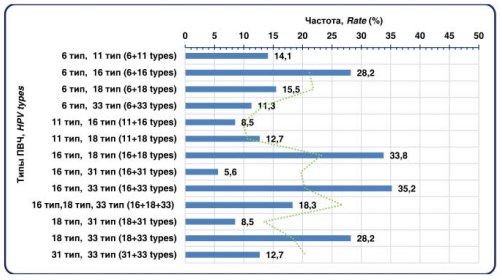
Рисунок 4. Ассоциации ПВИ
Результатыисследования выявили взаимосвязь количества ассоциантов ПВИ и количественных характеристик эякулята (r=0,1713, р=0,1532) (рис. 5).
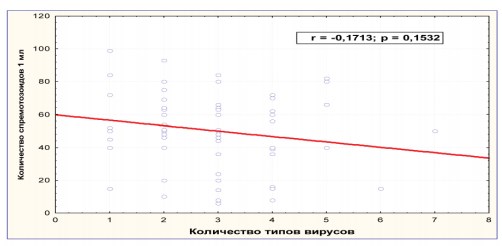
Рисунок 5. Ассоциации ПВИ и количество сперматозоидов (млн.) в 1 мл
Кроме того, наличие микст ПВИ влияло на подвижность и морфологические характеристики эякулята (рис. 6, 7).
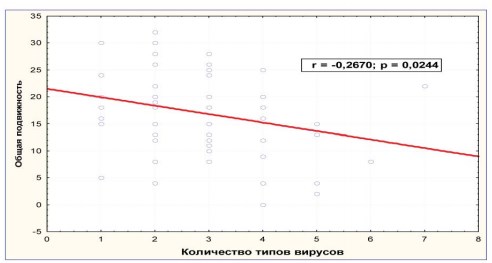
Рисунок 6. Ассоциации ПВИ и общая подвижность сперматозоидов
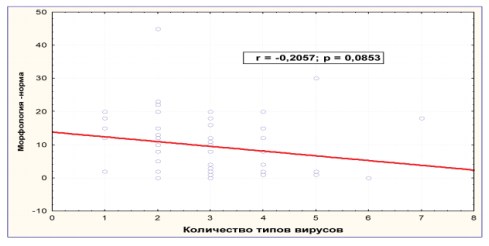
Рисунок 7. Ассоциации ПВИ и морфология эякулята
При всех видах патоспермии наиболее чаще были идентифицированы 16 (48,8%), 18 (48,7%) и 33 (45,7%) типы ПВИ (табл.1).
Таблица 1. Распределение типов вирусов по видам патоспермии
| Тип вируса | Астенозооспермия | Астенотератозооспермия | Олигоастенозооспермия | Олигоастенотератозооспермия | Всего | p |
| 6 | 12 (60,0%) | 5 (25,0%) | 2 (10,0%) | 1 (5,0%) | 20 (100%) | 0,26 |
| 11 | 5 (35,71%) | 4 (28,57%) | 2 (14,29%) | 3 (21,43%) | 14 (100%) | 0,27 |
| 16 | 21 (48,84%) | 12 (27,91%) | 2 (4,65%) | 8 (18,60%) | 43 (100%) | 0,26 |
| 18 | 19 (48,72%) | 9 (23,08%) | 2 (5,13%) | 9 (23,08% | 39 (100%) | 0,37 |
| 31 | 5 (35,71%) | 2 (14,29%) | 2 (14,29%) | 5 (35,71%) | 14 (100%) | 0,053 |
| 33 | 16 (45,71%) | 11 (31,43%) | 1 (2,86%) | 7 (20,00%) | 35 (100%) | 0,094 |
| 35 | 5 (83,33%) | 0 (0,00%) | 0 (0,00%) | 1 (16,67%) | 6 (100%) | 0,25 |
| 39 | 4 (66,67%) | 1 (16,67%) | 1 (16,67%) | 0 (0,00%) | 6 (100%) | 0,35 |
| 45 | 2 (40,00%) | 2 (40,00%) | 0 (0,00%) | 1 (20,00%) | 5 (100%) | 0,65 |
| 52 | 2 (40,00%) | 3 (60,00%) | 0 (0,00%) | 0 (0,00%) | 5 (100%) | 0,15 |
| 56 | 3 (40,00%) | 0 (0,00%) | 0 (0,00%) | 2 (40,00%) | 5 (100%) | 0,27 |
| 58 | 3 (60,00%) | 1 (20,00%) | 1 (20,00%) | 0 (0,00%) | 5 (100%) | 0,39 |
| 59 | 4 (80,00%) | 1 (20,00%) | 0 (0,00%) | 0 (0,00%) | 5 (100%) | 0,42 |
| 67 | 3 (75,00%) | 0 (0,00%) | 0 (0,00%) | 1 (25,00%) | 5 (100%) | 0,46 |
Обсуждение
Согласно данным ВОЗ, ПВИ является наиболее распространённой инфекцией, передающаяся половым путём, вызывающей заболевания МВП и репродуктивной системы, которые носят рецидивирующий характер, и существенно ухудшают качество жизни пациентов [12, 13, 16].
В настоящее время имеется достаточное количество работ посвящённых причастности ПВИ к развитию бесплодия у мужчин.
Дискутабельным остаётся вопрос о патогенетических звеньях ПВИ, влияющих на количественные и качественные характеристики эякулята. В ходе проведённого исследования отмечено, что при инфертильности ассоциированной с ПВИ, наиболее часто встречающимся видом патоспермии была астенозооспермия (56%). Конкретные механизмы, лежащие в основе данного вида патосмермии, до сих пор обсуждаются. Одна из версий: ПВИ вызывает двигательной активности сперматозоидов [17]. В других исследованиях, изучая параметры эякулята ассоциированного с ПВИ, был сделан вывод о том, что ПВИ может вызывать ухудшение всех параметров эякулята, но доминирующими нарушениями являются: снижение общей и прогрессирующей подвижности сперматозоидов и изменения морфологических характеристик эякулята [7]. Факторами патогенности, за счёт которых вызываются различные нарушения эякулята, являются вирусные пептиды Е6-Е7, L1. Именно данные вирусные пептиды снижают пенетрационную способность сперматозоидов, а также вызывают целый ряд нарушений эякулята [17].
В нашем исследовании, часто встречающие типы ПВИ, которые вызывали нарушение подвижности сперматозоидов и патологию морфологической картины эякулята, были 16, 18 и 33 типы вируса. Кроме того, ассоциация нескольких вирусов, возможно, суммирует патогенные свойства ПВИ и потенцирует патогенное воздействие на различные параметры эякулята. При наличии микст ПВИ были регистрированы существенно худшие параметры эякулята в сравнении, когда ПВИ была представлена в моноварианте.
Выводы
В настоящем исследовании установлено, что ПВИ может приводить к различным видам патоспермии.
При бесплодии, ассоциированном с ПВИ, отмечается нарушение подвижности сперматозоидов и ухудшение морфологических характеристик эякулята.
В ходе анализа было выявлено, что у больных с патозооспермией в большинстве случаев были выявлены 16, 18, 33 типы ПВИ.
В настоящее время необходимы дальнейшие проспективные исследования, которые будут, могут окончательно подтвердить связь между ПВИ и мужским бесплодием.
Распространённость различных представителей ПВИ в эякуляте и их релевантность для мужского бесплодия различаются в значительной степени вследствие методов выделения генома и амплификации, реальных вариации между исследуемыми популяциями и географических регионов, что требует дальнейших исследований.
ЛИТЕРАТУРА
- Jungwirth A, Diemer T, Kopa Z, Krausz C, Minhas S, Tournaye H. members of the EAU – ESTRO – ESUR –SIOG Male infertility Guidelines Panel. EAU – ESTRO – ESUR – SIOG Guidelines on Male infertility. Edn. presented at the EAU Annual Congress Copenhagen 2018. The Netherlands: Arnhem, 2018.
- Сухих Г.Т., Овчинников Р.И., Ушакова И.В. Влияние комплекса Сператон на функциональные характеристики сперматозоидов у мужчин с идиопатической патоспермией. Проблемы репродукции. 2016;22(4):106-110. DOI: 10.17116/repro2016224106-110
- Pierik FH, Van Ginneken AM., Dohle GR, Vreeburg JT, Weber RF. The advantages of standardized evaluation of male infertility. Int J Androl. 2000;23(6):340-6. DOI: 10.1046/j.1365- 2605.2000.00250.x
- Atkins D, Best D, Briss PA, Eccles M, Falck-Ytter Y, Flottorp S, GuyattGH, Harbour RT, Haugh MC, Henry D, Hill S, Jaeschke R, Leng G, LiberatiA, Magrini N, Mason J, Middleton P, Mrukowicz J, O’Connell D, Oxman AD, Phillips B, Schünemann HJ, Edejer T, Varonen H, Vist GE, Williams JW Jr, Zaza S; GRADE Working Group. Grading quality of evidence and strength of recommendations. BMJ. 2004;328(7454):1490. DOI: 10.1136/bmj.328.7454.1490
- Luttmer R, Dijkstra MG, Snijders PJ, Hompes PG, Pronk DT, Hubeek I, Berkhof J, Heideman DA, Meijer CJ. Presence of human papillomavirus in semen in relation to semen quality. Hum Reprod. 2016;31(2):280-286. DOI: 10.1093/humrep/dev317
- Набока Ю.Л., Коган М.И., Гудима И.А., Черницкая М.Л., Ибишев Х.С., Хасигов А.В., Митусова Е.В. Роль неклостридиальных анаэробов в развитии инфекционно-воспалительных заболеваний органов мочевой и половой систем. Урология. 2013;6:118-211. eLIBRARY ID: 21091599
- Garolla A, Pizzol D, Bertoldo A, Menegazzo M, Barzon L, Foresta C. Sperm viral infection and male infertility: focus on HBV, HCV, HIV, HPV, HSV, HCMV, and AAV. Journal of Reproductive Immunology. 2013;100:20-29. DOI: 10.1016/j. jri.2013.03.004
- Monavari, SH, Vaziri, MS, Khalili M, Shamsi-Shahrabadi M, Keyvani H, Mollaei H., Fazlalipour M. Asymptomatic seminal infection of herpes simplex virus: impact on male infertility. Journal of Biomedical Research. 2013;27:56-61. DOI: 10.7555/JBR.27.20110139
- Neofytou E, Sourvinos G, Asmarianaki M, Spandidos DA, Makrigiannakis A. Prevalence of human herpes virus types 1–7 in the semen of men attending an infertility clinic and correlation with semen parameters. Fertility and Sterility. 2009;91:2487-2494. DOI: 10.1016/j.fertnstert.2008.03.074
- Роговская С.И. Вакцины против вируса папилломы человека: новые возможности профилактики цервикального рака. Гинекология. 2007;9(1):15-20. eLIBRARY ID: 20404698
- Shigehara K, Sasagawa Т, Namiki М. Human papillomavirus infection and pathogenesis in urothelial cells: A mini-review. J. Infect. Chemother. 2014;20:741-747. DOI: 10.1016/j. jiac.2014.08.033
- Ибишев Х.С, Коган М.И. Лечение крупных рецидивирующих остроконечных кондилом наружных гениталий у мужчин. Урология. 2013;6:82-86. eLIBRARY ID: 21091587
- Ибишев Х.С, Крахоткин Д.В., Васильев А.А., Крайний П.А. Рецидивирующая инфекция нижних мочевых путей вирусной этиологии. Вестник урологии. 2017;5(1):26-31. DOI: 10.21886/2308-6424-2017-5-1-26-31
- Yang Y, Jia C-W, Ma Y-M, Zhou L-Y, Wan S-Y. Correlation between HPV sperm infection and male infertility. Asian J Androl. 2013;15(4):529-532. DOI: 10.1038/aja.2013.36
- Nasseri S, Monavari SH, Keyvani H, Nikkhoo B, Vahabpour Roudsari R, Khazeni M. The prevalence of Human Papilloma Virus (HPV) infection in the oligospermic and azoospermic men. Medical Journal of the Islamic Republic of Iran. 2015;29:272. PMCID: PMC4715409
- Ибишев Х.С., Тагиров З.Т., Ферзаули А.Х., Пархоменко О.В. Комплексная терапия остроконечных кондилом у мужчин. Поликлиника. 2011;2-1:102-103. eLIBRARY ID: 23590695
- Kim CH, Kim JH, Kim HJ, Kim KW, Lee JY, Yang SH, Choe J, Hwang D, Kim KC, Hwang ES. Detection of adeno-associated virus from semen suff ering with male factor infertility and having their conception partners with recurrent miscarriages. Journal of Bacteriology and Virology. 2012;42:339-345. DOI: 10.4167/jbv.2012.42.4.339
Статья опубликована в журнале "Вестник урологии" №2 2019, стр. 51-58













Комментарии