Гаврилова М.А., Садыкова Е.В., Логвиненко А.В., Цапенков Н.А., Знобищев В.Г., Лыков А.В., Кельн А.А., Ощепков В.Н.
Рак полового члена (РПЧ) – относительно редкий вид плоскоклеточного рака. Он обычно возникает в эпителии крайней плоти и головки полового члена. Фимоз, недостаточная личная гигиена, курение и инфицирование вирусом папилломы человека являются основными факторами риска развития РПЧ. В западной Европе и США РПЧ встречается редко – заболеваемость менее 1,0 на 100 000 мужчин [1, 2]. Наибольший уровень заболеваемости раком полового члена выявлен среди латиноамериканцев (1,01 на 100 000), за которыми следуют коренные (американские) индейцы (0,77 на 100 000), афроамериканцы (0,62 на 100 000) и, наконец, белые мужчины (0,51 на 100 000). В отличие от развитых западных стран, в остальном мире уровень заболеваемости раком полового члена намного выше и достигает 10-20% от всех злокачественных новообразований у мужчин: от 0,7-3,0 на 100 000 населения в Индии до 8,3 на 100 000 – в Бразилии. В России заболеваемость РПЧ в 2014 год составила 0,82 случая на 100 000 мужского населения и отмечен стабильный рост за последние 10 лет [3].
Важными факторами риска развития РПЧ являются низкое социальное положение, несоблюдение гигиенических мер и религиозные правила [4,5]. РПЧ редко встречается в странах, где распространено обрезание. Раннее обрезание (новорожденные, дети до полового созревания) снижает риск развития заболевания в 3-5 раз. Обрезание у взрослых не имеет значения с точки зрения профилактики РПЧ. Уровень заболеваемости увеличивается с возрастом, однако известны случаи развития болезни у молодых людей и детей [4]. Выделяют следующие факторы риска развития РПЧ: фимоз, хроническое воспаление, в том числе баланопостит; лечение с использованием фотосенсибилизаторов и фотохимиотерапии (ультрафиолет А). Большое количество партнеров, раннее начало половой жизни и наличие кондилом полового члена ассоциированы с 3-5-кратным увеличением вероятности развития рака полового члена. Курение также является фактором риска. Многими авторами наличие ДНК вируса папилломы человека отмечено в 70-100% случаев интраэпителиальной неоплазии и в 4050% случаев инвазивного РПЧ [4, 5]. В диагностике первичного очага важное значение имеет физикальное обследование, Для определения опухолевой инвазии могут быть полезны ультразвуковое исследование (УЗИ) и магнитно-резонансная томография (МРТ) на фоне индуцированной медикаментозно эрекции. При оценке распространенности процесса определенную пользу может иметь позитронно-эмиссионная томография (ПЭТ) с 18F-DG. Биопсия первичной опухоли показана в следующих случаях: сомнения в точной природе поражения (метастатическое поражение, меланома и др.); если в процессе лечения не предполагается получение гистологического материала (лучевая терапия, лазерная хирургия и др.); если имеются сомнения в отношении метастатической природы поражения паховых лимфоузлов. Возможно использование различных методов биопсии: экцизионная, инцизионная, щипковая, игольчатая аспирация, взятие мазков-отпечатков.
В связи с низкой частотой РПЧ и отсутствием рандомизированных исследований в данной области существует масса противоречий относительно оптимальной тактики ведения этой категории больных. Выбор метода лечения определяется локализацией, размерами и типом роста первичной опухоли, стадией T, N, M и степенью дифференцировки G.
Основным методом лечения первичной опухоли полового члена является хирургический. У некоторых больных возможно местное применение химиопрепаратов, а также проведение лучевой терапии совместно или без системного лечения. В случаях местных рецидивов повторное органосохраняющее вмешательство может быть выполнено при отсутствии инфильтрации кавернозных тел [1, 6]. Инфильтративный локальный рецидив и рецидивная опухоль больших размеров служат показанием к резекции или ампутации полового члена. Пациентам с неоперабельными местными рецидивами проводят химиотерапию с последующей попыткой хирургического лечения в случае регрессии опухоли. Паховая лимфаденэктомия остается эффективным методом лечения регионарных метастазов [6-8]. Данное вмешательство ассоциировано с высокой частотой осложнений (расхождение краев раны, лимфостаз, нагноение раны). Это ограничивает широкое использование паховой лимфодиссекции при клинически негативных лимфоузлах с профилактической целью.
Применение лучевой терапии на первичную опухоль является альтернативным подходом органосохраняющего лечения, что позволяет добиться хороших результатов у определенной категории больных (Т1-2, размер опухоли менее 4 см в наибольшем измерении). При РПЧ могут применяться дистанционная лучевая терапия (ДЛТ), брахитерапия (БТ) или сочетанная лучевая терапия.
Согласно рекомендациям Американского общества брахитерапии (ABS) наилучшими кандидатами на лечение методом брахитерапии являются пациенты с локализованной опухолью полового члена без признаков инфильтрации подлежащих тканей, имеющей размер не более 2 см в наибольшем измерении [9]. Рекомендуется также проводить облучение паховых лимфоузлов с обеих сторон. Могут быть использованы различные варианты брахитерапии, включая метод наружных аппликаций и различные виды инвазивной брахитерапии.
На сегодняшний день отсутствуют проспективные рандомизированные исследования для оценки эффективности различных вариантов лучевой терапии для лечения РПЧ. Полный эффект ДЛТ достигается в 60%, БТ – в 70-90% случаев [4,10,11]. Однако сравнение результатов дистанционной лучевой терапии и брахитерапии не всегда корректно, поскольку пациентам с большими опухолями (более 4 см) БТ не проводится. К тому же, использование различных доз в разных ретроспективных исследованиях, делает весьма сложным сравнение результатов разных видов лечения и их побочных эффектов.
Для достижения необходимого местного эффекта необходимо использование высоких доз облучения, что может служить причиной развития ятрогенных осложнений. Стеноз уретры (20-35%), некроз головки полового члена (10-20%) и поздний фиброз являются наиболее серьезными вариантами лучевых реакций. После лучевой терапии сохранить половой член удается приблизительно в 80% случаев. Согласно данным литературы частота местного контроля опухоли после БТ составляет 90% с сохранением полового члена в 87% наблюдений [12, 13, 14].
В настоящее время для лучевой терапия РПЧ выделяют две группы показаний, преследующих разные лечебные цели:
- органосохраняющее лечение у больных раком полового члена Т2, поражением головки или венечной борозды, опухолью менее 4 см, согласных на последующее тщательное наблюдение. Для подведения необходимой дозы (более 60 Гр) может быть использована сочетанная лучевая терапия (ДЛТ в сочетании с БТ);
- паллиативная лучевая терапия у больных диссеминированным РПЧ с целью паллиативного местного лечения методом выбора является ДЛТ до суммарной очаговой дозы (СОД) 40-50 Гр.
Несмотря на низкие показатели заболеваемости и смертности, выбор метода лечения больных РПЧ остается серьезной проблемой, так как радикальное оперативное лечение сопряжено с тяжелой психологической травмой пациента. И если для начальных форм заболевания применимы органосохраняющие хирургические методики, то для T1b-T2 опухолей общепринятым считается частичная или полная ампутация полового члена [15,16]. Альтернативный подход – применение лучевой терапии, эффективность которой в отечественной литературе освещается лишь в единичных работах [16-18].
КЛИНИЧЕСКИЙ СЛУЧАЙ
Больной П. 57 лет, при поступлении в клинику предъявлял жалобы на наличие новообразования на головке полового члена в течение 1 года. Наблюдался в КВД у венеролога, где проводилось консервативное лечение, без эффекта. В этой связи было заподозрено наличие злокачественного новообразования и пациент был направлен на консультацию к онкологу, где диагноз рака полового члена был верифицирован гистологически: метаплазия плоскоклеточного эпителия с выраженным дискератозом 2-3 степени, плоскоклеточная карцинома in situ. Установлен диагноз: рак полового члена T1N0M0. Сопутствующий диагноз: ИБС, хроническая сердечная недостаточность ФК 3, атеросклеротический кардиосклероз, постоянная форма фибрилляции предсердий, тахисистолический вариант, артериальная гипертензия 3 степени, 3 стадии, риск 4, дискуляторная энцефалопатия 1 степени сложного генеза, хронический гастродуоденит в стадии неполной ремиссии, язвенная болезнь двенадцатиперстной кишки, ассоциированная с H.pylori, вне обострения. Из семейного анамнеза установлено, что у отца был выявлен рак поджелудочной железы. Больной отрицал наличие вредных привычек.
При объективном осмотре было установлено, что крайняя плоть не сужена, на головке полового члена вокруг наружного отверстия уретры имеется экзофитное образование до 1,5 см в диаметре, возвышающееся над головкой на 4-5 мм, хрящевой плотности. Лимфатические узлы паховой области при пальпации эластической консистенции, размером до 1,0 см, подвижные, безболезненные, кожа над л/узлами не изменена.При УЗИ лимфатических узлов: в паховой области с обеих сторон единичные л/узлы 17х9 мм неизмененной структуры, овальной формы, без видимых патологических изменений.
Учитывая клинические проявления, результат морфологического заключения, данные инструментальных исследований, сопутствующие заболевания, принято решение провести курс брахитерапии опухоли головки полового члена. На первом этапе лечения выполнено обрезание крайней плоти.
Для визуализация мишени и планирования выполнена КТ-топометрия с занесением сканов в планирующую систему «HDR plus», составлен план лечения в формате 3D (рис. 1) Были изготовлены индивидуальные решетчатые шаблоны для фиксации эндостатов в необходимой позиции. Мочевой пузырь дренировали уретральным катетером. Согласно The Paris dosimetric rules system in HDR brachytherapy [19] по шаблону были установлены 4 полимерных игольчатых эндостата диаметром 1,65 мм и длиной 150 мм. По макету в асептических условиях установлены 4 игольчатых импланта: 2 – через головку полового члена проксимальнее образования на расстоянии 2 см друг от друга, 2 – проведены касательно у наружного отверстия уретры на расстоянии 2 см друг от друга (рис. 2). Конструкция оставлена на весь период лечения. Все манипуляции осуществлялись под местной анестезией.
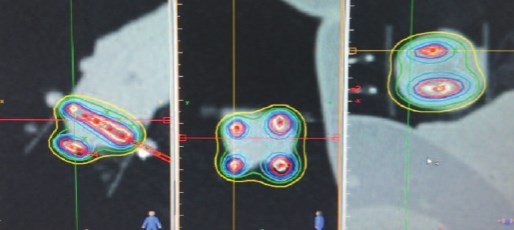
Рис.1. Дозиметрическое планирование
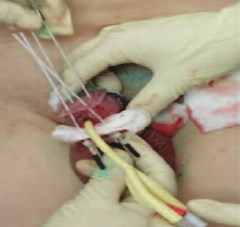
Рис. 2. Ход установки эндостатов
Был проведен курс брахитерапии на головку полового члена: разовая очаговая доза – 3 Гр, 18 сеансов облучения (2 раза в день с интервалом 6 часов, суточная доза составила 6 Гр), суммарная очаговая доза -54 Гр, режим фракционирования 5 раз в неделю на аппарате «MultiSourse» с источником 60Co. Первый сеанс брахитерапии был проведен через 6 дней после циркумцизии. Весь курс лучевого лечения занял 11 дней. Продолжительность каждого сеанса составила около 4 мин. Для изоляции органов мошонки и здоровых окружающих тканей были применены защитные экраны. Пациент перенес лечение удовлетворительно.
В процессе проведения лучевого лечения наблюдали умеренно выраженную лучевую реакцию в виде гиперемии кожи головки полового члена, отечности и экссудации в области опухоли, образование струпа. Пациент отмечал жжение и дискомфорт в области облучения, которые не потребовали применения анальгетиков. Зону облучения после каждого сеанса обрабатывали раствором антисептика. Шаблоны с эндостатами сняты в день последнего сеанса облучения (рис. 3). Рана после циркумцизии зажила первичным натяжением.
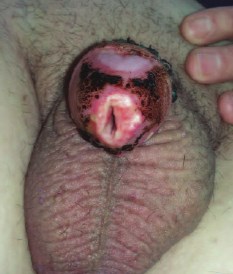
Рис. 3. Вид после удаления эндостатов
Через 2 недели после окончания лучевого лечения пациент отметил появление лучевой реакции средней степени выраженности, сопровождавшееся частичной десквамацией эпителия головки полового члена. После проведенного консервативного лечения в течение 10 дней, включавшего обработку головки полового члена растворами антисептиков, явления баланита заметно уменьшились до полного исчезновения. При контрольном осмотре через 3 месяца пациент не предъявлял жалоб. Также не было отмечено затруднения при мочеиспускании. При осмотре были выявлены точечные рубцы в месте стояния эндостатов и незначительное сужение наружного отверстия уретры. Воспалительных изменений не было зарегистрировано. Данных за опухолевый рост не выявлено (рис. 4). Пациент возобновил половую жизнь.
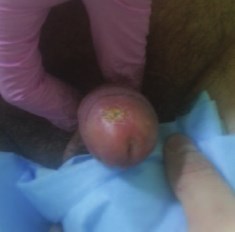
Рис. 4. Вид через 3 месяца после окончания лечения
ЗАКЛЮЧЕНИЕ
В результате лечения больного РПЧ методом высокомощностной брахитерапии удалось достичь ремиссии с хорошим косметическим эффектом. Таким образом, высокомощностная брахитерапия является эффективным альтернативным методом лечения РПЧ. Качество жизни при использовании данного метода лечения выше, чем при хирургическом.
ЛИТЕРАТУРА
1. Mobilio G, Ficarra V. Genital treatment of penile carcinoma. Curr Opin Urol 2001;11(3):299-304.
2. Horenblas S, van Tinteren H, Delemarre JF, Boon TA, Moonen LM, Lustig V. Squamous cell carcinoma of the penis. II. Treatment of the primary tumor. J Urol 1992;147(6):1533-1538.
3. Злокачественные новообразования в России в 2014 году (заболеваемость и смертность) [под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой] МНИОНИ им. П.А. Герцена – филиал ФГБУ «НМИРЦ» Минздрава России. М., 2016. С. 16
4. Cubilla AL, Reuter V, Velazquez E, Piris A, Saito S, Young RH. Histologic classification of penile carcinoma and its relation to outcome in 61 patients with primary resection. Int J Surg Pathol 2001;9(2):111-120.
5. Misra S, Chaturvedi A, Misra NC. Penile carcinoma: a challenge for the developing world. Lancet Oncol 2004;5(4):240-247.
6. Bezerra AL, Lopes A, Santiago GH, Ribeiro KC, Latorre MR, Villa LL Human papillomavirus as a prognostic factor in carcinoma of the penis: analysis of 82 patients treated with amputation and bilateral lymphadenectomy. Cancer 2001;15;91(12):5-21.
7. Leijte JA, Valdés Olmos RA, Nieweg OE, Horenblas S. Anatomical mapping of lymphatic drainage in penile carcinoma with SPECT-CT: implications for the extent of inguinal lymph node dissection. Eur Urol 2008;54(4):885-890.
8. Solsona E, Iborra I, Rubio J, Casanova JL, Ricós JV, Calabuig C. Prospective validation of the association of local tumor stage grade as a predictive factor for occult lymph node micrometastasis in patients with penile carcinoma and clinically negative inguinal lymph nodes. J Urol 2001;165(5):1506-1509.
9. Crook JM, Haie-Meder C, Demanes DJ, Mazeron JJ, Martinez AA, Rivard MJ. American Brachytherapy Society-Groupe Européen de Curiethérapie-European Society of Therapeutic Radiation Oncology (ABS-GEC-ESTRO) consensus statement for penile brachytherapy. Brachytherapy 2013;12(3):191-198.
10. Azrif M, Logue JP, Swindell R, Cowan RA, Wylie JP, Livsey JE. External-beam radiotherapy in T1-2N0 penile carcinoma. Clin Oncol (R Coll Radiol) 2006;18(4):320-325.
11. Lont AP, Gallee MP, Meinhardt W, van Tinteren H, Horenblas S. Penis conserving treatment for T1 and T2 penile carcinoma: clinical implications of a local recurrence. J Urol 2006;176(2):575-580.
12. Crook JM, Grimard L, Esche B, Pond G. Penile brachytherapy: results for 60 patients. Brachytherapy 2007;6(2):82.
13. Zouhair A, Coucke PA, Jeanneret W, Douglas P, Do HP, Jichlinski P. Radiation therapy alone or combined surgery and radiation therapy in squamous-cell carcinoma of the penis. Eur Cancer 2001;37(2):198-203.
14. Hakenberg OW, Compérat EM, Minhas S, Necchi A, Protzel C, Watkin N. EAU guidelines on penile cancer: 2014 update. Urol 2015;67(1):142-150.
15. Hasan S, Francis A, Hagenauer A, Hirsh A, Kaminsky D, Traughber B, et al. The role of brachytherapy in organ preservation for penile cancer: A meta-analysis and review of the literature. Brachytherapy 2015;14(4):517-524.
16. Каприн А.Д., Замятин О.А., Ананьев А.П., Подшивалов А.В. Рак полового члена. Возможно ли сохранение органа? Лечащий врач 2000;(8):63-64.
17. Матвеев В.Б., Халафьян Э.А., Волкова М.И. и соавт. Органосохраняющее лечение рака полового члена. Урология и нефрология 2004;(8):26-30.
18. Миленин К.Н. Сочетанная лучевая терапия при органосохраняющем лечении рака полового члена: автореф. … дисс. канд. мед. наук. М., 2006, 22 с.
19. Hoskin PJ, Rembowska A. Dosimetry rules for brachytherapy using high dose rate remote afterloading implants. Clin Oncol (R Coll Radiol) 1998;10(4):226-230









Комментарии