Сероухов А.Ю., Пронкин Е.А., Глинин К.И., Мамаев И.Э.
Отделение урологии ГБУЗ «Городская клиническая больница имени В.М.Буянова Департамента здравоохранения города Москвы» 115516, г. Москва, ул.Бакинская, 26 Эл.почта: dr.seroukhov@gmail.com
Введение. Инфравезикальная обструкция, обусловленная доброкачественной гиперплазией предстательной железы (ДГПЖ), остается одной из наиболее распространенных проблем у мужчин старшей возрастной группы. По данным эпидемиологических исследований доля клинических проявлений, ассоциированных с ДГПЖ, увеличивается с возрастом с 14% у мужчин 40-50 лет до 8090% к 80 годам [1,2]. С внедрением в клиническую практику медикаментозных методов терапии симптомов нижних мочевых путей (СНМП), обусловленных ДГПЖ, увеличилась доля пациентов с большими объемами предстательной железы (более 80-100 см3 ), которым требуется хирургическое лечение.
Проведение открытой аденомэктомии в лечении пациентов с ДГПЖ больших размеров до сих пор является стандартом, рекомендованным Европейской Ассоциацией урологов и выполняется довольно часто. К недостаткам метода относится значительная хирургическая травма и высокий процент периоперационных осложнений. Лапароскопическая модификация аденомэктомии представляется достойной малоинвазивной альтернативой открытого хирургического лечения ДГПЖ.
Брюшинная лапароскопическая аденомэктомия. Техника операции. При чрезбрюшинной (ЧБ) методике пациент находится в положении на спине с опущенным головным концом на 5-7 градусов. После обработки операционного поля, мочевой пузырь дренируется уретральным катетером Фолей 18 Сн с баллоном 20 мл. Троакары устанавливаются стандартно согласно схеме (схемы 1, 2).
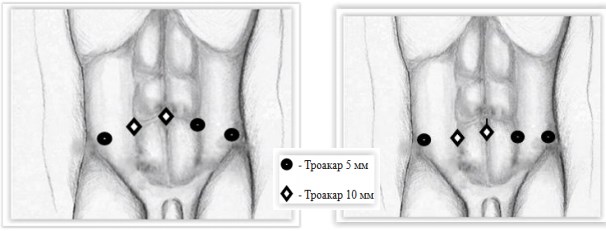
Схема 1. Положение портов при чрезбрюшинной аденомэктомии.
Схема 2. Положение портов при внебрюшинной аденомэктомии
После вскрытия брюшины, передняя стенка мочевого пузыря отделяется от брюшной полости. При помощи лапароскопических инструментов вскрывается позадилонное пространство. Обнажается передняя поверхность простаты. Поверхностный дорсальный венозный комплекс прошивается нитью полисорб 3/0 (выполнено у первых трех пациентов, в последующем не выполняли). Передняя поверхность капсулы простаты вскрывается поперечным разрезом до 6 см на 35 мм дистальнее границы шейки мочевого пузыря и предстательной железы при помощи ножниц или крючка с использованием спрей-коагуляции (Рис. 1). При этом ассистентом осуществляется тракции мочевого пузыря в краниальном направлении. После выделения передней комиссуры и передних отделов боковых долей, визуализируется вентральная полуокружность шейки мочевого пузыря на границе с простатической уретрой. Шейка мочевого пузыря вскрывается в поперечном направлении, выделяется средняя доля (при ее наличии). Ассистент осуществляет тракцию средней доли в направлении лона, в то время как хирург, после рассечения слизистой, начинает формировать слой между аденоматозными узлами и капсулой по задней полуокружности. Дальнейшая энуклеация осуществляется в слою посредством тракции за узлы (Рис.2). На всех этапах активно используется биполярная коагуляция. Основными зонами, требующими внимания, являются участки капсулы на 5-ти и 7-ми часах условного циферблата.
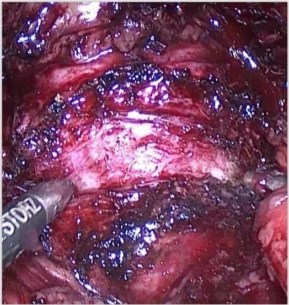
Рис. 1. Поперечный разрез капсулы простаты
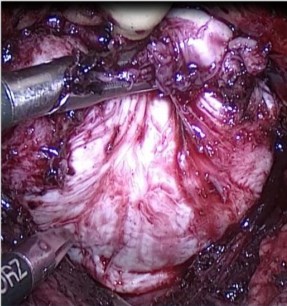
Рис. 2. Энуклеация узлов
После удаления узлов аденомы, производится коагуляция сосудов ложа, начиная с передней полуокружности. При этом оставляется интактной область мембранозной уретры с целью предупреждения возможного развития рубцовых изменений. Как правило, кровоточивость в данной зоне носит слабо выраженный характер. В мочевой пузырь проводится 3-х ходовый уретральный катетер Фолей 20 Сh, баллон раздувается на 30 мл (Рис. 3). Передняя поверхность капсулы простаты ушивается непрерывным швом полисорб 2/0 (Рис. 4).
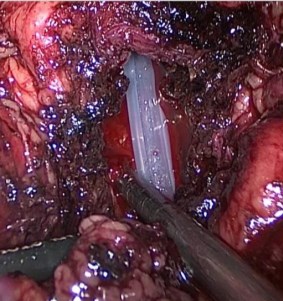
Рис. 3. Ложе с проведенным уретральным катетером
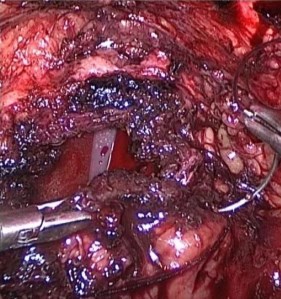
Рис. 4. Ушивание капсулы
Производится проверка шва на герметичность путем наполнения мочевого пузыря 150 мл физиологического раствора. Через контраппертуру устанавливается силиконовый дренаж в ретциево пространство. Брюшина восстанавливается непрерывным швом полисорб 3/0. Узлы аденомы погружаются в мешокэкстрактор. Троакары извлекаются. Мешок-экстрактор с узлами аденомы извлекается из брюшной полости через продленный разрез от 10 мм троакара по правой среднеключичной линии. Раны послойно ушиваются. Налаживается промывная система.
При внебрюшинной (ВБ) методике положение пациента на операционном столе аналогично, как и при чрезбрюшинном доступе. Мочевой пузырь дренируется уретральным катетером Фолей 18Сн с баллоном 20 мл. По средней линии, ниже пупка на 1 см, выполняется разрез кожи длиной около 2-х см. Апоневроз вскрывается. Брюшина в каудальном направлении тупо отделяется от передней брюшной стенки при помощи пальца, введенного через разрез. В направлении предпузырного пространства вводится баллонный spacemaker. Создается рабочее пространство посредством инсуфляции баллона. Spacemaker удаляется. В образовавшее пространство вводится баллонный троакар 10 мм. Баллон раздувается на 30 мл. Выполняется инсуфляция в предпузырное пространство 2 л углекислого газа. Расстановка троакаров осуществляется согласно схеме (схема 2). Последующий ход операции аналогичен предыдущей методике.
Узлы аденомы погружаются в мешок-экстрактор. Троакары извлекаются. Мешок удаляется из брюшной полости путем продления разреза от 10 мм троакара по средней линии. Раны послойно ушиваются. Налаживается промывная система.
Результаты. Ни в одном из случаев не потребовалось конверсии. Среднее время операции составило 183±48 мин. При этом, внебрюшинный тип операции оказался по времени значительно короче чрезбрюшинного (157±58 мин против 215±32 мин), что связано с значительными потерями времени на ушивание дефекта брюшины. Интраоперационная кровопотеря составляла в среднем 328±125 мл, статистически не различаясь от методики операции.
Ранние осложнения выявлены у 4 пациентов (25,0%). У одного развилась макрогематурия, купированная дополнительным раздуванием баллона катетера с созданием натяжения. Возникшая в результате кровотечения анемия скоррегирована трансфузией 2-х доз эритроцитарной массы и 2-х доз плазмы. У другого пациента 78 лет с сопутствующей дисциркуляторной энцефалопатией, произошла декомпенсация органического заболевания головного мозга с когнитивными нарушениями. Нормализация по психическому статусу достигнута к 4-му дню послеоперационного периода.
Серьезные осложнения выявлены ещѐ у 2 пациентов. У третьего пациента на 4-е сутки возникла тромбоэмболия мелких ветвей легочной артерии. И у четвертого на 5 сутки – динамическая кишечная непроходимость, связанная с перекручиванием брыжейки тонкой кишки через петлю подвздошной кишки. На фоне проведенной консервативной терапии в обоих случаях отмеченные осложнения разрешены, оба пациента выписаны из стационара в удовлетворительном состоянии.
Отключение промывной системы и активизацию больных производили на 1-е сутки. Восстановление кишечной деятельности отмечалось в среднем на 2,67±0,9 день, и происходило быстрее в группе у пациентов с внебрюшинным доступом (2,13±0,76 против ВБ, 3,29±1,1). Удаление страхового дренажа производилось после полного прекращения поступления, отделяемого и составило в среднем 3,81±2,95 дня (3,44±2,25 при ВБ, 4,29±3,99 при ЧБ). Уретральный катетер удаляли на 7,71±3,63 день (6,43±3,41 при ВБ, 9±3,61 при ЧБ).
Все пациенты выписаны в удовлетворительном состоянии из стационара с восстановленным самостоятельным мочеиспусканием.
Обсуждение. На протяжении многих десятилетий основным методом хирургического лечения пациентов с ДГПЖ больших размеров оставалась открытая аденомэктомия чреспузырным или чрескапсулярным методом. Наряду с высокой эффективностью данной операции, существенным недостатком является значительная хирургическая травма, высокий процент послеоперационных осложнений и, как следствие, удлинение сроков стационарного лечения пациента. В последнее время многообещающие результаты показывают методы хирургического лечения с использованием лазеров. Среди них в качестве способа оперативного лечения пациентов с ДГПЖ больших размеров выделяется трансуретральная энуклеация аденомы простаты с использованием гольмиевого лазера (HoLEP). Эффективность данной методики сравнима с открытыми вариантами аденомэктомии, но при этом сохраняются принципы малоинвазивности, позволяющие существенно сократить процент послеоперационных осложнений и сроки стационарной и амбулаторной реабилитации пациентов. К недостаткам HoLEP можно отнести высокую стоимость оборудования, длительную кривую обучения [3-6] и отсутствие гистологического материала ввиду использования морцеллятора. Последнее имеет высокую значимость по причине большого процента инцидентального выявления рака предстательной железы при операциях по поводу ДГПЖ (5,2-7,4%, а по некоторым данным и до 19%) [7-8].
В мировой хирургической практике получили широкое распространение лапароскопические техники оперативных вмешательств, обладающие меньшей инвазивностью по сравнению с открытыми. В лечении ДГПЖ применяют так называемую малоинвазивную аденомэктомию. По своей сути это позадилонная или чреспузырная аденомэктомия с применением обычных или робот-ассистированных лапароскопических методик. Рядом работ доказана эффективность лапароскопической аденомэктомии, сопоставимая с открытой, с меньшим процентом периоперационных осложнений [9].
Заключение. Лапароскопическая аденомэктомия является легко воспроизводимым методом хирургического лечения. Может быть применима в рутинной урологической практике у пациентов с большими объемами предстательной железы с целью минимизации операционной травмы и сокращения сроков реабилитации.
Литература
1. Parsons JK. Benign Prostatic Hyperplasia and Male Lower Urinary Tract Symptoms: Epidemiology and Risk Factors .Curr Bladder Dysfunct Rep (2010) 5:212–218.
2. Garraway WM, Collins GN, Lee RJ. High prevalence of benign prostatic hypertrophy in the community.Lancet. 1991;338:469–471.
3. Seki N, Mochida O, Kinukawa N, Sagiyama K, Naito S. Holmium laser enucleation for prostatic adenoma: analysis of learning curve over the course of 70 consecutive cases. J Urol 2003;170:1847–50.
4. Elzayat EA and Elhilali MM (2007) Minimally invasive treatment of benign prostatic hyperplasia: laser. AUA Update Series 2007 26: lesson 27
5. ElHakim A and Elhilali MM (2002) Holmium laser enucleation of the prostate can be taught: the first learning experience. BJU Int 90: 863869
6. Shah HN et al. (2007) Prospective evaluation of the learning curve for holmium laser enucleation of the prostate. J Urol 177: 14681474
7. Jones JS et al. (2008) Probability of finding T1a and T1b (incidental) prostate cancer during TURP has decreased in the PSA era. Prostate Cancer Prostatic Dis doi:10.1038/pcan.2008.14]
8. Merrill RM and Wiggins CL (2002) Incidental detection of population based prostate cancer incidence rates through transurethral resection of the prostate. Urol Oncol 7: 213219
9. Asimakopoulos AD et al. The surgical treatment of a large prostatic adenoma: the laparoscopic approach-a systematic review. J Endourol. 2012 Aug;26(8):960-7.
Статья опубликована в журнале "Вестник урологии" №1 2016, стр. 24-32









Комментарии