Павлов А.Ю. – д.м.н., профессор, заместитель директора ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID 206370 Дзидзария А.Г. – к.м.н., заведующий отделением урологии с койками онкологии и кабинетами ударно-волновой литотрипсии ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID 835856 Кравцов И.Б. – к.м.н., врач-уролог отделения урологии с койками онкологии и кабинетами ударно-волновой литотрипсии ФГБУ ««Российский научный центр рентгенорадиологии» Минздрава России, Москва, Россия; РИНЦ AuthorID 611931 Цыбульский А.Д. – к.м.н. старший научный сотрудник отделения онкоурологии ФГБУ «Российский научный центр рентгенорадиологии» МЗ РФ Москва, Россия; РИНЦ AuthorID 723876 Фастовец С.В. – к.м.н., врач-уролог отделения урологии с койками онкологии и кабинетами ударно-волновой литотрипсии ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России; РИНЦ AuthorID 758750
ВВЕДЕНИЕ
Частота односторонней дистопии почки по данным аутопсий, колеблется от 1:660 до 1:1000, в среднем составляет 1 случай на 800 новорожденных, чаще встречается поясничная дистопия и преимущественно у мальчиков. Чаще отмечается дистопия левой почки, чем правой. Двусторонняя дистопия встречается редко. Частота перекрестной дистопии почки составляет от 1:10 000 до 1:12 000 новорожденных [1-3].
В структуре онкологической заболеваемости населения РФ рак мочевого пузыря (РМП) занимает 9-е место среди мужчин и 17-е место среди женщин. Рак мочевого пузыря встречается у мужчин чаще, чем у женщин (соотношение 3:1). Прирост заболеваемости населения с 2007 по 2017 годы составил 24% [4-6]. По всему миру стандартизированная по возрасту частота заболевания составляет 9,0 случаев на 100 000 для мужчин и 2,2 случая – на 100 000 для женщин. В Европейском союзе стандартизированные по возрасту показатели встречаемости составляют 19,1 случая на 100 000 для мужчин и 4,0 случая на 100 000 для женщин [7-11]. Приблизительно у 75% пациентов РМП ограниченно слизистой оболочкой (стадия Та, CIS) или подслизистой оболочкой (стадия Т1). У более молодых пациентов (моложе 40 лет) этот процент еще выше. Пациенты с Ta, T1 и CIS имеют высокую распространенность вследствие длительной выживаемости во многих случаях и более низкого риска специфической смертности от рака по сравнению с опухолями T2-4 [12-15].
При анализе литературных данных, мы не нашли никаких рекомендаций по методам деривации мочи у пациентов с диагностированным раком мочевого пузыря при тазовой дистопии почек.
МАТЕРИАЛЫ И МЕТОДЫ
Представлен клинический случай
Пациент М., 1945 года рождения, поступил в отделение онкоурологии ФГБУ РНЦРР в сентябре 2018 года с жалобами на гематурию, учащенное мочеиспускание, дискомфорт в проекции мочевого пузыря при мочеиспускании.
Анамнез
В феврале 2018 года отмечен первый эпизод макрогематурии, за медицинской помощью не обращался. В августе 2018 года был повторный эпизод макрогематурии.
Инструментальная и лабораторная диагностика
По данным ультразвукового исследования (УЗИ) мочевого пузыря: стенки мочевого пузыря ровные, четкие, толщиной до 6 мм, устья мочеточников не расширены, в просвете множественные древовидные включения повышенной эхогенности с неровными четкими контурами без кровотока: на передней стенке 55х19х20 мм, на задней стенке 67х21х40 мм, 20х19 мм, 18х17 мм, на нижней стенке 15х13 мм, 12х10 мм.
По данным магнитно-резонансной томографии (МРТ) органов малого таза: мочевой пузырь слабого наполнения, вдоль его стенок отмечаются опухолевые массы с нечеткими и бугристыми контурами, распространяющиеся в просвет, наиболее крупные из которых исходят из верхней стенки размерами до 4,0х1,9 см и из нижней стенки размерами до 4,4х2,1 см (сагитальная проекция). Мышечный слой мочевого пузыря на уровне опухолевых масс с повышенным МР сигналом (инвазия). Окружающая паравезикальная клетчатка несколько тяжиста. Лимфатические узлы малого таза увеличены до 10 мм. Почки расположены в малом тазу, левая – на уровне L3-L4 и S2-S3, правая – на уровне L5-S1 и S2-S3. Данных о наличие очаговых изменений в костях, свободной жидкости на уровне исследования не получено.
В отделении в рамках рутинной практики выполнено цитологическое исследование мочи: в материале обнаружены клетки уротелиального рака.
По данным мультиспиральной компьютерной томографии (МСКТ) обе почки в малом тазу: левая на уровне L5-S2, правая – S2-S4, ротированы медиально. Размеры почек не нарушены, паренхима без патологии, чашечно-лоханочная системе не расширена (рис. 1), функция почек не нарушена, обе почечные артерии отходят от бифуркации аорты, почечные вены впадают в общую левую подвздошную вену (рис. 2). В просвете мочевого пузыря по всем стенкам экзофитно множество образований по типу цветной капусты с активным диффузным накоплением контрастного вещества, с выходом за пределы мышечного слоя (рис. 3-4). Лимфаденопатии в малом тазу и забрюшинно не выявлено.
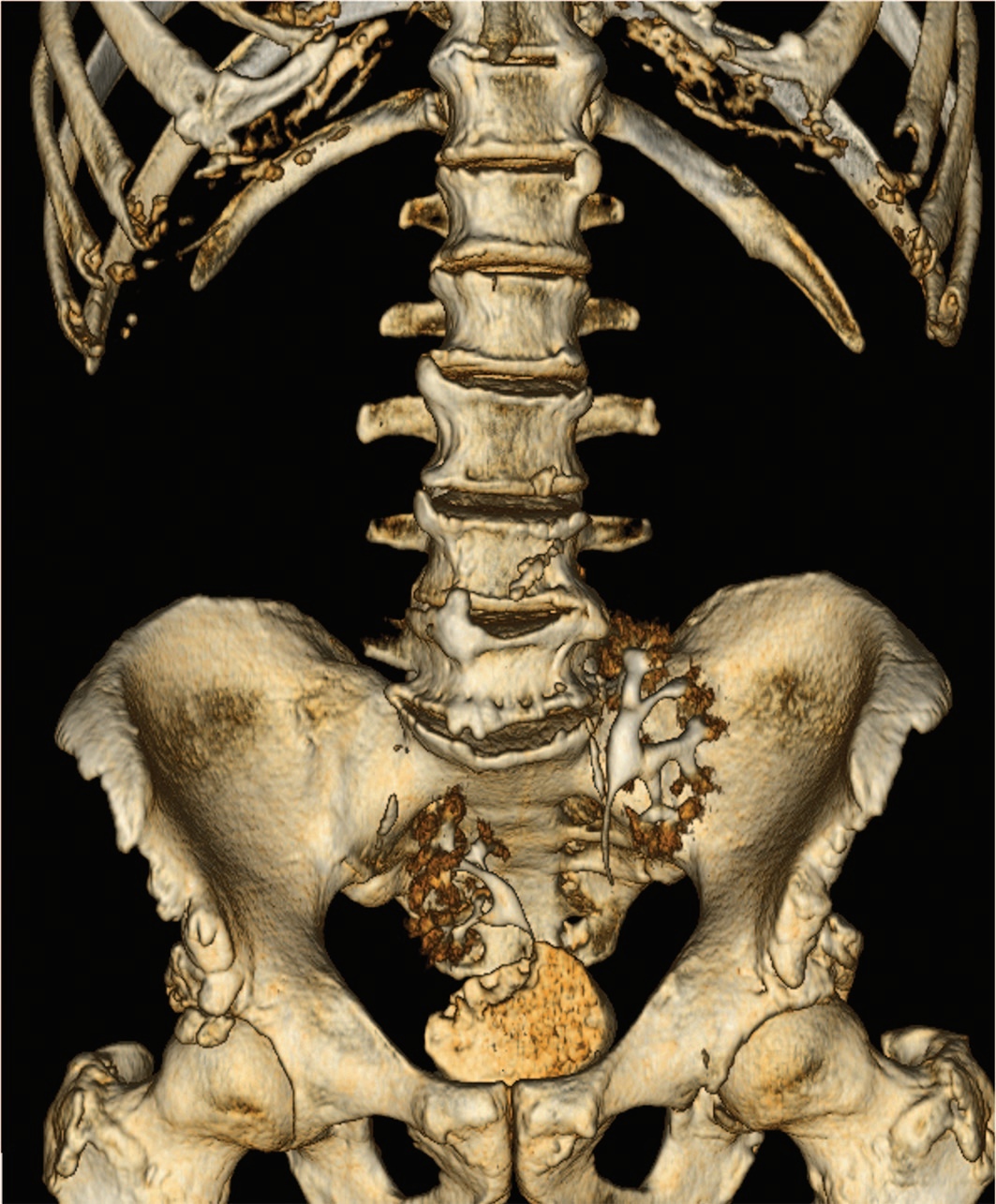
Рис. 1. МСКТ малого таза. ЧЛС не расширена, мочеточники укорочены.
Fig. 1. MSCT of the small pelvis.The calyx-pelvic system is not expanded, the ureters are shortened
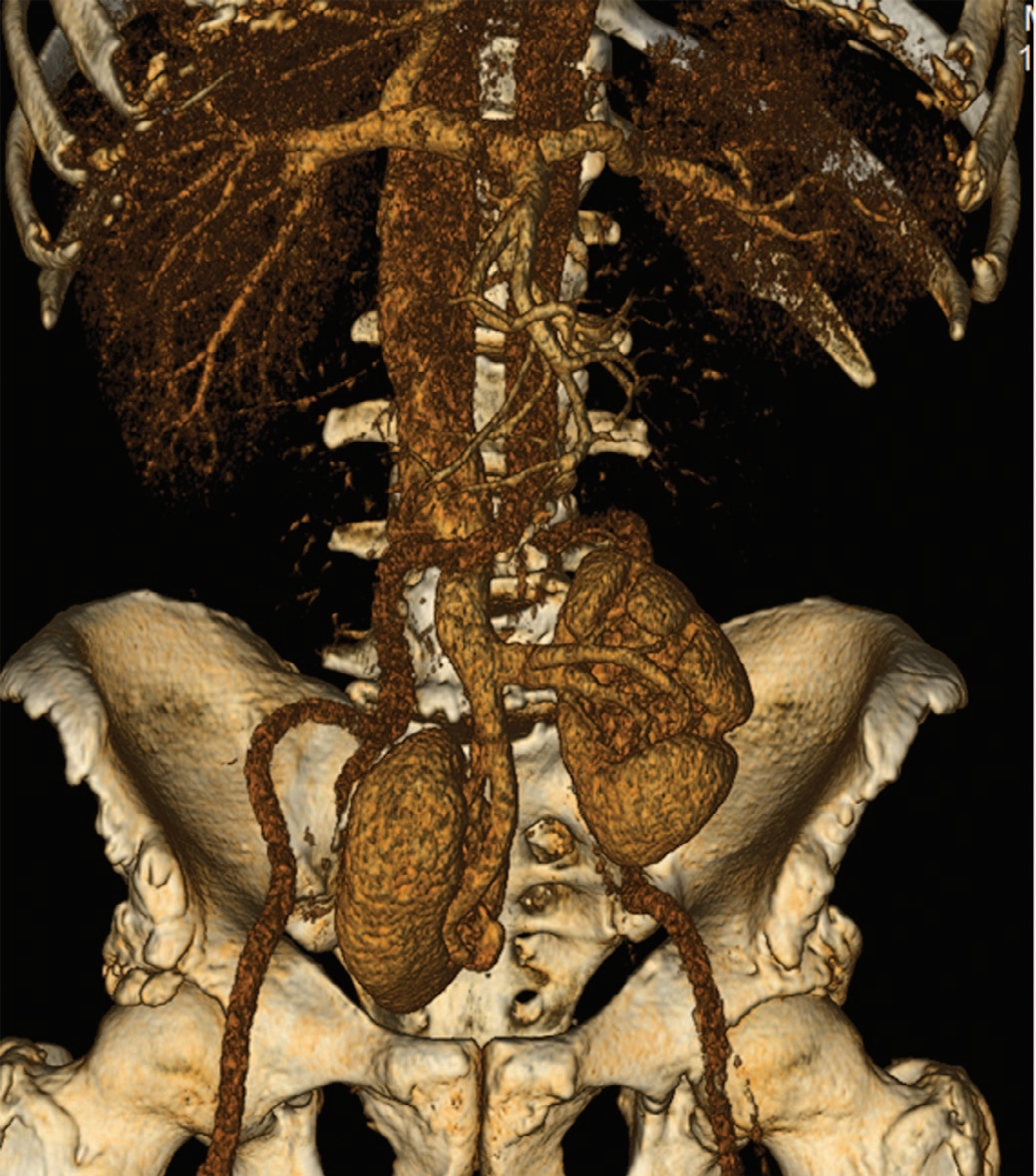
Рис. 2. МСКТ мочевого пузыря. Почечные артерии отходят от бифуркации аорты, почечные вены впадают в общую левую подвздошную вену
Fig. 2. MSCT of the bladder. Renal arteries extend from the bifurcation of the aorta, the renal veins empty into the left common iliac vein
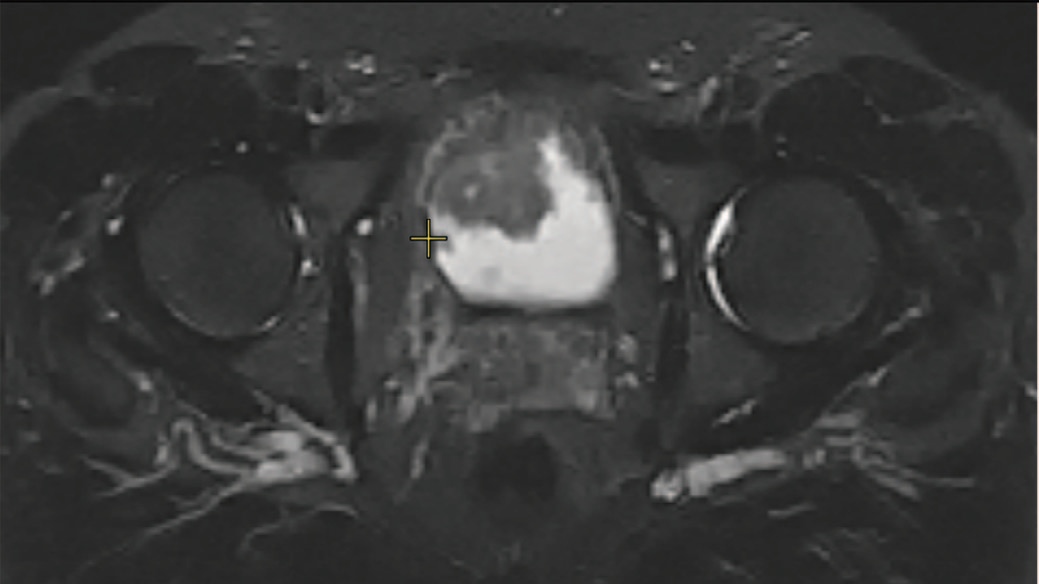
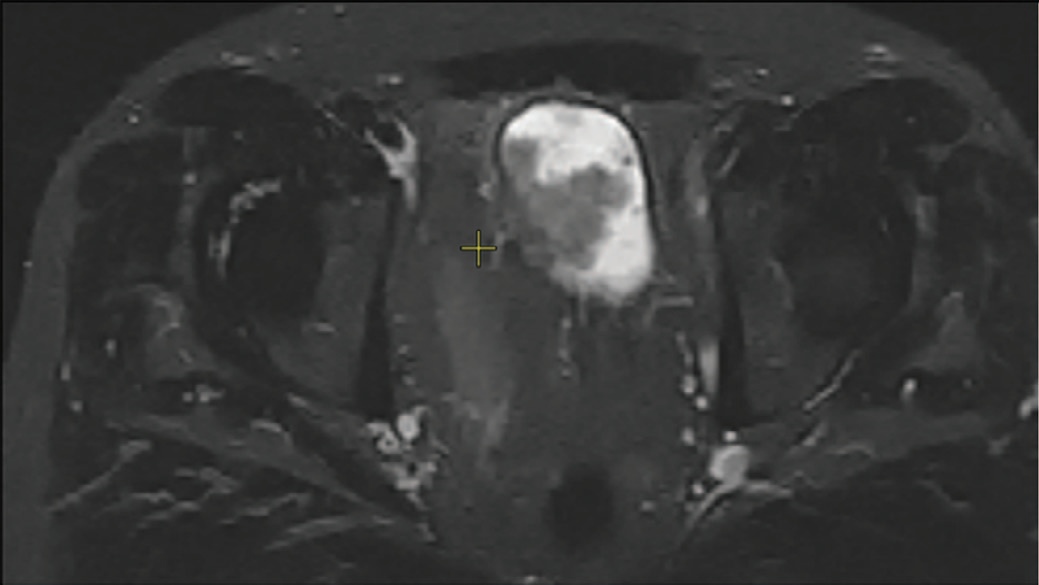
Рис. 3, 4. МСКТ мочевого пузыря. Множественные экзофитные образования мочевого пузыря с распространением до паравезикальной клетчатки.
Fig. 3, 4. MSCT of the bladder. Multiple exophytic formations of the bladder with spread to paravesical
Цистоскопия: в полости мочевого пузыря визуализируется нежноворсинчатое образование, легко кровоточащее при соприкосновении с инструментом, на передней (до 6 см), задней (до 7 см) стенках и в зоне треугольника Льето (до 2 см). Устья мочеточников визуализировать не удалось. Выполнена щипковая биопсия (по данным планового гистологического исследования: высокодифференцированный уротелиальный (переходноклеточный) рак).
Основываясь на данных МРТ, МСКТ, результатах цитологического исследования мочи, пациенту установлен диагноз: рак мочевого пузыря cT3bN0M0.
По данным ирригоскопии при обзорном исследовании органов брюшной полости рентгенологических признаков свободного газа в брюшной полости или кишечной непроходимости не определяется. При одномоментном двойном контрастировании заполнены все отделы толстой кишки и червеобразный отросток. Сигмовидная кишка расположена не типично – проксимальный отдел отклонен кверху, дистальный правее и кпереди, формируя окошко между петлями – вероятно, местоположение дистопированной почки. Контуры толстой кишки ровные и четкие, стенки эластичные, дополнительных теней на фоне воздуха не выявлено (рис. 5).
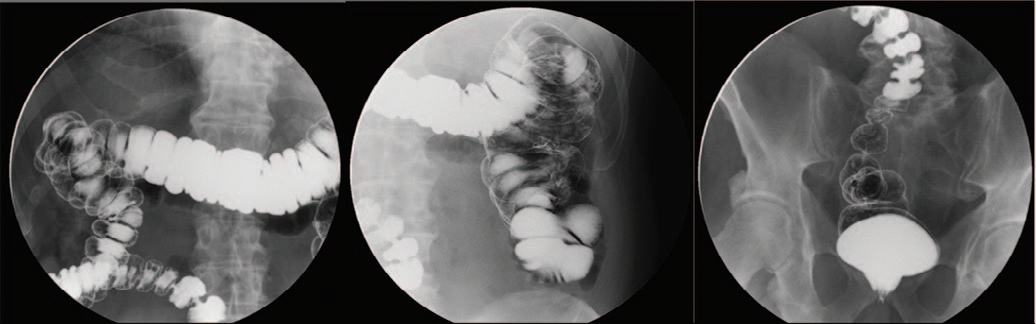
Рис. 5. Ирригоскопия органов брюшной полости.
Fig. 5. Irrigoscopy of the abdominal organs.
С целью оценки функционального состояния почечной паренхимы выполнена статическая нефросцинтиграфия: распределение: слева – 100%, справа –81%. Удельное распределение: слева – 76%, справа – 100%. Индекс интегрального захвата (две проекции с коррекцией на фон и введенную «активность»): общий: 49 (норма – 92-140), слева – 34 (норма – 46-70), справа – 15 (рис. 6).
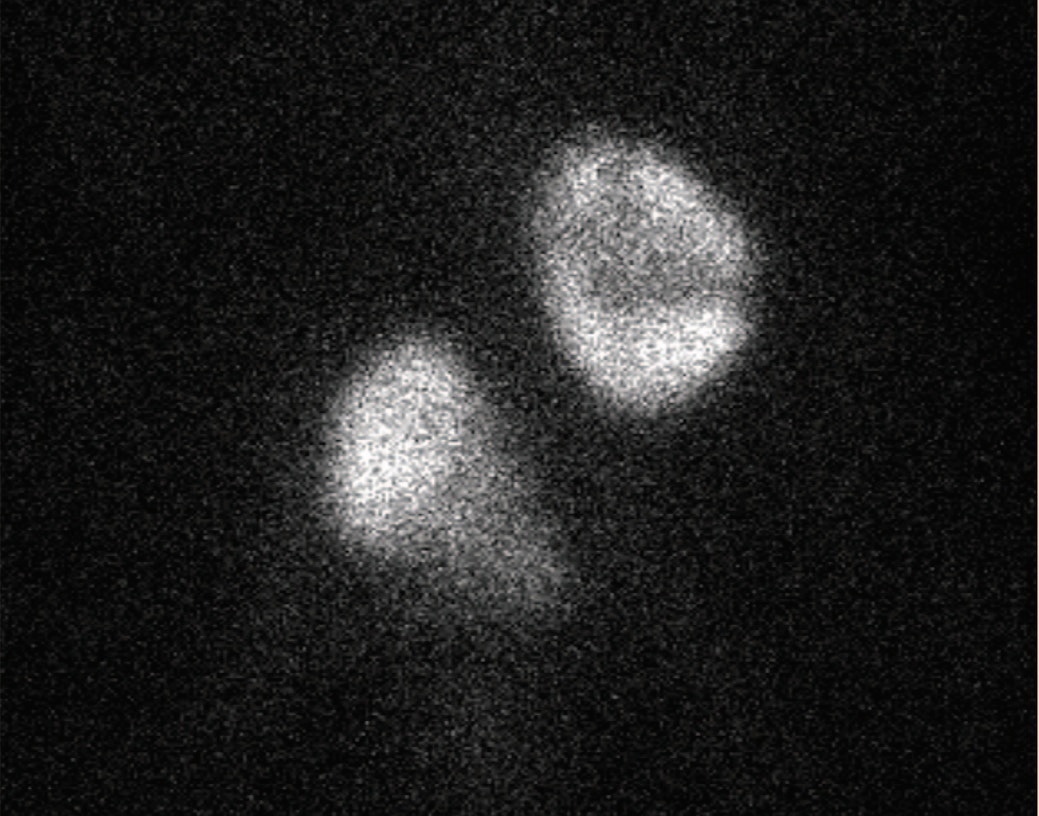
Рис. 6. Статическая нефросцинтиграфия
Fig. 6. Static nephroscintigraphy
Заключение. Дистопия обеих почек. Очаговые изменения левой почки средней степени выраженности на фоне диффузных изменений почечной паренхимы. Диффузные изменения паренхимы правой почки. Общий объем функционирующей паренхимы снижен.
Лечение
Результаты обследования пациента были обсуждены на окологическом консилиуме, данных за отдаленное метастазирование по данным проведенного комплексного обследования не было выявлено. С учетом подтвержденного диагноза рака мочевого пузыря сT3bN0M0 сопряженного с сопутствующей аномалией почек и мочевых путей (тазовой дистопии почек с укорочением мочеточников) было принято решение о выполнении лапароскопической радикальной цистпростатвезикулэктомии с попыткой деривации мочи (формирование уретероилеостомы) по Брикеру.
Применялся комбинированный эндотрахеальный наркоз и перидуральная анестезия.
Ход операции
Положение пациента на спине. В стерильных условиях выполнена катетеризация мочевого пузыря катетером Фолея 16 Сh. Выполнена установка лапароскопического одноразового порта 12 Сh по срединной линии ниже пупка на 2 см. Создание карбоксиперитонеума. Лапароскопия. Повреждения органов брюшной полости нет. В полости малого таза обнаружены левая и правая почки тесно прилежащие к мочевому пузырю. В левой подвздошной области установлен дополнительный троакар 12 Ch, в правой подвздошной области установлены дополнительные троакары 5 и 12 Ch. Поочередно слева и справа выполнена лимфаденэктомия от зоны бифуркации подвздошных сосудов до запирательной ямки. Запирательные нервы обнажены с обеих сторон. Тупым/ острым путем с выраженными техническими трудностями в связи с аномальным расположением почек произведено выделение единым блоком мочевого пузыря с предстательной железой с клипированием и пересечением кровоснабжающих сосудов. Выделены мочеточники с обеих сторон, максимально близко к мочевому пузырю наложены клипсы. Мочевой пузырь в комплексе с предстательной железой отсечен на уровне бульбозной части уретры. Мочеточники отсечены. Длина правого мочеточника составила 20 мм, длинна левого мочеточника – 45 мм. Правый мочеточник нитевидный, диспластичный. Выполнена экстракция удаленных тканей через мешок-экстрактор. Произведена мини-лапаротомия. Осуществлен доступ в брюшную полость. Выделена дистальная часть подвздошной кишки на протяжении 15 см на питающей сосудистой ножке. Выполнена резекция данного участка кишки. Мочеточники длиной около 10 см истончены, диспластичны. Учитывая короткую длину мочеточников и расположение почек принято решение о наложении анастомоза илеокондуита с лоханкой правой почки по типу конец-в-конец, уретероилеоанастомоз конец-в-бок слева (рис. 7).
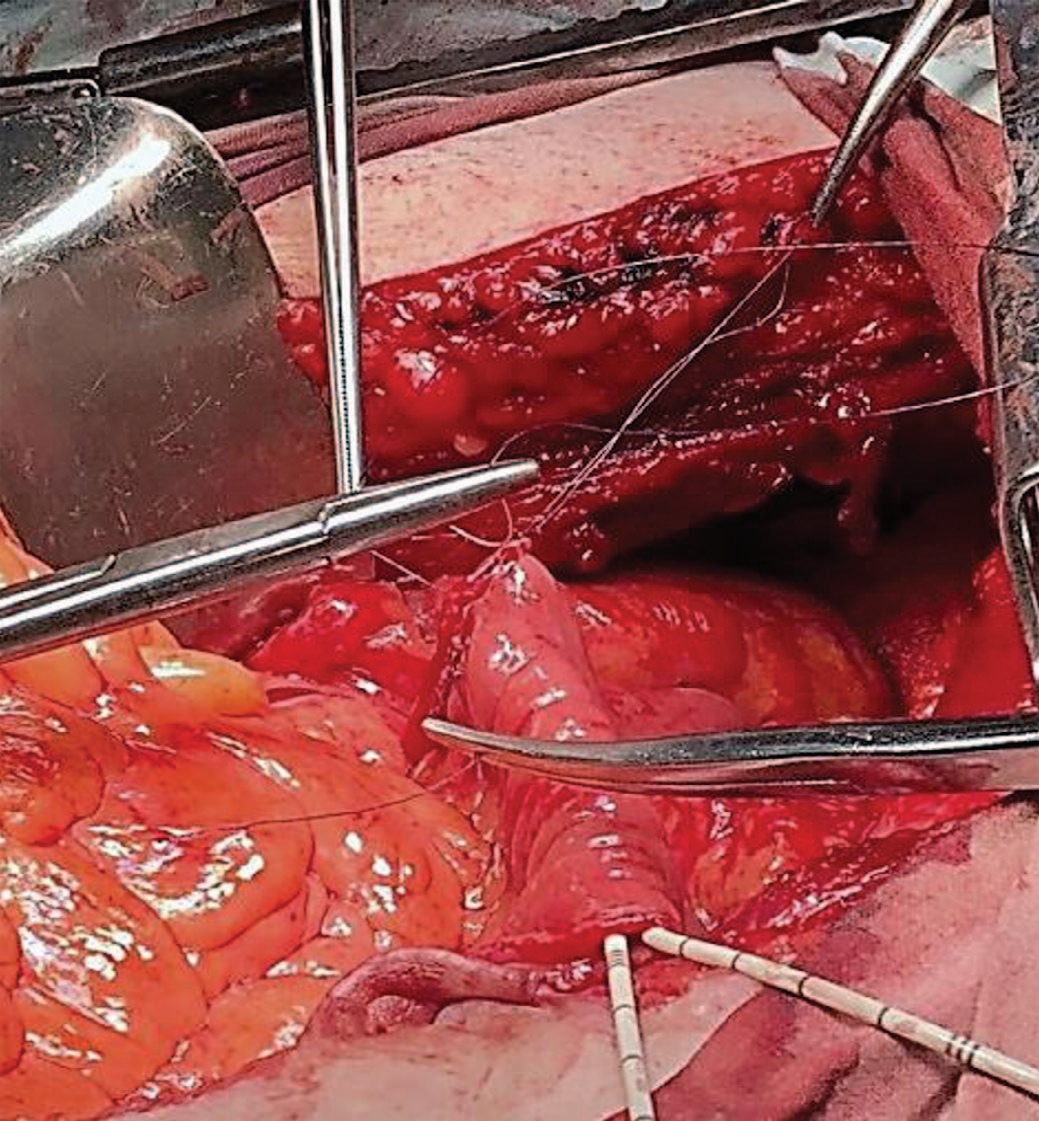
Рис. 7. Наложение анастомоза илеокондуит - лоханка справа.
Fig. 7. Imposition of the right ileoconduit – pelvis anastomosis.
Наложение анастомозов потребовало произвести максимальную мобилизацию правой почки (тупым/острым путем, учитывая подпаянную плотную клетчатку выполнена мобилизация правой почки с декапсуляцией среднего и нижнего сегмента. Осуществлен доступ к лоханке и сосудам правой почки. Лоханка правой почки после резекции диспластичного мочеточника на протяжении 20 мм анастомозирована с проксимальным концом кондуита. Левый мочеточник, резецированный до здоровых тканей, анастомозирован с илеокондуитом конец-вбок (рис. 8).
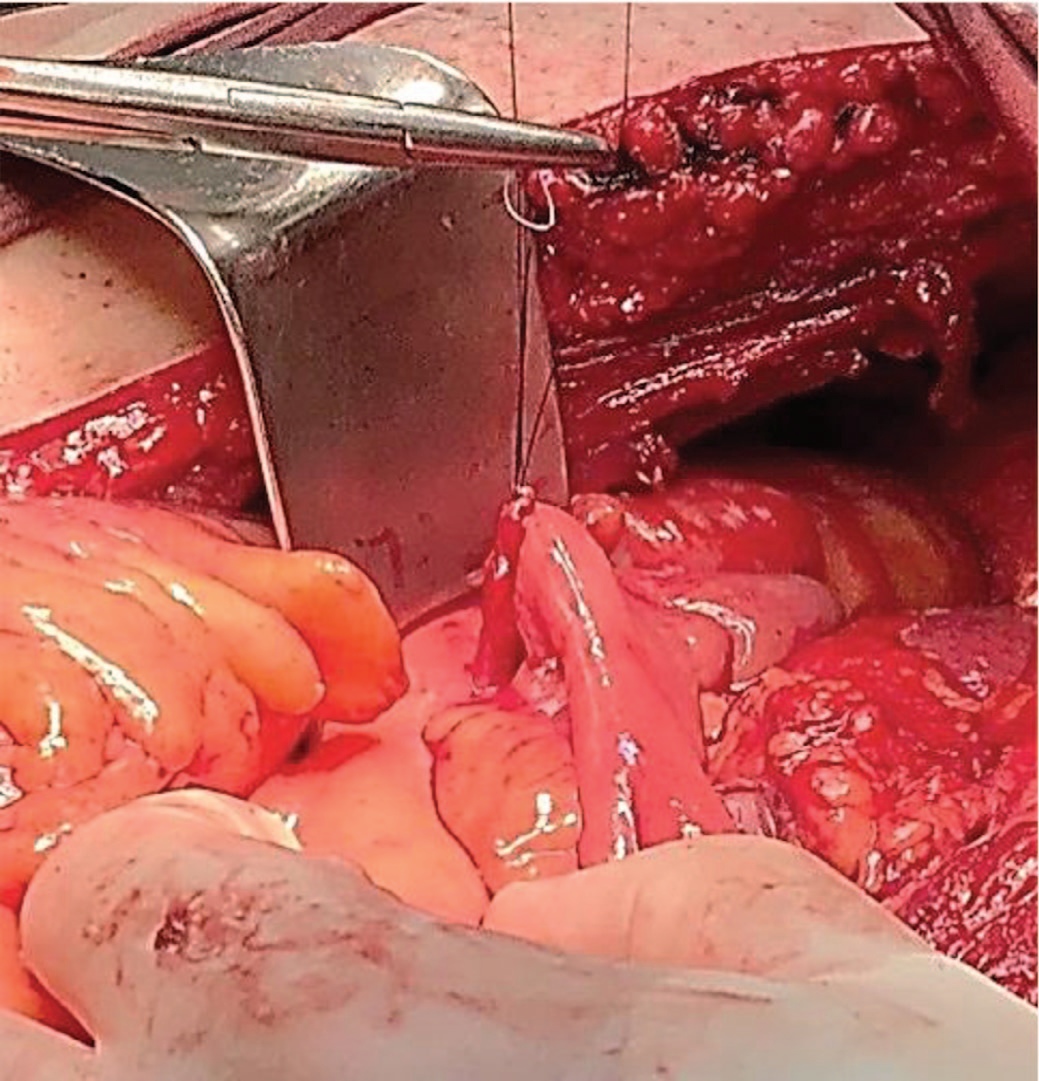
Рис. 8. Анастомоз левого мочеточника и кондуита конец-в-бок
Fig. 8. Anastomosis of the left ureter and conduit end to side
Мочеточники интубированы катетерами правый 7 Сh, левый 7 Сh. Гемостаз. Целостность кишечника восстановлена наложением анастомоза бок-в-бок аппаратом endoGIA. Анастомоз герметичен. Дистальный конец кондуита выведен на кожу по среднеключичной линии в левой подвздошной области c формированием выводящей стомы. Малый таз дренирован через уретру уретральным катетером Фолея 18 Ch, баллон катетера раздут на 40 мл. Дренирование брюшной полости: уретральный катетер поведен через уретру (баллон раздут до 20 мл), слева и справа в малый таз, а также дополнительно под кондуит установлены силиконовые дренажи. Послойное ушивание раны. Узловые швы на кожу. Йод. Ассептическая наклейка. Повязка с Катеджель на кондуит. Гемостаз. Сухо. Порты удалены. Троакарные ходы ушиты. Йод. Асептическая наклейка. Кровопотеря 1100 мл. Продолжительность оперативного вмешательства 7 ч. 55 мин. Осложнения не выявлены.
Патоморфологическое заключение
Высокодифференцированный уротелиальный (переходноклеточный) рак передней, правой боковой стенки и шейки мочевого пузыря. Опухоль врастает в слизистую, подслизистую, 2/3 мышечной оболочки мочевого пузыря. Не обнаружено врастания опухоли в паравезикальную жировую клетчатку. Не обнаружено врастания опухоли в устья мочеточников, простатическую часть уретры, предстательную железу, семенные пузырьки. В крае резекции простатической части уретры (верхушка предстательной железы) опухолевые клетки не обнаружены. Доброкачественная узловая железистая гиперплазия предстательной железы. Семенные пузырьки обычного гистологического строения. В запирательном лимфоузле очаг роста уротелиального рака мочевого пузыря диаметром 0,1 см.
По результатам гистологического исследования выставлен окончательный клинический диагноз: рТ2bN1М0G1R-.
Послеоперационный период
Отмечено неосложненное течение. На 4 сутки послеоперационного периода были удалены страховые дренажные трубки. На 14 сутки удалены интубирующие мочеточниковые дренажные трубки. Лабораторные показатели общего анализа крови на 14-е сутки после операции: гемоглобин 117,0 г/л; эритроциты 4,3х1012/л; лейкоциты 11,3х109/л; тромбоциты абс. 400,0х109/л; биохимический анализ крови: мочевина 5,9 ммоль/л; креатинин 101,1 мкмоль/л; ультразвуковое исследование почек на 15-е сутки после операции: правая почка: тазовая дистопия. Контуры четкие, ровные. Размеры: 100х61 мм. Толщина паренхимы 18 мм, кортико-медуллярная дифференцировка сохранена. Чашечно-лоханочная система: лоханка не расширена. Отдельные чашечки не расширены. Мочеточник в проксимальном отделе не расширен. Левая почка: тазовая дистопия. Контуры ровные, четкие. Размеры: 97х57 мм. Толщина паренхимы: 18 мм, кортико-медуллярная дифференцировка сохранена. Чашечно-лоханочная система: лоханка –10 мм. Отдельные чашечки не расширены. Пациент консультирован клиническим радиологом и химиотерапевтом. Учитывая стадию заболевания, объем хирургического лечения, данные послеоперационной морфологии, рекомендовано провести 4 курса химиотерпаии (ХТ) по схеме Гемцитабин 1000 мг/м2 в 1, 8 дни + Цисплатин 75 мг/м2 в 1 день 21-дневного цикла. На 15 сутки начат 1 курс полихимиотерапии (ПХТ).
Пациент был выписан в удовлетворительном состоянии под наблюдение уролога, онколога, терапевта по месту жительства на дальнейшее амбулаторное продолжение предписанной системной ПХТ.
При контрольной однофотонной эмиссионной компьютерной томографии (ОФЭКТ) выполненной амбулаторно на 45-е сутки после операции: четко визуализируются пиелоилеоанастомоз справа и уретероилеоанастомоз слева. Оба анастомоза проходимы. ЧЛС обеих почек не расширена. Очагов патологического накопления контрастного препарата не выявлено (рис. 9, 10).
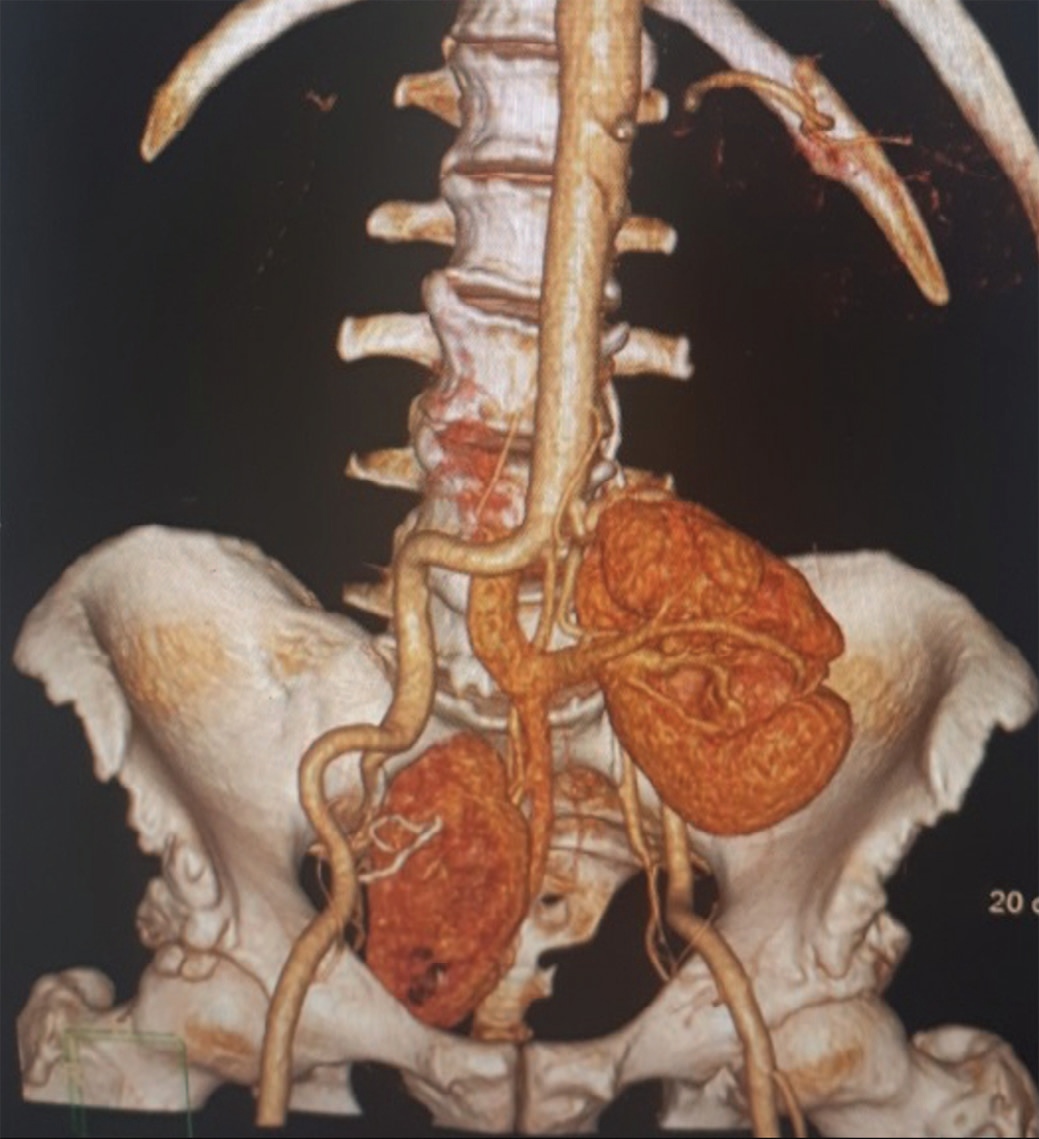
Рис. 9. ОФЭКТ. 3d реконструкция сосудов почек через 1,5 месяца.
Fig. 9. SFECT. 3d reconstruction of renal vessels in 1.5 months
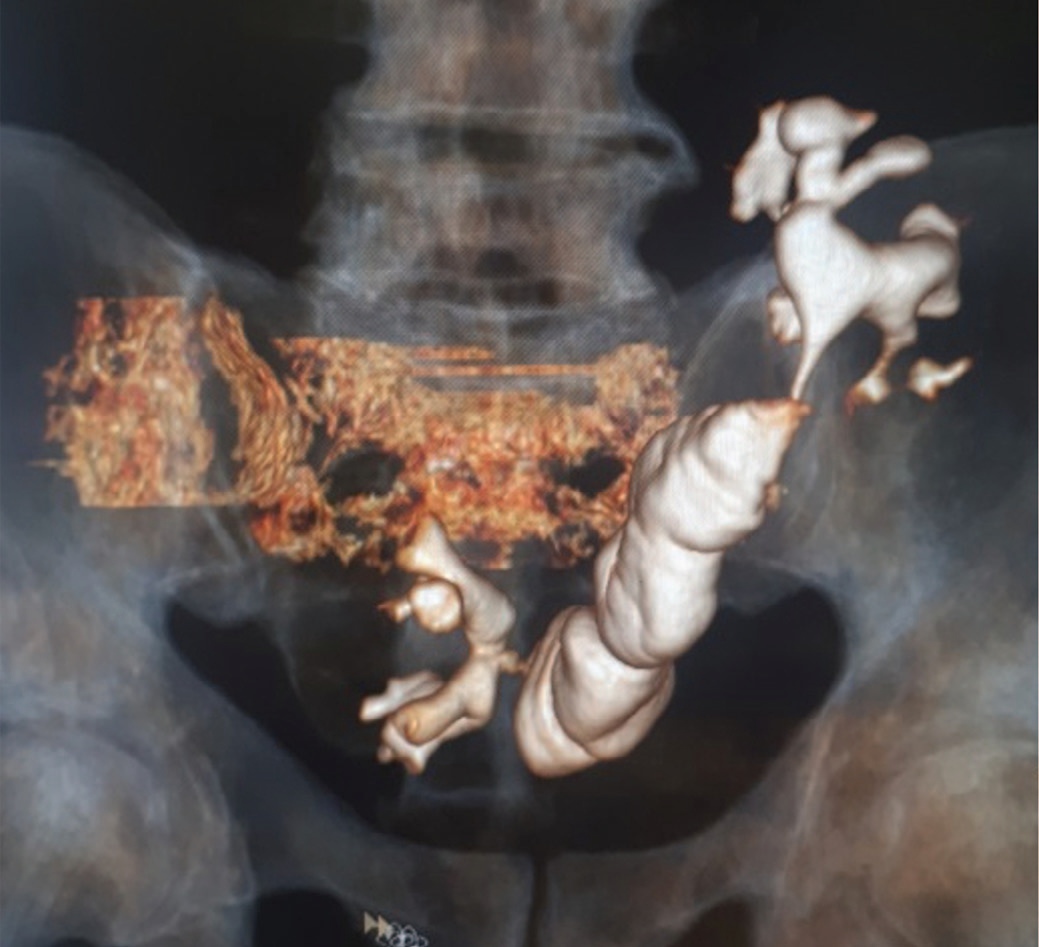
Рис. 10. 3d реконструкция илеокондуита.
Fig. 10. 3d reconstruction of the ileoconduit
Радикальная цистэктомия до настоящего времени остается стандартным методом лечения мышечно-инвазивного рака мочевого пузыря. После удаления мочевого пузыря остро встает вопрос о выборе метода деривации мочи. Удержание мочи является непременным условием высокого качества жизни больного. Формирование илеокондуита по Брикеру является одним из самых часто выполняемых методов деривации мочи после радикальной цистэктомии.
Врожденные аномалии расположения почек в большинстве случаев диагностируются еще в детском возрасте. Однако у данного пациента диагноз тазовая дистопия обеих почек оказался известным только в возрасте 78 лет. В течение жизни нарушений в функционировании почек и других симптомов, характерных для данной патологии пациент не отмечал.
ВЫВОДЫ
Метод отведения мочи определяется интраоперационно. У данного пациента состояние и длина правого мочеточника не позволила выполнить классический уретероилеоанастомоз (конец-в-конец), в связи с чем выполнен пиелоилеоанастомоз справа. Слева длина мочеточника позволила выполнить уретероилеоанастомоз конец-в-бок, но только при условии выведения илеокондуита на левую сторону.
Спустя 3 месяца после оперативного лечения осложнений не наблюдалось, по данным контрольных исследований оба анастомоза проходимы. Завершена запланированная адъювантная ПХТ. При контрольном обследовании данных за прогрессирование заболевания нет. Планируется контрольное обследование через 3 месяца.
ЛИТЕРАТУРА
- Исакова Ю.Ф. Детская хирургия национальное руководство. ГЭОТАР-Медиа, 2009. 1256 c. [Isakova Yu.F. Pediatric Surgery. National Guide. GEOTAR-Media 2009. 1256 p. (In Russian)]
- Bochner BH, Kattan MW, Vora KC. Postoperative nomogram predicting risk of recurrence after radical cystectomy for bladder cancer. J Clin Oncol 2006;24(24):3967–3972 https://doi.org/ 10.1200/JCO.2005.05.3884.
- Stein JP, Lieskovsky G, Cote R, S Groshen, A C Feng, S Boyd, et al. Radical cystectomy in the treatment of invasive bladder cancer: long-term results in 1054 patients. J Clin Oncol 2001;19(3):666–67. https://doi.org/10.1200/JCO.2001.19.3.666.
- Shabsigh A, Korets R, Vora KC, Brooks CM, Cronin AM, Savage C, et al. Defining early morbidity of radical cystectomy for patients with bladder cancer using standardized reporting methodology. Eur Urol 2009;55(1):164–176. https://doi.org/10.1016/j.eururo.2008.07.031.
- Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). [Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой]. М.; 2018, 250 c. [Malignant neoplasms in Russia in 2017 (morbidity and mortality). [Ed. A.D. Kaprin, V.V. Starinsky, G.V. Petrova]. M.; 2018, 250 p. (In Russian)]
- Compérat E, Larré S, Roupret M, Neuzillet Y, Pignot G, Quintens H, et al. Clinicopathological characteristics of urothelial bladder cancer in patients less than 40 years old. Virchows Arch 2015;466(5):589-94. https://doi.org/10.1007/s00428-015-1739-2.
- Halabi IE, Husseini ZE, Haibe Y, Charafeddine M, Mukherji D, Temraz S, et al. Cystectomy vs. bladder preservation after neoadjuvant chemotherapy in muscle-invasive bladder cancer: A tertiary medical center experience. Cancer Treat Res Commun 2020 Oct 10 10;25:100222. https://doi.org/10.1016/j.ctarc.2020.100222.
- Kadouri Y, Lachkar S, Dergamoun H, El Sayegh H, Benslimane L, Nouini Y. Management of the uncommon bladder cancers: a single-center experience over 10 years. Adv Urol 2020;2020:7563703. https://doi.org/10.1155/2020/7563703.
- Corongiu E, Grande P, Liberati E., Iacovelli R, Amini M, Mascioli P, et al. Clear cell carcinoma of the urinary bladder, a case report: surgical and oncological management. Arch Ital Urol Androl 2020 Oct 2;92(3). https://doi.org/10.4081/aiua.2020.3.218.
- Moschini M, Afferi L, Gandaglia G, D'Andrea D, Zamboni S, Di Bona C, at al. Prediction of the need for an extended lymphadenectomy at the time of radical cystectomy in patients with bladder cancer. Eur Urol Focus 2020 Oct 2;S2405-4569(20)30268-6. https://doi.org/10.1016/j.euf.2020.09.009.
- Black PC, Efstathiou J. Setting the stage for bladder preservation. Urol Oncol 2020 29: S1078-1439(20)30421-X. https://doi.org/10.1016/j.urolonc.2020.09.001.
- Nunzio C De, Cindolo L, Leonardo C, Antonelli A, Ceruti C, Franco G, et al. Analysis of radical cystectomy and urinary diversion complications with the Clavien classification system in an Italian real life cohort. Eur J Surg Oncol 2013;39(7):792-798. https://doi.org/10.1016/j.ejso.2013.03.008.
- Noon AP, Albertsen PC, Thomas F, Rosario DJ, Catto JWF. Competing mortality in patients diagnosed with bladder cancer: evidence of undertreatment in the elderly and female patients. Br J Cancer 2013;108(7):1534-1540. https://doi.org/10.1038/bjc.2013.106.
- Dyer T, Siemens DR, Nippak P, Meyer J, Booth CM. Histology at transurethral resection of bladder tumor and radical cystectomy for bladder cancer: Insights from population-based data. Can Urol Assoc J 2020 https://doi.org/10.5489/cuaj.6856.
- Mistretta FA, Musi G, Collà Ruvolo C, Conti A, Luzzago S, Catellani M, et al. Robot-assisted radical cystectomy for non-metastatic urothelial carcinoma of urinary bladder: a comparison between intracorporeal versus extracorporeal orthotopic ileal neobladder. J Endourol 2020. https://doi.org/10.1089/end.2020.0622.









Комментарии