С.В. Котов, И.Э. Мамаев, А.Г. Юсуфов, Р.И. Гуспанов, Р.А. Перов, С.В. Беломытцев, Е.А. Пронкин, К.И. Глинин, А.В. Макарченко, М.Б. Попова, М.А. Шоайдаров, К.К. Ахмедов, А.Ю. Сероухов
Позадилонная аденомэктомия (ПлАЭ), описанная Т. Millin в 1945 году, выполняется при доброкачественной гиперплазии предстательной железы больших размеров [1].
Несмотря на развитие малоинвазивных методов лечения, таких как трансуретральная хирургия с применением биполярной резекции или энуклеации аденомотозных узлов предстательной железы (ПЖ) при помощи гольмиевого лазера, ПлАЭ по-прежнему широко используется и остается предпочтительной при объеме ПЖ более 80-100 см3 [2]. Трансуретральная энуклеация гиперплазированных узлов ПЖ гольмиевым лазером имеет результаты схожие с открытой операцией, однако в настоящее время доступность лазерного оборудования в стационарах ограничена из-за его высокой стоимости. Совершенствование технологий и оперативной техники трансуретральной резекции привело к расширению показаний к операциям при больших объемах ПЖ, но вместе с этим – и к увеличению числа «незавершенных» резекций ПЖ и повторных вмешательств.
M.B. Mariano и соавт. выполнили первую лапароскопическую аденомэктомию (ЛА) в 2002 году [3].Данная методика воспроизвела этапы открытой ПлАЭ с привнесением преимуществ лапароскопического доступа. Согласно литературным источникам удовлетворительные результаты также получены при проведении операции лапароскопическим доступом с применениемробот-ассистированной техники и посредством однопортового доступа [4-7]. Однако лишь в единичных публикациях приводится сравнение лапароскопической аденомэктомии (ЛА) с традиционной ПлАЭ.
В настоящей статье приведена сравнительная характеристика ПлАЭ и чрези внебрюшинной ЛА, выполненных в Университетской клинике РНИМУ им. Н.И. Пирогова на базе урологических отделений ГКБ № 1 им. Н.И. Пирогова и ГКБ им. В.М. Буянова ДЗМ г.Москвы в период с 2014 по 2017 гг.
МАТЕРИАЛЫ И МЕТОДЫ
Использовались стандартные показания к хирургическому лечению ДГПЖ, основывающиеся на данных предоперационного исследования. Последнее включало в себя: анкетирование по шкале IPSS (International Prostatic Symptom Score); оценку качества жизни QoL (Quality of Life); определение уровня простатспецифического антигена (ПСА), проведение стандартных лабораторных исследований крови и мочи, измерение объема ПЖ с помощью ультразвукового исследования; проведение урофлоуметрии; измерение объема остаточной мочи; проведение, по показаниям, уретроцистоскопии для оценки сопутствующих заболеваний (стриктуры уретры, опухоли, камни и дивертикулы мочевого пузыря).
В первую (I)группу вошли 24 пациента, которым выполнена лапароскопическая аденомэктомия (ЛАЭ). Во вторую (II) группу вошли 400 пациентов, которым выполнена позадилонная аденомэктомия.Средние дооперационные значения в I и II группах составили: возраст мужчин 64,8 vs 70.5 лет; объем ПЖ 117 vs 120 cм3 ; Qmax 12.4 vs 8.3 мл/с, IPSS 23 vs 21.6 баллов; QoL 4.5 vs 4.5 баллов. В группе I оперативные вмешательства выполнялись через трансперитонеальный (12 пациентов) и внебрюшинный (12 пациентов) доступы. Техника ПлАЭ давно известна и хорошо описана, в связи с чемостановимся только на деталях лапароскопического варианта операции.
Для статистической обработки все данные о пациентах и результатах лечения внесены в базу данных, созданную на основе электронных таблиц Excel. Статистический анализ полученных результатов проводили с использованием известных статистических методов с применением блока программ Statistica SPPS 13.0 для Windows.
ТЕХНИКА ЛАПАРОСКОПИЧЕСКОЙ ОПЕРАЦИИ
Пациент под общей анестезией располагается на операционном столе в положении Тренделенбурга под углом до 10 градусов.Устанавливается уретральный катетер Фолея. При внебрюшинной методике выполняется разрез 2 см по средней линии на 1 см ниже пупка. После вскрытия переднего листка апоневроза и отведения прямой мышцы живота выполняется пальцевая диссекция для доступа к Ретциеву пространству. Брюшина смещается краниально. Затем в направлении лона вводится баллондиссектор, в который инсуффлируется до 800 мл газа под визуальным контролем. После создания рабочего пространства баллон-диссектор удаляется. Расстановка троакаров соответствует таковой при лапароскопической простатэктомии и схематично представлена ниже (рис. 1).
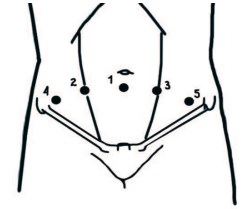
Рис. 1. Расположение троакаров при выполнении лапароскопической аденомэктомии: 1, 2 – троакары 10мм, 3, 4, 5 – троакары 5 мм
Простатическая капсула рассекается по передней поверхности на 5 мм каудальнее шейки мочевого пузыря при помощи монополярной коагуляции поперечным разрезом. Выполняется диссекция аденоматозных узлов по передней и латеральным поверхностям (рис. 2). Вентральная полуокружность уретры на границе с шейкой мочевого пузыря (МП) рассекается поперечно. Выделяется средняя доля ПЖ (при ее наличии). Осуществляется захват средней доли щипцами и тракция ее кпереди (рис. 3). Формируется дугообразный разрез слизистой в проекции шейки мочевого пузыря под средней долей аденомы между 8 и 4 часами условного циферблата.
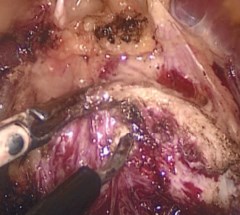
Рис. 2. Поперечный разрез капсулы предстательной железы и выделение передней поверхности аденоматозного узла
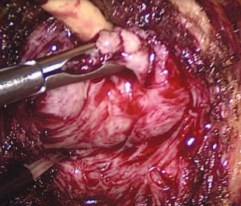
Рис. 3. Тракция средней доли предстательной железы и выделение задней поверхности аденоматозного узла
Разрез углубляется в пределах слоя между аденоматозными узлами и простатической капсулой. Выполняется последовательное выделение долей аденомы по направлению к верхушке железы. Следует дозировано применять коагуляцию на этапе диссекции аденомы в апикальной части с целью предотвращения повреждающего действия на сфинктер уретры. Удаленные аденоматозные узлы погружаются в мешок-экстрактор, который затем извлекается через продолженный разрез в проекции 10 мм порта. Достигается окончательный гемостаз посредством монои биполярной коагуляции, проводится ревизия ложа аденомы на предмет резидуальной ткани. В мочевой пузырь устанавливается 3-х ходовый уретральный катетер Фолея Сh 1822, баллон наполняется на 30-40 мл (рис. 4). Разрез капсулы ПЖ по передней поверхности ушивается непрерывным швом нитью V-loc 2/0 (рис. 5).
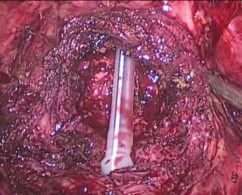
Рис. 4. Установка уретрального катетера
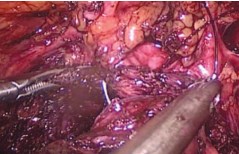
Рис.5. Ушивание капсулы предстательной железы
Мочевой пузырь наполняется 150,0 мл физиологического раствора для оценки герметичности швов.Страховой дренаж устанавливается на место одного из латеральных троакаров
При трансперитонеальной методике после вскрытия париетальной брюшины и диссекции тканей в Ретциевом пространстве мочевой пузырь отводится дорзально. Дальнейшие этапы операции аналогичны описанным выше.
РЕЗУЛЬТАТЫ
При сравнении периоперационных параметров между двумя группами пациентов не выявлено значимых различий по возрасту, объему ПЖ, суммой баллов IPSS и показателем QoL. В группе ЛАЭ конверсии к открытой операции не потребовалось ни в одном случае. Отмечено 3 осложнения: у одного пациента развилась динамическая кишечная непроходимость, разрешенная консервативно; в другом случае развился психоз на фоне сосудистой патологии головного мозга; у третьего пациента имела место ТЭЛА мелких ветвей на 4-е сутки послеоперационного периода. Гемотрансфузия не потребовалась ни в одном случае. Летальных исходов не было.
Интраоперационная кровопотеря в I группе составила 350 мл (210-420), во II – 235мл (0-1500).Средняя продолжительность дренирования мочевого пузыря в I группе была 7,4 дня, в II группе – 5,2 дня. Улучшение послеоперационных значений Qmax было отмечено в обеих группах. Средний показатель Qmax через 3 месяца после операции в группе I равнялся 22,1±5,04 мл/сек, в группе II – 21,9 (7-53,2) мл/сек (табл. 1).
Таблица 1. Периоперационные характеристики пациентов
| Параметры | ЛАЭ | ПлАЭ | р | |
|---|---|---|---|---|
| Средний возраст пациентов, лет | 70,5 | 64,8 | > 0,05 | |
| Объем предстательной железы до операции, мл | 120 | 117 | > 0,05 | |
| Qmax, мл/с | До операции | 8,3 | 12,4 | > 0,05 |
| Через 3 месяца после операции | 21,9 | 22,1 | > 0,05 | |
| Сроки дренирования мочевого пузыря, дни | 7,4 | 5,2 | > 0,05 | |
| Объем кровопотери, мл | 350 | 235 | > 0,05 | |
| Средняя продолжительность вмешательства, мин | 183 | 101,2 | > 0,05 | |
ОБСУЖДЕНИЕ
Согласно данным литературы, сравнительные исследования лапароскопической и открытой аденомэктомии показывают преимущества лапароскопии при том, что оба оперативныхметода сопоставимыпофункциональнымрезультатам[8]. Вместе с тем, имеется незначительное число публикаций по этой проблеме с небольшим числом пациентов. Многие исследования не являются сравнительными и носят описательный характер. В большинстве статей при оценке ЛАЭ констатируется низкий процент кровотечений и гемотрансфузий, короткое время послеоперационной ирригации и дренирования мочевого пузыря, короткий срок пребывания пациентов в стационаре, низкая потребность в анальгезии, непродолжительный период реабилитации, а также возможность выполнить пациентам цистолитоэктракцию, герниопластику и дивертикулэктомию при наличии показаний.
Применение лапароскопического оборудования позволяет значительно улучшить визуализацию операционного поля в сравнении с открытой хирургией. По мнению F. Porpiglia и соавт., визуализация уретры является одним из самых больших преимуществ лапароскопической техники, поскольку ее идентификация обеспечивает точный срез, благодаря чему минимизируется риск повреждения сфинктера мочевого пузыря и последующего раз-вития недержания мочи у пациента [9-10].
Уменьшение интраоперационной кровопотери при ЛАЭ достигается использование прецизионной техники энуклеации и селективной коагуляцией капсулярных кровеносных сосудов, а также спонтанным тромбообразованием в венах под влиянием СО2. Данные факторы способствуют уменьшению продолжительности послеоперационной ирригации мочевого пузыря [9,11].
Осложнения, которыемогут возникать при открытой операции (серомы, абсцессы), главным образом у пациентов с цистостомическими свищами и инфекцией мочевых путей, не встречаются в лапароскопической хирургии [7,12].
К недостаткам лапароскопического доступа можно отнести большее время операции, длительную кривую обучения и материальные расходы. Время лапароскопической операции всегда больше по сравнению с открытым оперативным вмешательством и зависит от опыта хирурга.Эти выводы нашли подтверждение и в нашем исследовании. Установлено, что средние результаты по объему кровопотери и срокам восстановления самостоятельногомочеиспускания в группе лапароскопической аденомэктомии, на опыте 24 операций несколько уступают таковым в группе открытого вмешательства.
Ограничения нашего исследования заключаются в небольшом числе пациентов, ввиду чего невозможно сделать достоверные выводы. В ситуации, когда различия в объективных результатах использованных методик минимальны, в дальнейшемцелесообразно провести сравнительную оценку и по субъективным показателям используя, к примеру, оценку пациентами уровня послеоперационного болевого синдрома. Мыубеждены, что необходимы проспективные исследования с большим числом пациентов, способные определить роль ЛА в клинической практике.
ЗАКЛЮЧЕНИЕ
Лапароскопическая аденомэктомия – довольно сложное оперативное вмешательство, требующее длительного обучения. Данная методика представляет собой приемлемую, безопасную и эффективную альтернативу другим видам хирургического лечения ДГПЖ с функциональными результатами, эквивалентными открытой хирургии, при этом имеющую ряд потенциальных преимуществ для пациента.
ЛИТЕРАТУРА
1. Millin TJ. Retropubic prostatectomy: a new extravesical technique: report on 20 cases. Lancet 1945;11:693. doi: 10.1016/S0022-5347(02)80316-0.
2. McVary KT, Roehrborn GC, Avins AL, Barry MJ, Bruskewitz RC, Donnell RF, et al. AUA guidelines: management of benign prostatic hyperplasia (BPH)revised.American UrologicalAssociation Education and Research Inc.; 2010. Доступно по: http://www.auanet.org/guidelines/benign-prostatic-hyperplasia-(2010-reviewed-and-validity-confirmed-2014).Ссылка активна на 03.03.2018.
3. Mariano MB, Graziottin TM, Tefilli MV. Laparoscopic prostatectomy with vascular control for benign prostatic hyperplasia. J Urol 2002;167:2528-9. doi: 10.1097/00005392-200206000-00046.
4.R. van Velthoven, PeltierA, Laguna MP, PiechaudT. Laparoscopic extraperitoneal adenomectomy (Millin): pilot study on feasibility. Eur Urol 2004;45:103-9. doi: 10.1016/s0302-2838(03)00420-2.
5. Sotelo R, Spaliviero M, Garcia-SeguiA, HasanW, Novoa J, Desai MM, et al. Laparoscopic retropubic simple prostatectomy. J Urol 2005;173:757-60. doi: 10.1097/01.ju.0000152651.27143.b0.
6. Rehman J,Khan SA, Sukkarieh T,Chughtai B,WaltzerWC. Extraperitoneal laparoscopic prostatectomy (adenomectomy) for obstructing benign prostatic hyperplasia: transvesical and transcapsular (Millin) techniques. J Endourol 2005;19:491-6. doi: 10.1089/end.2005.19.491.
7. Porpiglia F, FioriC,Cavallone B, Morra I, Bertolo R, Scarpa RM. Extraperitoneoscopic transcapsular adenomectomy: complications and functional results aer at least 1 year of followup. J Urol 2011;185:1668-73. doi: 10.1016/j.juro.2010.12.047.
8. Porpiglia F, Terrone C, Renard J, Grande S, Musso F, Cossu M, et al. Transcapsular adenomectomy(Millin): a comparative study, extraperitoneal laparoscopy versus open surgery. Eur Urol 2006;49:120-6. doi: 10.1016/j.eururo.2007.01.012.
9. A. García-Segui, M. Gascón-Mir. Comparative study between laparoscopic extraperitoneal and open adenomectomy. Actas Urol Esp 2012;36(2):110-116. doi: 10.1016/j.acuroe.2012.04.008.
10. McCullough TC, Heldwein FL, Soon SJ, Galiano M, Barret E,CathelineauX, et al. Laparoscopic versus open simple prostatectomy: an evaluation of morbidity. J Endourol 2009;23: 129-33. doi: doi.org/10.1089/end.2008.0401.
11. Nianzeng X, Yan Y, Zhang J, Wang J, Tian X, Niu Y, et al. Laparoscopic simple prostatectomy with prostatic urethra preserved for benign prostatic hyperplasia. Chin J Androl 2007;9:19-21. doi: 10.3978/j.issn.2223-4683.2012.02.03.
12. Сероухов А.Ю., Пронкин Е.А., Глинин К.И., Мамаев И.Э. Лапароскопическая аденомэктомия (предварительные результаты). Вестник урологии 2016;(1):24-31. doi: 10.1234/ XXXX-XXXX-2016-1-24-31.
Статья опубликована в журнале "Экспериментальная и клиническая урология". Номер №1/2018 стр. 92-95









Комментарии