С.А. Голованов, А.В. Сивков, А.М. Поликарпова, В.В. Дрожжева, М.И. Андрюхин, М.Ю. Просянников
Важным фактором, способным оказывать модулирующее влияние на образование камней в почках является рН мочи. Этот показатель используется как для оценки риска камнеобразования, так и для контроля результата противорецидивного лечения у пациентов с мочекаменной болезнью (МКБ) [1,2]. В норме моча слегка кислая с рН в среднем около 6,0, хотя кислотность ее у здорового человека может варьировать от 4,5 до 8,0 [3,4]. Кислотность мочи может изменяться при таких заболеваниях, как опухоли уротелия, нарушения обмена веществ и мочекаменная болезнь [5,7]. При МКБ, как установлено, кислотность мочи способна влиять на различные стадии камнеобразования, включая кристаллизацию, рост, агрегацию и ретенцию камня в мочевых путях [8-10]. Кроме того, рН мочи является важным фактором, который может способствовать формированию твердой (кристаллической) фазы и оказывать литолитический эффект в отношении мочевых камней [11,12]. Формирование некоторых типов мочевых камней, (оксалатных, фосфатных, уратных, цистиновых) в значительной степени зависит от рН мочи [1,8,12]. Щелочная реакция мочи рН мочи способствует формированию фосфат-содержащих камней, тогда как кислая рН мочи связана с образованием уратных и цистиновых камней [13,14].
Однако кислотность мочи является не единственным фактором, определяющим способность мочи к камнеобразованию, то есть, ее литогенные свойства. Повышение литогенности мочи происходит при нарушении экскреции различных ионов и веществ, способных влиять на камнеобразование [15]. Известен целый ряд различных ионов и веществ, нарушение экскреции которых с мочой, может повышать литогенный потенциалмочи, который, по-видимому, является результатом взаимного влияния друг на друга как метаболических, так и физико-химических факторов, включая рН мочи [15].
В опубликованных ранее работах исследовали зависимость формирования камней определенной химической природы от интенсивности воздействия таких метаболических факторов риска МКБ, как кальцийурии, уратурии, фосфатурии и магнийурии [16,17].
Цель работы: учитывая важное модифицирующее влияние рН мочи на литогенез, исследовать влияние этого физико-химического фактора на выраженность изучаемых метаболических факторов риска камнеобразования, а также на частоту и риск формирования мочевых камней различных метаболических типов.
МАТЕРИАЛЫ И МЕТОДЫ
Обследовано 636 больных МКБ (274 мужчин и 362 женщин в возрасте от 16 до 77 лет). Минеральный состав мочевых конкрементов и метаболические показатели определяли методами описанными ранее [16], рН утренней мочи определяли на анализаторе AutionMaxAX-4280 (фирмы Arcray, Япония). Значения показателей рН мочи были разделены на семь диапазонов, которые использовали в качестве факторов в дисперсионном анализе (модуль ANOVA программы Statistica v.10), а величины суточной экскреции кальция, мочевой кислоты, фосфатов, магния и процент содержания некоторых минералов в мочевых камнях в качестве зависимых переменных. Классификацию мочевых камней проводили по преобладающему минеральному компоненту (более 50% всей минеральной основы) [18-20].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты анализа показывают, что величина рН мочи оказывает заметное влияние на частоту образования камней различных метаболических типов у пациентов с МКБ (рис. 1).
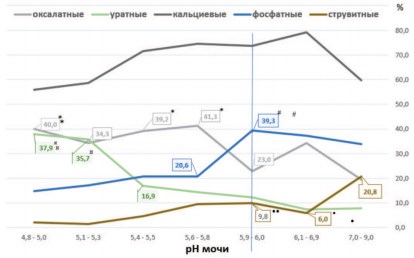
Рис.1. Частота выявления основных типов камней (в %) при различных величинах рН мочи. *p<0,01 vs. pH 5,9-6,0 (для оксалатных камней); #p<0,02 vs. pH 5,9-6,0 (для фосфатных камней);¤p<0,003 vs. pH 5,4-5,5 (для уратных камней); •p<0,015 vs. pH7,0-9,0,••p<0,03 vs. pH7,0-9,0 (для струвитных камней)
Можно заметить, что с повышением величины показателя рН мочи и смещением реакции мочи в щелочную сторону происходит некоторое снижение частоты выявления кальций-оксалатных камней у пациентов с МКБ (рис. 1). Корреляционный анализ, проведенный по семи диапазонам рН, указывает на такую тенденцию (r= -0,739; р = 0,0576). Однако более детальный анализ позволяет выявить следующие особенности. При росте рН от 5,9-6,0 до рН 7,0-9,0 статистически достоверного возрастания частоты выявления оксалатных камней не наблюдается. Смещение рН мочи в кислую сторону (от 5,9-6,0 до 4,8-5,0) вызывает рост случаев выявления оксалатных камней среди пациентов с МКБ на 70,4-79,6% (p< 0,01).
Известно, что вевеллит является основной минеральной фазой кальций-оксалатных мочевых камней. Как было установлено в настоящей работе, доля вевеллита в оксалатных камнях с преобладанием оксалатного компонента более 70%, составляла 80,2%, а веделлита – 11,3%. В камнях, представленных на 100% оксалатной минеральной фазой, доля вевеллита была еще выше – 92,2%, а веделлита – только 7,8%.
Анализ содержания оксалатов в мочевых камнях как функции величины рН мочи подтверждает факт учащения случаев оксалатного уролитиаза при повышении кислотности мочи (рис. 2). Сдвиг рН мочи в кислую сторону (от 5,9-6,0 до 4,85,0) ведет к увеличению доли вевеллита в камнях (рис. 2А). Динамика накопления веделлита в конкрементах имеет противоположный характер, свидетельствуя о накоплении этого минерала в камнях при защелачивании мочи от рН 5,1-5,3 до рН 6,1-6,9 (рис. 2В). Как было отмечено, вевеллит практически полностью представляет оксалатный компонент в камнях, поэтому доля оксалатов в мочевых камнях также увеличивается при повышении кислотности мочи (рис. 2С).
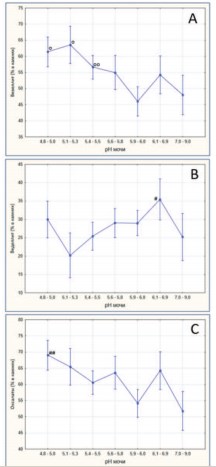
Рис. 2. Доли (в %) вевеллита (А), веделлита (В) и оксалатного минерального компонента (С) в мочевых камнях при различных значениях pH мочи. Данные представлены как М±m (средние со стандартными ошибками средних, обозначенными вертикальными линиями) оp<0,02vs. pH 5,9-6,0; ооp<0,07vs. pH 5,9-6,0; #p<0,068vs. pH 5,1-5,3; ##p<0,02vs. pH5,9-6,0
Полученные данные согласуются с результатами экспериментальных исследований. Было установлено, что кристаллы кальция оксалата моногидрата (вевеллита) наиболее активно образовывались при кислотных значениях рН (начиная с рН 4,0) и наименее интенсивно – при щелочных значениях (при рН 7,08,0) [21]. При этом различия по таким параметрам, как объем образующихся кристаллов, их число и масса отличались в 2-3 раза и более.
Таким образом, снижение показателя кислотности мочи ниже рН 6,0 способно повышать риск развития оксалатного уролитиаза. Очевидно, этот литогенный эффект реализуется путем модифицирующего влияния сдвигов рН мочи на другие метаболические факторы риска камнеобразования, и в первую очередь, на интенсивность кальцийурии.
Анализ влияния рН мочи на показатели экскреции некоторых литогенных веществ и ионов показал, что повышение экскреции кальция с мочой наблюдается при снижении рН мочи со значений 5,9-6,0 до 5,4-5,5, достигая максимума при рН равным 5,6-5,8 (рис. 3). Интересно отметить, что именно при этих значениях рН и максимальных значениях кальцийурии наблюдается максимальная активность формирования оксалатных камней у пациентов с МКБ (рис. 1). Высокая частота выявления оксалатных камней у пациентов сохраняется практически постоянной, колеблясь от 40,0% до 41,3%, при дальнейшем повышении кислотности мочи вплоть до рН 4,8-5,0, несмотря на значительное уменьшение кальциурии в 1,42 раза (рис. 1,3).
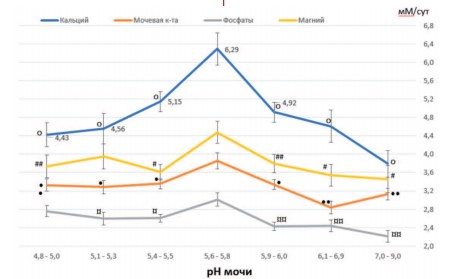
Рис.3. Показатели экскреции кальция, мочевой кислоты, фосфатов и магния (в мМ/сут) при различных значениях рН мочи. Значения экскреции фосфатов приведены как мМ/сут х10-1. Данные представлены как M±m (средние со стандартными ошибками средних, обозначенными вертикальными линиями). op< 0,005 vs. pH 5,6-5,8; #p< 0,02vs. pH5,6-5,8;##p< 0,057vs. pH5,6-5,8; •p< 0,009vs. pH 5,6-5,8;••p< 0,0006vs. pH 5,6-5,8;¤p< 0,03 vs. pH 5,6-5,8; ¤¤p< 0,003 vs. pH 5,6-5,8
Таким образом, в усилении оксалатного литогенеза снижение рН мочи (ниже 6,0) играет более значительную роль, чем повышенная экскреция кальция.
Действительно, в диапазоне рН от 5,9-6,0 до 5,6-5,8 повышение оксалатного литогенеза усугубляется кальцийурией (от 4,92 до 6,29 мМоль/сут), снижение которой должно стать целью противорецидивной терапии. При значениях рН от 5,6-5,8 до 5,4-5,5 метафилактика оксалатного уролитиаза в большей степени должна быть направлена на коррекцию нарушений рН мочи, поскольку в этих условиях даже понижение уровня кальциурии существенно не влияет на уменьшение частоты формирования оксалатных камней (рис. 1,3).
В отличие от оксалатных камней формирование фосфатных конкрементов, представленных карбонатапатитом, усиливается при защелачивании мочи. При максимальных значениях кальциурии и фосфатурии, наблюдаемых при рН 5,65,8, отмечается невысокая частота выявления фосфатных камней из карбонатапатита (20,6%) у пациентов с МКБ (рис. 1,3). Наибольшая частота фосфатного уролитиаза отмечается при увеличении рН до 5,96,0 (39,3%, p<0,02, рис. 1). Наблюдаемое при этом снижение уровней экскреции кальция и фосфатов свидетельствует о ведущей роли защелачивания мочи в формировании фосфатных камней (рис. 1,3). Это позволяет считать, что основной целью метафилактики этого типа камней должно стать поддержание рН мочи пациента в пределах от 5,65,8 до 5,4-5,5, а не борьба с сопутствующими кальциурией и фосфатурией, практически не влияющими на фосфатный литогенез.
Роль защелачивания мочи в формировании камней из карбонатапатита иллюстрирует рисунок 4. По мере увеличения рН мочи и ее защелачивания наблюдается прогрессивный рост доли карбонатапатита (фосфатного компонента) как в конкрементах в целом (рис. 4 А), так и в смешанных оксалатно-фосфатных кальциевых камнях (рис. 4 В). Подобные результаты были получены в других работах [22,23].
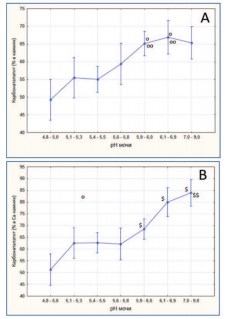
Рис. 4. Содержание карбонатапатита (в %) в мочевых камнях (A) и в смешанных кальциевых оксалатно-фосфатных камнях (В) при различных значениях рН мочи. Данные представлены как M±m (средние со стандартными ошибками средних, обозначенными вертикальными линиями). op< 0,03vs. pH 4,8-5,0; oop< 0,05 vs. pH5,6-5,8; $p< 0,035vs. pH4,8-5,0; $$p< 0,02vs. pH5,6-5,8
Влияние сдвигов рН мочи на частоту выявления у пациентов кальциевых (смешанных оксалатнофосфатных) камней не вполне однозначно. Как отмечалось, формирование оксалатного или фосфатного компонента в этих камнях регулируется разнонаправленными сдвигами рН мочи. Несмотря на то, что снижение частоты выявления кальциевых камней наблюдается при рН мочи ниже 5,4-5,5 и выше рН 6,1-6,9 (рис. 1), поддержание рН в этих пределах вряд ли следует рекомендовать в целях метафилактики, поскольку в этих условиях появляется опасность активации уратного или струвитного камнеобразования, соответственно.
Частота выявления случаев уратного уролитиаза имеет тесную связь со сдвигами рН мочи. Процент обнаружения уратных камней у пациентов постепенно возрастает при снижении рН мочи с щелочных значений этого показателя (7,0-9,0) до кислых значений (4,8-5,0), (рис. 1). Корреляционный анализ указывает на достаточно тесную обратную зависимость между изменениями рН мочи в семи выбранных диапазонах значений рН и частотой образования уратных камней (r = -0,815, p=0,0255).
Особенно заметный прирост частоты случаев возникновения уратного уролитиаза наблюдается при снижении рН мочи ниже 5,4-5,5 (рис. 1). При этом частота выявления уратных камней возрастала более чем в 2 раза – с 16,9% до 35,737,9% (рис. 1, p< 0,003).
Уратный уролитиаз обычно связан с постоянно низким рН мочи, который наблюдается почти у всех пациентов с уратными камнями, несмотря на то, что у большинства больных экскреция уратов не нарушается [24,25].
Как было отмечено в настоящей работе, частота выявления случаев уратного уролитиаза не возрастала при максимуме экскреции мочевой кислоты (рис. 1, значение рН 5,6-5,8), что подтверждает ведущую роль низких значений рН мочи в уратном литогенезе по сравнению с повышенной экскрецией уратов [26,27]. Действительно, при рН 5,0 мочевая кислота может образовывать кристаллы при весьма низкой молярной концентрации – около 2 ммоль/л, тогда как при рН 5,9-6,0 для ее кристаллизации требуется уже концентрация 4 ммоль/л и более [28].
Константа диссоциации мочевой кислоты (pKa) соответствует 5,5 [27,29]. Поэтому при рН мочи менее 5,5 мочевая кислота становится нерастворимой и в зависимости от ее концентрации в моче формируются кристаллы безводной кислоты или дигидрата мочевой кислоты [30]. Эту зависимость иллюстрирует рисунок 5, где большая часть уратных камней, представленных как чистыми 100% уратами, так и камнями с преобладание уратного компонента (>60% состава), формируется при кислых значениях рН мочи.
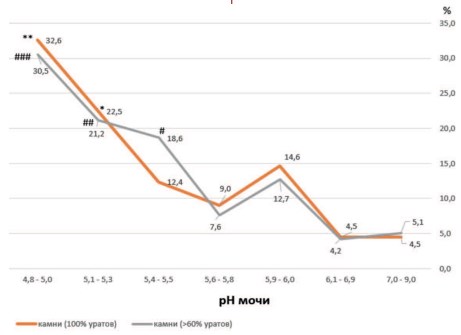
Рис. 5. Преимущественное формирование уратных камней (частота выявления в %) при кислых значениях рН мочи (ниже рН 5,6-5,8). Обозначения: *p < 0,02 vs. pH 5,6-5,8; **p < 0,02 vs. pH 5,6-5,8; (для камней, содержащих 100% уратов); #p < 0,02 vs. pH 5,6-5,8; ##p < 0,003 vs. pH 5,6-5,8; ###p < 0,00005 vs. pH 5,6-5,8 (для камней, содержащих более 60% уратов)
Обращает на себя внимание факт совпадения высокой частоты оксалатного и уратного уролитиаза при рН мочи ниже 5,5 (рис. 1). Известно, что кристаллы безводной мочевой кислоты могут служить гетерогенными центрами (нуклеантами) для образования кристаллов кальция оксалата моногидрата (вевеллита), особенно при перенасыщенности мочи оксалатом и кальцием в условиях дефицита ингибиторов кристалообразования [31,32]. Способность мочевой кислоты выполнять роль гетерогенного нуклеанта для кристаллов вевеллита гораздо выше, чем у муцина (гликопротеида) или клеточного детрита, однако ниже, чем у некоторых солей кальция [31]. Более того, мочевая кислота была обнаружена как минорный компонент в центральной части вевеллитных камней, ядре [33], что указывает на ее участие в оксалатном литогенезе и объясняет высокую частоту выявления оксалатных камней у пациентов при рН мочи ниже 5,5, в том числе и вевеллитных, камней, составляющих более 90% всех оксалатных конкрементов.
Отсюда понятно, что при кислых значения рН мочи относительный риск формирования оксалатных и уратных камней повышен в отличие от щелочных значений рН мочи, причем риск формирования уратных камней в 2,4 раза выше, чем оксалатных (табл. 1).
Таблица 1. Относительный риск образования мочевых камней при выявленных референсных значениях рН мочи
| pH< 5,9 | pH> 6,0 | RR | 95% CI | P | ||
| Оксалатные Камни |
Всего камней | Оксалатные камни | Всего камней | |||
| 138 | 358 | 38 | 144 | 1,47 | 1,09-1,99 | 0,0123 |
| pH< 5,4 | pH> 5,5 | RR | 95% CI | P | ||
| Уратные Камни |
Всего камней | Уратные камни | Всего камней | |||
| 61 | 165 | 35 | 329 | 3,48 | 2,40-5,04 | < 0,0001 |
| pH> 5,8 | pH< 5,6 | RR | 95% CI | P | ||
| Карбонат- апатитные Камни |
Всего камней | Карбонатапатитные Камни | Всего камней | |||
| 99 | 266 | 53 | 295 | 2,07 | 1,55-2,77 | < 0,0001 |
| pH>6,0 | pH< 5,9 | RR | 95% CI | P | ||
| Струвитные Камни | Всего камней | Струвитные Камни | Всего камней | |||
| 20 | 144 | 15 | 358 | 3,31 | 1,75-6.29 | 0,0002 |
Подобно фосфатным конкрементам, представленным карбонатапатитом, формирование струвитных мочевых камней происходит в щелочной среде. Корреляционный анализ, проведенный в семи диапазонах рН, показывает прямую зависимость частоты выявления струвитных камней по мере нарастания щелочных значений мочи (рис. 1, r = 0,889, p=0,0074). С наибольшей частотой струвитные камни обнаруживались при рН мочи 7,0-9,0, то есть, в 3,5 раза чаще, чем у пациентов с рН мочи 6,1-6,9 (рис. 1, p< 0,015).
Это связано с тем, что кристаллизация струвита (MgNH4PO4• 6H2O) наблюдается при рН мочи выше 7,0 [34-36], тогда как растворимость струвита возрастает при рН мочи ниже 6,5 [37]. Как известно, главной причиной формирования струвитных камней является инфекция мочевых путей, при которой жизнедеятельность уреаза-продуцирующих микроорганизмов (Proteusspp., Klebsiellapneumoniae и Providenciaspp.) приводит у усилению аммониагенеза и сильному защелачиванию мочи [35,38]. Следует отметить, что повышение частоты встречаемости струвитных камней при повышении рН мочи до 7,0-9,0 не было связано с влиянием метаболических факторов риска. Не отмечалось повышения экскреции кальция, мочевой кислоты, а также входящих в состав струвитных камней фосфатов и магния. Более того, экскреция этих веществ и ионов была значительно ниже по сравнению с их максимальными значениями, зарегистрированными в диапазоне рН мочи 5,6-5,8 (рис. 1).
Это свидетельствует о ведущей роли в струвитном литогенезе ощелачивания мочи, но не о влиянии на этот процесс известных метаболических факторов риска, экскретируемых с мочой. Кроме того, следует обратить внимание на особую роль рН мочи в регуляции экскреции кальция, мочевой кислоты, фосфатов и магния. Максимальная суточная экскреция этих ионов и мочевой кислоты отмечается при рН мочи 5,6-5,8 и снижается при рН выше или ниже этих значений (рис. 1). Очевидно, диапазон изменения рН мочи 5,4-6,0 можно считать оптимальным для процесса экскреции этих веществ.
Роль рН мочи в регуляции экскреции веществ подтверждают результаты длительной метафилактики у пациентов с удаленными струвитными камнями, которым для ацидификации мочи назначался L-метионин [39]. В результате проведенной терапии показатель рН мочи снижался в среднем с 7,5 до 5,5, при этом у больных наблюдалось повышением показателей экскреции магния, мочевой кислоты. Экскреция кальция проявляла тенденцию к повышению (p = 0,08). Подобные изменения показателей экскреции при снижении щелочных значений рН мочи были отмечены ранее [17]. В настоящей работе эта зависимость представлена на рисунке 1.
Подобно фосфатным камням из карбонатапатита струвитные мочевые камни склонны образовываться в щелочной моче. Поэтому при щелочных значения рН мочи относительный риск формирования таких камней повышен по сравнению с кислыми значениями рН. Так, риск образования камней из карбонатапатита при рН > 5,5 в 2 раза выше, чем для мочи с рН < 5,6. Для струвитных камней показатель относительного риска составляет 3,3 при рН мочи >6,0, по сравнению с мочой, имеющей рН < 5,9 (табл.1).
ЗАКЛЮЧЕНИЕ
В результате проведенной работы показано, что кислотность мочи способна регулировать суточную экскрецию кальция,мочевой кислоты, фосфатов и магния. Максимальная экскреция этих метаболических факторов риска МКБ отмечается при рН мочи в диапазоне 5,6-5,8 и снижается при смещении выше или ниже от этих значений. Наибольшая частота выявления случаев оксалатного уролитиаза наблюдается при рН 5,6-5,8 и совпадает с максимумом экскреции кальция, что необходимо учитывать при проведении метафилактики. При значениях рН ниже 5,6-5,8метафилактику оксалатного уролитиаза в большей степени следует направлять на коррекцию нарушений рН мочи, поскольку в этих условиях низкий уровень кальциурии существенно не влияет на оксалатный литогенез.
Наиболее часто уратные камни образуются при рН < 5,4-5,5; карбонатапатитные – при рН > 5,6-5,8; струвитные – при рН =7,0-9,0, в то время как в этих условиях наблюдается низкая экскреция метаболических факторов риска. Можно полагать, что кислотность мочи в большей степени способна влиять на частоту образования уратных и фосфатных камней, нежели изучаемые в работе метаболические факторы риска, что следует учитывать при проведении противорецидивного лечения МКБ.
ЛИТЕРАТУРА
1.Grases F, Costa-Bauza A, Prieto RM. Renal lithiasis and nutrition. Nutr J 2006;5:23. doi:10.1186/1475-2891-5-23.
2. Barbas C, Garcia A, Saavedra L, Muros M. Urinary analysis of nephrolithiasis markers. J Chromatogr B Analyt Technol Biomed Life Sci, 2002;781(1-2):433-55. doi:10.1016/S1570-0232(02)00557-3.
3. Welch AA, Mulligan A, Bingham SA, Khaw KT. Urine pH is an indicator of dietary acid-base load, fruit and vegetables and meat intakes: results from the European Prospective Investigation into Cancer and Nutrition (EPIC)-Norfolk population study. Br J Nutr 2008;99(6):1335-43. doi:10.1017/S0007114507862350.
4.Thongboonkerd V, Mungdee S,Chiangjong W. Should urine pH be adjusted prior to gel-based proteome analysis? J Proteome Res 2009; 8(6):3206-11. doi:10.1021/pr900127x.
5. Ide H, Kikuchi E, Hagiwara M, Hayakawa N, Hongo H, Miyajima A, et al. Urinary pH levels are strongly associated with bladder recurrence after nephroureterectomy in upper tract urothelial carcinoma patients with a smoking history. Ann Surg Oncol 2016;23(Suppl 5):1029-1038.
6. Cho YH, Lee SY, Jeong DW, Choi EJ, Nam KJ, Kim YJ, et al. The association between a low urine pH and the components of metabolic syndrome in the Korean population: Findings based on the 2010 Korea National health and nutrition examination survey. J Res Med Sci 2014;19(7):599-604.
7. Bihl G, Meyers A. Recurrent renal stone disease-advances in pathogenesis and clinical management. Lancet 2001;358(9282):651-6. doi:10.1016/S0140-6736(01)05782-8.
8. Tiselius HG. A hypothesis of calcium stone formation: an interpretation of stone research during the past decades. Urol Res 2011;39(4):231-43. doi:10.1007/s00240-010-0349-3.
9. Han H, Segal AM, Seifter JL, Dwyer JT. Nutritional Management of Kidney Stones (Nephrolithiasis). Clin Nutr Res 2015;4(3):137-52. doi:10.7762/cnr.2015.4.3.137.
10. Ratkalkar VN, Kleinman JG. Mechanisms of Stone Formation. Clin Rev Bone Miner Metab 2011;9(3-4):187-197. doi:10.1007/s12018-011-9104-8.
11. Worcester EM, Coe FL. Nephrolithiasis. Prim Care 2008;35(2):369-91. doi:10.1016/j.pop.2008.01.005, vii.
12. McKay CP. Renal stone disease. Pediatr Rev 2010;31(5):179-88. doi:10.1542/pir.31-5-179.
13. Grases F, Costa-Bauzá A, Gomila I, Ramis M, García-Raja A, Prieto RM. Urinary pH and renal lithiasis. Urol Res 2012;40(1):41-6. doi:10.1007/s00240-011-0389-3.
14. Wagner CA. Mohebbi N. Urinary pH and stone formation. J Nephrol 2010;23(Suppl 16):S165-9.
15. Türk C, Knoll T, Petřík A, Sarica K, Skolarikos A , Straub M, et al. Guidelines on Urolithiasis – EAU,2015. URL: http://uroweb.org/wp-content/uploads/22-Urolithiasis_LR_full.pdf.
16. Голованов СА, Сивков АВ, Дрожжева ВВ, Анохин НВ. Метаболические факторы риска и формирование мочевых камней. Исследование I: влияние кальцийурии и урикурии. Экспериментальная и клиническая урология 2017;(1):52 – 57.
17. Голованов СА, Сивков АВ, Дрожжева ВВ, Анохин НВ. Метаболические факторы риска и формирование мочевых камней. Исследование II: влияние фосфатурии и магнийурии. Экспериментальная и клиническая урология 2017;(2):42 – 48.
18. Rendina D, De Filippo G, De Pascale F, Zampa G, Muscariello R, De Palma D et al. The changing profile of patients with calcium nephrolithiasis and the ascendancy of overweight and obesity: a comparison of two patient series observed 25 years apart. Nephrol Dial Transplant 2013;28 (Suppl 4):iv146-51. doi: 10.1093/ndt/gft076.
19. Cho ST, Jung SI, Myung SC, Kim TH. Correlation of metabolic syndrome with urinary stone composition. Int J Urol 2013;20(2):208-13. doi: 10.1111/j.1442-2042.2012.03131.x.
20. Daudon M, Lacour B, Jungers P. Influence of body size on urinary stone composition in men and women. Urol Res 2006;34(3):193-9. doi: 10.1007/s00240-006-0042-8.
21. Manissorn J, Fong-Ngern K, Peerapen P, Thongboonkerd V. Systematic evaluation for effects of urine pH on calcium oxalate crystallization, crystal-cell adhesion and internalization into renal tubular cells. Sci Rep 2017;7(1):1798. doi: 10.1038/s41598-017-01953-4.
22. Parks JH, Worcester EM, Coe FL, Evan AP, Lingeman JE. Clinical implications of abundant calcium phosphate in routinely analyzed kidney stones. Kidney Int 2004;66(2):777-85.
23. Coe FL, Evan AP, Worcester EM, Lingeman JE. Three pathways for human kidney stone formation. Urol Res 2010;38(3):147-60. doi: 10.1007/s00240-010-0271-8.
24. Hesse A, Schneider HJ, Berg W, Hienzsch E. Uric acid dihydrate as urinary calculus component. Invest Urol 1975;12(5):405-9.
25. Atsmon A, deVries A, Frank M. Uric Acid Lithiasis. Amsterdam: Elsevier; 1963. pp 423-427
26. Sakhaee K. Epidemiology and clinical pathophysiology of uric acid kidney stones. J Nephrol 2014;27(3):241-5. doi: 10.1007/s40620-013-0034-z.
27. Abou-Elela A. Epidemiology, pathophysiology and management of uric acid urolithiasis: a narrative review. J Adv Res 2017;8(5):513-527. doi: 10.1016/j.jare.2017.04.005.
28. Daudon M, Frochot V. Crystalluria. ClinChem Lab Med 2015;53 (Suppl 2):s1479-87. doi: 10.1515/cclm-2015-0860.
29. Finlayson B, Smith A. Stability of first dissociable proton of uric acid. J Chem Eng Data 1974;19:94-97.
30. Grases F, VillacampaAI,Costa-BauzaA, Sohnel O. Uric acid calculi: types, etiology and mechanisms of formation. Clin Chim Acta 2000;302(1-2):89-104.
31. Grases F, Sanchis P, Isern B, Perello J, Costa-Bauza A. Uric acid as inducer of calcium oxalate crystal development. Scand J Urol Nephrol 2007;41(1):26-31. doi: 10.1080/00365590600831571/
32. Grases F, Costa-Bauza A, Ramis M, Montesinos V, Conte A. Simple classification of renal calculi closely related to their micromorphology and etiology. Clin Chim Acta 2002\322(1-2):29-36.
33. Grases F, Sanchis P, Perello J, Costa-Bauza A. Role of uric acid in different types of calcium oxalate renal calculi. Int J Urol 2006;13(3):252-6.
34. Elliot JS, Sharp RF, Lewis L. The solubility of struvite in urine. J Urol 1959;81(3):366-8.
35. Hesse A, Heimbach D. Causes of phosphate stone formation and the importance of metaphylaxis by urinary acidification: a review. World J Urol 1999;17:308-315.
36. Siener R, Struwe F, Hesse A. Effect of L-Methionine on the Risk of Phosphate Stone Formation. Urology. 2016;98:39-43. doi: 10.1016/ j.urology.2016.08.007
37. Jacobs D, Heimbach D, Hesse A. Chemolysis of struvite stones by acidification of artificial urine. Scand J Urol Nephrol 2001;35:345-349.
38. Hesse A, Tiselius HG, Siener R, Hoppe B. Urinary Stones: Diagnosis, Treatment, and Prevention of Recurrence. 3rd ed. Basel: Karger; 2009. 39. Jarrar K, Boedeker RH, Weidner W. Struvite stones: long term follow up under metaphylaxis. Ann Urol (Paris). 1996;30(3):112-7.
Статья опубликована в журнале "Экспериментальная и клиническая урология". Номер №1/2018 стр. 84-91









Комментарии