Виноградов И.В., Садакова И.В.
Фиброз кавернозных тел – патологический процесс замещения нормальной кавернозной ткани фиброзной с полной потерей физиологической способности ткани к релаксации, что приводит к развитию эректильной дисфункции. К сожалению, в доступной нам литературе мы не нашли точных данных о распространенности кавернозного фиброза как причины эректильной дисфункции [1]. Поскольку патогенез и симптоматика болезни Пейрони и кавернозного фиброза схожи, в МКБ 10 эти два патологических состояния объединены в одну группу – пластическая индурация полового члена (N 48.6).
Фиброз кавернозных тел относится к числу редких заболеваний. Так, его распространенность по данным Vale JA. с соавт. составляет 388 человек на 100 000 населения (2-3% в мужской популяции), а ежегодный прирост выявляемости заболевания составляет 25,7 человек на 100 000 населения [2].
Единственным эффективным методом лечения тотального кавернозного фиброза является фаллопротезирование [3]. Существующие консервативные методики не оказывают должного лечебного эффекта и используются лишь как подготовительные мероприятия перед операцией. Они направлены на улучшение кровообращения в тканях полового члена или максимально возможную коррекцию его размеров.
Так, по мнению Wilson S.K., наличие кавернозного фиброза значительно осложняет процесс хирургического вмешательства, создавая трудности при имплантации фаллопротезов [4]. Это связано с тем, что фиброзные изменения в тканях ведут к выраженному обеднению кровотока, изменению качественных характеристик кавернозной ткани и белочной оболочки. Уменьшение количества гладкомышечных клеток и увеличение синтеза коллагеновых волокон приводят к дефициту кавернозной ткани с последующей потерей ее эластичности.
Частота развития инфекционных осложнений при фаллопротезировании у больных кавернозным фиброзом составляет до 20% случаев [1]. Это может быть связано с недостаточной васкуляризацией тканей полового члена на фоне фиброзных изменений, а также с применением мало или аваскуляризированных трансплантатов для замещения дефектов белочной оболочки. Вышеперечисленное объясняет необходимость усовершенствования хирургических методик фаллопротезирования у данной группы пациентов с целью снижения частоты развития таких осложнений, как перипротезная инфекция [5].
Даже при благоприятном исходе операции пациенты не всегда бывают полностью удовлетворены результатами лечения. По данным некоторых авторов, изучавших качество жизни пациентов после фаллопротезирования, из 92% мужчин, удовлетворенных исходом операции, 70% заявили об улучшении качества сексуальной функции, 20% - не отметили каких-либо изменений, 10% пациентов пожаловались на некоторое ухудшение качества половой жизни. По мнению Kava BR. с соавт., одной из основных причин неудовлетворённости является уменьшение размеров полового члена (длины и толщины) [6].
За период с 2009 по 2011 гг. двадцати больным тотальным кавернозным фиброзом нами было выполнено фаллопротезирование с использованием полужестких имплантов. У 5 пациентов (25%) в раннем послеоперационном периоде развилось осложнение в виде протезной инфекции, что потребовало удаления протезов. Остальные 15 больных были осмотрены через год после операции. При этом 6 пациентов (33,3 %) указали на недостаточную удовлетворенность результатами операции, несмотря на появившуюся возможность вести половую жизнь. Причиной послужило выраженное уменьшение длины и окружности полового члена.
Высокий процент осложнений, а также необходимость сохранения нормальных размеров полового члена после имплантации протезов, побудили нас к разработке и применению новой методики в реконструктивной хирургии тотального кавернозного фиброза.
У ряда пациентов с тотальным кавернозным фиброзом при выполнении фаллопротезирования мы использовали одновременную аутотрансплантацию васкуляризированных мышечных фрагментов.
МАТЕРИАЛЫ И МЕТОДЫ
Под наблюдением находилось 11 пациентов с диагностированным тотальным кавернозным фиброзом. Средний возраст больных составил 51,2±6,4 года. Было произведено комбинированное оперативное вмешательство фаллопротезирование полужесткими протезами с одновременной аутотрансплантацией васкуляризированного мышечного фрагмента.
Выбор трансплантанта осуществляли из двух вариантов: прямая мышца живота или передняя зубчатая мышца.
При отсутствии рубцов в области предполагаемой сосудистой ножки, донорскую зону определяли совместно с пациентом с учетом особенностей течения послеоперационного периода. Так, в случае использования прямой мышцы живота возникает слабость передней брюшной стенки, что впоследствии может привести к возникновению послеоперационных вентральных грыж. Это играет немаловажную роль, поскольку обращающиеся пациенты находятся в той возрастной категории, когда для них сохраняется актуальность физических нагрузок, в том числе и на мышцы брюшного пресса.
Mы проанализировали результаты использования васкуляризированного мышечного фрагмента при выполнении фаллопротезирования при тотальном кавернозном фиброзе, а также сравнили результаты применения двух видов мышечных лоскутов: передней зубчатой мышцы (n=3), и фрагмента прямой мышцы живота (n=8).
ТЕХНИКА ОПЕРАЦИИ
Все операции проведены под эндотрахеальным наркозом. На первом этапе выполняли фаллопротезирование с использованием полужестких имплантов через венечный доступ. Выбор доступа осуществляли на основании необходимости тщательной мобилизации покровных тканей полового члена с целью последующей фиксации мышечного трансплантата. Выполняли вертикальные корпоротомии длиной не менее 5-6 см, бужирование кавернозных тел, в том числе с использованием кавернотомов или ножниц Метценбаума.
Затем осуществляли имплантацию цилиндров полужесткого протеза (использовали фаллопротезы уменьшенного диаметра). Дефекты белочной оболочки ушивали непрерывным швом. Затем приступали к следующему этапу – аутотрансплантации васкуляризированного мышечного фрагмента. В случае использования передней зубчатой мышцы плечо больного отводили до угла 90о. Разрез выполняли по переднему краю широчайшей мышцы спины, начиная от вершины подмышечной впадины. Край широчайшей мышцы поднимали, обнажая торакодорсальные сосуды и их ветви, идущие к передней зубчатой мышце. Сосудисто-нервный пучок выделяли на всем протяжении, обязательно сохраняя магистральное питание широчайшей мышцы спины и ее моторный нерв. Затем фрагмент мышцы, избранный для пересадки, отделяли от ребер (рис.1). Далее мышцу перемещали в область полового члена, фиксировали к его белочной оболочке.
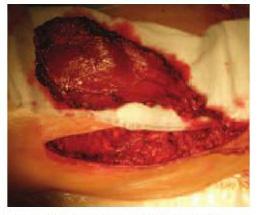
Рис. 1. Забор фрагмента передней зубчатой мышцы на питающих сосудах
После этого выполняли микрососудистый этап: анастомозирование торакодорсальных сосудов трансплантата с эпигастральными сосудами соответствующей стороны передней брюшной стенки нитью 7-0 или 8-0 пролен с использованием оптического увеличения до 4-х крат. Операция заканчивалась наложением кожных швов в области венечной борозды полового члена, послойным ушиванием раны донорской зоны, установкой уретрального катетера Фолея и фиксацией полового члена к коже бедра в вытянутом состоянии, для придания покоя и стабильности тканям и области сосудистых анастомозов.
При использовании ротированного фрагмента прямой мышцы живота на питающей ножке из продольного доступа по средней линии передней брюшной стенки, начинающегося на 3-4 см выше пупочного кольца и до лона, рассекали переднюю стенку влагалища прямой мышцы живота. Выделяли латеральный край мышцы, пересекая при этом вступающие в него сосуды и нервы (конечные ветви межреберных сосудисто-нервных пучков). На задней поверхности мышцы легко определялся нижний эпигастральный сосудистый пучок, который на уровне таза отходит латерально к наружным подвздошным сосудам. Это и есть одна из точек ротации лоскута. Затем правую или левую порцию прямой мышцы живота пересекали вблизи зоны ее прикрепления к реберной дуге.
Отмеряли необходимую длину мышечного лоскута (в соответствии с длиной полового члена) и отсекали так, чтобы уровень пересечения располагался выше дугообразной линии (рис. 2).
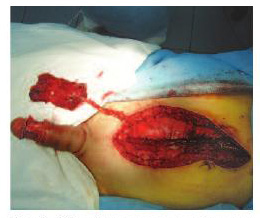
Рис. 2. Забор фрагмента прямой мышцы живота на питающих сосудах
Оставшийся фрагмент мышцы отсекали от симфиза при помощи электроножа. Рану передней брюшной стенки ушивали послойно. Операция заканчивалась наложением кожных швов в области венечной борозды полового члена, послойным ушиванием раны донорской зоны, установкой уретрального катетера Фолея.
РЕЗУЛЬТАТЫ
Ранний послеоперационный период у всех пациентов протекал без осложнений. Состояние больных соответствовало срокам и тяжести перенесенной операции и на первые сутки расценивалось как удовлетворительное. Местная реакция в виде отека и незначительной гиперемии реципиентной зоны, а также болевая симптоматика были умеренными и соответствовали реакции тканей после стандартного фаллопротезирования. Признаков развития инфекции, тенденций к отторжению трансплантата отмечено не было.
Срок наблюдения за больными составил от 1,5 до 2 лет. Осложнений в виде развития протезной инфекции, эрозии белочной оболочки в отдаленном послеоперационном периоде не выявлено.
Субъективно все пациенты отметили не только стойкий функциональный, но и косметический результат, связанный с увеличением толщины полового члена в связи с перемещением мышечного фрагмента. Субъективные данные об удовлетворенности результатами операции были объективизированы путем заполнения пациентами и их постоянными половыми партнершами специальных шкалопросников до и после операции: QoL – шкала индекса оценки качества жизни, LSS – шкала «балл удовлетворенности жизнью» и the EDITS - шкала удовлетворенности проведенным лечением. При сравнении результатов опроса и проведении балльной оценки выявлено, что все пациенты были удовлетворены результатами проведенного лечения, а при сравнении качества их жизни до и после операции отмечено улучшение: по шкале QoL на 4 балла, по шкале LSS - на 13 баллов.
ОБСУЖДЕНИЕ
При оценке результатов оперативного лечения эректильной дисфункции может наблюдаться антогонизм между оценкой результатов врачом с объективных позиций (техничность выполнения самой операции, отсутствие осложнений в раннем и позднем послеоперационном периоде) и субъективными ощущениями пациента, его удовлетворенностью качеством половой жизни после проведенного вмешательства.
Фаллопротезирование при эректильной дисфункции, вне зависимости от причин ее вызвавших, должно являться операцией радикальной, а не паллиативной.
На наш взгляд, предложенная методика является оптимальной, так как отсутствует антагонизм в отношении оценки ее результативности с точки зрения и врача и пациента. Техническая сложность выполнения данного вида оперативного вмешательства также не является чрезмерной.
ВЫВОДЫ
Исходя из результатов исследования, можно говорить о перспективности методики комбинированного хирургического лечения пациентов с кавернозным фиброзом, которое заключается в фаллопротезировании с одновременной аутотрансплантацией васкуляризированного мышечного фрагмента.
Несмотря на относительный травматизм и технические сложности данного вмешательства, оно помогает избежать таких послеоперационных осложнений, как протезная инфекция. Мы связываем это с эффектом непрямой реваскуляризации после привнесения в реципиентную зону васкуляризированного фрагмента ткани.
Кроме того, стойкость косметического результата, о которой упоминали пациенты, позволяет говорить и о достаточной удовлетворенности больных результатами лечения, что можно объяснить увеличением толщины полового члена после проведенной операции.
ЛИТЕРАТУРА
1. Живов А.В., Плеханов А.Ю. Кавернозный фиброз и эректильная функция. // Андрология и генитальная хирургия. 2004. № 4. С. 36 - 41.
2. Vale JA, Feneley MR, Lees WR, Kirby RS. Venous leak surgery: long-term follow-up of patients undergoing excision and ligation of the deep dorsal vein of the penis. //BJU.1995. Vol. 76. P. 192-195.
3. Carson CC, Mulcahy JJ, Govier FF. Efficacy, safety and patient satisfaction outcomes of the AMS 700CX inflatable penile prosthesis: results of a long-term multicenter study. AMS 700CX Study Group. // J Urol. 2000. Vol. 164, N 2. P. 376 - 380.
4. Wilson SK. Pearls, pitfalls and perils on penile prosthesis implantation. AUA postgraduate course. // AUA Annual Meeting, 1998
5. Martínez-Salamanca JI, Mueller A, Moncada I, Carballido J, Mulhall JP. Penile prosthesis surgery in patients with corporal fibrosis: A State of the Art Review. // J Sex Med. 2011. Vol. 8, N 7. P. 1880–1889
6. Kava BR, Yang Y, Soloway CT. Efficacy and patient satisfaction associated with penile prosthesis revision surgery.// J Sex Med. 2006. Vol. 4, N 2. P.509–518.
Статья опубликована в журнале "Экспериментальная и клиническая урология". Номер №1/2013 стр. 64-66











Комментарии