В.И. Киселев1, В.М. Друх1, И.Н. Кузнецов2, Е.Л. Муйжнек3, Е.А. Андрианова4, Ю.Ю. Андреева5, Д.О. Аллина5, О.Б. Лоран5, Г.А. Франк5
1ФГАОУ ВО «Российский университет дружбы народов», г. Москва;
2ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Министерства здравоохранения Российской Федерации, г. Москва;
3Закрытое акционерное общество «ИльмиксГрупп», г. Москва;
4 ГБОУ ДПО «Российская медицинская академия последипломного образования» Министерства здравоохранения Российской Федерации, г. Москва
Рак предстательной железы (РПЖ) – одно из наиболее часто встречающихся злокачественных новообразований, которое является основной причиной онкологической смертности у мужчин в развитых странах [1]. В 2013 г. в структуре заболеваемости злокачественными новообразованиями мужского населения России РПЖ составил 12,9% [2].
Простатическая интраэпителиальная неоплазия (ПИН) представляет собой диспластическое заболевание, которое формируется в результате пролиферативных изменений эпителия протоков и ацинусов предстательной железы (ПЖ). В зависимости от выраженности патологических изменений эпителия ПЖ выделяют ПИН низкой (lowgrade prostatic intraepithelial neoplasia, LGPIN) и высокой (high-grade prostatic intraepithelial neoplasia, HGPIN) степени [3]. Согласно многочисленным исследованиям у 38100% мужчин с установленным диагнозом ПИН впоследствии при анализе биопсийного материала обнаруживаются признаки аденокарциномы [4]. Согласно современным представлениям, ПИН высокой степени представляет собой предраковый процесс и является наиболее значимым прогностическим маркером развития РПЖ. Возникновение ПИН связано с прогрессивным накоплением аномалий генотипа и фенотипа, по совокупности которых она занимает промежуточное положение между нормальным эпителием ПЖ и карциномой. Появляются признаки клеточной атипии, наблюдается потеря или приобретение определённых биомаркеров, включая маркеры дифференцировки, стромальные маркеры, факторы роста и их рецепторы, изменяется экспрессия онкогенов, генов-супрессоров опухолевого роста, число и структура хромосом [5].
Данные последних лет подтверждают, что существует стойкая тенденция к увеличению частоты ПИН с возрастом, а раннее выявление ПИН является профилактической мерой, позволяющей снизить смертность от РПЖ [6, 7].
Основную роль в регуляции роста и функционирования ПЖ играет гормональный фактор. Развитию гиперплазии ПЖ способствует дигидротестостерон (ДГТ) – биологически активный андроген, образующийся в клетках ПЖ из свободного тестостерона под действием фермента 5α-редуктазы [8]. ДГТ, связываясь с андрогеновыми рецепторами (ARs), активирует их транскрипционную активность, что приводит к стимулированию пролиферации простатических клеток [9]. Однако известно, что блокирование гормональных стимулов не всегда оказывается эффективным методом терапии патологических процессов ПЖ из-за высокой вероятности развития гормон-резистентности [10]. В основе явления резистентности лежат изменения функциональной активности ARs, вследствие которых их активация может происходить в результате взаимодействия с лигандами, отличными от андрогенов [11]. У мужчин пожилого возраста также наблюдается увеличение уровня женских половых гормонов эстрогенов, вызывающих аномальную клеточную пролиферацию в ПЖ [12]. Эстрогены также являются стимуляторами молекулучастников провоспалительных сигнальных каскадов (цитокинов и ядерного фактора транскрипции NF-κB (nuclear factor-κB)), опосредующих функциональную связь между воспалением и канцерогенезом [13].
По сравнению с нормальной тканью предстательной железы и доброкачественной гиперплазией ПЖ, ПИН высокой степени демонстрирует повышение ангиогенной активности, выражающейся в увеличении плотности сосудов [14], что объясняется значительным повышением экспрессии VEGF (vascular endothelial growth factor), IGFBP-2 и IGFBP-3 (insulin-like growth factorbinding protein-2, 3) в фокусах высокой ПИН [15, 16]. Кроме того, эти процессы ассоциированы с транскрипционным фактором – гипоксия-индуцированным фактором 1α (HIF-1α hypoxia-inducible factor-1α) [17]. Сходным образом изменяется уровень апуриновой-апиримидиновой эндонуклеазы (Ape1/ref-1-apurinic apyrimidinic endonuclease redox effector factor-1) – низкий в доброкачественной гиперплазии, он возрастает в ПИН и карциноме предстательной железы [18].
Кроме того, развитие патологии ПЖ сопровождается повышением экспрессии антиапоптотических факторов Bcl-2 (B-cell lymphoma 2), что может способствовать выживанию трансформированных клеток [19]. Наконец, злокачественная трансформация клеток ПЖ связана с нарушением эпигенетической регуляции (аномальным метилированием промоторных районов генов и модификацией гистонов), в результате чего происходит функциональная инактивация генов-супрессоров опухоли [20, 21].
Один из современных подходов для профилактики и лечения предраковых состояний ПЖ состоит в разработке таргетной терапии, направленной на ключевые звенья жизнеспособности трансформированных простатических клеток.
Активная субстанция индол-3карбинол (И3К) и его физиологический метаболит 3,3-дииндолилметан (ДИМ) являются мощными онкопротекторами с широким спектром противоопухолевой активности [22]. В исследованиях in vitro и in vivo ДИМ нормализует уровень тестостерона и эстрогена, выступая в качестве уникального бифункционального модулятора рецепторов гормонов [23-25]. Помимо этого ДИМ селективно модулирует активность широкого спектра молекулярных мишеней и опосредуемых ими патологических сигнальных каскадов: блокирует клеточный цикл опухолевых клеток [26], способствует их апоптозу [27], оказывает противовоспалительное действие [28], подавляет неоангиогенез [29]. Показано, что ДИМ способен проявлять эпигенетическую деметилирующую активность, а также ингибирующую активность в отношении гистон-деацитилаз I класса, реактивируя гены-супрессоры опухолевого роста [30, 31]. Наконец, ДИМ проявляет избирательную активность в отношении пула так называемых опухолевых стволовых клеток, являющихся, согласно современным представлениям, основным источником опухолевых рецидивов и метастазирования [32].
Новая лекарственная форма Инфемин содержит активное вещество – 3,3’-дииндолилметан, а также вспомогательные компоненты, обеспечивающие высокую биодоступность активной субстанции [33].
Целью настоящего исследования является морфологическое изучение ПЖ у пациентов с ПИН по результатам 12-месячной терапии новой фармацевтической композицией – Инфемин на основе 3,3’-дииндолилметана.
МАТЕРИАЛЫ И МЕТОДЫ
Тестовые композиции. Препарат Инфемин, капсулы (ЗАО «ИльмиксГрупп», Россия), содержащий ДИМ (150 мг), рыбий жир (20 мг), αтокоферола ацетата (5 мг), в качестве вспомогательного вещества полисорбат 80 (575 мг). Препарат сравнения – плацебо, содержащий полисорбат 80 (750 мг).
Пациенты и лечение. В исследовании препарата Инфемин приняли участие 68 пациентов в возрасте 51-78 лет с гистологически верифицированным диагнозом простатическая интраэпителиальная неоплазия. Пациенты имели объем остаточной мочи ≤150 мл, уровень ПСА ≤10 нг/мл, максимальную объемную скорость тока мочи ≥ 5 мл/с. На момент проведения анализа получены данные 18 пациентов, полностью завершивших исследование и имеющих результаты морфологического изучения биоптатов ПЖ.
В исследование не включались пациенты с установленным диагнозом РПЖ и другими злокачественными новообразованиями, острой задержкой мочеиспускания, нейрогенными дисфункциями и дивертикулами мочевого пузыря, стриктурой уретры, склерозом шейки мочевого пузыря, инфекциями мочеполовой системы в фазе активного воспаления, а также пациенты, имеющие конкременты в мочевом пузыре. Критериями невключения в исследование также были: оперативные вмешательства на органах малого таза в анамнезе или их планирование в течение ближайших 12 месяцев, терапия хронического простатита за 1 месяц и терапия гиперплазии ПЖ или ПИН за 3 месяца до приема первой дозы исследуемого препарата, злоупотребление алкоголем, наркотическая или лекарственная зависимость, наличие психического заболевания и/или неконтролируемого физического состояния. Не допускалось использование других экспериментальных препаратов за 30 дней до приема первой дозы исследуемого препарата.
За 28 дней до начала периода активной терапии пациенты проходили скрининговое обследование, в ходе которого осуществлялся сбор анамнеза, проводились физикальный осмотр и лабораторные исследования. Лабораторные исследования включали общие анализы крови и мочи, а также биохимический анализ крови (определение уровня общего белка, глюкозы, креатинина, общего билирубина, активности аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ)) и определение уровня ПСА в сыворотке крови. Также проводилась диагностика гепатитов В и С, ВИЧинфекции, анализ крови на RW.
В ходе начального скрининга для всех пациентов были получены данные ЭКГ (PQ, QRS, QT), проведены урологический осмотр с пальцевым ректальным исследованием, биопсия ПЖ, урофлоуметрия, трансректальное ультразвуковое исследование (ТРУЗИ) с определением остаточной мочи, заполнение опросников IPSS+QoL, IIEF (International Prostate Symptom Score + Quality of Life, International Index of Erectile Function).
После подписания информированного согласия пациентов распределили на две группы. Пациентам первой группы (34 человек) препарат назначался в дозе 900 мг ДИМ в сутки (3 капсулы 2 раза в сутки), вторая группа (34 человека) – получала плацебо (3 капсулы 2 раза в сутки). Активная терапия проводилась в течение 12 месяцев с контрольными визитами в начале исследования, через 3, 6 и 9 месяцев после начала исследования.
Оценка эффективности терапии проводилась на основании динамики морфологического индекса (МИ) к моменту окончания терапии (статистически значимое снижение МИ по сравнению с плацебо). МИ определялся по данным гистологического исследования биоптатов ПЖ на этапе скрининга и через 12 месяцев после начала исследования.
Расчет МИ проводился по формуле:
МИ={[число фокусов ПИН низкой степени]+2*[число фокусов ПИН высокой степени]+3*[число фокусов рака]} / [число столбиков биопсии]
С целью определения эффективности терапии также определялась динамика объема ПЖ (по данным УЗИ), показателя соотношения строма/паренхима (по данным морфологического исследования), доля пациентов с хроническим воспалением (по данным морфологического исследования). У всех пациентов производился регулярный контроль биохимических показателей и уровня ПСА.
Настоящий анализ является промежуточным, проведенным на основании имеющихся на данный момент данных обследования пациентов.
Для определения статистической значимости различий между группами был использован t-критерий Стьюдента. Данные представлены в виде среднего арифметического ± стандартное отклонение (M±s) или в виде среднего арифметического ± стандартная ошибка среднего (M±m). Для сравнения признаков в независимых выборках использовался критерий χ2. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимался p≤0,05. Статистическая обработка результатов исследования проводилась с помощью программы SPSS Statistics 19.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При анализе данных, полученных в результате морфологического изучения биоптатов ПЖ, была оценена динамика морфологического индекса – главного критерия эффективности терапии – у 18 пациентов. Через 12 месяцев терапии было показано, что произошло уменьшение МИ в группе терапии активным препаратом (n=9) с 0,48 до 0,36. В то же время в группе плацебо (n=9) отмечалось увеличение МИ с 0,29 до 0,48 (рис. 1). В группе терапии активным препаратом не наблюдалось статистической значимости в изменении величины МИ (p=0,582). В то же время в группе плацебо прирост МИ статистически значим (p=0,038). Статистически значимых отличий между группами обнаружено не было.
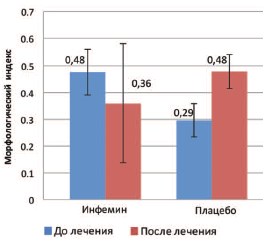
Рис. 1. Величина морфологического индекса у пациентов с диагнозом PIN до и после 12-месячной терапии в группах приема активного препарата (Инфемин) и плацебо. Данные представлены в виде M±m
Также по результатам исследования у пациентов был рассчитан показатель соотношения строма/паренхима. В группе терапии активным препаратом наблюдалось статистически значимое увеличение данного показателя с 48,75 до 64,38 (p=0,015). В группе приема плацебо также было установлено увеличение соотношения строма/паренхима с 47,5 до 53,75. Однако статистической значимости в изменении данного параметра установлено не было (p=0,095) (рис.2). Отличия между группами также были статистически незначимы.
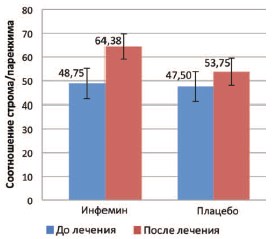
Рис. 2. Соотношение строма/паренхима у пациентов с диагнозом PIN до и после 12-месячной терапии в группах приема активного препарата (Инфемин) и плацебо. Данные представлены в виде M±m
Анализ пациентов с развившимся РПЖ показал, что в группе приема Инфемин через 12 месяцев терапии не было ни одного пациента с фокусами рака. В то же время в группе приема плацебо было выявлено 3 (33,3%) случая РПЖ. У всех трех пациентов обнаружена ацинарная аденокарцинома, сумма баллов по Глисону равнялась 6 (3+3). При этом статистической значимости отличий между группами выявлено не было.
В ходе исследования было показано, что при приеме исследуемого препарата не происходит статистически значимого изменения уровня ПСА, а также доли пациентов с хроническим воспалением в течение 12 месяцев наблюдения (табл. 1, 2).
Таблица 1. Изменение показателя ПСА (нг/мл) у пациентов с диагнозом ПИН до и после 12-месячной терапии в группах приема препарата Инфемин и плацебо. Данные представлены в виде M±s
| Показатель | Инфемин (n=6) | Плацебо (n=6) | p |
|---|---|---|---|
| ПСА до лечения (нг/мл) | 6,98±2,55 | 7,15±3,45 | 0,923 |
| ПСА после лечения (нг/мл) | 5,28±3,16 | 8,44±6,99 | 0,336 |
Таблица 2. Доля пациентов с хроническим воспалением до и после 12-месячной терапии в группах приема препарата Инфемин и плацебо. Данные представлены в виде M±s
| Показатель | Инфемин (n=6) | Плацебо (n=6) | p |
|---|---|---|---|
| Доля пациентов с хроническим воспалением до лечения, % | 89 | 89 | 1,000 |
| Доля пациентов с хроническим воспалением после лечения,% | 56 | 22 | 0,257 |
Таблица 3. Изменение объема предстательной железы (VПЖ) у пациентов с диагнозом ПИН до и после 6-месячной терапии в группах приема препарата
Инфемин и плацебо. Данные представлены в виде M±s
| Показатель | Инфемин (n=6) | Плацебо (n=6) | p |
|---|---|---|---|
| VПЖ до лечения (см3) | 53,76±21,46 | 63,01±21,45 | 0,142 |
| VПЖ через 6 месяцев терапии (см3) | 54,44±20,22 | 65,64±20,22 | 0,089 |
Также было установлено, что не происходит статистически значимого изменения объема предстательной железы через 6 месяцев терапии препаратом.
Таким образом, предварительные данные свидетельствуют о положительном влиянии препарата в отношении ПИН, заключающемся в снижении тяжести и распространенности неопластического процесса в ПЖ. По-видимому, препарат также обладает определенным антипролиферативным действием, поскольку на фоне его применения растет соотношение строма/паренхима. Однако, данный эффект не был отражен в соответствующем изменении объема ПЖ в течение 6 месяцев терапии. Возможно, при окончательном анализе данных исследования после 12 месяцев терапии данный эффект станет значимым.
ЗАКЛЮЧЕНИЕ
Таким образом, по предварительным результатам изучения морфологической структуры ПЖ у пациентов с ПИН можно заключить, что Инфемин является эффективным препаратом для лечения ПИН, позволяющим снизить тяжесть и распространенность неопластического процесса в ПЖ.
Научно-исследовательские и опытно-конструкторские работы были выполнены в ФГАОУ ВО (Федеральное государственное автономное образовательное учреждение высшего образования) «Российский университет дружбы народов» в рамках исполнения договора № 02.G25.31.0080 от «23» мая 2013 г. на реализацию комплексного проекта по созданию высокотехнологичного производства «Производство лекарственных средств на основе биотехнологий для лечения социально значимых заболеваний» финансируемого Министерством образования и науки Российской Федерации в соответствии с постановлением Правительства Российской Федерации №218 от 9 апреля 2010 года.
ЛИТЕРАТУРА
1. Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. // CA Cancer J Clin. 2012. Vol.62. P.10–29.
2. Злокачественные новообразования в России в 2012 году (заболеваемость и смертность)./ Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России, 2014. 250 с. http://www.oncology.ru/service/statistics/malignant_tumors/2012.pdf.
3. Drago JR, Mostofi FK, Lee F. Introductory remarks and workshop summary.// Urology. 1992. 39, (Suppl). P. 2-8.
4. Montironi R, Mazzucchelli R, Algaba F, Lopez-Beltran A. Morphological identification of the patterns of prostatic intraepithelial neoplasia and their importance.// J Clin Pathol. 2000. Vol. 53, N 9. P. 655–665.
5. Bostwick DG, Liu L, Brawer MK, Qian J. High-Grade Prostatic Intraepithelial Neoplasia. // Rev Urol. 2004. Vol. 6, N 4. P. 171–179.
6. Epstein JI, Grignon DJ, Humphrey PA, McNeal JE, Sesterhenn IA, Troncoso P, Wheeler TM. Interobserver reproducibility in the diagnosis of prostatic intraepithelial neoplasia. //Am J Surg Pathol. 1995. Vol. 19, N 8. P. 873-886.
7. Rekhi B, Jaswal TS, Arora B. Premalignant lesions of prostate and their association with nodular hyperplasia and carcinoma prostate.// Indian J Cancer. 2004. Vol. 41, N 2. P. 60-65.
8. Carson III C, Rittmaster R. The role of dihydrotestosterone in benign prostatic hyperplasia.// Urology. 2003. Vol. 61. P. 2–7
9. Roy AK, Lavrovsky Y, Song CS, Chen S, Jung MH, Velu NK, Bi BY, Chatterjee B. Regulation of androgen action. // Vitam Horm. 1999. Vol. 55. P. 309-352.
10. Heilen CA, Chang C. Androgen receptor in prostate cancer.// Endocrine Reviews. 2004. Vol. 25, N 2. P. 276-308.
11. Suzuki H, Ueda T, Ichikawa T, Ito H. Androgen receptor involvement in the progression of prostate cancer. // Endocr Relat Cancer. 2003. Vol. 1, N 2. P. 209-216.
12. Nanni S, Narducci M, Della Pietra L, Moretti F, Grasselli A, De Carli P, Sacchi A, Pontecorvi A, Farsetti A. Signaling through estrogen receptors modulates telomerase activity in human prostate cancer. // 2002. J. Clin. Invest. Vol. 110. P. 219–227.
13. Ellem SJ, Wang H, Poutanen M, Risbridger GP. Increased endogenous estrogen synthesis leads to the sequential induction of prostatic inflammation (prostatitis) and prostatic premalignancy. // Am J Pathol. 2009. Vol. 175, N 3. P. 1187-1199.
14. Sinha AA, Gleason DF, Staley NA, Wilson MJ, Sameni M, Sloane BF. Cathepsin B in angiogenesis of human prostate: an immunohistochemical and immunoelectron microscopic analysis. // Anat Rec. 1995. Vol. 241. P. 353–362.
15. Tennant MK, Thrasher JB, Twomey PA, Birnbaum RS, Plymate SR. Insulin-like growth factorbinding protein-2 and -3 expression in benign human prostate epithelium, prostate intraepithelial neoplasia, and adenocarcinoma of the prostate. // J Clin Endocrinol Metab. 1996. Vol. 81. P. 411–420.
16. Mazzucchelli R, Montironi R, Santinelli A, Lucarini G, Pugnaloni A, Biagini G. Vascular endothelial growth factor expression and capillary architecture in high-grade PIN and prostate cancer in untreated and androgen-ablated patients. // Prostate. 2000. Vol. 45. P. 72–79.
17. Zhong H, Semenza GL, Simons JW, De Marzo AM. Up-regulation of hypoxia-inducible factor 1alpha is an early event in prostate carcinogenesis. // Cancer Detect Prev. 2004. Vol. 28, N 2. P. 88-93.
18. Kelley MR, Cheng L, Foster R, Tritt R, Jiang J, Broshears J, Koch M. Elevated and altered expression of the multifunctional DNA base excision repair and redox enzyme Ape1/ref-1 in prostate cancer. // Clin Cancer Res. 2001. Vol. 7, N 4. P. 824–830.
19. Krajewska M, Krajewski S, Epstein JI, Shabaik A, Sauvageot J, Song K, Kitada S, Reed JC. Immunohistochemical analysis of bcl-2, bax, bcl-X, and mcl-1 expression in prostate cancers. // Am J Pathol. 1996. Vol. 148, N 5. P. 1567-1576.
20. Maruyama R, Toyooka S, Toyooka K. Abberant promoter methylation profile of prostate cancers and its relationship to clinicopathological features. // Clinical cancer research. 2002. Vol. 8, N 2. P. 514-519.
21. Kang GH, Lee S, Lee HJ, Hwang KS. Aberrant CpG island hypermethylation of multiple genes in prostate cancer and prostatic intraepithelial neoplasia. // J Pathol. 2004. Vol. 202, N 2. P. 233-240.
22. Zhang WW, Feng Z, Narod SA. Multiple therapeutic and preventive effects of 3,3'-diindolylmethane on cancers including prostate cancer and high grade prostatic intraepithelial neoplasia.// J Biomed Res. 2014. Vol. 28, N 5. P. 339-348.
23. Le HT, Schaldach CM, Firestone GL, Bjeldanes LF. Plant-derived 3,3'-Diindolylmethane is a strong androgen antagonist in human prostate cancer cells. // J Biol Chem. 2003. Vol. 278. P. 21136-21145.
24. Smith S, Sepkovic D, Bradlow HL, Auborn KJ. 3,3′-diindolylmethane and genistein decrease the adverse effects and estrogen in LNCaP and PC-3 prostate cancer cells. // J Nutr. 2008. Vol. 138, N 12. P. 2379–2385.
25. Nachshon-Kedmi M, Fares FA, Yannai S. Therapeutic activity of 3,3′ diindolylmethane on prostate cancer in an in vivo model.// Prostate. 2004. Vol. 61. P. 153–160.
26. Banerjee S, Kong D, Wang Z, Bao B, Hillman GG, Sarkar FH. Attenuation of multi-targeted proliferation-linked signaling by 3,3′-diindolylmethane (DIM): from bench to clinic. // Mutat Res. 2011. Vol. 728. P. 47–66.
27. Nachshon-Kedmi M, Yannai S, Haj A, Fares FA. Indole-3-carbinol and 3,3’-diindolylmethane induce apoptosis in human prostate cancer cells. // Food Chem Toxicol. 2003. Vol. 41, N 6. P. 745-752.
28. Kim EJ, Park H, Kim J, Park JH. 3,3′-diindolylmethane suppresses 12-OTetradecanoylphorbol13-acetate-induced inflammation and tumor promotion in mouse skin via the downregulation of inflammatory mediators. // Mol Carcinog. 2010. Vol. 49, N 7. P. 672–683.
29. Chang X, Tou JC, Hong C, Kim HA, Riby JE, Firestone GL, Bjeldanes LF. 3,3'-Diindolylmethane inhibits angiogenesis and the growth of transplantable human breast carcinoma in athymic mice. // Carcinogenesis. 2005. Vol. 26, N 4. P.771-778.
30. Wu TY, Khor TO, Su ZY, Saw CL, Shu L, Cheung KL, Huang Y, Yu S, Kong AN. Epigenetic modifications of Nrf2 by 3,3’-diindolylmethane in vitro in TRAMP C1 cell line and in vivo TRAMP prostate tumors. // The AAPS J. 2013. Vol. 15, N 3. P. 864-874.
31. Beaver LM, Yu TW, Sokolowski EI, Williams DE, Dashwood RH, Ho E. 3,3'-Diindolylmethane, but not indole-3-carbinol, inhibits histone deacetylase activity in prostate cancer cells. // Toxicol Appl Pharmacol. 2012. Vol. 263. N 3. P. 345-51.
32. Semov A, Iourtchenco L, Liu LF, Li S, Yan X, Xiaoxue S, Muyjnek E, Kiselev V, Alakhov V. Diindolylmethane (DIM) selectively inhibits cancer stem cells. // Biochem Biophys Res Commun. 2012. Vol. 424. P. 45–51.
33. Kiselev VI, Vasilyeva IG. A pharmaceutical composition for peroral administration of diindolylmethane 2011. WO 2011/034465 A1.
Статья опубликована в журнале"Экспериментальная и клиническая урология" №4 2015, стр.54-58








Комментарии