Лубенников А.Е., Трушкин Р.Н., Кантимеров Д.Ф., Исаев Т.К., Артюхина Р.Ю.
Сведения об авторах:
- Лубенников А.Е. – к.м.н., врач-уролог урологического отделения ГБУЗ «Городская клиническая больница № 52 Департамента здравоохранения города Москвы»; Москва, Россия
- Трушкин Р.Н. – к.м.н., заведующий урологическим отделением ГБУЗ «Городская клиническая больница № 52 Департамента здравоохранения города Москвы»; Москва, Россия; РИНЦ AuthorID 454825
- Кантимеров Д.Ф. – к.м.н., врач-уролог урологического отделения ГБУЗ «Городская клиническая больница № 52 Департамента здравоохранения города Москвы»; Москва, Россия; РИНЦ AuthorID 957687
- Исаев Т. К. – к.м.н., врач-уролог урологического отделения ГБУЗ «Городская клиническая больница № 52 Департамента здравоохранения города Москвы»; Москва, Россия
- Артюхина Л.Ю. – к.м.н., заведующая отделением патологии трансплантированной почки ГБУЗ «Городская клиническая больница № 52 Департамента здравоохранения города Москвы»; Москва, Россия
ВВЕДЕНИЕ
С момента начала активного применения трансплантации почки в качестве наилучшего метода заместительной почечной терапии при терминальной хронической почечной недостаточности (ТХПН) подходы к реципиентам в значительной степени претерпели изменения. Сегодня билатеральная нефрэктомия по поводу аутосомнодоминантной поликистозной болезни почек (АДПБП) перед трансплантацией почки выполняется по строгим показаниям, в связи с чем все больше и больше в практиках нефрологов, урологов будут встречаться пациенты с трансплантированной почкой и собственными почками [1].
Данные подход имеет массу преимуществ для пациента: нет дополнительной хирургической агрессии, почки до трансплантации участвуют в обмене кальция, фосфора, выделяют воду, ренин, то есть участвуют в поддержании гомеостаза [2-4]. Но, несмотря на тщательный отбор пациентов для пересадки почки без предварительной нефрэктомии, все же у 10-20% пациентов возникает необходимость в удалении собственных почек в основном из-за активной мочевой инфекции и инфицирования кист (ИК) [1, 5-11].
Дифференциальная диагностика пиелонефрита собственных почек, ИК и пиелонефрита трансплантированной почки в ряде случаев может быть затруднительна. Ориентироваться на анализы мочи, крови, уровень С-реактивного белка (СРБ) невозможно. Ультразвуковое исследование (УЗИ), мультиспиральная компьютерная томография (МСКТ) в оценке характера содержимого кист при АДПБП обладает крайне низкой диагностической значимостью [12, 13]. Более информативным методом является магнитно-резонансная томография с использованием протоколов диффузно взвешенных изображений (МРТ-ДВИ) [14]. Кроме этого, с помощью МРТДВИ возможно визуализировать степень дисфункции трансплантированной почки на фоне отторжения, острого канальцевого некроза, токсичности иммуносупрессивной терапии [15]. Несмотря на то что МРТ-ДВИ обладает высокой (до 90%) чувствительностью в отношении ИК при АДПБП, специфичность данного метода низкая, по данным ряда публикаций не превышает 40%, что означает большое количество ложноположительных результатов [16].
С одной стороны, наличие подозрительной ИК у пациента на иммуносупрессивной терапии диктует необходимость выполнения нефрэктомии, с другой – большое количество ложноположительных результатов при МРТДВИ в отсутствии других, более информативных неинвазивных методов диагностики, может привести к большому числу неоправданных оперативных вмешательств.
Мы провели данное исследование с целью выяснения предикторов воспалительных изменений в почке и последующей нефрэктомии по поводу ИК после трансплантации почки. Также была проведена оценка выжидательной тактики при наличии единичных ИК, выявленных при МРТ-ДВИ в отсутствии клинических и лабораторных проявлений инфекции мочевых путей (ИМП).
МАТЕРИАЛЫ И МЕТОДЫ
В исследование было включено 55 пациентов с АДПБП, которым выполнена трансплантация почки без предварительной нефрэктомии в период с 2000 по 2019 год. Мужчин было 23 (41,8%), женщин – 32 (58,2%). Средний возраст составил 58,1±9,2 лет.
Билатеральная нефрэктомия по поводу ИК проведена у 10 пациентов. Диагноз ИК был выставлен на основании клинической картины, лабораторных данных и МРТ-ДВИ. Основными жалобами пациентов были боль в области почек/почки, лихорадка, у 3 пациентов имелась макрогематурия. В лабораторных анализах отмечался умеренный лейкоцитоз, нейтрофилез, повышение уровня СРБ, у 4 больных была выявлена патогенная флора при посеве мочи. Заключение о наличии ИК при МРТ-ДВИ формулировалось при гиперинтенсивном сигнале на ДВИ с гипоинтенсивным сигналом на картах измерения коэффициента диффузии (признаки рестрикции диффузии), а также при наличии гиперинтенсивного сигнала на Т2-взвешанных изображениях, с изо- или гипоинтенсивным МР-сигналом на Т1-взвешанных изображениях.
При многофакторном анализе с помощью бинарной логистической регрессии была оценена значимость и достоверность факторов риска нефрэктомии в посттрансплантационном периоде. В качестве предикторов рассматривались возраст, пол, длительность периода ожидания трансплантации почки, отягощенный урологический анамнез, проводимая иммуносупрессивная терапия, пиелонефрит трансплантированной почки до нефрэктомии. За отягощенный урологический анамнез принимали перенесенные операции на почках по поводу нагноения кист (резекции и пункции), а также неоднократные стационарные лечения по поводу активной ИМП. Все пациенты получали трехкомпонентную иммуносупрессивную терапию: глюкокортикоид, ингибитор кальциневрина и мофетил микофенолат. Разница заключалась только во втором компоненте, часть пациентов получала такролимус, а часть циклоспорин, именно этот фактор и был оценен.
У 17 из 45 пациентов, которые продолжают находится под наблюдением, по различным показаниям была проведена МРТ-ДВИ собственных почек. Медиана времени от трансплантации почки до исследования составила 10 мес. (Q1-Q3: 6-33). МР-признаки инфицирования в единичной мелкой кисте выявлены у 5 (29%) пациентов (рис. 1).
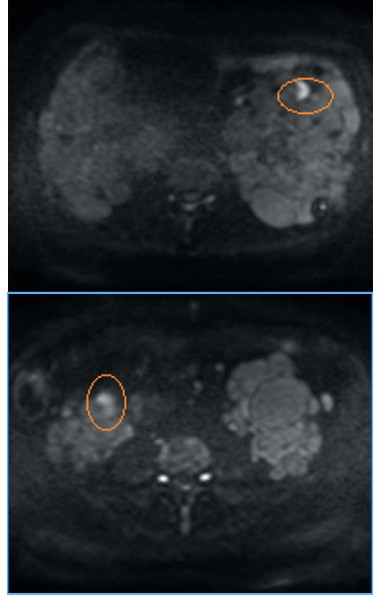
Рис. 1. Примеры МРТ-ДВИ, случайно выявленные единичные кисты, в которых не исключается наличии инфицированного содержимого (обведено)
Fig. 1. Examples of MRI-DWI, randomly detected single cysts, which do not exclude the presence of infected content (circled)
У этих больных проведено дообследование, включающее общий анализ крови, биохимический анализ крови с оценкой СРБ, интерлейкина-6, общий анализ мочи и посев мочи. Возможность проведения контрольного МРТ-ДВИ через 3 мес. была у двух пациентов.
Для статистической обработки данных использовалась программа SPSS 26 версии (IBM, USA). Анализ номинальных данных оценивали с помощью критерия Фишера, так как всегда минимальное предполагаемое число было менее 10. Различия показателей считались статистически значимы при p0,4 согласно рекомендациям Rea & Parker. С целью выявления факторов риска нефрэктомии была использована бинарная логистическая регрессия с исключением факторов по Вальду.
РЕЗУЛЬТАТЫ
За последние 20 лет в Московском государственном нефрологическом центре (МГНЦ) отмечается рост числа пациентов с АДПБП, которым выполняется трансплантация почки без предварительной нефрэктомии (рис. 2).
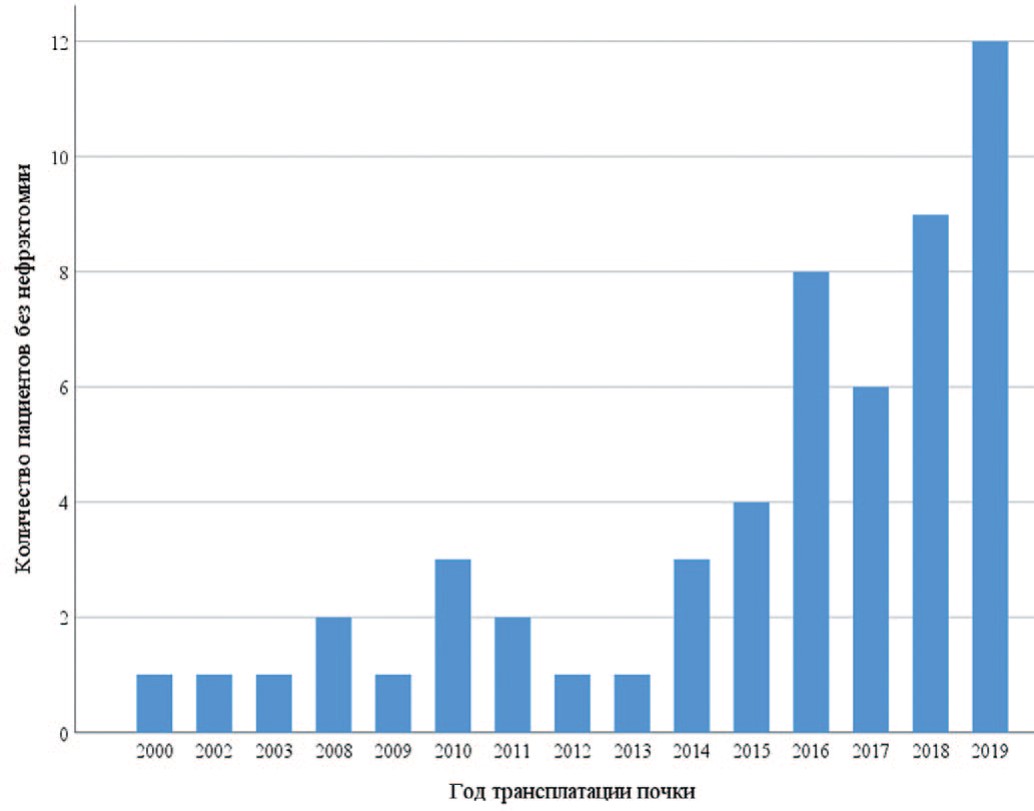
Рис. 2. Количество пациентов с АДПБП в зависимости от года трансплантации почки, которым пересадка почки выполнена без нефрэктомии
Fig. 2. The number of patients with ADPKD depending on the year of kidney transplantation, which kidney transplant is made without nephrectomy
У всех 10 (18,1%) пациентов, которым выполнена билатеральная нефрэктомия после трансплантации почки, ИК были подтверждены при гистологическом исследовании. Медиана времени от трансплантации почки до нефрэктомии составила 7 мес. (Q1-Q3: 1-8), минимальный срок 1 мес., максимальный – 41 мес. У 8 пациентов нефрэктомия выполнена в течение 1-го года после пересадки почки. Умер один пациент, у которого помимо ИК почек имелись ИК печени и сахарный диабет 2 типа, смерть произошла в результате прогрессирования сепсиса.
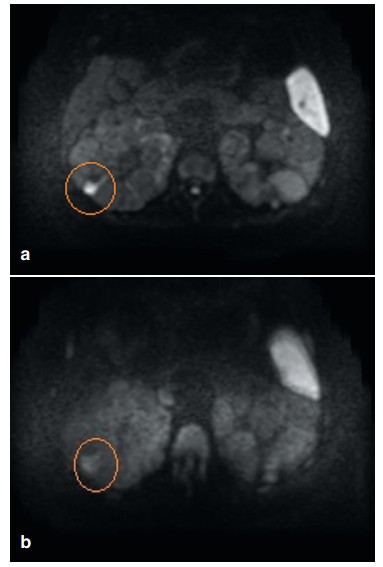
Рис. 3. МРТ-ДВИ правой почки до и через 3 месяца наблюдения. а - в правой почке единичная, мелкая киста с признаками воспаления, б - спустя 3 мес, воспалительные изменения в кисте не отмечаются
Fig. 3. MRI-DWI of the right kidney before and after 3 months of observation. a - in the right kidney is a single, small cyst with signs of inflammation, b - after 3 months, inflammatory changes in the cyst are not noted
При многофакторном анализе зависимости вероятности нефрэктомии от возраста, пола, длительности периода ожидания трансплантации почки, отягощенного урологического анамнеза, варианта иммуносупрессивной терапии, пиелонефрита трансплантированной почки до нефрэктомии с помощью метода бинарной логистической регрессии было установлено, что только отягощенный урологический статус был достоверно значимым фактором (p=0,021). Он увеличивал шансы нефрэктомии в 6,8 раз (AOR 6,83; 95%ДИ 1,34-34,8). При однофакторном анализе с использованием точного критерия Фишера пиелонефрит трансплантированной почки статистически достоверно (p=0,045) ассоциировался с риском нефрэктомии и повышал ее шансы в 4,6 раза (95% ДИ 1,07-19,8), однако связь данных событий была не сильная (V Крамера 0,293).
При дообследовании пациентов со случайно выявленными признаками ИК при МРТ-ДВИ не было выявлено воспалительных изменений, в связи с чем оперативное лечение не проводилось. При дальнейшем наблюдении через 4, 8, 10, 17, 41 мес. клинических и лабораторных проявлений ИМП зафиксировано не было.
При МРТ-ДВИ через 3 мес. у двух пациентов, доступных для контрольного обследования, отмечен полный регресс изменений, характерных для ИК (рис. 3).
ОБСУЖДЕНИЕ
Сегодня согласно международным рекомендациям по трансплантации почки, нефрэктомия при АДПБП до или во время трансплантации почки показана в случае необходимости свободного места для трансплантата, при наличии ИК, макрогематурии, болевого синдром, связанного с почками. Необходимость в удалении собственных почек при АДПБП после трансплантации почки возникает у 3-18% пациентов по данным различных литературных источников (табл. 1), что согласуется с нашими результатами. Воспалительные изменения со стороны собственных почек занимают ведущее положение в причинах нефрэктомии.
Таблица 1. Литературные данные по частоте нефрэктомии после трансплантации почки
Table. 1. Literature data on the frequency of nephrectomy after kidney transplantation
| Автор Author |
количество больных, перенесших нефрэктомию после трансплантации почки, % Number of patients who underwent nephrectomy after kidney transplantation, n,% |
количество больных, которым проведена нефрэктомия в связи с ИК, ИМП Number of patients who had a nephrectomy due to IC, UTI, n,% |
|---|---|---|
| Hadimeri H., 1997 [5] | 7% (7 из 95) | 28% (2 из 7) |
| Fuller T.F., 2005 [6] | 6% (9 из 148) | 100% (9) |
| Cohen D., 2008 [7] | 2,7% (3 из 109) | 100% (3) |
| Patel P., 2011 [8] | 13,7% (20 из 146) | 50% (10 из 20) |
| Chebib F.T., 2015 [9] | 18% (79 из 435) | 15% (12 из 79) |
| Grodstein E.I., 2017 [10] | 16,3% (54 из 334) | Нет информации |
| Maxeiner A., 2019 [1] | Нет информации | 28,1% (9 из 32) |
| Anselmo A., 2019 [11] | 8,3% (7 из 84) | 85,7% (6 из 7) |
Если при показаниях к нефрэктомии, не связанных с воспалительными изменениями в почках, результаты операции до и после трансплантации не отличаются, а по результатам исследования F.T. Chebib и соавт. они лучше после пересадки почки, то при воспалительных изменениях ряд авторов отмечают худшие результаты оперативного лечения после пересадки почки [5-9, 17, 18]. В нашем исследовании летальный исход был у одного пациента с ИК почек и печени, смерть наступила после билатеральной нефрэктомии от прогрессирования сепсиса.
Мы отметили, что достоверным предиктором воспалительных изменений в почке после трансплантации почки был только осложненный урологический анамнез. При этом события, в результате которых данный анамнез был осложненным, отмечались задолго до трансплантации почки. Нам представляется, что с целью сокращения числа пациентов, которым после пересадки почки может потребоваться нефрэктомия по поводу ИК, необходимо детально изучать анамнез и учитывать ранее перенесенные операции на почках по поводу ИК, а также частоту эпизодов ИМП, тяжесть течения, при этом давность этих событий не имеет значение. При упоминании в анамнезе на вмешательства по поводу ИК, частые рецидивы ИМП, показано рассмотрение вопроса о билатеральной нефрэктомии до или одномоментно с трансплантацией почки.
В нашей работе нефрэктомия по поводу ИК у 80% пациентов выполнена в первый год после пересадки почки, а острый пиелонефрит трансплантата, при однофакторном анализе, достоверно ассоциировался с нефрэктомией. Известно, что ИМП встречается более чем у 50% реципиентов почечного трансплантата, развивается чаще у женщин, при этом в 80% случаев – в течение первого года после пересадки почки, а пик заболеваемости приходится на первый месяц [19]. В ряде публикаций показано, что у пациентов с АДПБП после трансплантации почки увеличивается частота ИМП по сравнению с пациентами без АДПБП [20, 21]. Вероятно, острый пиелонефрит трансплантированной почки может приводить к развитию ИК в собственных почках, чаще в течение первого года после пересадки. В связи с этим наибольшую настороженность в отношении ИК собственных почек необходимо проявлять именно в первый год после пересадки. С течением времени, при адекватно функционирующем трансплантате, отмечается уменьшение размеров собственных почек и снижение частоты осложнений с их стороны [22].
Учитывая малую информативность лабораторных методов, УЗИ и МСКТ в дифференциальной диагностике пиелонефрита трансплантата и ИК в собственных почках, целесообразно проведение МТР-ДВИ, которая обладает высокой чувствительностью в отношении ИК [7, 8]. Однако этот метод не лишен недостатков из-за большого количества ложноположительных результатов (низкая специфичность), что может привести к большому числу необоснованных нефрэктомий при АДПБП [9]. С одной стороны, подозрение на ИК в нефункционирующих почках в условиях иммуносупрессивной терапии диктует необходимость оперативного лечения, с дугой – вероятность ложноположительного заключения МРТ-ДВИ и выполнение необоснованной операции ставят под сомнение необходимость хирургического подхода. Мы считаем, что при единичных, мелких кистах, с воспалительными изменениями на МРТ-ДВИ, при отсутствии клинических и лабораторных признаков системной воспалительной реакции (СВР) от оперативного лечения в объеме нефрэктомии необходимо воздерживаться. Таких пациентов можно наблюдать с последующей контрольной МРТ-ДВИ. В подобных ситуациях сложно интерпретировать изменения на МРТ, это могут быть действительно ИК, которые из-за малого объема не проявляют себя клинически и лабораторно, либо ложноположительное заключение МРТ. К сожалению, в подобных ситуациях выполнение более информативного диагностического метода, а именно пункции подозрительной кисты под УЗ контролем, в подавляющем большинстве случаев технически невыполнимо.
ВЫВОДЫ
После трансплантации почки у пациентов с АДПБП и без предтрансплантационной нефрэктомии инфицирование кист и необходимость в нефрэктомии отмечается в 10-20% случаев. Предиктором является осложненный урологический статус, ранее проведенные операции на собственных почках по поводу ИК и рецидивирующая ИМП в анамнезе. Чаще ИК развиваются в первый год после пересадки почки и, возможно, ассоциированы с острым пиелонефритом трансплантата.
МРТ-ДВИ обладает высокой чувствительностью, но низкой специфичностью в диагностике ИК в собственных почках. При выявлении единичных кист с признаками инфицирования на МРТ без проявлений СВР возможно динамическое наблюдение за пациентами.
ЛИТЕРАТУРА
- Maxeiner A, Bichmann A, Oberländer N, El-Bandar N, Sugünes N, Ralla B, et al. Native nephrectomy before and after renal transplantation in patients with autosomal dominant polycystic kidney disease (ADPKD). J Clin Med 2019;8(10):1622. https://doi.org/10.3390/ jcm8101622.
- Liu L, Zhang Y, Fu F, Zhuo L, Wang Y, Li W. Long-term clinical spectrum and circulating RAS evaluation of anephric patients undergoing hemodialysis: A report of four cases and literature review. J Renin Angiotensin Aldosterone Syst 2018;19(3):1-6. https://doi.org/10.1177/1470320318799904.
- De Santo NG, Manzo M, Raiola P, Lanzetti N, Capasso G, Ficociello R, et al. Failure of blood pressure to increase following erythropoietin therapy in the renoprival status. Int J Artif Organs 1992;15(3):144-6.
- Oettinger CW, Merrill R, Blanton T, Briggs W. Reduced calcium absorption after nephrectomy in uremic patients. N Engl J Med 1974;291(9):458-60. https://doi.org/10.1056/ NEJM197408292910906.
- Hadimeri H, Norden G, Friman S, Nyberg G: Autosomal dominant polycystic kidney disease in a kidney transplant population. Nephrol Dial Transplant 1997;12(7):1431-1436,
- Fuller TF, Brennan TV, Feng S, Kang SM, Stock PG, Freise CE: End-stage polycystic kidney disease: Indications and timing of native nephrectomy relative to kidney transplantation. J Urol 2005;174(6): 2284-2288.
- Cohen D, Timsit MO, Chretien Y, Thiounn N, Vassiliu V, Mamzer MF, et al. Place of nephrectomy in patients with autosomal dominant polycystic kidney disease waiting for renal transplantation. Prog Urol 2008;18(10): 642-649. https://doi.org/10.1016/ j.purol.2008.06.004.
- Patel P, Horsfield C, Compton F, Taylor J, Koffman G, Olsburgh J. Native nephrectomy in transplant patients with autosomal dominant polycystic kidney disease. Ann R Coll Surg Engl 2011;93(5):391-395. https://doi.org/10.1308/003588411X582690.
- Chebib FT, Prieto M, Jung Y, Irazabal MV, Kremers WK, Dean PG, et al. Native nephrectomy in renal transplant recipients with autosomal dominant polycystic kidney disease. Transplant Direct 2015;1(10):e43. https://doi.org/10.1097/TXD.0000000000000554.
- Grodstein EI, Baggett N, Wayne S, Leverson G, D'Alessandro AM, Fernandez LA, et al. An evaluation of the safety and efficacy of simultaneous bilateral nephrectomy and renal transplantation for polycystic kidney disease: a 20-year experience. Transplantation 2017;101(11):2774-2779. https://doi.org/10.1097/TP.0000000000001779.
- Anselmo A, Iaria G, Pellicciaro M, Sforza D, Parente A, Campisi A, et al. Native nephrectomy in patients with autosomal dominant polycystic kidney disease evaluated for kidney transplantation. Transplant Proc 2019;51(9):2914-2916. https://doi.org/10.1016/ j.transproceed.2019.08.010.
- Neuville M, Hustinx R, Jacques J, Krzesinski JM, Jouret F. Diagnostic algorithm in the management of acute febrile abdomen in patients with autosomal dominant polycystic kidney disease. PLoS One 2016;11(8):e0161277. https://doi.org/10.1371/journal.pone.0161277.
- Oh J, Shin CI, Kim SY. Infected cyst in patients with autosomal dominant polycystic kidney disease: Analysis of computed tomographic and ultrasonographic imaging features. PLoS One 2018;13(12):e0207880. https://doi.org/10.1371/journal.pone.0207880.
- Caroli A, Schneider M, Friedli I, Ljimani A, De Seigneux S, Boor P, et al. Diffusion-weighted magnetic resonance imaging to assess diffuse renal pathology: a systematic review and statement paper. Nephrol Dial Transplant 2018 Sep 1;33(suppl_2):ii29-ii40. https://doi.org/10.1093/ndt/gfy163.
- Abou-El-Ghar ME, El-Diasty TA, El-Assmy AM, Refaie HF, Refaie AF, Ghoneim MA. Role of diffusion-weighted MRI in diagnosis of acute renal allograft dysfunction: a prospective preliminary study. Br J Radiol 2012;85(1014):206-11. https://doi.org/10.1259/ bjr/53260155.
- Suwabe T, Ubara Y, Ueno T, Hayami N, Hoshino J, Imafuku A, et al. Intracystic magnetic resonance imaging in patients with autosomal dominant polycystic kidney disease: features of severe cyst infection in a case-control study. BMC Nephrol 2016;17(1):170. https://doi.org/10.1186/s12882-016-0381-9.
- Rozanski J, Kozlowska I, Myslak M, Domanski L, Sienko J, Ciechanowski K, et al. Pretransplant nephrectomy in patients with autosomal dominant polycystic kidney disease. Transplant Proc 2005;37(2): 666-668.
- Sulikowski T, Tejchman K, Zietek Z, Rozanski J, Domanski L, Kaminski M, et al. Experience with autosomal dominant polycystic kidney disease in patients before and after renal transplantation: A 7-year observation. Transplant Proc 2009;41(1):177-180.
- Pellé G, Vimont S, Levy PP, Hertig A, Ouali N, Chassin C et al. Acute pyelonephritis represents a risk factor impairing long-term kidney graft function. Am J Transplant 2007:7:899–907.
- Illesy L, Kovács DÁ, Szabó RP, Asztalos L, Nemes B. Autosomal dominant polycystic kidney disease transplant recipients after kidney transplantation: a single-center experience. Transplant Proc 2017;49(7):1522-1525. https://doi.org/10.1016/j.transproceed.2017.06.014.
- Roozbeh J, Malekmakan L, Harifi MM, Tadayon T. Posttransplant outcomes of patients with autosomal dominant polycystic kidney disease versus other recipients: a 10-year report from South of Iran. Exp clin Transplant 2018;16(6):676-681. https://doi.org/10.6002/ect.2016.0163.
- Veroux M, Gozzo C, Corona D, Murabito P, Caltabiano DC, Mammino L, et al. Change in kidney volume after kidney transplantation in patients with autosomal polycystic kidney disease. PLoS One 2018 Dec 27;13(12):e0209332. https://doi.org/10.1371/ journal.pone.0209332.









Комментарии