- Цеденова К.О. – аспирант кафедры онкологии ФДПО ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России, k.o.tsedenova@gmail.com
- Комаров М.И. – к.м.н., научный сотрудник урологического отделения ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России, 0050037@mail.ru, AuthorID 940704
- Матвеев В.Б. – д.м.н., профессор, член-корреспондент РАН, заведующий урологическим отделением ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России, vsevolodmatveev@mail.ru, AuthorID 173319
- Панахов А.Д. – к.м.н., научный сотрудник урологического отделения ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России, anar@rambler.ru
Первичный рак уретры признан редкой злокачественной опухолью, составляющей менее 1% всех опухолевых заболеваний [1]. В 2008 году в 28 странах Евросоюза зарегистрировано 4292 случая этого заболевания с предполагаемой частотой 655 новых случаев в год. Стандартизованное по возрасту соотношение составило 1,1 на миллион жителей (1,6 млн у мужчин и 0,6/млн у женщин) [2]. Пик возникновения рака уретры отмечен у группы больных в возрасте более 75 лет [3].
Предрасполагающими факторами для развития первичного рака уретры у мужчин являются: стриктуры уретры [4, 5], хроническое раздражение уретры вследствие длительной катетеризации/уретропластики [6-8], дистанционная лучевая терапия [9], брахитерапия [10], хроническое воспаление уретры вследствие заболеваний, передающихся половым путем [11,12]. У женщин развитие первичного рака уретры связывают с дивертикулами уретры [13-15] и рецидивирующими инфекциями уротелиального тракта [16]. Аденокарцинома также может иметь врожденную этиологию [17,18].
Преобладающим гистологическим типом первичного рака уретры является уротелиальная карцинома (54-65%), следующими по частоте встречаемости являются плоскоклеточная карцинома (16-22%) и аденокарцинома (10-16%) [2,3]. В недавнем отчете Голландского Национального реестра злокачественных опухолей сообщается, что у женщин, больных первичным раком уретры, гистологически в 45% случаев выявлен уротелиальный рак, в 29% случаев – аденокарцинома, в 19% случаев – плоскоклеточный рак и в 6% – другие гистологические типы опухолей [19].
ОПИСАНИЕ СЛУЧАЯ
Больная N. в сентябре 2017 г. отметила появление кровянистых выделений из половых путей, по поводу которых обратилась к гинекологу по месту жительства, где был выявлен полип эндометрия, выполнено раздельное диагностическое выскабливание полости матки и цервикального канала, гистологически: фиброзно-железистый полип. Однако пациентку продолжали беспокоить вышеуказанные жалобы. При дальнейшем обследовании выявлена опухоль уретры, выполнена биопсия опухоли, пациентка направлена в НМИЦ онкологии им. Н.Н.Блохина. Объективно: опухоль, исходящая из уретры с инфильтрацией нижней трети передней стенки влагалища, синюшнобагрового цвета, контактно кровоточит, размерами 8х5 см.
При магнитно-резонансной томографии (МРТ) выявлено: на уровне нижней трети влагалища отмечается опухолевое образование с нечеткими контурами, вовлекающее переднюю стенку влагалища и уретру, заднюю стенку влагалища поверхностно, общими размерами не менее 2,8х3,0х4,8 см. Достоверных МР-признаков распространения процесса на стенки мочевого пузыря и прямой кишки, на правый леватор, прямую кишку, мезоректальную клетчатку, ножки клитора не выявлено. Отмечена кистозная трансформация одного из передних наружных подвздошных узлов справа размерами 1,0х0,7 см. В правой паховой области определяется уплотненный лимфатический узел 1,2х1,0 см. Паховые лимфатические уз-лы слева – без выраженных особенностей (рис. 1).
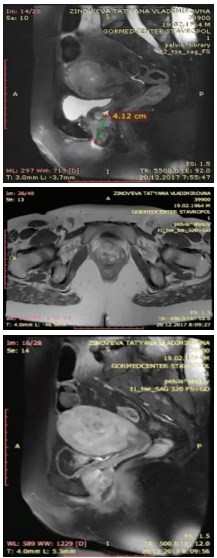
Рис. 1. МРТ органов малого таза
При компьютерной томографии (КТ): по органам брюшной и грудной полости – без патологии. В малом тазу отмечается неравномерное утолщение стенки влагалища по передне-правой полуокружности до 2,8 см, наружные контуры стенки нечеткие. Инфильтрат распространяется на правую ножку клитора и правый леватор. В центральных отделах образования (в проекции уретры) отмечается участок сравнительно пониженной плотности с четкими контурами 2,6х2,2 см. Мочевой пузырь заполнен однородным содержимым, его стенка не утолщена. Прямая кишка – без выраженных патологических изменений. Паховые и тазовые лимфатические узлы не увеличены.
При гистологическое исследование (биопсия опухоли уретры по месту жительства – пересмотр препаратов в НМИЦ онкологии им. Н.Н. Блохина): некротические массы, среди которых определяются небольшие комплексы низкодифференцированного рака солидного строения, вероятнее всего, аденогенной природы. Заключение: Низкодифференцированная аденокарцинома уретры.
19.01.2018 г. больной выполнена резекция уретры и передней стенки влагалища (рис. 2).
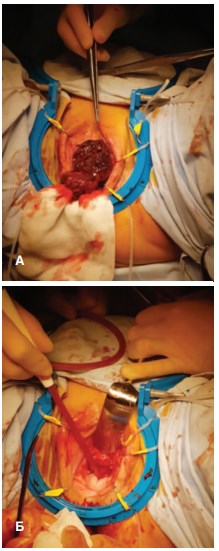
Рис. 2. Интраоперационно: А – опухоль; Б – вид после удаления опухоли
По данным гистологического исследования операционного материала опухоль представлена недифференцированной карциномой уретрыс фокусом высокодифференцированной аденокарциномы. Учитывая нестандартность случая, принято решение о проведении иммуногистохимического исследования (ИГХ).
ИГХ-исследование: В низкодифференцированном участке опухоли определяется экспрессия маркеров: CK18, chromogranin, synaptophysin, p53; индекс пролиферации (индекс мечения ki67)- 80%. В высокодифференцированном участке опухоли определяется экспрессия маркеров CK18, CK20, cdx2, p53; индекс пролиферации ( индекс мечения ki67)- 65%. В опухолевых клетках не определяется экспрессия маркеров: СK7, GATA3, HMWCK, CK5/6, p63. Заключение: с учетом морфологической картины и результатов ИГХ-исследования в уретре имеет место комбинированная карцинома, представленная преимущественно участками крупноклеточного нейроэндокринного рака (85%) и очагами высокодифференцированной аденокарциномы с кишечным иммунофенотипом (15%).
С целью определения лекарственной чувствительности опухоли проведено ИГХ исследование с антителами к рецепторам соматостатина 2 типа: SSTR-2A (клон UMB-1). Результаты: в нейроэндокринном компоненте опухоли определяется экспрессия SSTR-2A в виде мембранного окрашивания части клеток: имеются участки опухоли с окрашиванием отдельных, разрозненных клеток (2+, 30% клеток) и фокусы с диффузным сильным окрашиванием клеток (3+, 15% клеток). В участках высокодифференцированной аденокарциномы экспрессия рецепторов полностью отсутствует (0). Заключение: морфологическая картина опухоли уретры соответствует диагнозу комбинированного крупноклеточного нейроэндокринного рака с позитивным ИГХ статусом рецепторов соматостатина 2А типа. В участках высокодифференцированной аденокарциномы ИГХ статус рецепторов соматостатина 2А типа негативный.
Пациентке в послеоперационном периоде в связи с жалобами на пальпируемое образование в паховой области справа, выполнена пункция под ультразвуковым контролем (лимфатический узел, наибольший размер по данным УЗИ – 3,1 см). За период наблюдения размеры описанного лимфатического Рис. 1. МРТ органов малого таза узла увеличились (по сравнению с МРТ от 26.12.2017 г. размер лимфатического узла – 1,2 см). По результатам цитологического исследования пунктата – метастатическое поражение пахового лимфоузла справа.
В период с 01.02.2018 г. по 17.04.2018 г. больной проведено 3 курса полихимиотерапии по схеме Цисплатин 75 мг/м2 1 день; Паклитаксел 80 мг/м2 1-й, 8-й, 15-й дни.
24.05.2018 г. выполнено хирургическое лечение в объеме двусторонней пахово-бедренной лимфаденэктомии. Гистологически: в 9 лимфатических узлах слева элементов опухоли не выявлено; справа фрагмент жировой клетчатки размерами 12х7х4 см, в котором обнаружена инкапсулированная опухоль размерами 6х4х4см, имеющая строение комбинированного крупноклеточного нейроэндокринного рака с участками аденокарциномы с минимальными дистрофическими изменениями опухолевых клеток в фокусах аденокарциномы, очаги некрозов, кровоизлияний и некробиоза опухоли; в 15 лимфатических узлах – без признаков метастатического поражения.
С 06.2018 г. по 10.2018 г. проведено 4 курса адъювантной полихимиотерапии по схеме "EC": Этопозид 100 мг/м2 1-й, 2-й, 3-й день; Карбоплатин AUC 5 1-й день, на фоне которой пациентке проводилась терапия Соматостатином: ОктреотидЛонг 30 мг 1 раз в 28 дней.
При контрольном обследовании в декабре 2018 г. признаков прогрессирования заболевания не выявлено.
ОБСУЖДЕНИЕ
Мультимодальный подход к лечению первичного рака уретры включает радикальную операцию и химиотерапию с возможностью проведения дополнительной лучевой терапии [20,21].
Недавние ретроспективные исследования показали, что современные полихимиотерапевтические режимы на основе платины эффективны для распространенного первичного рака уретры, обеспечивая высокую общую выживаемость (ОВ) даже при наличии метастазов в регионарных лимфатических узлах. Более того, авторы подчеркнули важную роль хирургического лечения после химиотерапии для достижения долговременной выживаемости у пациентов с местно-распространенным раком уретры [22].
В многоцентровом исследовании 124 пациентов с распространенным первичным раком уретры, которым была проведена периоперационная химиотерапия на основе платины, были отмечены лучшие показатели безрецидивной и общей выживаемости в группе из 39 пациентов, которым проводилась неоадъювантная химиотерапия [22]. В другом исследовании было сообщено о результатах лечения 44 пациентов с распространенным первичным раком уретры, которым проводилась химиотерапия на основе Цисплатина. Общий коэффициент ответа для различных схем составил 72%, а медиана общей выживаемости – 32 месяца. Пациенты, которым было проведено хирургическое вмешательство после химиотерапии, имели значительно лучшую ОВ по сравнению с теми, кто подвергся только химиотерапии [23].
В Европе медиана пятилетней ОВ существенно не различается между полами [2,24]. Согласно RARECARE (проект наблюдения редких опухолей), медиана одногодичной и 5-летней ОВ пациентов с первичным раком уретры составляет 71% и 54%, соответственно [2]. При более длительном наблюдении SEER (программа Национального Онкологического Центра – источник информации об эпидемиологии, встречаемости и выживаемости онкологических заболеваний в США), изучившей 1615 случаев заболеваний первичным раком уретры, было доложено о медиане пятии десятилетней ОВ – 46% и 29% соответственно. Раково-специфическая выживаемость в течение 5 и 10 лет была 68% и 60%, соответственно [3].
Предикторами снижения выживаемости пациентов с первичным раком уретры являются: преклонный возраст (>65 лет) и принадлежность к черной расе [2,24,25]; стадия заболевания, степень злокачественности опухоли, вовлеченность лимфатических узлов [26] и наличие метастазов [27]; размер очага и расположение проксимального края опухоли [27]; объем хирургического вмешательства и возможность мультимодального подхода к лечению [25,27]; гистологический тип опухоли [2,19,25]; наличие сопутствующего рака мочевого пузыря [28]; локализация рецидива (уретральная/неуретральная) [29].
При интерпретации этих результатов необходимо учитывать некоторые ограничения. К примеру, в Голландском исследовании число больных было небольшим (n=91) [30]. В обширной базе данных SEER (n=2046) не указана связь проведенного лечения с выживаемостью [19]. Наконец, в отличие от проекта RARECARE [2], в базе данных SEER сообщалось о противоположных результатах относительно роли гистологического строения опухоли в выживаемости у мужчин [25].
ЗАКЛЮЧЕНИЕ
Первичный рак уретры является редким заболеванием. Мультимодальный подход к лечению больных с данной патологией позволяет достигнуть удовлетворительных показателей отдаленной выживаемости. Учитывая возможность сочетания различных гистологических вариантов рака уретры необходимо проведение полноценного гистологического исследования с применением всех методов морфологической диагностики для выбора правильного алгоритма лечения.
ЛИТЕРАТУРА
- Gatta G, van der Zwan JM, Casali PG, Siesling S, Dei Tos AP, Kunkler I, et al. Rare cancers are not so rare: the rare cancer burden in Europe. Eur J Cancer 2011;47(17):2493-511. doi: 10.1016/j.ejca.2011.08.008.
- Visser O, Adolfsson J, Rossi S, Verne J, Gatta G, Maffezzini M, et al. Incidence and survival ofrare urogenital cancers in Europe. Eur J Cancer 2012;48(4):456-64. doi: 10.1016/j.ejca.2011.10.031
- Swartz MA, Porter MP, Lin DW, Weiss NS. Incidence of primary carcinoma in the United States. Urology, 2006. 68(6):1164-8. doi: 10.1016/ j.urology.2006.08.1057
- Medina Pérez M, Valero Puerta J, Sánchez González M, Valpuesta Fernández I, Marín Martín J. [Squamosus carcinoma of the male urethra, its presentation as a scrotal abscess]. Arch Esp Urol 1999;52(7): 792-4.
- Van de Voorde W, Meertens B, Baert L, Lauweryns J. Urethral squamosus cell carcinoma associated with urethral stricture and urethroplasty. Eur J Surg Oncol 1994; 20(4): 478-83.
- Colapinto V, Evans DH. Primary carcinoma if the male urethra developing after utethroplasty for stricture. J Urol 1977;118(4):581-4.
- Mohanty NK, Jolly BB, Saxena S, Dawson L. Squamosus cell carcinoma of perineal urethrostomy. Urol Int 1995;55(2):118-9.
- Sawczuk I, Acosta R, Grant D, White RD. Post urethroplasty squamosus cell carcinoma. NY State J Med 1986;86(5):261-3.
- Mohan H, Bal A, Punia RP, Bawa AS. Squamous cell carcinoma of the prostate. Int J Urol 2003;10(20:114-6.
- Arva NC1, Das K. Diagnostic dilemmas of squamous differentiation in prostate carcinoma case report and review of the literature. Diagn Pathol 2011;6:46. doi: 10.1186/1746-1596-6-46.
- Cupp MR, Malek RS, Goellner JR, Espy MJ, Smith TF. Detection of human papillomavirus DNA in primary squamous cell carcinoma of the male urethra. Urology 1996;48(4):551-5. doi: 10.1016/S0090-4295(96)00246-4
- Wiener JS, Liu ET, Walther PJ. Oncogenic human papillomavirus type 16 is associated with squamous cell cancer of the male urethra. Cancer Res 1992;52(18):5018-23.
- Ahmed K, Dasgupta R, Vats A, Nagpal K, Ashrafian H, Kaj B, et al. Urethral diverticular carcinoma: an overview of current trends in diagnosis and management. Int Urol Nephrol 2010;42(2):331-41. doi: 10.1007/ s11255-009-9618-x
- Chung DE, Purohit RS, Girshman J, Blaivas JG. Urethral diverticula in women: discrepancies between magnetic resonance imaging and surgical findings. J Urol 2010;183(6):2265-9. doi: 10.1016/j.juro.2010.02.016.
- Thomas AA, Rackley RR, Lee U, Goldman HB, Vasavada SP, Hansel DE. Urethral diverticula in 90 female patients: a study with emphasis on neoplastic alterations. J Urol 2008;180(6):2463-7. doi: 10.1016/ j.juro.2008.08.040
- Libby B, Chao D, Schneider BF.Non-surgical treatment of primary female urethral cancer. Rare Tumors 2010;2(3):e55. doi: 10.4081/rt.2010.e55.
- Gandhi JS, Khurana A, Tewari A, Mehta A. Clear cell adenocarcinoma of the male urethral tract. Indian J Pathol Microbiol 2012;55(2):245-7. doi: 10.4103/0377-4929.97895
- Mehra R, Vats P, Kalyana-Sundaram S, Udager AM, Roh M, Alva A, et al., et al. Primary urethral clear-cell adenocarcinoma: comprehensive analysis by surgical pathology, cytopathology, and next-generation sequencing. Am J Pathol 2014;184(3):584-91. doi: 10.1016/j.ajpath.2013.11.023 184: 584.
- Derksen JW, Visser O, de la Rivière GB, Meuleman EJ, Heldeweg EA, Lagerveld BW. Primary urethral carcinoma in females: an epidemiologic study on demographical factors, histological types, tumourstage and survival. World J Urol 2013;31(1):147-53. doi: 10.1007/s00345-012-0882-5.31: 147.
- Cahn DB, Handorf E, Ristau BT, Geynisman DM, Simhan J, Kutikov A, et al. Contemporary practice patterns and survival outcomes for locally advanced urethral malignancies: A National Cancer Database Analyses. Urol Oncol 2017;35(12):670.e15-670.e21. doi: 10.1016/j.urolonc.2017.07.026
- Dayyani F1, Hoffman K, Eifel P, Guo C, Vikram R, Pagliaro LC, et al. Management of advanced primary urethral carcinomas. BJU Int 2014;114(1):25-31. doi: 10.1111/bju.12630
- Gakis G, Morgan TM, Daneshmand S, Keegan KA, Todenhöfer T, Mischinger J, et al. Impact of perioperative chemotherapy on survival in patients with advanced primary urethral cancer: results of the international collaboration on primary urethral carcinoma. Ann Oncol 2015;26(8):1754- 9. doi: 10.1093/annonc/mdv230.
- Dayyani F, Pettaway CA, Kamat AM, Munsell MF, Sircar K, Pagliaro LC. Retrospective analysis of survival outcomes and the role of cisplatin-based chemotherapy in patients with urethral carcinomas referred to medical oncologists. Urol Oncol 2013;31(7):1171-7. doi: 10.1016/j.urolonc.2012.01.011
- Sui W, RoyChoudhury A, Wenske S, Decastro GJ, McKiernan JM, Anderson CB. Outcomes and prognostic factors of primary urethral cancer. Urology 2017;100:180-186. doi: 10.1016/j.urology.2016.09.042..
- Champ CE, Hegarty SE, Shen X, Mishra MV, Dicker AP, Trabulsi EJ, et al. Prognostic factors and outcomes after definitive treatment of female urethral cancer: a population-based analysis. Urology 2012;80(2):374-81. doi: 10.1016/j.urology.2012.02.058 80: 374.
- Gakis G, Morgan TM, Efstathiou JA, Keegan KA, Mischinger J, Todenhoefer T , et al. Prognostic factors and outcomes in primary urethral cancer: results from the international collaboration on primary urethral carcinoma. World J Urol 2016;34(1):97-103. doi: 10.1007/ s00345-015-1583-734: 97.
- Rabbani F. Prognostic factors in male urethral cancer. Cancer 2011;1;117(11):2426-34. doi: 10.1002/cncr.25787
- Gakis G, Efstathiou JA, Daneshmand S, Keegan KA, Clayman RH, Hrbacek J, et al. Oncological outcomes of patients with concomitant bladder and urethral carcinoma. Urol Int 2016;97(2):134-41. doi: 10.1159/000448335
- Gakis G, Morgan TM , Daneshmand S , Keegan KA , Clayman RH, Mischinger J. Impact of salvage surgery and radiotherapy on overall survival in patients with recurrent primary urethral cancer. J Clin Oncol (Meeting Abstracts), 2015; 33:4568.
- Golijanin D, Yossepowitch O, Beck SD, Sogani P, Dalbagni G. Carcinoma in a bladder diverticulum: presentation and treatment outcome. J Urol 2003;170(5):1761-4. doi: 10.1097/01.ju.0000091800.15071.52
Статья опубликована в журнале "Экспериментальная и клиническая урология" №2 2019 г., стр. 38-43









Комментарии