Кирпатовский В.И., Голованов С.А., Дрожжева В.В., Кудрявцева Л.В., Фролова Е.В., Векильян М.А., Каприн А.Д.
Сведения об авторах:
- Кирпатовский В.И. – д.м.н., профессор, гл. научный сотрудник НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID: 604441
- Голованов С.А. – д.м.н., группы лабораторной диагностики Научно-лабораторного отдела НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID: 636685
- Дрожжева В.В. – научный сотрудник научно-лабораторного отдела НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID: 696724
- Кудрявцева Л.В. – старший преподаватель кафедры патологической анатомии Медицинского института РУДН; Москва, Россия; РИНЦ AuthorID: 844343
- Фролова Е.В. – старший научный сотрудник отдела «Биология» ВИНИТИ РАН; Москва, Россия;
- Векильян М.А. – к.м.н., главный врач НИИ урологии и интервенционной радиологии им. Н.А.Лопаткина – филиал ФГБУ «НМИРЦ» Минздрава России; Москва, Россия
- Каприн А.Д. – д.м.н., профессор, академик РАН, Генеральный директор ФГБУ «НМИЦ радиологии» Минздрава России; Москва, Россия; РИНЦ AuthorID 96775
ВВЕДЕНИЕ
Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из наиболее распространенных урологических заболеваний мужчин пожилого возраста, причем частота ее выявления во всем мире в последние годы возрастает [1]. Общепринятой концепцией является многофакторность патогенеза ДГПЖ. Основную роль в индукции пролиферации ткани предстательной железы (ПЖ) отводят возрастным изменениям гормонального фона мужского организма, в первую очередь метаболизма тестостерона, с усиленной его трансформацией за счет активации 5α-редуктазы в ткани ПЖ в дигидротестостерон, обладающей более выраженной способностью стимулировать клеточную пролиферацию. Дополнительную роль отводят нарушению баланса андрогены/эстрогены, действию других факторов, стимулирующих клеточную пролиферацию (в том числе инсулин, факторы роста) и хронической ишемии тазовых органов [2]. Часто при гистологическом исследовании выявляют сочетание ДГПЖ с хроническим воспалением ПЖ, не связанное с бактериальной инфекцией.
Многофакторность патогенеза ДГПЖ предполагает, что у разных категорий больных вклад определенных факторов в развитие заболевания может быть различным. В данной статье мы хотели обратить внимание на особенности патогенеза ДГПЖ, развивающегося на фоне метаболического синдрома. Предпосылками данного исследования были многочисленные данные литературы свидетельствующие о том, что при развитии метаболического синдрома (МС) возрастает частота формирования ДГПЖ с сопутствующими расстройствами мочеиспускания и увеличивается скорость прогрессии ДГПЖ, несмотря на то, что у многих этих пациентов выявляется андрогенная недостаточность, то есть фактор избыточной андрогенной стимуляции у этих больных имеет не основное значение [3-10]. При этом с увеличением числа компонентов МС, имеющихся у больных, таких как артериальная гипертония, гипергликемия, гиперинсулинемия, абдоминальное ожирение,гипертриглицеридемия и снижение уровня холестерина липопротеинов высокой плотности, выраженность патологических изменений со стороны ПЖ и мочевых путей возрастает [11-14]. При этом отдельные компоненты имеют более важное значение.
Ключевыми звеньями патогенеза дисфункции ПЖ и мочевого пузыря у больных с МС считаются нарушения липидного и углеводного обмена с развитием ожирения и инсулинорезистентности вплоть до развития сахарного диабета 2-го типа [13, 15, 16]. Гипергликемия способствует развитию оксидантного стресса и ведет к развитию инсулинорезистентности с возрастанием уровня инсулина, являющегося митогенным фактором, усиливающим пролиферацию эпителиальных клеток простатических желез [17]. G.I. Russo и соавт. также выявили достоверную взаимосвязь между МС, инсулинорезистентностью и выраженными расстройствами мочеиспускания [16]. Ожирение также, как и нарушения углеводного обмена, коррелирует с интенсивностью оксидантного стресса, воспалением и развитием ДГПЖ [18].
Активация прооксидантных процессов в ткани ПЖ и мочевого пузыря ведет к повышению экспрессии маркеров тканевого воспаления и инфильтрации ткани клетками воспаления [19-23]. Длительно текущее воспаление при наличии МС ведет как к функциональным расстройствам мочеиспускания, так и к морфологическим изменениям в ткани ПЖ и мочевого пузыря, включая фиброз, лейкоцитарную инфильтрацию и экспрессию маркеров воспаления [20, 22]. Более того, по мнению G. Rastrelli и соавт. при определенных ситуациях хроническое воспаление может играть не меньшую роль в развитии ДГПЖ, чем андрогенная стимуляция [3, 22].
Таким образом, более частое развития ДГПЖ с сопутствующими расстройствами мочеиспускания и более быстрое прогрессирование заболевания при наличии МС связано с индуцированным нарушением углеводно-липидного обмена, развитием оксидантного стресса и хронического абактериального воспаления, негативно влияющих на функцию органов [22]. Однако конкретные патогенетические механизмы этих нарушений мало исследованы.
Этим вопросам посвящено настоящее исследование.
МАТЕРИАЛЫ И МЕТОДЫ
Опыты проведены на 20 белых беспородных крысах-самцах массой 290-320 г. У 10 животных моделировали МС (1-я группа), а 10 крыс служили контролем (2-я группа). Моделирование МС осуществляли путем содержания животных в течение 3 месяцев на диете с повышенным содержание углеводов и жиров, как описано в работе [24]. В конце периода наблюдения у всех животных определяли суточный диурез, брали пробы крови и мочи, удаляли ПЖ и мочевой пузырь для определения их массы и проведения гистологического исследования. Выполняли биохимическое исследование крови и мочи с определение показателей функции почек и состояние углеводного и липидного обмена. Также определяли активность ряда ферментов в моче и в стенке мочевого пузыря на автоматическом анализаторе «ADVIA-2000», как описано в работе [20]. Уровень инсулина в крови определяли иммунохемилюминесцентным методом на иммунохимическом анализаторе Access 2 («Beckman Coulter»).
Тонкие срезы ткани ПЖ и мочевого пузыря сразу после удаления органов исследовали методом лазерной конфокальной микроскопии с окрашиванием флуоресцентными зондами – этиловым эфиром тетраметил-родамина (TMRE) для определения активности митохондрий и 2,4-дихлорфлуоресцеин в виде диацетатного эфира (2,4-DCF) в качестве маркера на активные формы кислорода, как описано в работах [25, 26].
Статистическую обработку цифровых данных проводили по методу Стьюдента с использованием программы Statistica 10. Усредненные данные выражали в виде средних значений и ошибки средней (M±m), достоверными считали различия при p<0,05.
РЕЗУЛЬТАТЫ
Через 3 месяца масса тела крыс в группе с МС возросла на 17,3% (с 298±8 г до 356±7 г), тогда как в контрольной группе – лишь на 5,3% (с 305±6 до 322±6 г) (p<0,01). В крови животных с МС выявлялись характерные биохимические изменения: гипергликемия с увеличением уровня инсулина в крови, гиперурикемия, гипертриглицеридемия, а также увеличение соотношения холестерина липопротеидов низкой и высокой плотности (ХЛПНП/ХЛПВП) (табл. 1).
Таблица 1. Биохимические показатели крови в сравниваемых группах
Table 1. Biochemical parameters of blood in the compared groups
| Показатели Parameters |
МС (1-я группа) MS (1-st group) |
Контроль (2-я группа) CONTROL (2-ND GROUP) |
|---|---|---|
| Глюкоза (мМ/л) Glucose (mM/l) |
8,6±0,2*** | 6,8±0,2 |
| Мочевая кислота (мМ/л) Uric acid (mM/l) |
0,09±0,005* | 0,06±0,005 |
| Триглицериды (мМ\Л) Trigleceride (mM/l) |
1,49±0,13*** | 0,41±0,03 |
| ХЛПНП (мМ/л) CLPLD (mM/l) |
0.36±0,04 | 0,32±0,02 |
| ХЛПВП (мМ/л) CLPHD (mM/l) |
0,44±0,04 | 0,51±0,04 |
| ХЛПНП/ ХЛПВП CLPLD/ CLPHD |
0,81±0,02** | 0,63±0,03 |
| Инсулин (МЕ) Insulin (IU) |
0,14±0,02* | 0,06±0,02 |
Достоверность различий: *p<0,05, **p<0,01, ***p<0,001
Significance of differences: *p<0.05, **p<0.01, ***p<0.001
Масса ПЖ у крыс с МС увеличилась на 23,2% по сравнению с массой железы контрольных крыс (с 0,86±0,03 до 1,12±0,04 г) (p<0,05), а гистологическое исследование выявило типичную картину ДГПЖ с развитием очаговой простатической интраэпителиальной неоплазии (ПИН) низкой степени (рис. 1).
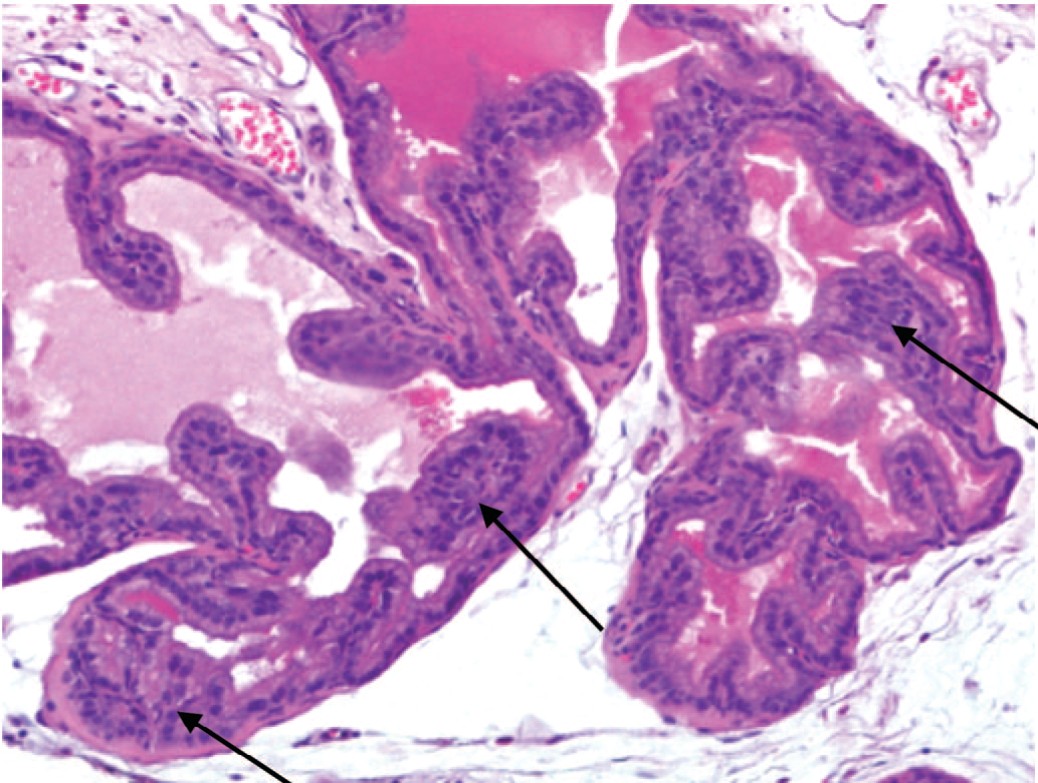
Рис. 1. Развитие ДГПЖ с очаговой ПИН низкой степени (указаны стрелками) у крыс с МС. Окраска гематоксилином и эозином. Ув. 200х
Fig. 1. The development of BPH with low-grade focal PIN (indicated by arrows) in rats with MS. Stained with hematoxylin and eosin. Magnification 200x
Масса удаленного пузыря у крыс с МС также была достоверно больше, чем у крыс контрольной группы (увеличение с 93±7 до 136±11 г, на 28,7%), а при гистологическом исследовании выявили развитие гипертрофии детрузора и гиперплазию уротелия (рис. 2), что является характерными морфологическим признаками инфравезикальной обструкции, вызванной развитием ДГПЖ.
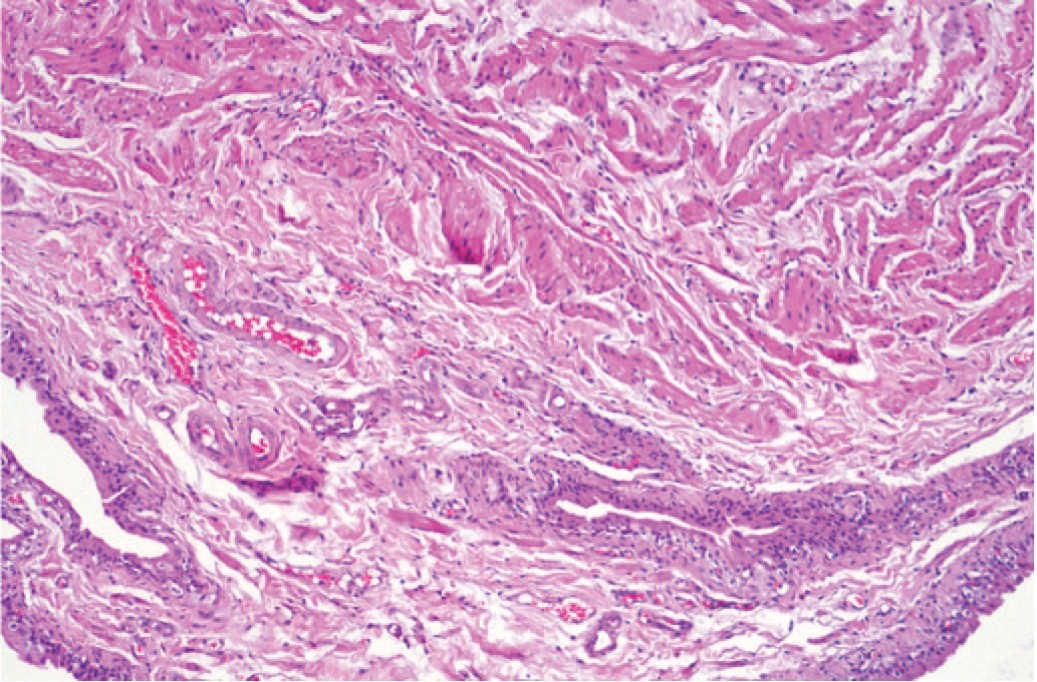
Рис. 2. Гипертрофия мочевого пузыря и гиперплазия уротелия у крыс с МС. Окраска гематоксилином и эозином. Ув. 100х
Fig 2. Bladder hypertrophy and urothelial hyperplasia in rats with MS. Stained with hematoxylin and eosin. Magnification 100x
Таким образом, у крыс опытной группы развивались метаболические изменения, типичные для МС, с формированием ДГПЖ и сопутствующими изменениями состояния мочевого пузыря.
У этих крыс с доказанным МС методом лазерной конфокальной микроскопии срезов свежеудаленных органов, позволяющей изучать метаболические процессы реально протекающие в живой ткани, определяли связь активации продукции активных форм кислорода (АФК), определяющих развитие оксидантного стресса, с состоянием митохондрий и метаболическими последствиями, влияющими на функциональное состояние ПЖ и мочевого пузыря.
При окрашивании срезов ПЖ и мочевого пузыря флуоресцентным зондом DCF, интенсивность свечения которого пропорциональна его взаимодействию с АФК, установили, что у крыс с МС интенсивность флуоресценции DCF оказалась существенно выше, чем у крыс контрольной группы (рис. 3А), что свидетельствовало о значительном увеличении продукции активных форм кислорода.
При этом усиленная продукция АФК выявляется преимущественно в эпителии простатических желез, но также определялась в клетках интерстициальной ткани, относящихся к клеткам воспалительной реакции (рис. 3Б), тогда как в норме флуоресценции интерстициальных клеток не обнаруживали.
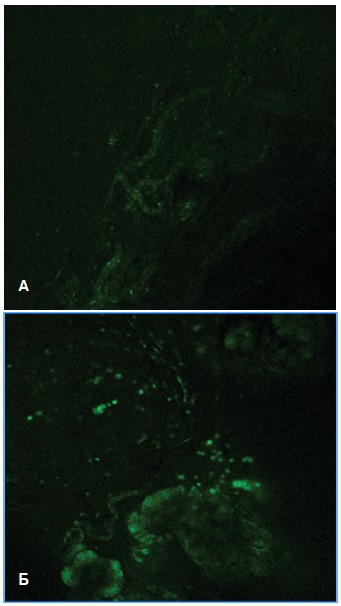
Рис. 3. Интенсивность флуоресценции DCF в срезах предстательной железы интактных крыс (А) и при моделировании МС (Б)
Fig 3. The intensity of DCF fluorescence in rat prostate sections in intact rats (A) and in MS modeling (Б)
При окрашивании срезов ПЖ зондом TMRE, который способен накапливаться в функционально полноценных митохондриях с высоким трансмембранным потенциалом, установили, что интенсивность флуоресценции зонда в опытах с крысами 1-й группы (с МС) оказалась существенно ниже, чем в опытах с контрольными крысами (рис. 4). Это свидетельствует о развивающемся повреждении митохондриального аппарата эпителиальных клеток простатических желез с уменьшением доли митохондрий с высоким трансмембранным потенциалом, участвующих в синтезе аденозинтрифосфата (АТФ), и увеличении доли функционально неполноценных митохондрий, что является признаком развития энергодефицитного состояния клеток и тканевой гипоксии.
В связи с липофильными свойствами TMRE способен также связываться с липидным компонентом секрета простатических желез (лецитиновые зерна, кристаллы холестерина, липоидные тельца), вызывая их флуоресценцию. В контрольных опытах выявляли наличие окрашенного секрета в просвете большинства желез, а также в просвете простатических протоков (рис. 4А), то в время как в ПЖ крыс с МС окрашивалась лишь небольшая часть желез с наличием секрета в их просвете (рис. 4Б), а в протоках желез секрет практически не выявлялся. Флуоресцировали лишь гладкомышечные клетки протока. При этом в этих же клетках протока отмечали усиленную продукцию АФК, проявляющейся в интенсивной флуоресценции DCF (рис. 5).
Количественное определение интенсивности флуоресценции DCF и TMRE (усредненные данные в 45 полях зрения) выявило достоверное увеличение свечения DCF на 55% и уменьшение свечения TMRE в ткани ПЖ крыс с МС на 43% (p<0,05).
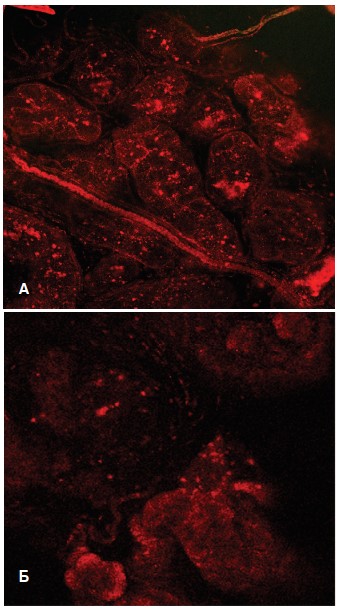
Рис. 4. Флуоресценция зонда TMRE в срезах предстательной железы интактных крыс (А) и крыс с МС (Б)
Fig 4. Fluorescence of the TMRE probe in prostate sections of intact rats (A) and rats with MS (Б)
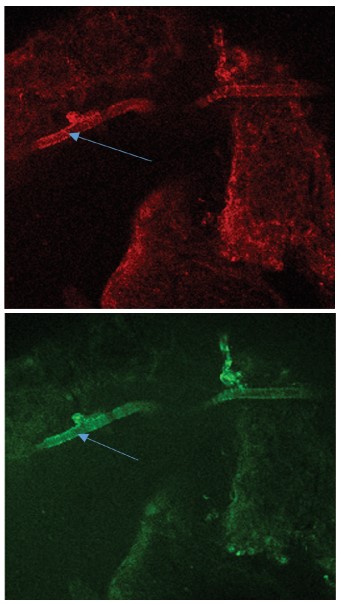
Рис. 5. Флуоресценция зондов TMRE (красный цвет) и DCF (зеленый цвет) в срезах предстательной железы крыс с МС. Стрелками указан проток предстательной железы без секрета
Fig. 5. Fluorescence of TMRE (red) and DCF (green) probes in prostate sections of rats with MS. The arrows indicate the prostate duct without a secret.
Полученные данные свидетельствуют, что при развитии МС в ткани ПЖ усиливается продукция АФК с ухудшением функциональной активности митохондрий эпителия простатических желез, что ведет к снижению функциональной активности органа.
При исследовании срезов мочевого пузыря крыс с МС также, как и в ПЖ, наблюдали активацию продукции АФК (усиление флуоресценции DCF) в гладкомышечных клетках детрузора наряду с ухудшением функционального состояния митохондрий этих клеток (уменьшение интенсивности флуоресценции TMRE (рис. 6). В норме в гладкомышечных клетках детрузора выявлялось минимальное свечение DCF (рис. 6А), которое резко усиливалось у крыс с МС (рис. 6Б). При этом в интерстиции обнаруживались скопления клеток, активно продуцирующие АФК (рис. 6Б), являющиеся клетками воспалительной реакции, усиливающие развивающийся оксидантный стресс. Интенсивность флуоресценции TMRE в митохондриях клеток детрузора диффузно снижалась.
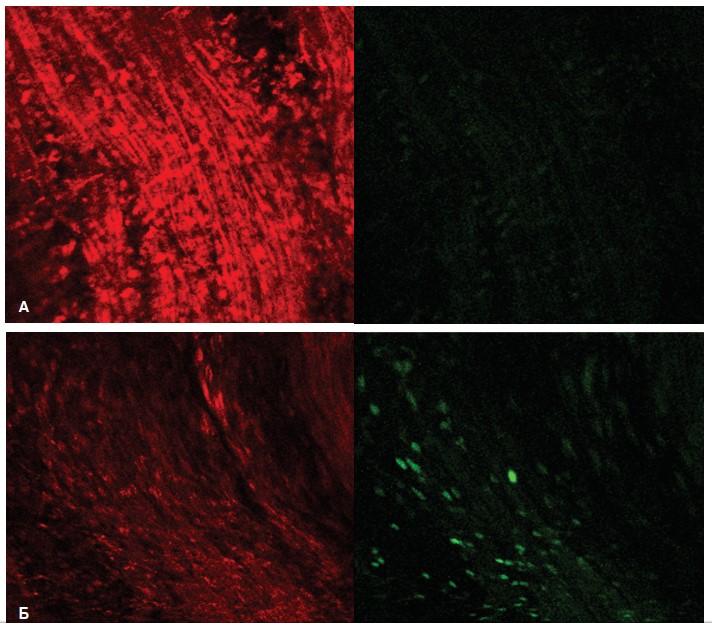
Рис. 6. Интенсивность флуоресценции TMRE (красный цвет) и DCF (зеленый цвет) в срезах мочевого пузыря интактных крыс (А) и крыс с МС (Б)
Fig. 6. The fluorescence intensity of TMRE (red) and DCF (green) in the bladder sections of intact rats (A) and rats with MS (Б)
Количественный анализ интенсивности флуоресценции, проведенный в 50 полях зрения, выявил, что флуоресценция TMRE в детрузоре снижалась на 28,6%, а DCF – возрастала на 93,4%.
Таким образом, у крыс с МС в мочевом пузыре, как и в ПЖ, происходит активация продукции АФК (оксидантный стресс) с нарушением функции митохондрий, что может являться причиной развивающейся дисфункции органа.
Избыточная продукция АФК вызывает повреждение клеточных структур, в том числе цитоплазматической мембраны клеток и мембран внутриклеточных органелл, что может вести к нарушению их барьерных свойств и при выраженном повреждении – к гибели клеток. Маркером выраженности повреждения клеток является выход из них внутриклеточных ферментов с увеличением их активности в окружающей среде (в частности, в моче) и снижением активности в ткани органов.
Проведенное сравнительное исследование активности ряда внутриклеточных ферментов в моче интактных крыс и крыс с МС выявило достоверное увеличение активности всех изученных ферментов (табл. 2).
Таблица 2. Активность внутриклеточных ферментов в моче (МЕ/мМ креатинина) и в ткани мочевого пузыря и предстательной железы (МЕ/мг белка) интактных крыс и крыс с МС
Table 2. The activity of intracellular enzymes in the urine (IU / mM of creatinine) and in the bladder and prostate tissue (IU / mg of protein) of intact rats and rats with MS
| Ферменты Enzymes |
Моча Urine |
Ткань мочевого пузыря Bladder tissue |
Ткань предстательной железы Рrostate tissue |
|||
|---|---|---|---|---|---|---|
| Норма/norm | МС/MS | Норма/norm | МС/MS | Норма/norm | МС/MS | |
| АСТ AST | 1,5±0,3 | 3,7±0,8* | 312±14 | 239±15** | 20,9±0,3 | 58,5±5,7** |
| АЛТ ALT | 1,1±0,4 | 3,9±0,5* | 36±0,8 | 27±3,2* | 14,3±1,2 | 19,1±1,6* |
| Щелочная фосфатаза Alkaline phosphatase |
25,1±5,3 | 55,7±3,3** | 371±48 | 147±17** | 533±52 | 354±32* |
| ЛДГ LDH |
4,9±1,3 | 11,1±0,5** | 1481±56 | 875±32** | 149±13 | 189±29 |
Достоверность различий: *p<0,05, **p<0,01, ***p<0,001
Significance of differences: *p<0.05, **p<0.01, ***p<0.001
При этом активность этих же ферментов в ткани мочевого пузыря достоверно снижалась, что позволило заключить, что источником гиперферментурии являются клетки мочевого пузыря (эпителий и гладкомышечные клетки детрузора). В ткани ПЖ выявлена другая картина. Активность трансаминаз (АСТ, АЛТ) достоверно возрастала, активность ЛДГ достоверно не менялась, хотя также имела тенденцию к росту, а активность щелочной фосфатазы достоверно снижалась.
ОБСУЖДЕНИЕ
Результаты, полученные в ходе экспериментальных исследований с моделированием МС у крыс, подтвердили описанные в литературе данные о связи развивающихся метаболических нарушений углеводно-липидного обмена с формированием ДГПЖ и развитием гипертрофии мочевого пузыря, являющейся признаком дисфункции мочеиспускания. Выявленные патологические изменения как в ПЖ, так и в мочевом пузыре крыс с МС, происходили на фоне активации продукции АФК (что выявляли по усилению флуоресценции зонда DCF), способствующие развитию оксидантного стресса. В ПЖ основным источником АФК являлся эпителий простатических желез, а в мочевом пузыре – гладкомышечные клетки детрузора. При этом в обоих органах у крыс с МС в интерстициальной ткани выявляли значительное количество клеток, активно продуцирующих АФК, что позволяет отнести их к клеткам воспаления и сделать заключение о развитии неспецифической воспалительной реакции в ткани этих органов. По мнению C. De Nunzio и соавт. ПЖ является иммунокомпетентным органом, обладающим сложной иммунной системой, которая может активироваться при действии различных стимулов, в том числе комплексом метаболических нарушений (помимо инфекции, возрастных изменений, рефлюкса мочи и аутоиммунных процессов), что приводит к формированию неспецифической воспалительной реакции [22].
Поскольку АФК являются радикальными соединениями, способными при повышенной концентрации повреждать белковые структуры, в том числе ферменты, активировать перекисное окисление липидов, в том числе входящих в состав клеточных мембран, а также повреждать ДНК, нарушая процесс регенерации клеток, выявленная усиленная продукция АФК может вызывать деструктивные процессы в клетках и инициировать воспалительную реакцию в ответ на развивающееся повреждение. Ее развитие при МС подтверждается данными ряда авторов об увеличении экспрессии провоспалительных цитокинов (интерлейкинов 1β, 6, 8, фактора некроза опухолей), производных эйкозаноидов, являющихся медиаторами воспаления липидного происхождения, а также инфильтрации ткани органов нейтрофильными лейкоцитами, активированными лимфоцитами и макрофагами [21, 23, 27-29].
Происходящие патологические процессы в ПЖ и мочевом пузыре крыс с МС проявляются также в ухудшении функционального состояния пула митохондрий в эпителии простатических желез и гладкомышечных клеток детрузора, что проявлялось в снижении накопления флуоресцентного зонда TMRE. Это соединение способно проникать за счет активного транспорта только в активно функционирующие митохондрии с высоким трансмембранным потенциалом. Поврежденные митохондрии со сниженным потенциалом при этом не окрашиваются. Снижение интенсивности флуоресценции TMRE в изученных органах указывает на возрастание доли функционально поврежденных митохондрий с нарушенной АТФ-синтезирующей способностью или ее утратившей, то есть на развитие энергодефицитного состояния (тканевой гипоксии). При этом в наших опытах выявлена связь активации продукции АФК с нарушением функции митохондрий. С одной стороны, оксидантный стресс, повреждая наружную митохондриальную мембрану, может быть причиной их дисфункции, а с другой стороны – именно в поврежденных митохондриях с нарушенной АТФ-синтетической способностью происходит активация продукции АФК [30, 31]. Таким образом, формируется «порочный круг» взаимоусиления оксидантного и гипоксического повреждения клеток.
Определение активности внутриклеточных ферментов в ткани ПЖ у крыс с МС выявило увеличение активности трансаминаз (АЛТ, АСТ) и тенденцию к увеличению активности ЛДГ по сравнению с опытами на интактных крысах, что может быть связано с активными пролиферативными процессами в гиперплазированной ПЖ. При этом активность щелочной фосфатазы достоверно снижалась. Учитывая, что этот фермент имеет как растворимую цитоплазматическую фракцию, так и фракцию, связанную с мембранами митохондрий, снижение ее активности может косвенно указывать на деструкцию части митохондрий и выход фермента за пределы клеток, что может вносить вклад в повышении активности щелочной фосфатазы в моче крыс с МС.
Остается неясен вопрос о первичности механизма повреждения – является ли триггером цепи патологических процессов оксидантный стресс, вызвавший последующее повреждение митохондрий, или оксидантный стресс развивается вторично. В литературе имеется ряд данных, полученных как в экспериментах на животных, так и в клинических исследованиях, свидетельствующих о том, что при развитии МС происходит ухудшение кровоснабжения тазовых органов, приводящиее к развитию тканевой гипоксии. В работе В.И. Кирпатовского и соавт. показано, что при моделировании МС у крыс происходит 2-3 кратное ухудшение параметров микроциркуляции как в ПЖ, так и в мочевом пузыре [24]. В клинических исследованиях ряд авторов отмечал возрастание индекса резистивности простатических артерий и артерий шейки мочевого пузыря [32, 33]. У значительной части больных ДГПЖ на фоне МС отмечали наличие выраженной артериальной гипертонии и атеросклероза магистральных сосудов, что ухудшает кровоснабжение тазовых органов [34]. Данные P. Vaupel и соавт. свидетельствуют о значительном снижении парциального давления кислорода в ткани измененной ПЖ (6 мм рт. ст. по сравнению с 26 мм рт. ст. в норме). Состояние гипоксии гиперплазированной ПЖ подтверждают установленные этими авторами данные об усилении экспрессии фактора, индуцируемого гипоксией-1α (HIF-1α), относящегося к провоспалительным цитокинам [35]. Таким образом, возможно, что первичным патогенетическим фактором инициации патологического процесса в ПЖ и мочевом пузыре являются нарушения системной гемодинамики вследствие заболеваний сердечно-сосудистой системы, являющихся важными компонентами МС.
Развитие оксидантного стресса и тканевой гипоксии негативно сказывается на функциональном состоянии ПЖ и мочевого пузыря. Если в норме при конфокальной микроскопии во всех железах и в протоках выявляли окрашенный TMRE секрет, то в ПЖ крыс с МС секреторная активность простатических желез была резко снижена: секрет выявлялся лишь в просвете отдельных желез и не выявлялся в их протоках. Снижение флуоресценции секрета ПЖ отражает уменьшение содержания в нем липидных компонентов (лецитиновых зерен, кристаллов холестерина, липоидных телец). Поскольку считается, что количественное содержание лецитиновых зерен и кристаллов холестерина в секрете ПЖ отражает ее функциональное состояние, то их уменьшение свидетельствует о нарушении функции этого органа [36]. То есть, помимо развития ДГПЖ МС приводит к нарушению секреторной функции железистого эпителия. Возможно, это связано с частым развитием андрогенного дефицита, выявляемым при МС как в экспериментальных исследованиях, так и в клинике [24, 37-39].
В мочевом пузыре крыс с МС также развиваются нарушения, влияющие на его функциональную полноценность. Определение активности внутриклеточных ферментов в ткани мочевого пузыря и в моче выявило достоверное снижение активности всех ферментов в ткани мочевого пузыря при повышении их активности в моче, что является отражением процессов цитолиза и выхода ферментов из поврежденных клеток в мочу. Поскольку основную долю ткани мочевого пузыря составляет мышечная оболочка (детрузор), логично предположить, что снижение тканевой активности ферментов и рост ферментурии связан с повреждением гладкомышечных клеток, что является основой дисфункции мочевого пузыря, выявляемой как в экспериментальных исследованиях, так и в клинике у больных с МС, преимущественно по типу гиперактивности детрузора [6, 24, 40, 41].
ЗАКЛЮЧЕНИЕ
Таким образом, патогенетической основой дисфункции ПЖ и мочевого пузыря при развитии МС является активация продукции активных форм кислорода и развитие тканевой гипоксии вследствие дисфункции митохондрий, что ведет к формированию неспецифической воспалительной реакции. Эти изменения в предстательной железе ведут как формированию ДГПЖ, так и к снижению секреторной активности простатических желез, а в мочевом пузыре – к повреждению клеток детрузора, ведущего к нарушению его функции.
ЛИТЕРАТУРА
- Chughtai B, Forde JC, Dana Marie Thomas D, Laor L, Hossack T, Henry H Woo, et al. Benign prostatic hyperplasia Nat Rev Dis Primers 2016(2):16031. https://doi.org/10.1038/nrdp.2016.31.
- Foo KT. What is a disease? What is the disease clinical benign prostatic hyperplasia (BPH)? World J Urol 2019;37(7):1293-1296. https://doi.org/10.1007/s00345-019-02691-0.
- Rastrelli G, Vignozzi L, Corona G, Maggi M. Testosterone and benign prostatic hyperplasia. Sex Med Rev 2019;7(2):259-271. https://doi.org/10.1016/j.sxmr.2018.10.006.
- Vignozzi L, Gacci M, Maggi M. Lower urinary tract symptoms, benign prostatic hyperplasia and metabolic syndrome. Nat Rev Urol 2016;13(2):108-119. https://doi.org/10.1038/nrurol.2015.301.
- Yin Z, Yang JR, Rao JM, Song W, Zhou KQ. Association between benign prostatic hyperplasia, body mass index and metabolic syndrome in Chinese men. Asian J Androl 2015;17(5):826-830. https://doi.org/10.4103/1008.-682X.148081.
- De Nunzio C, Cindolo L, Gacci M, Pellegrini F, Carini M, Lombardo R, et al. Metabolic syndrome and lower urinary tract symptoms in patients with benign prostatic enlargement: a possible link to storage symptoms. Urology 2014;84(5):1181-1187. https://doi.org/10.1016/j.urology.2014.07.018.
- Yoo S, Oh S, Park J, Cho SY, Cho MC, Jeong H, Son H. The impacts of metabolic syndrome and lifestyle on the prevalence of benign prostatic hyperplasia requiring treatment: historical cohort study of 130454 men. BJU Int 2019;123(1):140-148. https://doi.org/10.1111/bju.14528.
- Fu Y, Zhou Z, Yang B, Zhang K, He L, Zhang X. The relationship between the clinical progression of benign prostatic hyperplasia and metabolic syndrome: a prospective study. Urol Int 2016;97(3):330-335. https://doi.org/10.1159/000448484.
- Sebastianelli A, Gacci M. Current status of the relationship between metabolic syndrome and lower urinary tract symptoms. Eur Urol Focus 2018;4(1):25-27. https://doi.org/10.1016/j.euf.2018.03.007.
- Calogero AE, Burgio G, Condorelli A, Cannarella R, La Vignera S. Epidemiology and risk factors of lower urinary tract symptoms/benign prostatic hyperplasia and erectile dysfunction. Aging Male 2019;22(1):12-19. https://doi.org/10.1080/13685538.2018.1434772.
- Byun HK, Sung YH, Kim W, Jung JH, Song JM, Chung HC. Relationship between prostate-specific antigen, prostate volume and components of metabolic syndrome in healthy Korean men. Korean J Urol 2012;53(11):774-778. https://doi.org/10.4111/kju.2012.53.11.774.
- Rohrmann S, Smit E, Giovannucci E, Platz EA. Association between markers of the metabolic syndrome and lower urinary tract symptoms in the Third National Health and Nutrition Examination Survey (NHANES III). Int J Obes (Lond) 2005;29(3):310-316. https://doi.org/10.1038/sj.ijo.0802881.
- Pashootan P, Ploussard G, Cocaul A, Gouvello A, Desgrandchamps F. Association between metabolic syndrome and severity of lower urinary tract symptoms (LUTS): an observation study in a 4666 European men cohort. BJU Int 2015;116(1):124-130. https://doi.org/10.1111/bju.12931.
- Park JS, Koo KC, Kim HK, Chung BH, Lee KS. Impact of metabolic syndrome-related factors on the development of benign prostatic hyperplasia and lower urinary tract symptoms in Asian population. Medicine (Baltimore) 2019;98(42):e17635. https://doi.org/10.1097/MD.0000000000017635.
- Zhang X, Zeng X, Liu Y, Dong L, Zhao X, Qu X. Impact of metabolic syndrome on benign prostatic hyperplasia in elderly Chinese men. Urol Int 2014;93(2):214-219. https://doi.org/10.1159/000357760.
- Russo GI, Castelli T, Urzi D, Privitera S, La Vignera S, Condorelli RA, et al. Emerging links between non-neurogenic lower urinary tract symptoms secondary to benign prostatic obstruction, metabolic syndrome and its components: A systematic review. Int J Urol 2015;22(11):982-990. https://doi.org/10.1111/iju.12877.
- Расин М.С. Хроническое воспаление и инсулинорезистентность в патогенезе доброкачественной гиперплазии предстательной железы (обзор литературы). Экспериментальная и клиническая урология 2016(1):52-56. [Rasin M.S. Chronic inflammation and insulin resistance in the pathogenesis of benign prostatic hyperplasia (literature review). Eksperimental'naya i klinicheskaya urologiya = Experimental and clinical urology 2016(1):52-56. (in Russian)].
- Vanella L, Russo GI, Cimino S, Fragalà E, Favilla V, Li Volti G, et al. Correlation between lipid profile and heme oxygenase system in patients with benign prostatic hyperplasia. Urology 2014;83(6):1444:7-13. https://doi.org/10.1016/j.urology.2014.03.007.
- Gacci M, Vignozzi L, Sebastianelli A, Salvi M, Giannessi C, De Nunzio C, et al. Metabolic syndrome and lower urinary tract symptoms: the role of inflammation. Prostate Cancer Prostatic Dis 2013(16):101-106. https://doi.org/10.1038/pcan.2012.44.
- Cantiello F, Cicione A, Salonia A, Autorino R, Ucciero G, Tucci L, et al. Metabolic syndrome correlates with periurethral fibrosis secondary to chronic prostate inflammation: evidence of a link in a cohort of patients undergoing radical prostatectomy. Int J Urol 2014;21(3):264-269. https://doi.org/10.1111/iju.12233.
- Xia BW, Zhao SC, Chen ZP, Chen C, Liu TS, Yang F, Yan Y. The underlying mechanism of metabolic syndrome on benign prostatic hyperplasia and prostate volume. Prostate 2020;80(6):481-490. https://doi.org/10.1002/pros.23962.
- De Nunzio C, Presicce F, Tubaro A. Inflammatory mediators in the development and progression of benign prostatic hyperplasia. Nat Rev Urol 2016;13(10):613-26. https://doi.org/10.1038/nrurol.2016.168.
- He Q, Wang Z, Liu G, Daneshgari F, MacLennan GT, Gupta S. Metabolic syndrome, inflammation and lower urinary tract symptoms: possible translational risks. Prostate Cancer Prostatic Dis 2016;19(1):7-13. https://doi.org/10.1038/pcan.2015.43.
- Кирпатовский В.И., Чочуев О.С., Голованов С.А., Дрожжева В.В., Кудрявцева Л.В., Фролова Е.В., Казаченко А.В. Экспериментально вызванный метаболический синдром у крыс: патогенез развития ДГПЖ и дисфункции мочеиспускания. Экспериментальная и клиническая урология 2016;(4):4-9. [Kirpatovskiy V.I., Chochuev O.S., Golovanov S.A., Drozhzheva V.V., Kudryavtseva L.V., Frolova E.V., Kazachenko A.V. Experimentally induced metabolic syndrome in rats: pathogenesis of BPH and urinary dysfunction. Eksperimental'naya i klinicheskaya urologiya = Experimental and clinical urology 2016;(4):4-9. (In Russian)].
- Плотников Е.Ю., Высоких М.Ю., Цвиркун Д.В., Казаченко A.B., Кирпатовский В.И., Зоров, Д.Б. Митохондриальная регуляция продукции активных форм кислорода и азота в клетках почки крысы при ишемии / реперфузии. Доклады академии наук 2005;400(5):701-704. Plotnikov E. Ju., Visokhih M. Ju., Tsvirkun D.V., Kazachenko A.V., Kirpatovskiy V.I., Zorov D.B. Mitochondrial regulation of active oxygen and nitrite forms production in rat kidney cells in ischemia/reperfusion. Dokladi Acadimii Nauk 2005;400(5):701-704. (In Russian).
- Кирпатовский В.И., Плотников Е.Ю., Казаченко А.В., Голованов С.А., Сыромятникова Е.В., Высоких М.Ю., Зоров Д.Б. Роль генерации митохондриями активных форм кислорода и оксида азота в постишемических расстройствах функции почки. Урология 2006(4):19-23. [Kirpatovskiy V.I., Plotnikov E.Ju., Kazachenko A.V., Golovanov S.A., Ciromjatnikova E.V., Visokhih M.Ju., Zorov D.B. Role of mitochondrial generation of active oxygen forms and nitric oxide in postischemical renal function disorders. Urologiya = Urologiia 2006(4):19-23 (In Russian)].
- Freinbichler W, Colivicchi MA, Stefanini C, Bianchi L, Ballini C, Misini B, et al. Highly reactive oxygen species: detection, formation, and possible functions. Cell Mol Life Sci 2011;68(12):2067-79. https://doi.org/10.1007/s00018-011-0682-x.
- Vignozzi L, Morelli A, Sarchielli E, Comeglio P, Filippi S, Cellai I, et al. Testosterone protects from metabolic syndrome-associated prostate inflammation: an experimental study in rabbit. J Endocrinol 2012;212(1):71-84. https://doi.org/10.1530/JOE-11-0289.
- Grzesiak K, RyЕ A, Stachowska E, Słojewski M, Rotter I, Ratajczak W, et al. The relationship between eicosanoid levels and serum levels of metabolic and hormonal parameters depending on the presence of metabolic syndrome in patients with benign prostatic hyperplasia. Int J Environ Res Public Health 2019;16(6):1006. https://doi.org/10.3390/ijerph16061006.
- Dan Dunn J, Alvarez LA, Zhang X, Soldati T. Reactive oxygen species and mitochondria: A nexus of cellular homeostasis. Redox Biol 2015(6):472-485. https://doi.org/10.1016/j.redox.2015.09.005.
- Lambert AJ, Brand MD. Reactive oxygen species production by mitochondria. Methods Mol Biol 2009(554):165-81. https://doi.org/10.1007/978-1-59745-521-3_11.
- Abdelwahab O, El-Barky E, Khalil M.M, Kamar A. Evaluation of the resistive index of prostatic blood flow in benign prostatic hyperplasia. Int Braz J Urol 2012;38(2):250-255. https://doi.org/10.1590/s1677- 55382012000200014.
- Shinbo H, Kurita Y, Nakanishi T, Imanishi T, Otsuka A, Furuse H, et al. Resistive index: a newly identified predictor of outcome of transurethral prostatectomy in patients with benign prostatic hyperplasia. Urology 2010;75(1):143-147. https://doi.org/10.1016/j.urology.2009.08.017.
- Hwang EC, Kim SO, Nam DH, Yu HS, Hwang I, Jung SI, et al. Men with hypertension are more likely to have severe lower urinary tract symptoms and large prostate volume. Low Urin. Trac Symptoms 2015;7(1):32-36. https://doi.org/10.1111/luts.12046.
- Vaupel P, Kelleher DK. Blood flow and oxygenation status of prostate cancers. Adv Exp Med Biol 2013(765):299-305. https://doi.org/10.1007/978-1-4614-4989-8_42.
- Андрология. под ред. Щеплев П.А., Аполихин О.И. (Клинические рекомендации. М.: изд. МЕДПРАКТИКА-М, 2007;164 с. [Sheplev P.A., Apolikhin O.I., editors. Andrology. (Clinical recommendations). Medpractica-M, 2007;164 p. (In Russian)].
- Тюзиков И.А., Греков Е.А., Калинченко С.Ю. Варианты клинического течения и морфометрических параметров доброкачественной гиперплазии предстательной железы у мужчин с метаболическим синдромом и андрогенным дефицитом. Урология 2015(5):66-69. [Tyuzikov I.A., Grekov E.A., Kalinchenko S.Ju. Variants of the clinical course and morphometric parameters of benign prostatic hyperplasia in men with metabolic syndrome and androgen deficiency. Urologiya = Urologiia 2015(5):66-69. (in Russian)].
- Vikram A, Jena G. Role of insulin and testosterone in prostatic growth: who is doing what? Med Hypotheses 2011;76(4):474-8. https://doi.org/10.1016/j.mehy.2010.11.024.
- Калинченко С.Ю., Тюзиков И.А., Ворслов Л.О., Тишова Ю.А. Ожирение, инсулинорезистентность и репродуктивное здоровье мужчины: патогенетические взаимодействия и современная патогенетическая фармакотерапия. Эффективная фармакотерапия 2015(27):66-79. [Kalinchenko S. Ju., Tyuzikov I.A., Vorslov L.O., Tishova Ju.A. Obesity, insulin resistance, and male reproductive health: pathogenetic interactions and modern pathogenetic pharmacotherapy. Effektivnaya farmakoterapiya = Effective pharmacotherapy 2015(27):66-79. (In Russian)].
- Кирпатовский В.И., Мудрая И.С., Греков Е.А., Кабанова И.В., Голованов С.А., Дрожжева В.В. и др. Влияние экспериментально вызванного метаболического синдрома на функциональное состояние мочевого пузыря у крыс. Экспериментальная и клиническая урология 2013(1):8-13. [Kirpatovskiy V.I., Mudraya I.S., Grekov E.A., Kabanova I.V., Golovanov S.A., Drozhzheva V.V., et al. The effect of experimentally induced metabolic syndrome on the functional state of the bladder in rats. Eksperimental'naya i klinicheskaya urologiya = Experimental and Сlinical urology 2013(1):8-13. (In Russian)].
- Zhao S, Chen C, Chen Z, Xia M, Tang J, Shao S, et al. Relationship between metabolic syndrome and predictors for clinical benign prostatic hyperplasia progression and International Prostate Symptoms Score in patients with moderate to severe lower urinary tract symptoms. Urol J 2016;13(3):2717-2726.









Комментарии