Журнал "Экспериментальная и клиническая урология" Выпуск №2 за 2015 год
Гулиев Б.Г., Загазежев А.В.
Протяженные рецидивные сужения мочеточников являются показанием к выполнению сложных реконструктивных операций с использованием неизмененных тканей мочевыводящих путей, изолированных сегментов тонкой кишки или аутотрансплантации почки [1, 2, 3]. При неэффективности этих операций, тяжелом соматическом состоянии больных, не позволяющем проведения подобных вмешательств, приходится прибегать к пункционной нефростомии или внутреннему дренированию верхних мочевыводящих путей (ВМП) обычными или нитиноловыми стентами. Однако наличие постоянного наружного дренажа, необходимость его периодической замены ухудшают качество жизни пациента, а стандартные полиуретановые или силиконовые стенты не позволяют дренировать ВМП в течение длительного времени. Альтернативой являются нитиноловые стенты, которые в урологической практике активно применяются при лечении больных со стриктурой мочеточника и уретры, доброкачественной гиперплазией предстательной железы. За последние два десятилетия в литературе увеличилось количество публикаций о возможности хирургической коррекции сужений или облитераций мочеточника нитиноловыми эндопротезами [4 – 8]. По данным большинства авторов частыми показаниями к их использованию являются опухолевые обструкции ВМП [4 – 6], рецидивные протяженные сужения мочеточника [6 – 8] или стриктуры мочеточниково-кишечных анастомозов [9 – 10].
В отечественной литературе имеются несколько сообщений об эндопротезировании мочеточника [11–13].
Мы приводим результаты восстановления проходимости мочеточника нитиноловыми стентами у 48 больных.
МАТЕРИАЛЫ И МЕТОДЫ
С 2003 по 2015 гг. в нашей клинике эндопротезирование мочеточника выполнено 48 больным. Показанием к операции у 30 больных были рецидивные стриктуры ВМП, а у 18 – опухолевые обструкции мочеточников. Мужчин было 26, женщин – 22, возраст больных колебался от 28 до 75 лет. У 19 пациентов были диагностированы протяженные сужения брюшного отдела мочеточника, у 6 – пиелоуретерального сегмента (ПУС) мочеточника, у 4 – мочеточника пересаженной почки, у одного – стриктура уретерокаликоанастомоза после операции Нейверта. 4-м больным ранее была выполнена пересадка трупной почки по поводу хронической почечной недостаточности. Двум из них в связи с некрозом мочеточника донорской почки производилось анастомозирование собственного мочеточника с лоханкой пересаженной почки. Однако в обоих случаях отмечался рецидив стриктуры ПУС. У остальных двух пациентов было диагностировано сужение уретероцистоанастомоза. Повторные реконструктивные и эндоскопические операции у этих больных также были безуспешными. Причиной стеноза мочеточника у 6 больных была опухоль прямой кишки, у 11 – рак шейки матки. Больному с болезнью Бурневилля-Прингла был установлен металлический протез в ПУС единственной правой почки.
Показаниями к эндопротезированию мочеточника были неэффективность пластических операций на ВМП и желание больных избавиться от наружных дренажей. Во всех случаях использовали нитиноловые стенты из никелида титана. У 43 больных установили отечественный эндопротез фирмы «МИТ», а у 5 – дренирование ВМП осуществляли стентом Memokath. 47 больным было проведено одностороннее эндопротезирование мочеточника. Одному пациенту с болезнью Ормонда произведено эндопротезирование обоих мочеточников (рис. 1).
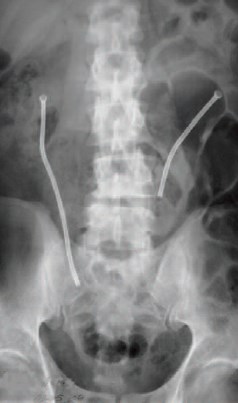
Рис. 1. Компьютерная томограмма. Эндопротезирование обоих мочеточников у больного с болезнью Ормонда
Нитиноловые эндопротезы можно установить чрескожным антеградным или трансуретральным ретроградным доступом. Перкутанное эндопротезирование мочеточника произведено у 12 пациентов. Причиной использования чрескожного доступа было наличие нефростомического дренажа, установленного ранее в связи с обструктивным пиелонефритом. У больных с пересаженной почкой также технически сложно выполнить трансуретральную уретероскопию из-за девиации мочеточника.
При антеградном эндопротезировании в положении больного на животе бужировали нефростомический ход, устанавливали кожух Amplatz. После осмотра полостной системы почки антеградно в мочеточник проводили струну, выполняли эндоуретеротомию с бужированием суженного участка мочеточника до 14 Ch. Далее проводник эндопротеза устанавливали таким образом, что его рентгеноконтрастный дистальный конец располагался на 2 – 3 см ниже зоны стриктуры. После извлечения струны в проводник вводилось доставочное устройство со встроенным в него эндопротезом. Затем выполняли антеградную пиелоуретерографию, и при правильном положении стента извлекали его толкатель. Операция заканчивалась установкой нефростомического дренажа, который при хорошей проходимости мочеточника удалялся на 3 – 5 сутки.
У 36 больных эндопротезирование выполнялось ретроградным доступом. При этом операция начиналась с цистоскопии и уретероскопии. После осмотра мочевого пузыря и мочеточника этапы установки стента были аналогичными, как при антеградном доступе. Всегда после эндопротезирования с целью контроля за состоянием ВМП и стента выполняли уретеропиелографию, на которой отмечалась нормальная проходимость протеза. Некоторые авторы рекомендуют на несколько дней дополнительно установить обычный стент, но мы к нему не прибегали. В послеоперационном периоде проводилась антибактериальная и симптоматическая терапия. Больных на 4–5 сутки выписывали на амбулаторное лечение.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Во всех случаях удалось адекватно установить нитиноловый стент в зону сужения мочеточника. Серьезных интраи послеоперационных осложнений при эндопротезировании мочеточника мы не наблюдали. В послеоперационном периоде наблюдалась гематурия у 4-х и обострение хронического пиелонефрита у трех больных. Больным в различные сроки после операции выполнялись лабораторные и инструментальные исследования, направленные на уточнение функционального состояния ВМП и почек. Результаты эндопротезирования за период наблюдения от 8 до 65 месяцев были хорошими у 31 (64,6%), удовлетворительными – у 13 (27,1%) больных. Только у 4-х (8,3%) больных наблюдались неудовлетворительные результаты, связанные с обструкцией эндопротеза пролиферативной тканью, наблюдавшиеся через 10, 12, 20 и 24 месяцев после операции. Этим больным выполнена уретероскопия с реканализацией нитинолового стента. За время наблюдения 8 из 17 онкологических пациентов умерли от прогрессирования опухолевого заболевания. Двум больным была выполнена нефрэктомия: в одном случае по поводу гнойного пиелонефрита, в другом – из-за отсутствия функции трансплантированной почки. Но проходимость нитинолового эндопротеза у этих пациентов была адекватной. У больной с болезнью БурневилляПрингла спустя 16 мес после эндопротезирования ПУС наблюдалась обструкция мочеточника увеличивающимися ангиолипоматозными узлами. Поэтому ретроградно установлен второй нитиноловый стент. У этой же больной в лоханочном конце проксимального эндопротеза образовался камень, по поводу чего проводилась перкутанная нефролитотрипсия. На компьютерной томограмме (рис. 2) визуализируются два эндопротеза, ретроградно установленные в пиелоуретеральный сегмент единственной правой почки. На лоханочном конце верхнего стента визуализируется камень. На рисунке 3 визуализируется лоханочный конец верхнего эндопротеза после контакной литорисии камня.
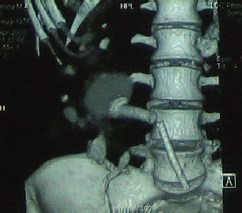
Рис. 2. Компьютерная томограмма. Два эндопротеза, ретроградно установленные в пиелоуретеральный сегмент единственной правой почки
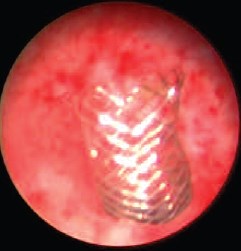
Рис. 3. Компьютерная томограмма. Лоханочный конец верхнего эндопротеза после контакной литорисии камня
Из 48 больных 30 (62,5%) имели единственную почку и в течение длительного времени дренирование ВМП осуществлялось с помощью нефростомического дренажа. Неоднократные операции на ВМП, протяженность сужения мочеточника, наличие тяжелых сопутствующих заболеваний не позволяли провести у них реконструктивные вмешательства. Поэтому эндопротезирование мочеточника у них было методом выбора, что позволяло восстановить проходимость ВМП, избавить больных от наружных дренажей и улучшить качество их жизни.
Наш собственный опыт и данные других клиник позволяют уточнить показания к эндопротезированию мочеточника, изучить отдаленные результаты этих операций и оценить их эффективность. Показаниями к данной операции первоначально были опухолевые обструкции ВМП. Так A.G. Papatsoris и N. Buchnolz 73 пациентам установили 86 эндопротезов. В 55 случаях причиной обструкции были рецидивные сужения мочеточника, в 31 случае – опухоли органов малого таза или забрюшинная лимфоаденопатия. За период наблюдения, равный в среднем 17,1 мес (от 1 до 55 мес), функция 68 (79%) эндопротезов была удовлетворительной. У 6 из остальных 18 случаев наблюдалась инкрустация эндопротеза, а у 12 – его миграция вниз по мочеточнику [6]. F.J. Burgos и соавт. выполнили эндопротезирование мочеточника 24 больным с экстенсивными сужениями ВМП [14]. Причиной нарушения уродинамики ВМП у 11 из них были опухоли органов малого таза, у 13 – протяженные стриктуры различного генеза. Эффективность дренирования нитиноловыми стентами за период наблюдения от 3 до 60 месяцев составила у 86,5%. Обструкция эндопротеза наблюдалась в двух случаях, поэтому были установлены обычные полиуретановые стенты. Онкологические больные умерли через 7, 8 и 9 месяцев после операции. У больного после облитерации эндопротеза мочеточника F.J. Burgos и соавт. выполняли аутотрансплантацию почки [15].
В литературе встречаются единичные публикации о возможности коррекции стриктур мочеточниково-кишечных анастомозов с помощью нитиноловых стентов [9, 10]. P. Palascak и соавт. сообщают о результатах антеградного эндопротезирования у 8 больных, у 7 из которых стриктура мочеточника была диагностирована в среднем через 20,9 месяцев после деривации мочи по Camey I и у одного больного – после уретероилеоанастомоза по Wallace [10]. За период наблюдения от 7 до 68 месяцев у 7 пациентов с 9 стриктурами мочеточниково-кишечный анастомоз был проходим. У одного пациента образовался камень в дистальной части эндопротеза, по поводу чего проводилась дистанционная литотрипсия. Миграцию нитинолового стента, гематурию, боль и рецидив сужения авторы не наблюдали.
Недостатками эндопротезирования мочеточника являются гиперплазия уротелия или инкрустация стента, приводящие к нарушению его проходимости. Для исключения этих осложнений некоторые авторы предлагают покрывать нитиноловые стенты антипролиферативным веществом или слоем политетрафлуороэтилена [16 – 18]. Так E. Liatsikos и соавт. проводили экспериментальные исследования с использованием обычных нитиноловых стентов и эндопротезов, покрытых PacliataxelDES, обладающим антипролиферативным действием [17]. По их данным при применении покрытых Pacliataxel-DES эндопротезов гиперплазия и воспаление в стенке мочеточника менее выражены. Отечественная компания «МИТ» производит нитиноловые стенты с покрытием из политетрафлюорорэтилена, который исключает контакт мочи и уротелия с нитями эндопротеза. Широкое использование данных эндопротезов позволит в дальнейшем оценить их эффективность в лечении больных с рецидивными и опухолевыми сужениями мочеточников.
ЗАКЛЮЧЕНИЕ
Эндопротезирование мочеточника является малоинвазивным и эффективным способом восстановления проходимости ВМП при протяженных рецидивных или опухолевых стриктурах мочеточника. Для получения хороших отдаленных результатов необходимо использовать нитиноловые эндопротезы адекватной длины, чтобы после установки концы протеза располагались проксимальнее и дистальнее сужения на 0,5 – 1,0 см. В отличие от реконструктивных операций на ВМП эндопротезирование мочеточника не является радикальным способом хирургического лечения больных с органической обструкцией ВМП. Однако у определенной группы больных с опухолевыми и рецидивными протяженными сужениями мочеточников эндопротезирование является операцией выбора.
ЛИТЕРАТУРА
1. Комяков Б.К., Гулиев Б.Г. Хирургия протяженных сужений мочеточников. СПб., Диалект, 2005. 256 с.
2. Wolf B, Chartier-KAstler E, Mozer P, Haerting A, Bittker MO, Roupret M. Long-term functional outcomes after ileal ureter substitution: a single-center experience. // Urology. 2011. Vol. 78, N 3. P. 692-695.
3. Knight RB., Hudak SJ, Morey AF. Strategies for open reconstruction for upper ureteral strictures. // Urol Clin North Am. 2013. Vol. 40, N 3. P. 351-361.
4. Barbalias GA, Siablis D, Liatsikos E.N. et al. Metal stents: a new treatment of malignant ureteral obstruction. //J. Urol. 1997. Vol.158 (1). P. 54.
5. Lang EK, Winer AG, Abbey-Mensah G, Anne R, Allaei A, Friedman F, Thomas R, La Nasa J, Davis R. Long-term results of metallic stents for malignant ureteral obstruction in advanced cervical carcinoma. // J Endourol. 2013. Vol. 27, N 5. P. 645-651.
6. Papatsoris AG, Buchnolz N. A novel thermo-expandable ureteral metal stent for the minimally invasive management of ureteral strictures. // J. Endourol. 2010. Vol. 24, N 3. P. 487-491.
7. Slavis SA, Wilson RW, Jones RJ, Swift C. Long-term results of permanent indwelling wallstents for benign mid-ureteral stents. // J. Endourol. 2000. Vol. 14, N 7. P. 1189-1193.
8. Bourdoumis A, Kachrilas S, Kapoor S, Zaman F, Papadopoulos G, Buchholz N, Masood J. The use of a thermo-expandable metal alloy stent in theminimally invasive management of retroperitoneal fibrosis: a single center experience from the United Kingdom. // J Endourol. 2014. Vol. 28, N 1. P. 96-99/
9. Barbalias GA, Liatsikos E.N, Karnabatidis D, Yarmenitis S, Siablis D. Ureteroileal anastomosic strictures: an innovative approach with metallic stents. // J Urol. 1998. Vol. 160, N 4. P. 1270.
10. Palascak P, Bouchareb M, Zachoval R, Urban M, Sauvain JL, Palascak R. Treatment of benign ureterointestinal anastomotic strictures with permanent ureteral Wallstents after Camey and Wallace urinary diversion: long-term follow-up. // J Endourol. 2001. Vol. 15, N 6. P. 575-580 (в другом журнале)
11. Мартов А.Г., Ергаков Д.В., Ларионов И.Н., Голубев М.Ю. Комбинированное лечение папиллярных опухолей лоханки и мочеточника единственной почки в сочетании с эндопротезированием мочеточника. //Урология. 2005. N 5. С. 62-64.
12. Комяков Б.К., Гулиев Б.Г. Эндопротезирование мочеточника. // Урология. 2006. N 3. С. 50-53.
13. Гулиев Б.Г., Загазежев А.М. Результаты эндопротезирования протяженных сужений мочеточника нитиноловыми стентами. // Эндоскопическая хирургия. 2013. N 2. С. 31-35.
14. Burgos FJ, Linares A, Gomez V, Seanz J., Pascual J., Briones G., Llorente M.T. Efficacy of self-expanding metallic stents for treatment of ureteral obstruction. //Eur. Urol. Suppl. 2001. Vol. 39 (5). P. 86.
15. Burgos RJ, Peres P, Arias F. Rodriguez R.P, Gomez I, Fernandez E. Renal autotransplantation: an alternative after metallic ureteral stent incrustation. // XIXth Congress of the European Association of Urology. Eur. Urol. Suppl. 2004. Vol. 3, N 2. P. 227
16. Tekin MI, Aytekin C, Aygun C, PeSkircioğlu L, Boyvat F, Ozkardeş H. Covered metallic ureteral stent in the management of malignant ureteral obstruction: preliminary results. // Urology. 2001. Vol. 58, N 6. P. 919-923.
17. Liatsikos EN, Karnabatidis D, Kagadis GC, Rokkas K, Constantinides C, Christeas N, Flaris N, Voudoukis T, Scopa CD, Perimenis P, Filos KS, Nikiforidis GC, Stolzenburg JU, Siablis D. Application of Paclitaxel – Eluting metal mesh stents within the pig ureter: an experimental study. //Eur Urol. 2007. Vol. 51, N 1. P. 217-223.
18. Kallidonis PS, Georgiopoulos IS, Kyriazis ID, Al-Aown AM, Liatsikos EN. Drug-eluting metallic stents in urology. // Indian J Urol. 2014. Vol. 30, N 1. P. 8-12.









Комментарии