С.В. Чигринец, Г.В. Брюхин
Кафедра гистологии, эмбриологии и цитологии Южно-Уральского государственного медицинского университета Минздрава России, Челябинск
Нарушение репродуктивного здоровья мужчин – одна из актуальных проблем медицины во всем мире. Известно, что на долю мужского фактора приходится не менее 50% всех случаев бесплодия в паре, при которых нередко обнаруживают патозооспермию – нарушение качества эякулята. Мужское бесплодие с неизвестной причиной (идиопатическое) широко распространено и, по разным авторам, составляет 30- 40% среди всех причин мужской инферильности. Это вызвано несколькими факторами, включая активные формы кислорода (ROS), генетический, эпигенетический фактор, а также токсический фактор – эндокринные дизрапторы (EDs) [1].
В 1993 году впервые в науку введен термин «эндокринные дизрапторы» (эндокринные дизрегуляторы, гормоноподобные ксенобиотики), к которым отнесены химические соединения, способные нарушать функцию эндокринной системы [2]. На сегодняшний день значение эндокринных дизрапторов в регуляции деятельности систем жизнеобеспечения остается до конца не изученным.
Наиболее известные эндокринные дизрапторы: диоксины, полихлорированные бифенилы, полибромированные дифениловые эфиры, пластификаторы – фталаты, а также фенольные соединения: бисфенол А (BPA), триклозан (TCS), 4-нонилфенол (4-NP) и др. [3-6].
BPA и ТCS – нестойкие фенольные соединения, которые широко используются человеком в повседневной жизни – в быту, медицине (лабораторной диагностике) и обнаруживаются в образцах мочи в 100% и 93%, соответственно [7].
Биомониторинг BPA и TCS осуществляют, главным образом, по образцам мочи, крови и материнского молока [8,9]. Вместе с тем, уровень этих соединений в других тканях организма и эффект их воздействия остается малоизученным. Так Т. Geens и соавт. показали, что BPA и TCS не одинаково накапливаются в тканях организма человека и поэтому мониторинг этих соединений в образцах мочи не отражает их истинного влияния на репродуктивные органы и репродуктивное здоровье в целом [4].
Методы обнаружения эндокринных дизрапторов в семенной жидкости предложены для фталатов C.F. Wang и соавт., тяжелых металлов W. Guzikowski и соавт. и бисфенола А – J. Vitku и соавт. [10- 12]. Вместе с тем исследований по определению триклозана в семенной жидкости в доступной литературе нам встретить не удалось. Кроме того, не определена точка cut-off для BPA и TCS в семенной жидкости для оценки риска субфертильности/инфертильности у мужчин.
Цель настоящего исследования – определение точки cut-off для BPA и TCS в семенной жидкости методом газовой хроматографии с масс-спектрометрией (GC-MS) для оценки риска патозооспермии (субфертильности/инфертильности) у мужчин репродуктивного возраста.
МАТЕРИАЛЫ И МЕТОДЫ
Исследован 41 образец эякулята мужчин, обратившихся в клинику по лечению бесплодия в 2017-2018 гг. для спермиологического анализа в связи с бесплодием в браке, невынашиванием беременности партнершей, а также планированием беременности или донорством спермы. Спермиологическое исследование проводили согласно рекомендациям Всероссийской организации здравоохранения (ВОЗ) [13]. После оценки качества 41 образец эякулята мужчины были разделены на две группы: 1 группа – пациенты с нормозооспермией, 2 группа – с патозооспермией. Заключения по спермограмме были основаны на критериях, изложенных в рекомендациях ВОЗ (2010): олигоспермия – объем эякулята < 1,5 мл; астенозооспермия – доля прогрессивно подвижных сперматозоидов в эякуляте < 32%; тератозооспермия – доля морфологически нормальных сперматозоидов < 4%; олигозооспермия – общее число сперматозоидов в эякуляте < 39 млн. и/или концентрация сперматозоидов < 15 млн/мл. В группу исследования были включены пациенты с идиопатической формой бесплодия и патозооспермией, группа контроля – пациенты с нормозооспермией, планирующие беременность в супружеской паре, а также доноры спермы. Мужчины, употребляющие не более 600 мл пива или 280 мл вина или 80 мл крепких спиртных напитков в сутки, отнесены к группе «непьющих» мужчин.
EDs в семенной жидкости измеряли методом газовой хроматографии с масс-спектрометрией. Обязательное условие для всех пациентов, обратившихся в клинику с целью обследования и наблюдения, – подписание информированного согласия.
Полученные данные подвергнуты статистической обработке при помощи программы IBM SPSS Statistics v.21. В работе применен ROC-анализ; различия между группами считали статистически значимыми при р<0,05.
РЕЗУЛЬТАТЫ
В 100% образцов эякулята обнаружен BPA со срединной концентрацией 0,12 (0,05-0,30) нг/мл. TCS обнаружен в 85,4% образцов эякулята со срединной концентрацией 0,16 (0,08-0,23) нг/мл. Средний возраст всех пациентов составил 31,0±0,5 лет, средний индекс массы тела (ИМТ) – 25,4±0,5 кг/м2, 42% мужчин имели избыточную массу тела (ИМТ 25-30 кг/м2), 11% – ожирение I степени (ИМТ>30 кг/м2 ).
Группа контроля составила 44% образцов эякулята (n=18). Группа исследования составила 56% образцов (n=23), из них тератозооспермия – 24% (n=10), астенотератозооспермия – 15% (n=6), олиготератозооспермия – 7% (n=3), астенозооспермия – 5% (n=2) и олигоастенотератозооспермия (ОАТ синдром) – 5% (n=2). Группы были сопоставимы по возрасту, периоду воздержания, ИМТ, курению и приему алкоголя. Данные представлены в таблице 1.
Таблица 1. Сопоставление групп по возрасту, периоду воздержания, индексу массы тела, курению и употреблению алкоголя
| Параметр | 1 группа(п=18) нормозооспермия | 2 группа (п=23) патозооспермин | Р | |
| Me (Q1-Q3) | Me (Q1-Q3) | |||
| Возраст, лет | 31.5(29.0-33.8) | 29.5 (28.0-33.5) | 0.369 | |
| Период воздержания, сутки | 3.0 (3.0-4.0) | 4.0 (3.0-4.0) | 0.078 | |
| ИМТ. кг/м2 | 25.1 (22.3-26.8) | 25.5 (24.2-26.8) | 0.356 | |
| Курение | некурящие | 11 (44.0%) | 14 (56.0%) | 0.901 |
| курящие | 6 (46.2%) | 7 (53.8 %) | ||
| Алкоголь | непьющие | 8 (44.4%) | 10(55.6%) | 1.0 |
| пьющие | 8 (44.4%) | 10 (55.6%) | ||
* – cвязь статистически значимая при р< 0,05
При этом частота патозооспермии среди курящих и употребляющих алкоголь составила 53,8% и 55,6%, соответственно; среди некурящих и не употребляющих алкоголь – 56,0% и 55,6%, соответственно.
С помощью анализа ROC-кривых установлено, что площадь под ROC-кривой, соответствующей взаимосвязи прогноза патозооспермии и концентрации TCS и ВРА в семенной жидкости, составляет 0,701±0,086 с 95% ДИ 0,531-0,863 и 0,832±0,073 с 95% ДИ 0,689-0,975, соответственно (рис. 1). Полученная модель статистически значима для триклозана (р=0,033) и бисфенола А (р<0,001).
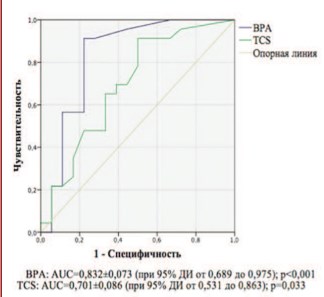
Пороговое значение концентрации TCS и ВРА в точке cut-off – 0,150 и 0,103 нг/мл, соответственно. Это означает, что если концентрация TCS и ВРА в семенной жидкости окажется равной или превышающей данное значение, то прогнозируется высокий риск патозооспермии. Чувствительность и специфичность метода для триклозана составила 71,2% и 66,7%, соответственно, бисфенола А – 91% и 78%, соответственно.
ЗАКЛЮЧЕНИЕ
Полученные результаты (риск патозооспермии в зависимости от концентрации ВРА и TCS) статистически значимы и убедительно доказывают влияние данных эндокринных дизрапторов (бисфенола А и триклозана) на качество эякулята. В дальнейшем их можно рассматривать как этиологический фактор, приводящий к ухудшению репродуктивного здоровья мужчин (субфертильности/инфертильности). Полученные результаты – точка cutoff для TCS и BPA в семенной жидкости – могут быть применены в клинической практике для прогнозирования риска патозооспермии и проведения лечебно-профилактических мероприятий, направленных на снижение концентрации эндокринных дизрапторов (бисфенола А и триклозана) в семенной жидкости.
ЛИТЕРАТУРА
- Nieschlag E, Behre HM, Nieschlag S. Andrology: male reproductive health and dysfunction. 3rd Edition Springer-Verlag Berlin Heidelberg 2010,629 p. doi: 10.1007/978-3-540-78355-8
- Colborn T, vom Saal FS, Soto AM. Developmental effects of endocrinedisrupting chemicals in wildlife and humans. Environ Health Pеrspect 1993;101(5):378–384. doi: 10.1289/ehp.93101378
- Chen M, Tang R, Fu G, Xu B, Zhu P, Qiao S, et al. Association of exposure to phenols and idiopathic male infertility. J Hazard Mater 2013;250-251:115-121. doi:10.1016/j.jhazmat.2013.01.061
- GeensT,NeelsH,CovaciA.Distributionof bisphenol-A,triclosanandn-nonylphenol in human adipose tissue, liver and brain. Chemosphere 2012; 87(7):796-802. doi:10.1016/j.chemosphere.2012.01.002
- Den Hond E, Tournaye H, De Sutter P, Ombelet W, Baeyens W, Covaci A, et al. Human exposure to endocrine disrupting chemicals and fertility: A casecontrol study in male subfertility patients. Environ Int 2015; 84:154-160. doi:10.1016/j.envint.2015.07.017
- Pirard C, Sagot C, Deville M, Dubois N, Charlier C. Urinary levels of bisphenol A, triclosan and 4-nonylphenol in a general Belgian population. Environment International 2012;48:78-83. doi:10.1016/ j.envint.2012.07.003
- Li X, Ying GG, Zhao JL, Chen ZF, Lai HJ, Su HC. 4-Nonylphenol, bisphenol-A and triclosan levels in human urine of children and students in China, and the effects of drinking these bottled materials on the levels. Environ Int 2013;Feb;52:81-86. doi:10.1016/j.envint.2011.03.026
- Allmyr M, Adolfsson-Erici M, McLachlan MS, Sandborgh-Englund G. Triclosan in plasma and milk from Swedish nursing mothers and their exposure via personal care products. Sci Total Environ 2006;372(1):87-93. doi:10.1016/j.scitotenv.2006.08.007
- Calafat AM, Ye X, Wong LY, Reidy JA, Needham LL. Urinary concentrations of triclosan in the U.S. population: 2003–2004. Environ Health Perspect 2008;116 (3):303-307. doi:10.1289/ehp.10768
- Wang CF, Tian Y. Reproductive endocrine-disrupting effects of triclosan: Population exposure, present evidence and potential mechanisms. Environ Pollut 2015;Nov; 206:195-201. doi:10.1016/j.envpol.2015.07.001
- Guzikowski, W, Szynkowska, MI, Motak-Pochrzest H, Pawlaczyk, A, Sypniewski S. Trace elements in seminal plasma of men from infertile couples. Arch Med Sci 2015;11(3):591–598. doi: 10.5114/aoms.2015.52363
- Vitku J, Heracek J, Sosvorova L, Hampl R, Chlupacova T, Hill M, et al. Associations of bisphenolAand polychlorinated biphenylswith spermatogenesis and steroidogenesis in two biological fluids from men attending an infertility clinic. Environ Int 2016;89-90:166-173. doi:10.1016/j.envint.2016.01.021
- WHO laboratory manual for the examination and processing of human semen. Fifth edition. World Health Organization, Department of Reproductive Health and Research. 2010;287 p
Статья опубликована в журнале"Экспериментальная и клиническая урология" №3 2018, стр.48-51













Комментарии