Журнал "Экспериментальная и клиническая урология" Выпуск №3 за 2015 год
Сивков А.В., Ромих В.В., Захарченко А.В., Пантелеев В.В., Борисенко Л.Ю., Пантелеева М.В.
Тревожные состояния, депрессии и другие психологические расстройства различной выраженности часто являются осложнением соматических заболеваний, в том числе и нейрогенной дисфункции мочевого пузыря (НДМП), проявляющейся ургентным учащенным мочеиспусканием, особенно в сочетании с императивным недержанием мочи (НМ). При отсутствии неврологического нарушения такое сочетание симптомов принято определять как «гиперактивный мочевой пузырь» (ГМП). Распространенность НДМП достаточно высока, и, согласно исследованиям, проведенным в 2001 году, наблюдается у 3 – 43% взрослого населения [1].
Дисфункция нижних мочевых путей, связанная с неврологическими заболеваниями/повреждениями (нейроинфекции, заболевания межпозвонковых дисков, последствия травм, нарушений мозгового кровообращения и т.п.) – одна из наиболее частых причин обращений к нейроурологам. При анализе исследований по распространенности данного нарушения становится очевидным, что частота встречаемости НДМП с императивной симптоматикой увеличивается с возрастом. Ургентное учащенное мочеиспускание чаще наблюдается у женщин, чем у мужчин. Оно вызывает значительные психоэмоциональные расстройства примерно у половины пациентов [2]. При НДМП существенно снижается не только качество жизни, но и социальная адаптация человека. Пациенты с симптомами учащенного императивного мочеиспускания отмечают эмоциональный и физический дискомфорт, связанный с необходимостью использования дополнительных средств личной гигиены, частого посещения туалета, невозможностью адекватно выполнять свои профессиональные и социальные задачи, что в большинстве случаев приводит к развитию различных неврологических и психологических нарушений, особенно у жителей крупных мегаполисов.
В настоящее время появились работы о распространенности депрессии различного генеза у пациентов с НДМП. Исследователи делают вывод, что депрессия у пациентов с НДМП возникает в 11,4% по сравнению с 3,6% у лиц без симптомов императивного и учащенного мочеиспускания, уровень безработицы составляет 42,0% среди лиц, имеющих данные симптомы, 33,6% – среди лиц без симптомов императивного и учащенного мочеиспускания, а снижение качества сексуальной жизни – 15,4%, против 2,8% в контрольной группе [3]. Все вышеперечисленное свидетельствует о том, что НДМП – это заболевание, значительно снижающее качество жизни именно за счет социальной дезадаптации пациентов, которая приводит к появлению психоэмоциональных нарушений/депрессивных расстройств, а они, в свою очередь, усиливают дезадаптацию и снижают качество жизни (замкнутый круг).
Снижение качества жизни и депрессивные нарушения у пациентов с императивной симптоматикой связаны не только с течением основного заболевания (грыжи, протрузии межпозвонковых дисков, последствия острого нарушения мозгового кровообращения и.т.д.), но и прежде всего с симптомами учащенного ургентного мочеиспускания. Так, пытаясь вести социально активную жизнь, люди постоянно думают о непредсказуемом позыве к мочеиспусканию, возникновении возможного недержания мочи, необходимости предохранять себя от недержания и скрывать уже возникший эпизод, использовать средства «урологической защиты» (памперсы, прокладки) и многое другое. Очевидно, что на фоне подобных обстоятельств снижается уровень как физического, так и социального функционирования.
Большое число людей с симптомами императивного мочеиспускания, особенно сочетающихся с НМ, несмотря на ряд негативных влияний, описанных выше, в течение длительного времени не обращаются за медицинской помощью. Пациенты применяют поведенческие методики: принудительное мочеиспускание «по часам», ограничение питьевого режима с целью максимально «разгрузить мочевой пузырь», становятся привязанными к местам расположения туалетов, тем самым в течение длительного времени поддерживая низкий уровень качества жизни и вызывая прогрессию депрессивных состояний [4]. Чаще всего пациенты аргументируют отказ от обращения к врачу стеснением, считая данную проблему слишком интимной, уверенностью в отсутствии эффективного лечения, учитывая ранний негативный опыт и, наконец, принятием своего состояния как должного, связанного со старением, полом, наследственностью [5].
В практике лечения НДМП существуют три основных направления:
- немедикаментозное (тренировка мочевого пузыря, электростимуляция, нейромодуляция и т.д.);
- медикаментозное лечение, которое в настоящий момент получило наибольшее распространение в связи со своей доступностью, возможностью длительного применения и достаточно высокой эффективностью;
- использование малоинвазивных методик – ботулинотерапия, которая в последнее время получила бурное развитие.
Хирургическое лечение (аугментация, миоэктомия и пр.) в настоящий момент применяется редко и только по особым показаниям [6, 7].
Несмотря на все плюсы М-холиноблокаторов, многие авторы отмечают их недостаточную эффективность при длительном применении или отказ от лечения, вызванный побочными эффектами, такими как запор, сухость во рту и прочее. По данным некоторых исследований, побочные эффекты отмечены у 74% в группе наблюдения [8]. Многие пациенты отмечают неудобства, связанные с необходимостью постоянного приема таблеток, что также часто приводит к отказу от терапии. Однако, несмотря на вышеперечисленные недостатки медикаментозного лечения, в целом, качество жизни больных на фоне приема препаратов значительно улучшается, а у пациентов с императивным НМ частота эпизодов НМ уменьшается на 52-55% [9, 10].
Пациентам, у которых не отмечено положительного эффекта немедикаментозного и медикаментозного методов лечения, имеющим какие-либо противопоказания или побочные эффекты, может быть предложено введение ботулинического токсина типа А (БТА) в стенку мочевого пузыря [11]. По результатам многих исследований БТА эффективен не только при нейрогенной детрузорной гиперактивности (ГД), что является основной причиной учащенного ургентного мочеиспускания у пациентов с НДМП, но и при идиопатическом ГМП [12, 13].
После введения БТА у пациентов отмечается частичное или полное устранение симптомов императивного НМ и снижение частоты императивных позывов, что приводит к повышению качества жизни и социальной адаптации [16]. При нейрогенной ГД вводят в среднем 200 Ед БТА. Эффект проведенной терапии наблюдается на 7-й – 10-й день и сохраняется 6-12 месяцев [14, 15]. У пациентов с идиопатическим ГМП, рефрактерным к М-холинолитической терапии, введение БТА в 82% случаев устраняет императивное НМ [17, 18].
В исследовании, проведенном в 2004 году А. Reitz и соавт., 200 пациентам с нейрогенной ГД был введен БТА. У 191(95,5%) отмечен положительный эффект, что подтверждено уродинамическим исследованием: максимальная цистометрическая емкость (Maximal Cystometric Capacity – MCC) увеличилась с 272 до 420 мл (+54.4%), максимальное детрузор-ное давление при наполнении (pdetmax) снизилось с 61 до 30 см Н2О (-51%). При этом 132 из 180 (73,3%) больных с ургентным недержанием мочи отметили полное удержание мочи, 45 из 163 (27,6%) – полностью отказались от антимускариновой терапии, а 118 (72,4%) – значительно уменьшили дозу этих препаратов после введения БТА [19].
С учетом огромного воздействия императивной симптоматики на психоэмоциональное здоровье пациентов, влияние лечения именно на эти факторы очень важно для оценки качества самого метода. В настоящее время недостаточно исследований, описывающих динамику показателей психического и социального статусов пациента с симптомами учащенного мочеиспускания до и после ботулинотерапии.
В 2010 году исследование, в котором приняли участие 14 пациентов с поллакиурией более 14 раз, высокими баллами по визуальной аналоговой шкале, шкале боли и депрессии, выявило, что после введения БТА (200 Ед) существенно улучшились показатели указанных шкал, повысился уровень психологического состояния и, следовательно, возросла социальная адаптация [20].
Множество эпидемиологических исследований подтверждают высокую распространенность НДМП [21]. Огромное число людей трудоспособного возраста с симптомами учащенного ургентного мочеиспускания оказываются дезадаптированными в социальном и психологическом плане. Оценка эффективности новых и перспективных методов лечения, таких как ботулинотерапия, должна основываться как на объективных данных, прежде всего показателях уродинамики, так и на динамике психоэмоционального состояния, как главного фактора качества жизни.
Цель исследования: изучить изменения психоэмоционального статуса пациентов, получивших лечение в объеме введения БТА в стенку мочевого пузыря по поводу НДМП, проявляющейся учащенным ургентным мочеиспусканием.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 54 пациента с НДМП (учащенное мочеиспускание с императивными позывами с и без императивного НМ), наблюдавшихся в НИИ урологии им. Н.А.Лопаткина в 2013 – 2014 годах. У всех пациентов наличие нейрогенной ГД было подтверждено уродинамически. Группу составили 15 мужчин и 39 женщин в возрасте от 38 до 73 лет (средний возраст 59,5±1,6 года).
Критерии включения:
- подписанное информированное согласие на участие в исследовании;
- наличие императивных позывов и поллакиурии (по дневникам мочеиспусканий);
- уродинамически подтвержденная ГД;
- отсутствие сопутствующих тяжелых соматических состояний. Критерии исключения:
- выраженный пролапс органов таза;
- психические расстройства, требующие наблюдения врача-психиатра;
- нарушение функции почек;
- инфравезикальная обструкция;
- онкологические заболевания;
- острые воспалительные заболевания;
- беременность и период лактации.
Пациенты были разделены на 2 группы:
Группу I составили пациенты с нейрогенной ГД без императивного
Группу II – пациенты с нейрогенной ГД и императивным НМ.
Всем пациентам проведено специальное обследование до и через два месяца после лечения, включавшее:
- оценку дневников регистрации мочеиспусканий;
- комбинированное уродинамическое исследование (КУДИ) в объеме урофлоуметрии и цистометрии наполнения / опорожнения;
- нейропсихологическое тестирование;
- консультацию врача – невролога.
Изменение частоты микций и эпизодов НМ оценивали по дневникам регистрации мочеиспусканий. Критериями по результатам КУДИ были выбраны: максимальная цистометрическая емкость в мл – Мaximal Cystometric Capacity – (MCC) и максимальная амплитуда сокращений детрузора при наполнении – pdetmax (см Н2О).
Нейропсихологическое тестирование состояло из госпитальной шкалы оценки тревоги и депрессии (HADS), неспецифического опросника качества жизни SF-36, шкалы восприятия состояния мочевого пузыря (PPBC).
Госпитальная шкала оценки тревоги и депрессии (HADS) – состоит из 14 вопросов, где суммарный балл от 0 до 7 принят за норму, от 8 до 10 определяет наличие субклинической депрессии, а 11 и выше – клинически выраженную депрессию.
Неспецифический опросник качества жизни SF-36 носит сравнительный характер и состоит из 8 доменов: физическое функционирование (ФФ), ролевое функционирование, обусловленное физическим состоянием (РФФ), телесная боль (Б), общее здоровье (ОЗ), жизнеспособность/энергичность (Ж), социальное функционирование (СФ), ролевое функционирование, обусловленное эмоциональным состоянием (РЭФ) и психическое здоровье (ПЗ). Показатели каждой шкалы варьируют между 0 и 100, где 100 представляет полное здоровье, все шкалы формируют два показателя: душевное и физическое благополучие. Результаты представляются в виде оценок в баллах по 8 шкалам, составленных таким образом, что более высокая оценка указывает на более высокий уровень качества жизни.
Шкала восприятия состояния мочевого пузыря (PPBC), состоит из 6 утверждений, оценивающих степень беспокойства от 1 до 6 баллов:
- состояние моего мочевого пузыря не создает для меня никаких проблем;
- состояние моего мочевого пузыря создает для меня некоторые, очень небольшие проблемы;
- состояние моего мочевого пузыря создает для меня некоторые небольшие проблемы;
- состояние моего мочевого пузыря создает для меня некоторые умеренные проблемы;
- состояние моего мочевого пузыря создает для меня некоторые серьезные проблемы;
- состояние моего мочевого пузыря создает для меня много серьезных проблем.
Этап лечения состоял в выполнении всем пациентам уретроцистоскопии, с введением 200 Ед БТА, разведенных в 0,9% физиологическом растворе. Инъекции были выполнены через цистоскоп гибкой иглой в мышечный слой мочевого пузыря.
При статистической обработке данных использовали программы Statistica 10 и Microsoft Excel 2010 с применением непараметрических методов оценки уровня достоверности для малых групп.
РЕЗУЛЬТАТЫ
При анализе дневников мочеиспускания до лечения у 42 пациентов не отмечено НМ, а у 12 (22,2%) – отмечено императивное НМ, что послужило основой для разделения пациентов на 2 группы: 42 и 12 пациентов, соответственно.
Средняя частота мочеиспусканий в сутки до лечения у пациентов I группы составила 13,9±0,7 (от 9 до 23), а в группе II – 17,92±0,93 (12-23). Через 2 месяца после введения БТА число мочеиспусканий пациентов I группы достоверно снизилось до 8,4±0,35 (5-12) раз (р< 0,001), а у пациентов II группы – до 11,25±0,98 (7-18) раз в сутки (р< 0,005).
По результатам лечения, ни у одного из пациентов II группы не отмечено симптомов императивного НМ. Исходя из данных устного опроса выявлено, что лишь 4 (18,2%) пациента из 12 с императивным НМ продолжали придерживаться принудительного ритма мочеиспускания, аргументируя посещения туалета привычкой и сохраняющимся страхом возникновения НМ в общественных местах.
По данным КУДИ у всех пациентов до лечения была выявлена ГД: в группе I показатель pdetmax, в среднем, составил 19,5±0,9 см Н2О (13-37), а в группе II – 34,0+0,7 см Н2О (30-37). У больных I и II групп среднее значение МСС было равно 137,1±5,6 мл (81-221) и 118,5+6,4 мл (87-154) соответственно. После введения БТА МСС пациентов I группы достоверно (р< 0,001) увеличилась, в среднем, до 231,8± 8,5 мл (180-361 мл), а во II группе – до 186,8±3,8 мл (118-280 мл), тогда как средний показатель Pdetmax достоверно (р< 0,001) снизился до 7,6±0,8 см Н2О (2-18) и до 14,1± 1,21 см Н2О (7-21) соответственно (табл. 1 и 2).
При анализе данных шкалы восприятия состояния мочевого пузыря (PPBC) до ботулинотерапии ни один пациент обеих групп не определил состояние своего мочевого пузыря, соответственно вопросам №1 и №2. В группе I 20 (47,6%) человек отметили, что «мочевой пузырь приносит им много серьезных проблем» (ответ №6), 6 (14,3%) человек дали ответ №5, 12 (28,6%) – ответ №4 и 4 (9,5%) пациента определили состояние как «некоторые небольшие проблемы» (ответ №3). После введения БТА 28 (66,7%) пациентов ответили, что мочевой пузырь приносит им некоторые очень небольшие проблемы (ответ №2), 8 (19,0%) человек дали ответ №4, а 6(14,3%) человек – ответ №3.
Исходно в группе II, ответы распределились следующим образом: № 6 – 6 (50%) человек, № 5 – 4 (33,3%) человека, № 4 – один (8,3%) и № 3 – один (8,3%) человек. После ботулинотерапии, 8 (66,6%) пациентов ответили, что мочевой пузырь приносит им некоторые умеренные проблемы (ответ №4), два (16,7%) пациента дали ответ №5, а два (16,7%) пациента – ответ №2.
Таким образом, данные шкалы восприятия состояния мочевого пузыря, полученные после ботулинотерапии, у всех пациентов подтвердили улучшение уровня субъективной оценки пациентами своего состояния, обусловленное уменьшением проблем из-за нарушенного мочеиспускания.
До лечения, при оценке показателей тревоги и депрессии по госпитальной шкале HADS, у всех пациентов обеих групп выявлены признаки тревоги и депрессии. В группе I:45,2% (n=19) имели субклинически выраженные признаки тревоги и депрессии (8-10 баллов), а 54,8% (23) – клинически выраженные (15-32 балла). В группе II у всех пациентов был отмечен высокий уровень тревоги и депрессии (15-32 балла).
Таблица 1. Изменение уродинамических показателей и выраженности поллакиурии до и после введения БТА в группе I (n=42)
| Показатель | до БТА | после БТА | % | p | |
|---|---|---|---|---|---|
| Число мочеиспусканий в сутки | среднее | 13,9 ± 0,7 | 8,4 ± 0,35 | 39,6 | <0,001 |
| диапазон значений | 9 23 | 5 – 12 | |||
| MCC , мл | среднее | 137,1 ± 5,6 | 231,8 ± 8,5 | + 69,1 | <0,001 |
| диапазон значений | 81 221 | 180 – 361 | |||
| рdet.max, см H2O | среднее | 19,5 ± 0,9 | 7,6 ± 0,8 | 61,0 | <0,001 |
| диапазон значений | 13 37 | 2 18 | |||
Таблица 2. Изменение уродинамических показателей и выраженности поллакиурии до и после введения БТА в группе II (n=12)
| Показатель | до БТА | после БТА | % | p | |
|---|---|---|---|---|---|
| Число мочеиспусканий в сутки | среднее | 17,9 ± 0,9 | 11,25 ± 0,98 | 37,2 | <0,005 |
| диапазон значений | 12 23 | 7 – 18 | |||
| MCC , мл | среднее | 118,5 ± 6,4 | 186,8 ± 3,8 | + 57,6 | <0,001 |
| диапазон значений | 87 154 | 118 – 280 | |||
| рdet.max, см H2O | среднее | 34,0 ± 0,7 | 14,1 ± 1,2 | -41,4 | <0,005 |
| диапазон значений | 30 37 | 7 – 21 | |||
После ботулинотерапии у пациентов группы I клинически выраженных признаков тревоги и депрессии не зарегистрировано, субклинические (8-10 баллов) – наблюдали у 8 (18,3%) человек. В группе II признаки субклинической депрессии (8-10 баллов) зарегистрированы только у 12,4% (одна женщина, двое мужчин). Согласно результатам устной беседы, пациенты связывают отсутствие депрессии с возможностью дольше оставаться сухими и, как следствие, вести социально-активный образ жизни, страха возникновения эпизодов НМ (рис. 1, 2).
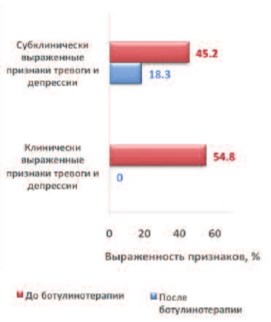
Рис. 1. Динамика выраженности признаков тревоги и депрессии в группе I
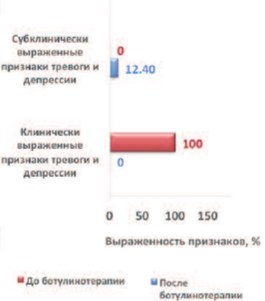
Рис. 2. Динамика выраженности признаков тревоги и депрессии в группе II
При обработке результатов опросника SF-36 у пациентов группы I до введения БТА было выявлено: снижение баллов по домену "ФФ" до 76,17±1,6 домену "РФФ" – до 69,5±1,9. В свою очередь домен "Б" у пациентов без НМ показал умеренное снижение и составил 94,23±0,81. Многие пациенты считали свою болезнь достаточно тяжелой, а варианты ее лечения малоэффективными, что согласно домену "ОЗ" соответствовало 76,17±1,6, а согласно домену "Э" – 83,38±2,38. Домен "СФ" составил 72,48±2,15. Низкие показатели выявлены и по результатам анализа остальных доменов, в частности балл домена "РЭФ" составил всего 65,73± 1,99, что пациенты трактовали как необходимость траты более длительного времени на выполнение прежней обычной домашней работы и на дополнительные гигиенические процедуры. Максимальное снижение показателей отмечено в домене "ПЗ" (средний бал 70,88±2,26), заключающееся, со слов пациентов, в постоянном плохом настроении, постоянном пребывании в тревожном состоянии, связанном с необходимостью быть рядом с туалетом, возможным срывом запланированной деятельности из-за резко возникающего позыва к мочеиспусканию.
Таблица 3. Динамика показателей шкалы SF-36 до и после ботулинотерапии у пациентов I группы
| Домен | до БТА | после БТА | p |
|---|---|---|---|
| Физическое функционирование | 76,17±1,6 | 90,17±1,08 | <0,005 |
| Ролевое функционирование, обусловленное физическим состоянием |
69,5±1,9 | 89,38±1,6 | <0,05 |
| Интенсивность боли | 94,23±0,81 | 97,98±0,45 | >0,05 |
| Общее здоровье | 76,17±1,6 | 88,33±1,8 | <0,05 |
| Энергичность | 83,38±2,38 | 88,43±1,89 | >0,05 |
| Социальное функционирование | 72,48±2,15 | 81,62±1,9 | <0,05 |
| Ролевое функционирование, обусловленное эмоциональным состоянием | 65,73±1,99 | 86,9±2,26 | <0,001 |
| Психическое здоровье | 70,88±2,26 | 89,12±1,66 | <0,05 |
Таблица 4. Динамика показателей шкалы SF-36 до и после ботулинотерапии у пациентов II группы
| Домен | до БТА | после БТА | p |
|---|---|---|---|
| Физическое функционирование | 60,92±1,27 | 85,17±1,39 | <0,001 |
| Ролевое функционирование, обусловленное физическим состоянием |
55,5±2,57 | 90,25±0,94 | <0,001 |
| Интенсивность боли | 89,08±1,66 | 95,33±0,74 | >0,05 |
| Общее здоровье | 71,5±1,82 | 83,83±1,64 | >0,05 |
| Энергичность | 75,0±1,8 | 89,0±1,02 | <0,05 |
| Социальное функционирование | 69,58±1,87 | 94,25±0,73 | <0,001 |
| Ролевое функционирование, обусловленное эмоциональным состоянием | 65,33±1,52 | 86,5±1,38 | <0,001 |
| Психическое здоровье | 58,5±1,36 | 79,75±1,65 | <0,001 |
Через 2 месяца после введения БТА балл по доменам SF-36 у всех пациентов значительно увеличился: по домену "ФФ" – до 90,17±1,08 (+18,4%), по домену "РФФ" – до 89,38±1,6 (+28,6%), домен "Б" у пациентов первой группы восстановился практически до 100 баллов и составил 97,98± 0,45 (+4%), домен "ОЗ" – 88,33±1,8 (+16,1), домен "Э" – 88,43±1,89 (+6,1%), показатели по домену "СФ" повысились до 81,62±1,9 (+12,6%), балл по домену "РЭФ" – до 86,9±2,26 (+32,2%), шкала показателей "ПЗ" – до 89,12±1,66 баллов (+25,7%). Динамика показателей SF-36 наглядно представлена в таблице №3.
У пациентов с императивным НМ (группа II) исходные баллы по доменам опросника SF-36 фиксировались на более низком уровне по сравнению с группой I. После ботулинотерапии отмечен выраженный прирост баллов: "ФФ" с 60,92±1,27 до 85,17±1,39 (+39,8%), "РФФ" с 55,5±2,57 до 90,25±0,94 (+62,6%), домен "Б" с 89,08±1,66 до 95,33±0,74 (+7%), "ОЗ" с 71,5±1,82 до 83,83±1,64 (+17,2%), "Э" с 75,0±1,8 до 89,0±1,02 (+18,7%), домен "СФ" с 69,58±1,87 до 94,25±0,73 (+35,5%), домен РЭФ с 65,33±1,52 до 86,5±1,38 (+32,4), домен "ПЗ" с 58,5±1,36 до 79,75±1,65 (+36,3%). У группы пациентов с императивным НМ после ботулинотерапии отмечается умеренно выраженное снижение баллов по шкале "ПЗ", что говорит о возможно продолжающейся депрессии и тревожном состоянии и требует наблюдения в динамике (табл. 4).
Таким образом, в обеих группах, динамика SF-36 показателей опросника на фоне ботулинотерапии продемонстрировала достоверную положительную динамику по большинству доменов, отражающих физическое и психоэмоциональное состояние пациентов и улучшение качества жизни в целом.
ОБСУЖДЕНИЕ
При анализе литературных данных определено, что в ряде проведенных исследований оценивалось качество жизни пациентов с НДМП до и после ботулинотерапии. Однако данных о комплексном психоневрологическом обследовании, включавнабор шкал для изучения эмоционального, психического, психологического, социального и физического здоровья, в доступных источниках не найдено.
По данным нашего исследования, у пациентов с НДМП, проявляющейся императивным учащенным мочеиспусканием с наличием или без НМ, в обеих исследуемых группах выявлены существенные потери в качестве жизни пациентов и их психоэмоциональном статусе, обусловленные проблемами с мочеиспусканием, объективно подтвержденными уродинамическим исследованием.
Результаты КУДИ продемонстрировали достоверное улучшение ключевых уродинамических параметров после ботулинотерапии у пациентов обеих групп. Значительно снизилась частота мочеиспусканий на фоне увеличения максимальной цистометрической емкости, у больных группы II исчезли эпизоды ургентного недержания мочи.
Оценка исходного качества жизни по шкале SF-36 в обеих группах выявила значительное снижение показателей энергичности/жизнеспособности, социального функционирования и психического здоровья, что в свою очередь определяет снижение/уменьшение проявления тревоги и депрессии. Таким образом, нейропсихологическая составляющая клинической картины НДМП с нейрогенной ГД обусловлена степенью уродинамических нарушений и проявляется не только симптомами со стороны НМП, но и тревоги и депрессии. Более чем у 50% пациентов с императивным мочеиспусканием и у всех – с НМ, зарегистрирован высокий уровень тревоги и депрессии. Характерно, что у пациентов с императивным НМ отмечается высокий уровень тревоги и депрессии и низкое качество жизни.
Несмотря на исходную высокую степень уродинамических изменений, особенно у пациентов с императивным НМ, ботулинотерапия привела к достоверному улучшению качества жизни пациентов обеих групп на фоне снижения уровней тревоги и депрессии. Наибольшую положительную динамику по шкале SF-36 у пациентов I группы наблюдали в доменах ролевого функционирования, обусловленного физическим состоянием (+28,6%), ролевого функционирования, обусловленного эмоциональным состоянием (+32,2%) и психического здоровья (+25,7%). У пациентов II группы максимальное улучшение было достигнуто в доменах ролевого функционирования, обусловленно-го физическим состоянием (+62,6%), физического функционирования (+39,8%) и психического здоровья (+36,3%). Все это еще раз подтвердило зависимость качества жизни от эмоционального состояния пациента, непосредственно связанного с его физическим здоровьем.
Настоящее исследование продемонстрировало, что использование шкал SF-36 и HADS информативно у пациентов с НДМП для детальной оценки качества жизни и психоэмоционального состояния пациентов, так как освещает все стороны социальной жизни, включая психическое здоровье. Данные инструменты могут найти применение при организации будущих клинических исследований у пациентов с нарушениями мочеиспускания.
ЗАКЛЮЧЕНИЕ
Нейрогенная дисфункция мочевого пузыря, проявляющаяся учащенным ургентным мочеиспусканием с и без НМ, характеризуется выраженными уродинамическими нарушениями, значительным снижением качества жизни, псхоэмоциональными расстройствами и депрессией. Введение БТА в стенку мочевого пузыря является эффективным методом лечения гиперактивности детрузора, позволяющим достоверно улучшить не только объективные уродинамические показатели, но и добиться значительного снижения уровней тревоги и депрессии, и соответственно, существенно повысить качество жизни.
ЛИТЕРАТУРА
1. Milsom I, Abrams P, Cardozo L, Roberts RG, Thuroff J, Wein AJ. How widespread are the symptoms of an overactive bladder and how are they managed? A population–based prevalence study. // BJU Int. 2001. Vol. 87, Р. 760–766.
2. Irwin DE, Milsom I, Hunskaar S, Reilly K, Kopp Z, Herschorn S, Coyne K, Kelleher C, Hampel C, Artibani W, Abrams P. Population-based survey of urinary incontinence, overactive bladder, and other lower urinary tract symptoms in five countries: results of the EPIC study. // Eur Urol. 2006. Vol. 50, N 13. Р. 6–14.
3. Coyne KS, Sexton CC, Irwin DE, Kopp ZS, Kelleher CJ, Milsom I. The impact of overactive bladder, incontinence and other lower urinary tract symptoms on quality of life, work productivity, sexuality and emotional wellbeing in men and women: results from the EPIC study. // BJU Int. 2008. Vol.101, N 13. Р. 88–95.
4. Dallosso HM, Matthews RJ, McGrother CW, Donaldson MM, Shaw C Leicestershire MRC incontinence Study Group. The association of diet and other lifestyle factors with the onset of overactive bladder: a longitudinal study in men.// Public Health Nutr. 2004. Vol. 7, N 7. Р.885–891.
5. Sexton CC, Coyne KS, Kopp ZS, Irwin DE, Milsom I, Aiyer LP, Tubaro A, Chapple CR, Wein AJ; The overlap of storage, voiding and postmicturition symptoms and implications for treatment seeking in the USA, UK and Sweden: EpiLUTS.// BJU Int. 2009. Vol. 103, Suppl. 3. Р.12–23.
6. Hegde SS. Muscarinic receptors in the bladder: from basic research to therapeutics. // Br J Pharmacology. 2006. Vol.147. Р.80–87.
7. Chappie C. The contemporary pharmacological management of overactive bladder.// BJOG. 2006 Dec. Vol. 113, N 2. Р.19 – 28.
8. Thüroff JW, Chartier-Kastler E, Corcus J, Humke J, Jonas U, Palmtag H, Tanagho EA. Medical treatment and medical side effects in urinary incontinence in the elderly. // World J Urol. 1998. Vol. 16, N 1. Р.48-61.
9. Couillard DR, Webster GD. Detrusor instability. // Urol Clin North Am., 1995. Vol. 22, N 3. Р. 593 – 612.
10. Chappie CR, Roehrborn CG. A shifted paradigm for the further understanding, evaluation and treatment of lower urinary tracy symptoms in men: focus on the bladder. // Eur Urol. 2006. Vol. 49. Р.651 – 659.
11. Ghei M, Maraj BH, Miller R. Effects of botulinum toxin B on refractory detrusor overactivity a randomized double-blind, placebo-controlled crossover. // J Urol. 2005. Vol. 174. P.1873–1877.
12. Grosse J, Kramer G, Stohrer M. Success of repeat detrusor injections of botulinum A toxin in patient with severe neurogenic detrusor overactivity and incontinence. // Eur Urol. 2005. Vol. 47. Р.653–659.
13. Smith C.P., Somogyi G.T., Chancellor MB, Appell RA. A case for botulinum toxin-A in idio-pathic bladder overactivity. // Curr. Urol. Rep. 2004. Vol. 5, N 6. Р.432–436.
14. Anderson K., Appell R., Cardozo L. Pharmacological treatment of urinary incontinence // In “Incontinence: 3rd International Consultation on Incontinence” [P. Abrams, L. Cardozo, S. Khoury, A. Wein eds.]. UK. 2005. Р. 809– 854.
15. Knuepfer S, Juenemann KP2. Experience with botulinum toxin type A in the treatment of neuro-genic detrusor overactivity in clinical practice. // Adv Urol. 2014. Vol. 6, N1. Р.34–42.
16. Schurch B, de Sèze M, Denys P, Chartier-Kastler E, Haab F, Everaert K, Plante P, Perrouin-Verbe B, Kumar C, Fraczek S, Brin MF; Botulinum toxin type A is a safe and effective treatment for neurogenic urinary incontinence: results of a single treatment, randomized, placebo controlled 6-month study. // J Urol. 2005. Vol. 174, N 1. Р. 196–200.
17. Schmid DM, Sauermann P, Werner M, Schuessler B, Blick N, Muentener M, Strebel RT, Perucchini D, Scheiner D, Schaer G, John H, Reitz A, Hauri D, Schurch B. Experience with 100 cases treated with botulinum-A toxin injections in the detrusor muscle for idiopathic overactive bladder syndrome refractory to anticholinergics // J Urol. 2006. Vol. 176, N 1. Р. 177–185.
18. Сивков А.В., Ромих В.В. Фармакотерапия гиперактивного мочевого пузыря.// Consilium medicum. 2002. N 7. C. 348-356.
19. Reitz A, Stöhrer M, Kramer G, Del Popolo G, Chartier-Kastler E, Pannek J, Burgdörfer H, Göcking K, Madersbacher H, Schumacher S, Richter R, von Tobel J, Schurch B. European experience of 200 cases treated with botulinum-A toxin injections into the detrusor muscle for urinary incontinence due to neurogenic detrusor overactivity. // Eur Urol. 2004. Vol. 45, N 4. Р. 510-515.
20. Giannantoni A, Cagini R, Del Zingaro M, Proietti S, Quartesan R, Porena M, Piselli M. Drug Deliv. Botulinum A toxin intravesical injections for painful bladder syndrome: impact upon pain, psychological functioning and Quality of Life. // Curr Drug Deliv. 2010. Vol. 7, N 5. Р. 442-446.
21. Ромих В.В., Сивков А.В. Принципы клинической оценки гиперактивного мочевого пузыря.// Consilium Medicum. 2005. N 7. C. 569-574.









Комментарии