Журнал "Экспериментальная и клиническая урология" Выпуск №1 за 2015 год
Антонов К.К., Еркович А.А., Цырендоржиев Д.Д., Кузнецова Н.Н., Фарбирович В.Я., Курбаналиев Р.М.
В последние годы всё больше внимание исследователей привлекает вероятная взаимосвязь между хроническим бактериальным простатитом (ХБП) и клинико-лабораторными характеристиками андрогенодефицита (АД) [1, 2]. Известно, что у человека при острых, хронических и аутоиммунных заболеваниях наблюдается низкий уровень тестостерона в крови [3, 4]. Поскольку в большинстве случаев при этих заболеваниях происходит активация макрофагов, предполагается, что медиаторы макрофагов могут непосредственно влиять на регуляцию функций клеток Лейдига.
В основе любого воспалительного процесса в организме лежит дисбаланс между синтезом провоспалительных и противовоспалительных цитокинов. Хронический бактериальный простатит не является исключением для реализации подобного патофизиологического сценария. Несмотря на неспецифичность тех или иных цитокинов по отношению к характеру воспалительного процесса, измерение их уровня позволяет определить активность воспалительного процесса, что необходимо для выбора наиболее адекватной лечебно-диагностической тактики у пациентов с хроническим простатитом.
Многообразие оказываемых эффектов цитокинов на клетки организма позволяет открывать новые горизонты в изучении последствий развития воспаления. Многими авторами исследовались возможные параллели между уровнями некоторых цитокинов и гормонов. В исследованиях, проводимых на культуре клеток Лейдига, выделенной у мышей и крыс, был подробно продемонстрирован механизм ингибирующего влияния ИЛ-1 и ФНО-альфа на стероидогенез. Показано, что введение ИЛ-1 в культуру клеток Лейдига приводит к ингибированию активности транспортного стероидного острого регуляторного белка (StAR), обеспечивающего митохондриальный транспорт холестерина. В результате подавляющей активности ключевого этапа стероидогенеза под воздействием ИЛ-1 происходит нарушение конверсии предшественников тестостерона, в частности, 22–гидроксихолестерола, в тестостерон [5]. Ряд исследователей полагает, что ИЛ-1 ингибирует активность фермента, расщепляющего боковую цепь холестерина (20, 22-десмолаза), который необходим для преобразования холестерина в прегненолон, что также приводит к нарушению синтеза тестостерона [6]. В исследовании Hales, проводимом на клетках Лейдига мышей, описано дозозависимое ингибирующее действие ИЛ-1 на циклический аденозинмонофосфат (цАМФ), обеспечивающий экспрессию 20,22-десмолазы, 17,20-десмолазы и 3-бетагидроксистероиддегидрогеназы, без которых биосинтез тестостерона подавляется [7].
В литературе имеется достаточное количество результатов исследований, подтверждающих ингибирующий эффект и ФНО-альфа на продукцию тестостерона клетками Лейдига в эксперименте. Так, в одной из работ выполнялись инъекции рекомбинантного ФНО-альфа 6 мужчинам для оценки его влияния на гипоталамо-гипофизарно-тестикулярную ось. В ходе исследования измерялись уровни гонадотропинов, общего тестостерона (Т общ.) и глобулина, связывающего половые гормоны (ГСПГ). В результате было зафиксировано снижение уровней гонадотропинов и общего тестостерона и сделан вывод о том, что ФНОальфа оказывает влияние на все уровни гипоталамо-гипофизарнотестикулярной оси [8]. Другое исследование на человеке проводилось с использованием ИЛ-2 для лечения метастатического рака. Известно, что ИЛ-2 вызывает повышенную выработку ФНО-альфа, с чем, по мнению учёных, и было связано статистически значимое снижение уровня общего тестостерона в крови после курса инъекций ИЛ-2 [9]. Демонстрируя механизм ингибирующего действия ФНО-альфа на секрецию тестостерона, большинство исследований показывает его влияние на снижение активности цАМФ, аналогичное таковому у ИЛ-1, что приводит к нарушению каскада трансформаций предшественников тестостерона в культуре клеток Лейдига мышей. Некоторые независимые исследования свидетельствуют о вовлечении сфингомиелинового пути под воздействием ФНО-альфа с последующим подавлением синтеза тестостерона [10,11]. Более поздние исследования, посвящённые влиянию ФНО-альфа на стероидогенез, говорят о действии через путь активации ядерного фактора каппаби, по-видимому, в ответ на активацию протеинкиназы C [12, 13].
Таким образом, результаты представленных исследований подтверждают факт о прямом ингибировании ИЛ-1 и ФНО-альфа экспрессии ферментов генов стероидогенеза и самого стероидогенеза, что способствует серьезным нарушениям функционирования репродуктивной системы, ассоциированным с хроническим воспалительным процессом [14].
Считается, что использование методик измерения уровней цитокинов более специфично при диагностике простатита, чем исследование уровней лейкоцитов в секрете предстательной железы или семенной жидкости [15]. Безусловно, реализация этих методик способна определять объективность лечебно-диагностических мероприятий у пациентов с различными видами хронического простатита. Известные данные о взаимосвязи концентрации уровней цитокинов и тестостерона создают предпосылки для изучения влияния хронического воспалительного процесса в предстательной железе на андрогенный статус пациентов. Имеющиеся исследования демонстрируют лишь наблюдаемую тенденцию к ассоциации ХБП и АД. Именно отсутствие убедительных данных о влиянии ХБП на супрессию показателей андрогенного статуса приводит к поиску возможных патогенетических механизмов, объясняющих ассоциацию ХБП и клинико-лабораторных проявлений АД.
Связь хронического воспалительного процесса в предстательной железе и дефицита тестостерона особенно актуальна у пациентов молодого, трудоспособного возраста из-за широкой распространённости хронического простатита у данной популяционной группы и очевидного негативного влияния обозначенных состояний на фертильность.
Целью данного исследования было патогенетическое обоснование роли ХБП в формировании андрогенодефицита у пациентов фертильного возраста. Основной задачей исследования явилось определение влияния ХБП на уровни провоспалительных цитокинов – ФНО-альфа, ИЛ-1-бета и противовоспалительного цитокина – ИЛ-4 в эякуляте у пациентов с андрогенодефицитом, а также оценка влияния уровней вышеуказанных цитокинов на андрогенный статус этих пациентов после лечения ХБП.
МАТЕРИАЛЫ И МЕТОДЫ
Был обследован 41 пациент с хроническим бактериальным простатитом (средний возраст 26±3,9 лет). У всех пациентов осуществлялся сбор жалоб, анамнеза и проводился осмотр уролога. Пациентам с клинически установленным диагнозом проводилось дообследование, включавшее бактериологическое и микроскопическое исследование секрета предстательной железы, исследование гормонального профиля и измерение уровней прои противовоспалительных цитокинов в эякуляте.
Окраска мазков секрета предстательной железы осуществлялась по Романовскому-Гимзе, микроскопия проводилась при помощи микроскопа AxiostarPlusZeiss х1000. Для изучения андрогенного профиля у пациентов методом хемолюминесцентного анализа исследовался уровень общего тестостерона и глобулина, связывающего половые гормоны сыворотки крови, а в последующем рассчитывался уровень биологически доступного тестостерона (БДТ) и свободного тестостерона (Т св.). Расчёт проводился при помощи номограммы для вычисления уровня свободного тестостерона (Vermeulen A, Verdonik L, Kaufman J.M.) [16], а БДТ рассчитывался при помощи калькулятора расчёта биодоступного тестостерона, разработанного в отделении гормонологии, University Hospital of Ghent, Бельгия и размещённого на сайте Международного общества по вопросам старения мужчин – http://www.issam.ch/freetesto.htm.
Исследование уровня про(ИЛ1-бета и ФНО-альфа) и противовоспалительного (ИЛ-4) цитокинов проводилось в эякуляте иммуноферментным методом с использованием коммерческих тест-систем «Протеиновый контур» (г. Санкт-Петербург) и «DGR Internarional inc.» (Германия).
В ходе исследования пациенты были распределены на две группы. Первую группу составили 17 пациентов (средний возраст 27,3±4,2 года). Критерием для включения пациентов в группу было снижение уровня Т общ. ниже 12 нмоль/л.
Количество пациентов второй группы составило 24 человека, средний возраст – 27,4±3,8 года. Критерием включения пациентов в данную группу было отсутствие лабораторных признаков андрогенодефицита.
Наряду с клинико-лабораторными данными учитывались анамнестические данные, а именно – длительность заболевания у каждого пациента.
Для проведения сравнительного анализа была выделена группа контроля, в которую входили здоровые мужчины, сопоставимые по возрасту с пациентами групп исследования, средний возраст составил 27,1±5 года.
Всем пациентам назначалась антибактериальная терапия, соответствующая рекомендациям Европейской ассоциации урологов, заключающаяся в назначении левофлоксацина по 500 мг е/д курсом на 28 дней. В случае резистентности флоры секрета ПЖ к фторхинолонам, применялся препарат в соответствии с результатами антибиотикограммы. Помимо антибактериальной терапии проводился курс дренирующих предстательную железу процедур.
РЕЗУЛЬТАТЫ
Сравнивая полученные данные в группах пациентов, сопоставимых по возрасту, было отмечено статистически значимое различие в ряде показателей, характеризующих особенности течения воспалительного процесса, а также статистически значимое различие между характеристиками андрогенного статуса.
Следует отметить, что в отличие от пациентов I группы, у пациентов II группы анамнез заболевания был значительно короче, составив 4,5 месяца против 1,5 лет. При этом пациенты не занимались самолечением, а обратились к врачу практически сразу после появления первых симптомов, то есть на пике обострения.
Уровень ИЛ-1-бета преобладал в количественном отношении у пациентов II группы с хроническим бактериальным простатитом без лабораторных признаков андрогенодефицита, составив 166,8±33,6 пг/мл против 121,2±24,6 пг/мл (р≤ 0,01) у пациентов с сочетанием ХБП и андрогенодефицита (табл.1). Аналогичная тенденция наблюдалась и с ФНО-альфа, уровень которого был максимальным среди всех пациентов во II группе, составляя 80,6±29,2 пг/мл против 64±23,4 пг/мл (р≤ 0,01) у пациентов I группы. Средняя концентрация как ИЛ-1-бета, так и ФНО-альфа была значительно ниже у пациентов группы контроля, составив 21,8±3,5 и 26±4,7 пг/мл (р≤ 0,01) соответственно.
Таким образом, у пациентов с хроническим бактериальным простатитом наблюдалось превалирование концентраций провоспалительных цитокинов по сравнению со здоровыми мужчинами из группы контроля. Это позволяет сделать вывод о связи между повышенным количеством лейкоцитов в секрете предстательной железы и повышением провоспалительных цитокинов в эякуляте и, соответственно, о наличии воспалительного процесса в предстательной железе. При этом у пациентов I группы с длительным анамнезом заболевания, клинически характеризующимся сменой рецидивов и ремиссий, уровень провоспалительных цитокинов был достоверно ниже (р≤ 0,01), чем у пациентов II группы, где ХБП носит характер краткосрочного обострения.
Наряду с повышенными концентрациями провоспалительных цитокинов в исследуемых группах отмечается повышение концентрации ИЛ-4, относящегося к противовоспалительным цитокинам. Однако его уровень в группе контроля остался достоверно ниже (р≤ 0,01), составив 28,7±4,8 пг/мл против 94,9±33 и 72,6±25,7 пг/мл в I и II группе соответственно.
Известно, что соотношение про-и противовоспалительных цитокинов характеризует активность воспалительного процесса [17]. В наших исследованиях уровень ИЛ-4 был достоверно выше, а уровень ИЛ-1-бета и ФНО-альфа достоверно ниже в I группе, чем во II группе (р ≤ 0,01). Характер изменений уровней прои противовоспалительных цитокинов у пациентов с ХБП свидетельствует о длительном и рецидивирующем характере заболевания.
Исследования, посвященные изучению роли цитокинов в патогенезе хронического простатита, демонстрируют связь между повышением уровней ИЛ-1-бета, ФНО-альфа и возникновением болевого синдрома, однако, вместе с тем показывают отсутствие корреляции между колебаниями цитокинов и выраженностью симптомов нижних мочевых путей [15]. То есть у пациентов с длительным анамнезом заболевания, имеющего рецидивирующий характер, многократные периоды обострения сопровождаются повышением концентраций ИЛ-1-бета и ФНОальфа.
Таблица 1. Сравнение уровней цитокинов и показателей андрогенного статуса у пациентов с ХБП, с сочетанием ХБП и АД и у мужчин контрольной группы
| Признаки | I группа (n=17) | II группа (n=24) | III группа (n=12) |
|---|---|---|---|
| Возраст (лет) | 27,3±4,2 | 27,4±3,8 | 27,1±5 |
| ИЛ-1-бета (пг/мл) | 121,2±24,6 | 166,8±33,6 | 21,8±3,5 |
| р≤ 0,01 | |||
| ФНО-альфа (пг/мл) | 64±23,4 | 80,6±29,2 | 26±4,7 |
| р≤ 0,01 | |||
| ИЛ-4 (пг/мл) | 94,9±33 | 72,6±25,7 | 28,7±4,8 |
| р≤ 0,01 | |||
| Тобщ. (нмоль/л) | 10,1±1,9 | 15,5±4,5 | 20±4,2 |
| р≤ 0,01 | |||
| Тсв. (пг/мл) | 67,3±17,7 | 124±35,7 | 170,8±40,4 |
| р≤ 0,01 | |||
| БДТ (%) | 52,1±7,8 | 64,7±4,6 | 65,8±4,8 |
| р≤ 0,01 | |||
| Лейкоциты в секрете ПЖ (ед. в п/зр) |
29,4±12,6 | 32,9±17,9 | – |
Сравнительный анализ показателей андрогенного профиля у пациентов I и II групп показал более высокие уровни Т общ., Т св. и БДТ у пациентов II группы: Т общ. – 15,5±4,5 нмоль/л., Т св. – 124±35,7 пг/мл., БДТ – 64,7±4,6%. В тоже время аналогичные показатели андрогенного профиля у пациентов контрольной группы были достоверно выше, чем у пациентов II группы (р ≤ 0,01).
Таким образом, у пациентов с хроническим бактериальным простатитом отмечается снижение всех исследуемых показателей андрогенного профиля. При этом у пациентов I группы с длительным анамнезом ХБП уровень фракций тестостерона был достоверно ниже, чем у пациентов II группы.
После проведения курса лечения выполнялось повторное исследование уровня цитокинов в эякуляте, осуществлялся контроль бактериологической и микроскопической картины секрета предстательной железы, а также мониторинг андрогенного профиля у пациентов обеих групп. В этом случае, контрольные анализы секрета предстательной железы продемонстрировали эрадикацию бактериального агента у всех пациентов в исследуемых группах, либо снижение его концентрации до клинически незначимых значений – менее 103 КОЕ/мл.
Нормализация количества лейкоцитов в секрете предстательной железы наблюдалось также у пациентов обеих групп, после лечения составив у пациентов I группы – 3,7±1,9 в п/зр., у пациентов II группы – 5,2±1,6 в п/зр (р ≤ 0,01). Таким образом, лечение позволило добиться ликвидации как клинических, так и лабораторных критериев заболевания.
Исследование цитокинового профиля эякулята показало изменение соотношения прои противовоспалительных цитокинов. Отмечено статистически значимое снижение ИЛ-1-бета и ФНО-альфа в обеих группах исследования (р ≤ 0,01). ИЛ1-бета после лечения у пациентов I группы составил 57,7±11,7 пг/мл, у пациентов II группы – 50,5±10,2 пг/мл. ФНО-альфа составил у пациентов I группы – 46,2±9,3 пг/мл, а у паци-ентов II группы – 55,6±20,2 пг/мл (табл. 2).
Наряду с купированием воспалительного процесса в ПЖ, что подтверждается как уменьшением количества лейкоцитов в секрете ПЖ, так и снижением концентраций провоспалительных цитокинов в эякуляте, отмечалось снижение уровня ИЛ-4, составившего у пациентов I группы после лечения 35±8,3 пг/мл, а у пациентов II группы – 45,4±16 пг/мл (р ≤ 0,01).
Наблюдение за параметрами андрогенного статуса также показало ряд изменений. У пациентов I группы с андрогенодефицитом в среднем произошло статистически значимое повышение уровня Т общ., нормализовавшегося после лечения и составившего 16,6±5,7 нмоль/л (р ≤ 0,01). Отмечено некоторое повышение уровня Т общ. и у пациентов II группы, у которых этот показатель в среднем после лечения составил 17,8±4 нмоль/л (р ≤ 0,05).
Помимо изменений уровня Т общ. зафиксировано повышение и прочих фракций тестостерона. Так Т св. после лечения составил у пациентов II группы 116,5±37,8 пг/мл, а у пациентов II группы – 137,4±33,6 пг/мл. Доля БДТ в I группе составила 58,6±11%, а во II – 63,2±6,3%.
Сравнительный анализ показателей, полученных до и после лечения у пациентов I и II групп, демонстрирует статистически значимое уменьшение концентраций как про, так и противовоспалительных цитокинов у пациентов обеих групп: в I группе выявлено снижение ИЛ1бета со 121,2±24,6 до 57,7±11,7 пг/мл, ФНО-альфа с 64±23,4 до 46,2±9,3 пг/л, ИЛ-4 – с 94,9±33 до 35±8,3 пг/мл; во II группе – ИЛ-1-бета со 166,8±33,6 до 50,5±10,2 пг/мл, ФНО-альфа – с 80,6±29,2 до 55,6±20,2 пг/мл, ИЛ-4 – с 72,6±25,7 до 45,4±16 пг/мл.
Уменьшение концентраций исследуемых цитокинов в эякуляте сопровождалось статистически значимым уменьшением количества лейкоцитов в секрете предстательной железы в обеих группах: в I группе с 29,4±12,6 до 3,7±1,9 в п/зр, во II группе – с 32,9±17,9 до 5,2±1,6 в п/зр, а также купированием симптомов ХБП.
Таблица 2. Сравнение уровней цитокинов и показателей андрогенного статуса у пациентов с ХБП, сочетанием ХБП и АД до и после лечения
| Признаки | I группа (n=17) | II группа (n=24) | Контроль (n=12) | ||
|---|---|---|---|---|---|
| До лечения | После лечения | До лечения | После лечения | ||
| Возраст | 27,3±4,2 | 27,4±3,8 | 27,1±5 | ||
| ИЛ-1-бета (пг/мл) | 121,2±24,6 | 57,7±11,7 | 166,8±33,6 | 50,5±10,2 | 21,8±3,5 |
| р≤ 0,01 | р≤ 0,01 | ||||
| ФНО-альфа (пг/мл) | 64±23,4 | 46,2±9,3 | 80,6±29,2 | 55,6±20,2 | 26±4,7 |
| р≤ 0,01 | р≤ 0,01 | ||||
| ИЛ-4 (пг/мл) | 94,9±33 | 35±8,3 | 72,6±25,7 | 45,4±16 | 28,7±4,8 |
| р≤ 0,01 | р≤ 0,01 | ||||
| Тобщ. (нмоль/л) | 10,1±1,9 | 16,6±5,7 | 15,5±4,5 | 17,8±4 | 20±4,2 |
| р≤ 0,01 | р≤ 0,05 | ||||
| Тсв. (пг/мл) | 67,3±17,7 | 116,5±37,8 | 124±35,7 | 137,4±33,6 | 170,8±40,4 |
| р≤ 0,01 | р≤ 0,05 | ||||
| БДТ (%) | 52,1±7,8 | 58,6±11 | 64,7±4,6 | 63,2±6,3 | 65,8±4,8 |
| р≤ 0,01 | р≤ 0,05 | ||||
| Лейкоциты в секрете ПЖ (ед. в п/зр) |
29,4±12,6 | 3,7±1,9 | 32,9±17,9 | 5,2±1,6 | – |
| р≤ 0,01 | р≤ 0,01 | ||||
Таким образом, сочетание повышенного количества лейкоцитов в секрете предстательной железы и высокие уровни ИЛ-1-бета и ФНОальфа в эякуляте может рассматриваться как свидетельство наличия активного воспалительного процесса в предстательной железе. В этом случае изменение уровня лейкоцитов в соке ПЖ может достоверно отражать характер течения воспалительного процесса.
Наряду с уменьшением уровней цитокинов в эякуляте и лейкоцитов в секрете предстательной железы у пациентов обеих групп после лечения отмечалось статистически значимое повышение уровня общего тестостерона и его фракций (рис. 1, 2). Так уровень Т общ. у пациентов I группы достоверно повысился с 10,1±1,9 до 16,6±5,7 нмоль/л (р ≤ 0,01), у пациентов II группы – с 15,5±4,5 до 17,8±4 нмоль/л (р ≤ 0,05). Повышение концентрации общего тестостерона сопровождалось повышением Т св. и БДТ. У пациентов I группы Т св. повысился с 67,3±17,7 до 116,5±37,8 пг/мл, у пациентов II группы повышение не было статистически достоверным, однако, наблюдалась тенденция к повышению со 124±35,7 до 137,4±33,6 пг/мл (р ≥ 0,05). Повышение БДТ зафиксировано с 52,1±7,8% до 58,6±11% у пациентов I группы, а у пациентов II группы было отмечено незначительное уменьшение БДТ с 64,7±4,6% до 63,2±6,3%, что не было статистически значимым (р ≥ 0,05), и показатель находился в пределах нормальных значений. Следовательно, уменьшение концентрации цитокинов в эякуляте, уменьшение количества лейкоцитов в секрете ПЖ коррелировало с повышением показателей андрогенного профиля, а у пациентов I группы отмечена даже нормализация уровня Т общ.
ОБСУЖДЕНИЕ
Из результатов проведённого сравнительного анализа следует вывод о том, что у пациентов I группы с длительным рецидивирующим течением ХБП, чередующимся периодами ремиссии и обострения наблюдаются более глубокие изменения андрогенной составляющей гормонального профиля. Снижение уровня Т общ. и доли БДТ ниже нормативных значений сопровождается повышением цитокинов острой фазы воспаления – ИЛ-1-бета и ФНО-альфа, которые в свою очередь оказывают супрессивное влияние как на тестикулярный механизм выработки тестостерона, так и на гипоталамо-гипофизарнотестикулярный механизм регулирования его выработки.
Характерной особенностью, выявленной в результате анализа полученных данных, явилось отсутствие снижения ниже порогового значения Т общ. и БДТ у пациентов II группы, у которых наблюдалось статистически более выраженное повышение ИЛ-1-бета и ФНО-альфа. В ходе исследования установлено, что на выраженность гормональной супрессии влияет длительность течения воспалительного процесса. У пациентов I группы с длительностью заболевания 4,5 мес. наблюдалось достоверное повышение уровня ИЛ-4 по сравнению с пациентами II группы, длительность заболевания которых составляла 18 мес. Именно ИЛ-4 является ингибитором деятельности макрофагов, вырабатывающих ИЛ-1-бета и ФНО-альфа, таким образом, оказывая противовоспалительное действие. И повышение ИЛ-4 рассматривается как результат хронического воспалительного процесса. Как известно, хроническое воспаление характеризуется эпизодами обострения и ремиссии, что и наблюдается у пациентов I группы. Каждое обострение сопровождается повышением концентрации ИЛ-1-бета и ФНО-альфа в семенной жидкости и в органах репродуктивного тракта, приводя к ингибированию тестикулярной активности. Многократно повторяющиеся обострения, характерные для ХБП, приводят к более значимому снижению уровней андрогенов, наблюдаемому у пациентов I группы.
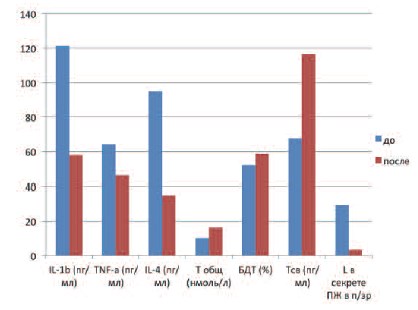
Рис. 1. Изменение уровней цитокинов и показателей андрогенного статуса у пациентов I группы с сочетанием ХБП и АД после лечения
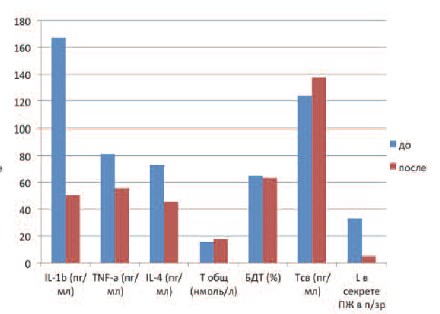
Рис. 2. Изменение уровней цитокинов и показателей андрогенного статуса у пациентов II группы с ХБП после лечения
ЗАКЛЮЧЕНИЕ
У пациентов с сочетанием ХБП и АД достоверно выше уровень ИЛ-4 в эякуляте, чем у пациентов с ХБП и у пациентов контрольной группы, что свидетельствует о длительном течении заболевания, соответствуя анамнестическим данным. Лечение ХБП сопровождается уменьшением концентраций как про, так и противовоспалительных цитокинов в эякуляте, коррелируя с повышением уровня Т общ. и Т св. у всех пациентов и с уменьшением количества лейкоцитов в секрете ПЖ.
Таким образом, в основе механизма формирования АД при ХБП у пациентов фертильного возраста лежит гиперпродукция провоспалительных цитокинов, воздействию которой больше подвержены пациенты с длительным анамнезом заболевания.
ЛИТЕРАТУРА
- Коган М.И., Ибишев Х.С., Ферзаули А.Х. Хронический бактериальный простатит и биохимический андрогенный дефицит // Материалы пленума правления российского общества урологов. Кисловодск. 2011. С. 326.
- Тюзиков И.А., Калинченко С.Ю., Ворслов Л.О., Греков Е.А. Коррекция андрогенного дефицита при хроническом инфекционном простатите как патогенетический метод преодоления неэффективности стандартной антибактериальной терапии на фоне растущей антибиотикорезистентности // Андрология и генитальная хирургия. 2013. №1. С.55.
- Cutolo M, Balleari E, Giusti M, Intra E, Accardo S. Sex hormone status of male patients with rheumatoid arthritis: evidence of low testosterone at baseline and after hu-man chorionic gonadotropin stimulation. // Arthritis Rheum. 1988. Vol. 31. N 10. P. 1314-1317.
- Handelsman DJ, Spaliviero JA, Turtle JR. Testicular function in experimental uremia. // Endocrinology. 1985. Vol. 117. N 5. P. 1974-1983.
- Mauduit C, Chauvin MA, Hartmann DJ. Interleukin-1a as a potent inhibitor of gonad-otropin action in porcine Leydig cells: site(s) of action. // Biol Reprod. 1992. Vol. 46. P. 1119-1126.
- Lin T,Wang D, Stocco DM. Interleukin-1 inhibits Leydig cell steroidogenesis without affecting steroidogenic acute regulatory protein messenger ribonucleic acid or protein levels. // J Endocrinol. 1998. Vol. 156. N 3. P. 461–467.
- Hales DB. Interleukin-1 inhibits Leydig cell steroidogenesis primarily by decreasing 17á-hydroxylase/C17–20 lyase cytochrome P450 expression. // Endocrinology 1992. Vol. 131. P. 2165–2172.
- Van der Poll T, Romijn JA, Endert E, Sauerwein HP. Effects of tumor necrosis factor on the hypothalamic-pituitary-testicular axis in healthy men. // Metabolism. 1993. Vol. 42. N 3. P. 303–307.
- Meikle AW, Cardoso de Sousa JC, Ward JH, Woodward M, Samlowski WE. Reduction of testosterone synthesis after high dose interleukin-2 therapy of metastatic cancer. // J Clin Endocrinol Metab. 1991. Vol. 73. N 5. P. 931–935.
- Budnik LT, Jahner D, Mukhopadhyay AK. Inhibitory effects of TNFα on mouse tu-mor Leydig cells: possible role of ceramide in the mechanism of action. // Mol Cell Endocrinol. 1999. Vol. 150. P. 39–46.
- Morales V, Santana P, Díaz R, Tabraue C, Gallardo G, López Blanco F, Hernández I, Fanjul LF, Ruiz de Galarreta CM. Intratesticular delivery of tumor necrosis factor-α and ceramide directly abrogates steroidogenic acute regulatory protein expression and Leydig cell steroidogenesis in adult rats. // Endocrinology. 2003. Vol. 144. N 11. P. 4763–477
- Hong CY, Park JH, Ahn RS, Im SY, Choi HS, Soh J, Mellon SH, Lee K. Molecular mechanism of suppression of testicular steroidogenesis by proinflammatory cytokine tumor necrosis factor α. // Mol Cell Biol. 2004. Vol. 24. N 7. P. 2593–2604.
- Li X, Youngblood GL, Payne AH, Hales DB. Tumor necrosis factor-α inhibition of 17α-hydroxylase/C17-20 lyase gene (Cyp17) expression. // Endocrinology. 1995. Vol. 136. N 8. P. 3519–3526.
- Payne AH, Hardy MP. The Leydig cell in health and disease 2007. Humana Press. P. 471.
- Дорофеев С.Д., Кудрявцев Ю.В., Кудрявцева Л.В. Иммуногистохимические аспекты хронического абактериального простатита // Эффективная фармакотерапия 2014. №2. С. 26-38.
- Vermeulen A, Verdonik L, Kaufman JM. Critical evaluation of simple methods for the free testosterone in serum. // J Clin Endocrinol Metab. 1999. Vol. 84. P.3666 – 3672. 17. Jang TL. Schaeffer AJ. The role of cytokines in prostatitis. // World J Urol.. 2003. Vol. 21. P. 95 – 99.









Комментарии