Шорманов И.С., Соловьев А.С.
С общепринятой точки зрения, хронический бактериальный простатит (ХБП) представляет собой хроническое рецидивирующее воспалительное заболевание предстательной железы (ПЖ), вызываемое различными бактериями, которое характеризуется стойким хроническим тазово-простатическим болевым синдромом в течение не менее трех месяцев подряд, сочетающимся с наличием инфекционных агентов в диагностически значимом титре при микробиологических исследованиях секрета предстательной железы. ХБП составляет в общей структуре воспалительных заболеваний предстательной железы около 5% [1]. Вместе с тем, достоверно показано, что ХБП, исходно начавшийся в результате проникновения инфекционных агентов в ПЖ, в дальнейшем может протекать и без их участия (аутоиммунные механизмы). На этом основании в течении заболевания выделяются инфекционная и постинфекционная фазы [2]. В этих условиях, неминуемо, основным звеном развития событий по мнению многих исследователей является не инфекция, а конгестия ПЖ, причем независимо от пусковых механизмов ХБП [3]. Развитие инфекционно-воспалительного процесса в ПЖ влечет за собой существенные изменения в ее микроциркуляторном русле, ведущие к дальнейшему прогрессивному повреждению тканей токсически-гипоксического генеза с прогрессирующим ухудшением всех ее функций. В связи с этим есть мнение, что повреждение тканей ПЖ вследствие нарушения ее гемодинамики является важнейшим механизмом развития ХБП, не зависящим от его этиологического фактора [4-6].
Давно установлено, что у больных ХБП регистрируются различные сдвиги микроциркуляции, гемокоагуляции и фибринолиза, выявляемые как при изучении соответствующих маркеров в плазме крови, так и на основании допплерографических исследований кровообращения в ПЖ. Однако более глубокое понимание сущности гемодинамических нарушений в патогенезе ХБП стало возможным только после открытия в конце XX века ключевой роли оксида азота (NO) в регуляции сосудистого гомеостаза, что послужило базисом для современного учения о системной эндотелиальной дисфункции [7].
Эндотелиальная дисфункция – это частичное снижение или полная утрата способности эндотелиальных клеток сосудов обеспечивать адекватный синтез сосудосуживающих и сосудорасширяющих факторов, определяющих структурнофункциональную целостность эндотелия и профилактические антиатерогенные эффекты [7].
Эндотелиальная дисфункция – ключевой фактор патогенеза всех сердечно-сосудистых заболеваний (в том числе, их самого раннего маркера – эректильной дисфункции), а также сахарного диабета и депрессии. Однако в последние годы накопилась большая доказательная база для утверждения, что эндотелиальная дисфункция является не только ключевым патогенетическим фактором всех этих заболеваний, но и играет важную роль в патогенезе многих заболеваний ПЖ за счет ее способности к самостоятельному сосудистому синтезу оксида азота [8-12].
Сегодня стали появляться работы, в которых нарушения простатического кровообращения (артериального и венозного) и микроциркуляторные нарушения в ПЖ, ассоциированные с эректильной дисфункцией, часто сопутствующей ХБП, рассматриваются в контексте локальных проявлений системной эндотелиальной дисфункции, которая может вносить свой вклад в патогенез различных симптомов ХБП, включая болевой синдром [13,14]. С учетом пока небольшого количества подобных публикаций в отечественной литературе изучение роли эндотелиальной дисфункции в патогенезе болевого синдрома при ХБП представляется актуальной и перспективной задачей, направленной, в конечном итоге, на улучшение результатов лечении и профилактики ХБП.
Цель исследования – изучить характер и частоту проявлений эндотелиальной дисфункции и уточнить их связь с болевым синдромом у больных с обострением хронического бактериального простатита (ХБП).
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 120 мужчин в возрасте 22-48 лет (средний возраст – 39,6±2,3 лет) с клинико-лабораторным подтверждением обострения ХБП и 30 практически здоровых мужчин того же возраста (группа контроля). Диагноз обострения ХБП устанавливался на основании характерной клинической картины заболевания, подтвержденной положительными результатами бактериологических исследований секрета ПЖ.
Для объективизации степени выраженности болевого синдрома при обострении ХБП использовали специальный валидный опросник – Международную шкалу оценки симптомов хронического простатита CPSI-QL (Chronic Prostatitis Symptom Index – Quality of Life), на основании результатов которого оценивали индекс боли (ИБ) по шкале от 1 до 10 [15]. Для оценки состояния эндотелиальной функции у всех пациентов клинически изучалось состояние эректильной функции, определялся плазменный уровень свободного L-аргинина – предшественника оксида азота и выполнялись ультразвуковые допплерографические (УЗ-ДГ) исследования гемодинамики ПЖ.
Для оценки состояния эректильной функции использовался опросник Международного Индекса Эректильной Функции IIEF-5 (шкала МИЭФ-5) [16].
Определение уровня свободного L-аргинина (предшественника оксида азота) плазмы крови проводили по стандартной методике с помощью анализатора аминокислот LC5001 фирмы «Биотроник» (Германия) путем разделения всех аминокислот на хроматографической колонке диаметром 3,2 мм, наполненной сферической катионообменной смолой из сульфированного полистирола ВТС 2710 [17]. Высота столба смолы в колонке составляла 210 мм. Элюирование аминокислот, нанесенных на ионообменную смолу с помощью инжектора, осуществляли по программе разделения гидролизатов белков, задаваемой процессором анализатора. При этом последовательно использовали 5 натрий-цитратных буферных растворов с рН от 3,45 до 10,5 при изменении температуры разделительной колонки от 48 до 70оС. Расчет площадей пиков, определение концентрации и идентификацию аминокислот осуществляли с помощью системы обработки данных СR3А, программирование которой проводили по результатам анализа стандартной смеси аминокислот (фирма «Сигма-олдрич») для калибровки анализаторов АА-S-18 и А-2S08. За нормальные значения плазменного уровня L-аргинина принимали диапазон 1,6-3,0 мг % (91,8-172,2 мкмоль/л) [17]. Для исследования особенностей кровообращения ПЖ и выявления нарушений ее гемодинамики (простатической эндотелиальной дисфункции) применялся метод трансректальной УЗ-допплерографии с цветным картированием на аппарате «Acuson Sequoia 512» (Япония) датчиком 3,5 МГц. Для оценки артериального кровотока в ПЖ использовали количественный угол-зависимый параметр пиковой (максимальной) систолической скорости (Vмакс.) применительно к центральной зоне (скорость кровотока в простатических – V макс. прост.) и уретральных артериях – V макс. уретр.) и периферической зоне ПЖ (скорость кровотока в капсулярных артериях – V макс. капсул.). Для оценки венозного кровотока использовали показатель средней скорости кровотока -Vвен.ср. Для оценки периферического сопротивления использовали расчетный индекс резистентности Пурсилота (IR) [18].
Статистическая обработка выполнялась в программе Microsoft Excel-2007 и Statistica 6.0. (StatSoft, USA). Для оценки межгрупповых различий значений признаков, имеющих непрерывное распределение, применяется t–критерий Стьюдента. Критический уровень достоверности нулевой статистической гипотезы (об отсутствии значимых межгрупповых различий или факторных влияний) принимали равным 0,05. Статистически значимой для всех показателей считали общепринятую в медико-биологических исследованиях величину, равную р<0,05 [19].
Результаты оценки клинической симптоматики у больных с обострением ХБП представлены в таблице 1. Как следует из таблицы, снижение либидо и нарушения эректильной функции в период обострения ХБП отмечались у 51,7% и 49,2% больных, соответственно. Таким образом, сексуальные нарушения в структуре клинической симптоматологии обострения ХБП занимали по частоте третье место после болевого синдрома и психо-эмоциональных расстройств. Наше исследование показало, что в период обострения ХБП пациенты имели в целом достоверно худшие показатели эректильной функции по сравнению со здоровыми мужчинами контрольной группы. Так, среднее значение индекса МИЭФ-5 было достоверно ниже, а интервал его индивидуальных колебаний – достоверно шире, чем в контрольной группе, что указывало не только на наличие эректильной дисфункции, но и на ее выраженный нестабильный характер в период обострения ХБП (р<0,05) (табл. 2).
Таблица 1. Частота различных клинических симптомов у больных с обострением хронического бактериального простатита
| Клинические симптомы | Абс. (чел.) | Частота в % |
|---|---|---|
| Болевой синдром в области малого таза/предстательной железы с иррадиацией боли в соседние анатомически зоны или без таковой |
120 | 100,0 |
| Повышенный уровень тревожности и депрессивности | 104 | 86,7 |
| Снижение работоспособности в связи с болью | 96 | 80,0 |
| Снижение либидо | 62 | 51,7 |
| Снижение частоты и выраженности адекватных эрекций | 59 | 49,2 |
| Ирритативные симптомы нижних мочевых путей (СНМП) | 52 | 43,3 |
| Снижение частоты и выраженности утренних спонтанных эрекций | 35 | 29,2 |
Таблица 2. Результаты оценки эректильной функции у здоровых мужчин и у больных с обострением хронического бактериального простатита
| Состояние эректильной функции | Контрольная группа (n=30) (среднее значение и доверительный интервал 0,95) |
Больные с обострением ХБП (среднее значение и доверительный интервал 0,95) |
p |
|---|---|---|---|
| Индекс ЭД по МИЭФ-5 (баллы) |
21,2±1,2 (20-25) |
15,6±3,4 (12-25) |
p<0,05 |
В ходе корреляционного анализа у больных с обострением ХБП была установлена достоверная отрицательная связь между индексом боли (ИБ) и тяжестью эректильной (эндотелиальной) дисфункции, оцененной в баллах по шкале МИЭФ5 (n=120; r=0,385; р=0,001) (рис. 1).
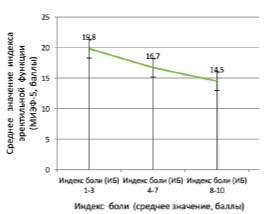
Рис. 1. Зависимость между индексом боли (ИБ) и индексом эректильной (эндотелиальной) функции МИЭФ-5 у больных с обострением ХБП
Результаты измерений плазменного уровня свободного L-аргинина представлены в таблице 3.
Таблица 3. Уровень свободного L-аргинина у здоровых мужчин и у больных с обострением хронического бактериального простатита
| Изучаемый показатель | Контрольная группа (n=30) (среднее значение и довери- тельный интервал 0,95) |
Больные с обострением ХБП (среднее значение и доверительный интервал 0,95) |
p |
|---|---|---|---|
| Плазменный уровень свободного L-аргинина (мкмоль/л) |
124,6±15,6 (91,8-172,2) | 104,3±25,4 (84,5-154,3) | <0,1 |
Как видно из таблицы 3, достоверных различий средних значений плазменного уровня свободного L-аргинина между здоровыми мужчинами контрольной группы и больными с обострением ХБП выявлено не было (р<0,1). Однако при анализе индивидуальных показателей плазменного уровня свободного L-аргинина было установлено, что ни у одного из клинически здоровых мужчин контрольной группы индивидуальный уровень этой аминокислоты не оказывался ниже нижней границы нормы, иными словами, у здоровых мужчин не отмечалось ни популяционного, ни индивидуального дефицита L-аргинина. Напротив, у 38 (31,7%) больных с обострением ХБП отмечалось снижение плазменного уровня L-аргинина ниже нижней границы полученного нами референтного диапазона, т.е., речь шла об абсолютном индивидуальном дефиците данной аминокислоты. При этом длительность клинического течения ХБП у больных с выявленным лабораторным индивидуальным дефицитом L-аргигина составляла не менее 10 лет (ДИ| 7-14 лет). Диапазон индивидуальных колебаний плазменного уровня L-аргинина у больных с обострением ХБП (независимо от наличия и степени выраженности эректильной (эндотелиальной) дисфункции) оказался достоверно шире, чем у здоровых мужчин контрольной группы, что свидетельствовало, по нашему мнению, о нестабильности эндогенного обмена L-аргинина у данной категории пациентов и его определенной роли в клинической картине заболевания (р<0,05). Однако достоверной связи между плазменным уровнем свободного L-аргинина и выраженностью боли (ИБ) у больных с обострением ХБП в ходе исследования не установлено (р<0,1).
Результаты ультразвуковой допплерографических (УЗ ДГ) исследований кровообращения предстательной железы представлены в таблице 4. Из таблицы 4 видно, что у всех больных с обострением ХБП по сравнению с контрольной группой клинически здоровых мужчин при проведении УЗ ДГ ПЖ выявлялись выраженные нарушения простатической регионарной гемодинамики, которые касались всех основных сосудистых коллекторов железы (р<0,05). Допплерографические находки при обострении ХБП заключались в достоверном снижении среднего показателя пиковой скорости кровотока по простатическим артериям на 28,9% по сравнению с аналогичным показателем у здоровых мужчин (дефицит артериального кровообращения (эндотелиальная дисфункция) ПЖ); в достоверном повышении индексов резистентности (ИР) кровотоку одновременно во всех крупных артериальных коллекторах ПЖ (простатических – на 7,7%, капсулярных – на 12,1% и уретральных – на 23,2%, в среднем – на 14,3%) и в достоверном снижении среднего показателя линейной скорости крови по венам на 27,4% по сравнению с аналогичным показателем у здоровых мужчин (венозная (эндотелиальная) дисфункция предстательной железы) (р<0,05). При проведении корреляционного анализа выявлена достоверная положительная связь между индексом боли (ИБ) и индексом резистентности кровотоку (ИР) в капсулярных артериях предстательной железы (n=120; r=0,231; р=0,001).
Таблица 4. Основные показатели простатического кровообращения у здоровых мужчин и у больных с обострением хронического бактериального простатита
| Изучаемые бассейны и показатели кровообращения |
Контрольная группа (среднее значение и доверительный интервал 0,95) |
Больные с обострением ХБП (среднее значение доверительный интервал и доверительный интервал 0,95) |
p | |
|---|---|---|---|---|
| Простатические артерии | V max (см/с) | 20,4±2,2 (16,6-24,5) |
14,5±1,9 (12,3-19,5) |
<0,05 |
| Индекс резистентности (ИР) | 0,91±0,06 (0,85-0,96) |
0,98±0,01 (0,88-1,00) |
<0,05 | |
| Капсулярные артерии |
V max (см/с) | 7,8 ± 1,1 (5,0-9,5) |
6,3 ± 1,6 (3,4-9,4) |
>0,05 |
| Индекс резистентности (ИР) | 0,58 ± 0,04 (0,52-0,68) |
0,65 ± 0,08 (0,59-0,71) |
<0,05 | |
| Уретральные артерии |
V max (см/с) | 8,2 ± 1,5 (6,2-10,3) |
7,3 ± 1,6 (4,5-9,4) |
>0,05 |
| Индекс рези- стентности (ИР) |
0,56 ± 0,03 (0,49-0,64) |
0,69 ± 0,05 (0,52-0,71) |
<0,05 | |
| Линейная скорость по венам |
V (см/с) | 7,3 ±0,06 (5,5-18,4) |
5,3 ±0,02 (3,5-10,2) |
<0,05 |
ОБСУЖДЕНИЕ
Результаты исследования показали, что в период обострения инфекционно-воспалительного процесса в ткани предстательной железы, третьей по клинической значимости и выраженности группой жалоб пациентов (после болевого синдрома и психо-эмоциональных расстройств), являются сексуальные нарушения. При этом снижение либидо и эректильная дисфункция отмечены практически у каждого второго пациента, а снижение частоты и выраженности утренних спонтанных эрекций имелись практически у каждого третьего мужчины.
У 31,7% пациентов с обострением ХБП, имевших признаки эректильной дисфункции, при лабораторных исследованиях диагностирован абсолютный дефицит плазменного свободного L-аргинина – ключевого предшественника оксида азота в эндотелии (р<0,05). С учетом выявленных особенностей диапазона плазменного уровня свободного L-аргинина у больных с обострением ХБП можно предположить, что дефицит L-аргинина может рассматриваться как дополнительный лабораторный маркер эректильной (эндотелиальной) дисфункции у больных с обострением ХБП, особенно, при длительности его течения свыше 10 лет, когда плазменный уровень свободного L-аргинина оказался сниженным у всех пациентов (р<0,05). Данные клинико-лабораторные маркеры эндотелиальной дисфункции сопровождались описанными характерными допплерографическими признаками (маркерами) нарушений регионарной простатической гемодинамики, которые в разной степени выраженности выявлялись у всех больных с обострением ХБП (р<0,05).
Согласно полученным данным, наиболее достоверными маркерами эндотелиальной дисфункции у больных с обострением ХБП, продемонстрировавших свою связь с болевым синдромом, можно рассматривать эректильную дисфункцию и нарушения простатической регионарной гемодинамики, выявляемые с помощью УЗ ДГ предстательной железы. С учетом отсутствия достоверной связи между плазменным уровнем L-аргинина и выраженностью болевого синдрома рекомендовать выполнение подобного лабораторного исследования рутинно всем пациентам с обострением ХБП считаем преждевременным, но при наличии сопутствующей эректильной дисфункции у мужчин с ХБП при его длительности более 10 лет вероятность выявления лабораторного дефицита свободного L-аргинина повышается, что следует учитывать при проведении диагностики и лечения таких пациентов. В целом результаты исследования наглядно показали важную, но недооцененную в клинической практике роль эндотелиальной дисфункции в патогенезе болевого синдрома при обострении хронического бактериального простатита.
ЗАКЛЮЧЕНИЕ
Проведенное исследование позволяет сделать достоверный вывод о том, что патогенез болевого синдрома при обострении ХБП является мультифакторным. Кроме «классической» инфекционно-воспалительной природы боли при ХБП при целенаправленном обследовании пациентов можно выявить другие важные неинфекционные и невоспалительные механизмы болевого синдрома. Одну из ключевых ролей играет эндотелиальная дисфункция, сопровождающаяся существенными нарушениями регионарного простатического кровообращения, достоверно коррелирующими с выраженностью болевого синдрома, поскольку это закономерно приводят к ишемии и гипоксии ПЖ, усугубляющей клиническое течение инфекционновоспалительной боли. В этой связи активное выявление эндотелиальной дисфункции у больных с обострением ХБП является целесообразной и патогенетической опцией, которая позволит успешно перейти от нашего традиционного понимания ХБП только лишь как локального проявления бактериальной инфекции предстательной железы к восприятию его как мультифакторного полиэтиологического симптомокомплекса. Выявленная в ходе исследования роль эндотелиальной дисфункции в патогенезе болевого синдрома при обострении ХБП предполагает расширение спектра традиционной фармакотерапии обострений ХБП от назначения только лишь этиотропной антимикробной монохимиотерапии к проведению комбинированной этиопатогенетической терапии обострений ХБП с обязательным дополнительным к антимикробным средствам назначением препаратов для патогенетической коррекции эндотелиальной дисфункции, что существенно улучшит результаты лечения и профилактики обострений ХБП и качество жизни пациентов.
ЛИТЕРАТУРА
1. Grabe M, Bartoletti R, Bjerklund Johansen TE, Cai T, Çek M, Köves B, et al. Guidelines on Urological Infections. EAU, 2015. 86 р.
2. Молочков В.А., Ильин И.И. Уретрогенный простатит. М.: Медицина, 1998. 228 с.
3. Strohmaier WL, Bichler KH. Comparison of symptoms, morphological, microbiological and urodynamic findings in patients with chronic prostatitis/pelvic pain syndrome. Is it possible to differentiate separate categories? Urol Int 2000; 65(2): 112-116
4. Тиктинский О.Л., Калинина С.Н., Михайличенко В.В. Андрология. М.: Медицинское информационное агентство, 2011. 576 с.
5. Ткачук В.Н. Хронический простатит. М.: МДВ, 2006. 112 с.
6. Серегин С.П., Панов А.В. Коррекция простатической гемодинамики при хронических простатитах. Вопросы курортологии. физиотерапии, лечебной физкультуры 1997; (2): 20-21
7. Celermajer DS. Endothelial dysfunction: does it matter? Is it reversible? J Am Coll Cardio 1997; 30(2): 325-333
8. Кирпатовский В.И., Мкртчян К.Г., Фролова Е.В., Казаченко А.В. Роль гормональных факторов и нарушения кровоснабжения предстательной железы в патогенезе ДГПЖ. Экспериментальная и клиническая урология 2013; (2): 38-45
9. Guay AT. ED2: erectile dysfunction = endothelial dysfunction. Endocrinol Metab Clin North Am 2007; 36(2): 453–463
10. Berger AP, Deibl M, Leonhartsberger N. Vascular damage as a risk factor for benign prostatic hyperplasia and erectile dysfunction. BJU Int 2005; 96(7): 1073-1078
11. Foley SJ, Bailey DM. Microvessel density in prostatic hyperplasia. BJU Int 2000; 85(1): 70-73
12. Burnett AL, Maguire MP, Chamness SL, Ricker DD, Takeda M, Lepor H, et al. Characteriozation and localization of nitric oxide synthase in the human prostate.\ Urology 1995; 45(3): 435-439
13. Тюзиков И.А., Мартов А.Г., Калинченко С.Ю. Влияние ожирения и андрогенного дефицита на кровообращение предстательной железы. Бюллетень Сибирской медицины. 2012;(2): 80-83
14. Тюзиков И.А., Греков Е.А. Калинченко С.Ю., Мартов А.Г. Оптимизация диагностики воспалительных заболеваний предстательной железы на основе междисциплинарного подхода. Экспериментальная и клиническая урология 2013; (1): 44-51
15. Litwin MS, McNaughton-Collins M, Fowler FJ Jr, Nickel JC, Calhoun EA, Pontari MA, et al. The National Institutes of Health chronic prostatitis symptom index: development and validation of a new outcome measure. Chronic Prostatitis Collaborative Research Network. J Urol 1999; 162(2):369-675
16. Rosen RC, Riley A, Wagner G, Osterloh IH, Kirkpatrick J, Mishra A. The international index of erectile function (IIEF): a multidimensional scale for assessment of erectile dysfunction. Urology 1997; 49(6):822-830
17. Бенсон Дж., Патерсон Дж. Хроматографический анализ аминокислот и пептидов на сферических смолах и его применение в биохимии и медицине. В кн.: Новые методы анализа аминокислот, пептидов и белков. [Пер. с англ. под ред. Овчинникова Ю.А.] М: Мир, 1974. С 9—84
18. Назаренко Г.И., Хитрова А.Н. Ультразвуковая диагностика предстательной железы в современной урологической практике. М.: ВИДАР, 2012. 288 с
19. Гланц С. Медико-биологическая статистика. Пер. с англ. М.: Практика, 1998. 459 с.









Комментарии