Нечипоренко А.Н., Пинчук С.В., Василевич Д.М., Василевич И.Б., Нечипоренко Н.А., Волотовский И.Д.
Сведения об авторах:
- Нечипоренко А.Н. – д.м.н., профессор 2-ой кафедры хирургических болезней учреждения образования «Гродненский государственный медицинский университет»; Гродно, Республика Беларусь; РИНЦ AuthorID 680390
- Пинчук С.В. – к.б.н. старший научный сотрудник лаборатории молекулярной биологии клетки Государственного научного учреждения «Институт биофизики и клеточной инженерии Национальной академии наук Беларуси»; Гродно, Республика Беларусь; РИНЦ AuthorID 193163
- Василевич Д.М. – врач-уролог урологического отделения УЗ «Гродненская университетская клиника»; Гродно, Республика Беларусь
- Василевич И.Б. – научный сотрудник лаборатории молекулярной биологии клетки Государственного научного учреждения «Институт биофизики и клеточной инженерии Национальной академии наук Беларуси»; Гродно, Республика Беларусь; РИНЦ AuthorID 1091468
- Нечипоренко Н.А. – д.м.н., профессор 2-ой кафедры хирургических болезней учреждения образования «Гродненский государственный медицинский университет»; Гродно, Республика Беларусь; РИНЦ AuthorID 680343
- Волотовский И.Д. – д.б.н., профессор, академик Национальной академии наук Беларуси, главный научный сотрудник лаборатории молекулярной биологии клетки Государственного научного учреждения «Институт биофизики и клеточной инженерии Национальной академии наук Беларуси»; Гродно, Республика Беларусь; РИНЦ AuthorID 202793
ВВЕДЕНИЕ
Недержание мочи при напряжении (НМпН) у женщин является не только очень большой социальной, медицинской и экономической нагрузкой на общество, но и серьезной проблемой для пациентки [1]. Развитие НМпН связано с различными факторами: слабостью мышц тазового дна; функциональной слабостью сфинктера уретры; дисплазией соединительной ткани, проявляющейся несостоятельностью фасций и связок переднего отдела влагалища; изменениями в сосудах и нервах, вызванных сдавлением; механической нагрузкой на подвешивающе-поддерживающий аппарат таза при повышении внутрибрюшного давления, родах через естественные родовые пути [2, 3].
Существуют методы консервативного лечения НМпН, направленные на улучшение функции сфинктера уретры – тренировка мышц тазового дна (упражнения Кегеля), электростимуляция и фармакотерапия [1].
Радикальным методом лечения НМпН у женщин, дающим хорошие отдаленные результаты, является хирургическое вмешательство, предполагающее замещение несостоятельной лонно-уретральной связки синтетической сетчатой лентой (общее название принципа операции – «петлевые (слинговые) операции»), которая создает опору для среднего отдела уретры и позволяет восстановить механизм удержания мочи [1].
Возможность развития интра- и послеоперационных осложнений и рецидивов НМпН являются основными недостатками хирургического лечения НМпН у женщин методом использования подуретрального слинга [4].
Не оправдало ожиданий клиницистов и использование инъекций объемобразующих веществ в область сфинктера уретры, хотя у некоторых пациенток был отмечен положительный эффект в виде восстановления удержания мочи [5].
Использование упомянутых методов лечения у ряда пациенток хоть и приводит к положительным результатам, но они не устраняют основную причину заболевания: нарушение структуры и функции сфинктерного комплекса.
Недостатки традиционных методов лечения НМпН явились причиной поиска новых методов терапии этого заболевания. Таким методом стала попытка восстановить/улучшить функцию сфинктера уретры имплантацией стволовых клеток в область сфинктера с целью увеличения его мышечной массы и, соответственно, увеличения силы сокращения [6].
Доклинические исследования использования стволовых клеток для лечения НМпН дали многообещающие результаты [6-11]. Эксперименты показали, что применение препаратов на основе стволовых клеток может повысить функцию сфинктера уретры у экспериментальных животных.
Несмотря на то, что в настоящее время клеточная терапия в лечении НМпН все же находится на экспериментальной стадии, несколько центров сообщили о результатах клинического использования этого метода лечения НМпН у женщин [12-21]. Причем использовались различные типы клеток, включая стволовые клетки из мышечной ткани, пуповинной крови, мезенхимальные стволовые клетки (МСК) из жировой ткани [13-21]. Результаты данных исследований продемонстрировали разную эффективность клеточной терапии НМпН, однако все авторы отмечают наличие положительного эффекта и отсутствие интра- и послеоперационных осложнений.
В целом, с учетом полученных положительных результатов доклинических исследований с использованием жировых МСК и результатов клинических исследований I фазы начато клиническое исследование II фазы [9-11, 17, 20, 21].
Для оценки возможностей клеточной терапии при лечении НМпН важно определить оптимальный состав клеточного трансплантата, количество вводимых клеток, разработать хирургическую технику введения, оценить отдаленные результаты и необходимость повторных трансплантаций. Это и явилось целью настоящего исследования.
МАТЕРИАЛЫ И МЕТОДЫ
В 2018-2019 гг. в Клинике урологии Гродненского государственного медицинского университета проведено обследование и хирургическое лечение 74 женщин с недержанием мочи при напряжении II-III степени (по классификации International Continent Society).
Для лечения с использованием аутологичных мезенхимальных стволовых клеток было отобрано 10 пациенток.
Критериями включения в эту группу были:
1. Отказ пациенток от выполнения подуретральной имплантации сетчатой ленты с позадилонным ее проведением;
2. Избыточная масса тела пациентки (более 85 кг).
Критериями исключения были:
1. Установленный диагноз рака даже после перенесенного радикального лечения;
2. Цистоцеле 3-4 степени;
3. Сахарный диабет.
Группу исследования составили пациентки в возрасте от 33 до 72 лет, средний возраст составил 56,2 года (σ = 11,08). Все пациентки обследованы однотипно. Выполнялись общеклинические лабораторные обследования, ультразвуковое исследование почек, мочевого пузыря, матки и ее придатков, обзорная и экскреторная урография с нисходящей цистограммой лежа и стоя на высоте пробы Вальсальвы, обследование на гинекологическом кресле с оценкой состояния стенок влагалища, мобильности уретры, выполнением кашлевой пробы.
Все пациентки заполняли анкету для оценки качества жизни (рис. 1), связанного с удержанием мочи. Использовали адаптированную и измененную нами анкету Incontinence Quality of Life (I-QoL) [22]. Анализ результатов анкеты I-QoL проводили по следующей методике. У женщины, которая гипотетически не отмечает никаких расстройств удержания мочи и по всем 22 вопросам анкеты I-QoL оценивает качество своей жизни на 5 баллов, общая сумма баллов составит 110. Эта величина принимается за 100% и рассматривается как «высокий уровень качества жизни». Сумма баллов в пределах 99-75% от максимально возможной расценивается как «незначительное снижение качества жизни»; 74-50% – «умеренное снижение качества жизни»; 49-25% – «значительное снижение качества жизни»; 25% и меньше – «резко выраженное снижение качества жизни».
| № | Вопрос Question |
До операции Before surgery |
После операции After surgery |
|---|---|---|---|
| 1 | Опасаюсь, что не успею дойти до туалета I'm afraid I won't be able to go to the toilet |
||
| 2 | Боюсь кашлять и чихать I'm afraid to cough and sneeze |
||
| 3 | Должна осторожно вставать со стула Must carefully get up from a chair |
||
| 4 | Волнует вопрос где находится туалет, когда нахожусь в новом месте Worried about the question of where the toilet is when I am in a new place |
||
| 5 | Имею депрессию I have depression |
||
| 6 | Чувствую себя привязанной. Не могу покинуть дом на продолжительное время I feel attached. Can't leave the house for a long time |
||
| 7 | Моя болезнь не позволяет мне делать то, что я хочу My illness does not allow me to do what I want |
||
| 8 | Думаю, что окружающие чувствуют запах мочи, исходящий от меня I think that people around me smell urine coming from me |
||
| 9 | Сознание того, что я не могу удержать мочу не дает мне покоя The knowledge that I can't hold urine does not give me rest |
||
| 10 | Должна часто посещать ванную Must go to the bathroom often |
||
| 11 | Недержание мочи заставляет меня детально обдумывать мои планы (продолжительный отъезд, посещение друзей, кинотеатра, пляжа) Urinary incontinence makes me think about my plans in detail (long trip, visiting friends, cinema, beach) |
||
| 12 | Меня беспокоит то, что моя болезнь усиливается с возрастом I'm concerned that my disease gets worse with age |
||
| 13 | Имею проблемы с непрерывным сном до утра I have problems with uninterrupted sleep until morning |
||
| 14 | Мне кажется, что моя болезнь раздражает окружающих It seems to me that my illness irritates others |
||
| 15 | Недержание мочи заставляет меня чувствовать себя больной Urinary incontinence makes me feel sick |
||
| 16 | Недержание мочи заставляет меня чувствовать себя бессильной Urinary incontinence makes me feel powerless |
||
| 17 | По причине болезни я меньше радуюсь жизни Due to illness, I enjoy life less |
||
| 18 | Боюсь, что буду мокрой I'm afraid I'll be wet |
||
| 19 | Чувствую, что не могу контролировать мой мочевой пузырь Feel, that I can't control my bladder |
||
| 20 | Должна контролировать что и сколько пить жидкости Must control what and how much to drink fluids |
||
| 21 | Болезнь ограничивает мой выбор одежды lness limits my choice of clothes |
||
| 22 | Боюсь подтекания мочи при половом акте Fear of leakage of urine during intercourse |
Примечание: в пустые клетки вносятся цифры, соответствующие оценке пациенткой своего состояния в баллах до и после операции: 1 - очень; 2 - достаточно сильно; 3 - средне; 4 - немного; 5 - нет.
Note: empty cells are filled with numbers corresponding to the patient's assessment of her condition in points before and after the operation: 1 - very; 2 - strong enough; 3 - medium; 4 - a little; 5 - no.
Рис. 1. Адаптированная анкета I-QoL для оценки качества жизни женщин с недержанием мочи
Fig. 1. Adapted I-QoL questionnaire to assess the quality of life of women with urinary incontinence
Такую же анкету пациентки заполняли через 12 месяцев после имплантации МСК.
Проведение всех этапов клеточной терапии начинали после получения добровольного информированного согласия пациенток на эксплантацию жировой ткани, процессинг и введение МСК, а также представление результатов лечения в открытой печати при условии сохранения анонимности. Первым этапом лечения являлась эксплантация жировой ткани. С целью минимизации воздействия местных анестетиков на ткань процедура проводилась под внутривенным наркозом. Разрезом по Пфанненштилю длиной 5-7 см рассекалась кожа. Подкожно-жировая клетчатка иссекалась скальпелем без использования электроножа для предотвращения повреждения жировой ткани. Проводился забор 15-20 г жировой ткани. Рана зашивалась послойно после осуществления гемостаза. На следующие сутки пациентка выписывалась из стационара.
Полученная жировая ткань в стерильном контейнере в 0,9% растворе хлорида натрия с антибиотиком (цефалоспорин III поколения) в течении 4-х часов доставлялась в ГНУ «Институт биофизики и клеточной инженерии НАН Беларуси».
Выделение МСК проводили согласно методике, описанной ранее [23]. Жировую ткань в стерильных условиях иссекали ножницами, гомогенизировали в слабо притертом гомогенизаторе и обрабатывали 0,1% раствором коллагеназы I типа (Sigma, США) в фосфатно-солевом буферном растворе (HyClone, США), рН 7,2 при 37ºС в течение 30 мин. Полученную клеточную суспензию фильтровали через фильтр (диаметр пор 100 мкм), центрифугировали при 370 g в течение 10 мин. После удаления супернатанта осадок заливали ростовой средой ДМЕМ, содержащей 10% эмбриональной телячьей сыворотки (HyClone, США), 2 мМ L-глютамина (Sigma, США), 1% базового раствора комплексного антибиотика-антимикотика (Sigma, США). Клетки высевали в количестве 2·105 кл/см2 в культуральные флаконы (Sarstedt, Германия) и культивировали в течение 24 ч при 37 ºС в СО2-инкубаторе во влажной воздушной атмосфере при 5% СО2. После этого среду с неадгезированными клетками удаляли и меняли на свежую. Последующую смену ростовой среды проводили каждые 72 ч. При достижении 70-80% конфлюентности монослоя клетки переводили в суспензию, обрабатывая их раствором трипсина (0,25%) и ЭДТА (0,02%) (Gibсo, США) и рассевали в количестве 5·103 кл/см2 на следующий пассаж. Для всех пациенток часть МСК третьего пассажа (2-3 млн клеток) криоконсервировали в жидком азоте под защитой ДМСО (10%) и сыворотки (50%).
Перед приготовлением инъекционного препарата, содержащего МСК, проводился контроль иммунофенотипа клеток. С этой целью МСК в количестве 105 ресуспендировали в 100 мкл фосфатно-солевого буферного раствора, вносили в суспензию связанные с флуорофорами антитела против антигенов CD34 (флуорофор РЕ-Cy7 – фикоэритрин-Cy7), CD44 и CD29 (флуорофор APC – аллофикоцианин), CD90 и CD105 (FITC – флуоресцеинизотиоцианат) и CD45 (APC-Cy7 – аллофикоцианин-Cy7) в разведениях согласно инструкции фирмы-производителя (Becton Dickinson, США). Клетки инкубировали в течение 30 мин в темноте при комнатной температуре, промывали в фосфатно-солевом буферном растворе и анализировали на проточном цитофлуориметре FACSCanto II (Becton Dickinson, США). В качестве контроля использовали МСК, не инкубированные с антителами.
Для приготовления инъекционного препарата использовали МСК третьего пассажа. С целью обеспечения лучшей фиксации клеток в месте введения инъекционный препарат представлял собой биокомпозит в виде смеси МСК с носителем на основе желатина [11]. В качестве носителя применяли гемостатический препарат Спонгостан, изготовленный в форме порошка (Spоngostan Absorbable Haemostatic Gelatin Powder), гидратированный в фосфатно-солевом буферном растворе. Для гидратации к 160 мг порошка добавляли 3 мл фосфатносолевого буферного раствора, перемешивали и инкубировали 15 мин при комнатной температуре. Далее к гидратированному порошку добавляли 1 мл суспензии МСК (8 млн клеток) в фосфатно-солевом буферном растворе, осторожно перемешивали и отбирали в стерильный шприц.
Вторым этапом хирургического лечения являлась имплантация МСК в стенку уретры и парауретральное пространство.
В условиях операционной под внутривенным наркозом после обработки операционного поля выполняли катетеризацию мочевого пузыря катетером Фолея 16 Ch. В средней трети уретры чресвлагалищно на 3, 6 и 9 часах условного циферблата выполняли введение по 1 мл смеси МСК с носителем в стенку уретры и парауретральную область. Иглу располагали перпендикулярно оси уретры. Суммарно вводили 3 мл смеси, содержащей не менее 6 млн МСК. После выполнения инъекций устанавливали тампон во влагалище. Катетер Фолея извлекали через 24 часа после введения смеси стволовых клеток [24]. На вторые сутки после имплантации стволовых клеток все пациентки выписывались из стационара.
РЕЗУЛЬТАТЫ
Все десять пациенток хорошо перенесли обе процедуры. Интраоперационных, ранних и поздних послеоперационных осложнений не было.
После извлечения катетера все пациентки мочились самостоятельно. При выполнении урофлоуметрии отмечено ослабление струи мочи и увеличение времени мочеиспускания, связанное с объем-образующим эффектом носителя. Остаточной мочи не было.
Результаты через 2 недели после имплантации
Выраженное снижение симптомов НМпН отмечали 7 пациенток, но при сильном кашле моча из уретры подтекала. Полное восстановление удержания при физической нагрузке отметили 2 пациентки, но их беспокоили симптомы гиперактивности мочевого пузыря – позывы на мочеиспускание, ургентное недержание мочи (недержание мочи при повелительном позыве на мочеиспускание). Не отмечала улучшения состояния по сравнению с дооперационным отмечала только 1 пациентка – недержание мочи при физической нагрузке сохранялось.
Результаты через 1 месяц после имплантации
В эти сроки наблюдения клиническая картина у всех пациенток не изменилась. Для купирования императивных расстройств мочеиспускания двум пациенткам назначены альфа-адреноблокаторы в сочетании с М-холино-блокаторами.
Результаты через 2 месяца после имплантации
Полностью удерживали мочу при физической нагрузке (кашлевая проба – отрицательная) 8 пациенток. Императивные расстройства мочеиспускания купированы медикаментозно у обеих пациенток. При сильном кашле и чихании 1 пациентка теряла малые объемы мочи (до 2 мл). Использование приемов поведенческой терапии (путем воздействия на режим мочеиспусканий – «тренировка мочевого пузыря» – пациентка мочилась через определенные временные интервалы) позволяли пациентке оценивать результат имплантации аутологичных МСК как удовлетворительный. Полностью сохранялось НМпН у 1 пациентки – потеря мочи при любой физической нагрузке.
Результаты через 6 месяцев после имплантации
Полностью удерживали мочу 9 женщин. Императивные расстройства мочеиспускания никто не отмечал, что позволило отменить медикаментозную терапию альфа-блокаторами в сочетании с М-холино-блокаторами у 2-х пациенток, у которых ранее такие расстройства мочеиспускания имели место. Только 1 пациентка теряла мочу при любой физической нагрузке.
Учитывая неэффективность клеточной терапии у этой пациентки решено выполнить имплантацию повторно с использованием криоконсервированных МСК. Пациентке еще раз проведена имплантация клеток по приведенной выше схеме.
Результаты через 12 месяцев после имплантации
Полностью удерживали мочу при физической нагрузке (кашель, чихание) 9 женщин. Императивных расстройств не отмечено. При осмотре на кресле дополнительных образований в проекции средней трети уретры не выявлено. При уретроцистоскопии дополнительных образований в просвете уретры и мочевого пузыря, а также признаков давления извне на уретру не выявлено. Пациентка, перенесшая повторную имплантацию аутологичных МСК, продолжала терять мочу при физической нагрузке. Ее состояние оставалось без улучшения (рис. 2).
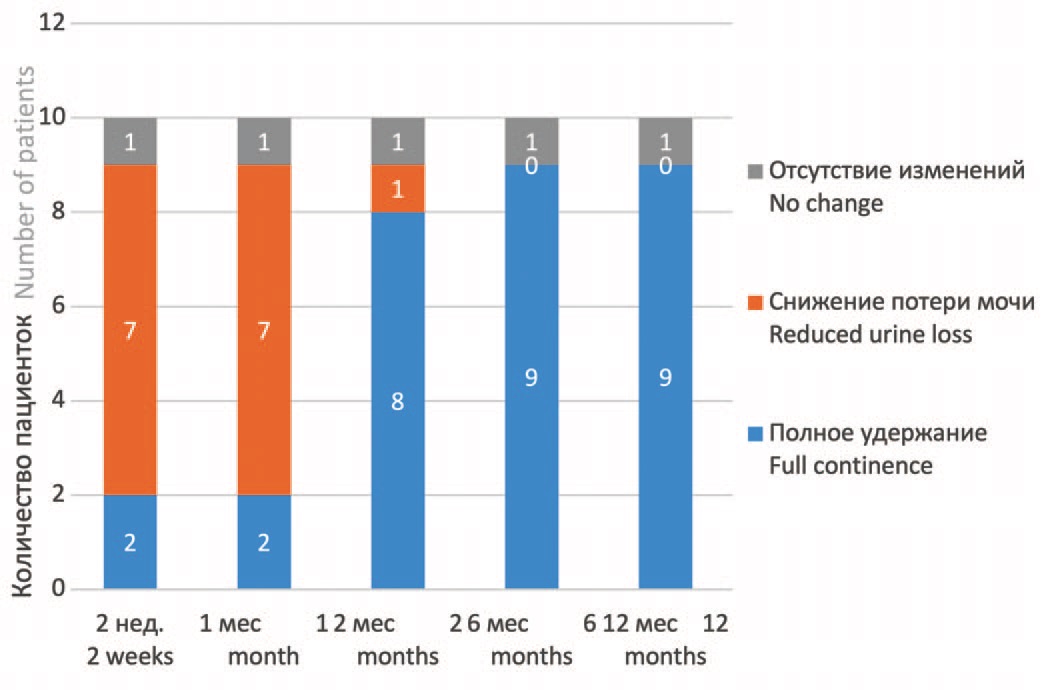
Рис. 2. Динамика состояния удержания мочи сроки 2 недели, 1, 2, 6 и 12 месяцев после операции
Fig. 2. Dynamics of urinary continence at 2 weeks, 1, 2, 6 and 12 months after surgery
ОБСУЖДЕНИЕ
В настоящее время для лечения НМпН у женщин разрабатываются и внедряются новые методы лечения - клеточная терапия препаратами на основе стволовых клеток, что может повысить функцию сфинктера уретры. Применяются различные типы клеток, включая стволовые клетки из мышечной ткани, пуповинной крови, мезенхимальные стволовые клетки (МСК) из жировой ткани и др. [13-21].
Нами проанализированы результаты использования аутологичных мезенхимальных стволовых клеток. При оценке анкет I-QoL у пациенток до операции количество баллов варьировало от 21 до 36 («резко выраженное снижение качества жизни» и «значительное снижение качества жизни»), а после операции – от 79 до 100 баллов («незначительное снижение качества жизни»), что подтверждает хороший результат имплантации аутологичных МСК. Большинство авторов так же отмечают положительные результаты и отсутствие интра- и послеоперационных осложнений [9, 11, 20, 21] при применении клеточной терапии для лечения стрессового недержания мочи у женщин.
I.M. Aragón, и соавт., отмечают, что данные, опубликованные в различных клинических испытаниях с использованием стволовых клеток не мышечного происхождения, показали способность таких клеток восстанавливать поврежденный сфинктер [12]. Все эти типы клеток отвечают требованиям, предъявляемым к клеткам для тканевой инженерии, таким как использование аутологичных клеток, доступность с помощью минимально инвазивных процедур, обеспечение достаточного количества клеток, способность к регенерации множества тканей и быстрое размножение хорошо контролируемым образом.
В исследовании K. Kuismanen, и соавт., наблюдалось пять пациенток с НМпН, которых лечили с использованием стволовых мезенхимальных клеток [17]. Препарат вводился через уретру с использованием цистоскопа и специальных игл. Только три женщины через 1 год после введения отмечали полное удержание мочи, еще две – только улучшение состояния. Применяемый авторами метод требует наличия дополнительного специального оборудования.
ВЫВОДЫ
1. Технически выполнение эксплантации и имплантации аутологичных мезенхимальных стволовых клеток не представляет трудностей, малоинвазивно и не вызывает побочных эффектов.
2. Положительный результат по критериям удержания мочи, расстройств мочеиспускания и субъективной оценке качества жизни достигнут у 90% пациенток.
3. Отсутствие даже небольшого положительного результата лечения недержания мочи при напряжении с использованием аутологичных мезенхимальных стволовых клеток у одной пациентки свидетельствует о том, что существуют патологические изменения органов мочеполовой системы, при которых клеточная терапия имеет низкую эффективность в устранении симптомов НМпН.
4. Первые собственные результаты применения метода внушают осторожный оптимизм, но требуется продолжение исследований в связи с малым количеством наблюдений и необходимостью определения критериев с целью правильного подбора пациенток для клеточной терапии.
ЛИТЕРАТУРА
1. Subak LL, Brubaker L, Chai TC, Creasman JM, Diokno AC, Goode PS, et al. Urinary Incontinence Treatment Network. High costs of urinary incontinence among women electing surgery to treat stress incontinence. Obstet Gynecol 2008;111(4):899-907. https://doi.org/10.1097/ AOG.0b013e31816a1e12.
2. Markland AD, Goode PS, Redden DT, Borrud LG, Burgio KL. Prevalence of urinary incontinence in men: results from the national health and nutrition examination survey. J Urol 2010;184(3):1022-1027. https://doi.org/10.1016/ j.juro.2010.05.025.
3. Delancey JO. Why do women have stress urinary incontinence? Neurourol Urodyn 2010;29(Suppl 1):13-17. https://doi.org/10.1002/nau.20888.
4. Chermansky CJ, Winters JC. Complications of vaginal mesh surgery. Curr Opin Urol 2012;22(4):287-291. https://doi.org/10.1097/MOU.0b013 e32835480b2.
5. Kerr LA. Bulking agents in the treatment of stress urinary incontinence: history, outcomes, patient populations, and reimbursement profile. Rev Urol 2005;7(Suppl 1):3-11.
6. Staack A, Rodríguez LV. Stem cells for the treatment of urinary incontinence. Curr Urol Rep 2011;12(1):41-46. https://doi.org/10.1007/ s11934-010-0155-z.
7. Wang HJ, Chuang YC, Chancellor MB. Development of cellular therapy for the treatment of stress urinary incontinence. Int Urogynecol J 2011;22(9):1075-1083. https://doi.org/10.1007/s00192-011-1432-1.
8. Goldman HB, Sievert KD, Damaser MS. Will we ever use stem cells for the treatment of SUI? ICI-RS 2011. Neurourol Urodyn 2012;31(3):386-389. https://doi.org/10.1002/nau.22217.
9. Lin G, Wang G, Banie L, Ning H, Shindel AW, Fandel TM, et al. Treatment of stress urinary incontinence with adipose tissue-derived stem cells. Cytotherapy 2010;12(1):88-95. https://doi.org/10.3109/14653240903350265.
10. Zhao W, Zhang C, Jin C, Zhang Z, Kong D, Xu W, et al. Periurethral injection of autologous adipose-derived stem cells with controlled-release nerve growth factor for the treatment of stress urinary incontinence in a rat model. Eur Urol 2011;59(1):155-163. https://doi.org/10.1016/j.eururo.2010.10.038.
11. Пинчук С.В., Молчанова А.Ю., Василевич И.Б., Жаворонок И.П., Пехтерева Е.И., Антипова О.А., и др. Использование гемостатического препарата Спонгостан в качестве носителя мезенхимальных стволовых клеток при лечении экспериментального недержания мочи у крыс. Доклады НАН Беларуси 2019;63(4):457-465. https://doi.org/10.29235/1561- 8323-2019-63-4-457-465. [Pinchuk SV, Molchanova AYu, Vasilevich IB, Zhavoronok IP, Pekhtereva EI, Antipova OA, et al. Use of hemostatic drug spongostan as a carrier of mesenchymal stem cells in the treatment of experimental urinary incontinence in rats. Reports of the NSA of Belarus 2019;63(4):457-465. https://doi.org/10.29235/1561-8323-2019-63-4-457-465. (In Russian)].
12. Aragón IM, Imbroda BH, Lara MF. Cell therapy clinical trials for stress urinary incontinence: current status and perspectives. Int J Med Sci 2018;15(3):195-204. https://doi.org/10.7150/ijms.22130.
13. Strasser H, Marksteiner R, Margreiter E, Pinggera GM, Mitterberger M, Frauscher F, et al. Autologous myoblasts and fibroblasts versus collagen for treatment of stress urinary incontinence in women: a randomised controlled trial. Lancet 2007 Jun 30;369(9580):2179-2186. https://doi.org/10.1016/S0140-6736(07)61014-9.
14. Mitterberger M, Marksteiner R, Margreiter E, Pinggera GM, Colleselli D, Frauscher F, et al. Autologous myoblasts and fibroblasts for female stress incontinence: a 1-year follow-up in 123 patients. BJU Int 2007;100(5):1081-1085. https://doi.org/10.1111/j.1464-410X.2007.07119.x.
15. Carr LK, Robert M, Kultgen PL, Herschorn S, Birch C, Murphy M, et al. Autologous muscle derived cell therapy for stress urinary incontinence: a prospective, dose ranging study. J Urol 2013;189(2):595-601. https://doi.org/10.1016/j.juro.2012.09.028.
16. Peters KM, Dmochowski RR, Carr LK, Robert M, Kaufman MR, Sirls LT, et al. Autologous muscle derived cells for treatment of stress urinary incontinence in women. J Urol 2014;192(2):469-76. https://doi.org/10.1016/j.juro.2014.02.047.
17. Kuismanen K, Sartoneva R, Haimi S, Mannerström B, Tomás E, Miettinen S, et al. Autologous adipose stem cells in treatment of female stress urinary incontinence: results of a pilot study. Stem Cells Transl Med 2014;3(8):936-41. https://doi.org/10.5966/sctm.2013-0197.
18. Lee CN, Jang JB, Kim JY, Koh C, Baek JY, Lee KJ. Human cord blood stem cell therapy for treatment of stress urinary incontinence. J Korean Med Sci 2010;25(6):813-816. https://doi.org/10.3346/jkms.2010.25.6.813.
19. Sharifiaghdas F, Zohrabi F, Moghadasali R, Shekarchian S, Jaroughi N, Bolurieh T, et al. Autologous muscle-derived cell injection for treatment of female stress urinary incontinence: a single- arm clinical trial with 24-months follow-up. Urol J 2019;16(5):482-487. https://doi.org/10.22037/uj.v0i0.4736.
20. Arjmand B, Safavi M, Heidari R, Aghayan H, T Bazargani S, Dehghani S, et al. Concomitant transurethral and transvaginalperiurethral injection of autologous adipose derived stem cells for treatment of female stress urinary incontinence: a phase one clinical trial. Acta Med Iran 2017;55(6):368-374.
21. Garcia-Arranz M., Gregorio S.A. Stem cells treatment for the local feminine stress urinary incontinence treatment (HULPURO). [Electronic resource]. URL: http://clinicaltrials.gov/ (accessed on 23 November 2020).
22. Wagner TH, Patrick DL, Bavendam TG, Martin ML, Buesching DP. Quality of life of persons with urinary incontinence: development of a new measure. Urology 1996;47(1):67-71; discussion 71-72. https://doi.org/10.1016/ s0090-4295(99)80384-7.
23. Pinchuk SV, Vasilevich IB, Kvacheva ZB, Volotovski ID. The influence of quercetin on the hepatic differentiation of human adipose-derived mesenchymal stem cells. Tsitologiia 2016;58(7):517-525.
24. Нечипоренко А.Н., Нечипоренко Н.А., Василевич Д.М., Волотовский И.Д., Пинчук С.В., Василевич И.Б. Инструкция по применению: Метод лечения недержания мочи у женщин с использованием аутологичных мезенхимальных стволовых клеток жировой ткани. Утв. М-вом здравоохранения Респ. Беларусь №172-1219, 26.12.2019. Гродно 2019;8с. [Nechiporenko AN, Nechiporenko NA, Vasilevich DM, Volotovski ID, Pinchuk SV, Vasilevich IB. A method for the treatment of urinary incontinence in women using autologous mesenchymal stem cells of adipose tissue. Instruction for use, approved by the ministry of health of the Republic of Belarus 26.12.2019(172-1219):8 p. (In Russian)].








Комментарии