Н.В. Орлова1, А.Н. Муравьев1,4, Т.И. Виноградова1, Н.М. Юдинцева2, Ю.А. Нащекина2, Н.В. Заболотных1, А.А. Лебедев1, М.Г. Шейхов1, П.К. Яблонский1,3
- 1 Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии Минздрава России, Санкт-Петербург, Российская Федерация
- 2 Институт цитологии РАН, Санкт-Петербург, Российская Федерация
- 3 Санкт-Петербургский государственный университет, Санкт-Петербург, Российская Федерация
- 4 Частное образовательное учреждение высшего образования «Санкт-Петербургский медико-социальный институт»
Пациенты с так называемым малым мочевым пузырем (МП) составляют наиболее тяжелый контингент среди больных, страдающих заболеваниями мочеполовой системы, в том числе и туберкулезом [1,2].
Практически всем этим больным требуется реконструктивно-восстановительная хирургическая помощь. В то же время на сегодняшний день множество проблем, связанных с реконструктивной хирургией МП, остаются нерешенными [3]. По всему миру для замещения нефункционирующего МП, при неэффективности консервативных методов лечения, используют фрагменты желудочно-кишечного тракта, что нередко приводит к ряду осложнений [4,5]. Однако использование кишечной ткани уже более ста лет остается золотым стандартом в реконструкции мочевых путей. Очевидно, что найти подходящую замену ткани МП с ее уникальными свойствами совсем не просто.
Тканевая инженерия занимает важное место среди со-временных научных тенденций и подразумевает разработку подходов для реконструкции или замещения поврежденных тканей с использованием клеток и скаффолдов. Однако в структуре общего объема публикаций по данной теме урологические аспекты освещены весьма скудно.
В последние годы для лечения поврежденных органов и тканей человека широкое практическое применение находят синтетические биорезорбируемые полимерные мате-риалы, которые используют в качестве скаффолдов для культивирования клеток. Скаффолды должны обладать следующими свойствами: механическая прочность, нетоксичность (в том числе и продуктов их деградации), способствовать росту клеток, при этом скорость деградации материала и восстановления поврежденной ткани должны быть сопоставимы [6,7].
Зарубежными учеными опубликованы успешные попытки создания тканевых аналогов стенки МП, применение «биоинженерных тканей» для трансплантации опробовано в экспериментальных условиях [8]. In vivo предпринят удачный опыт замещения МП у 14 собак выращенным in vitro неоцистисом [9]. После удачного эксперимента на лабораторных животных сгенерированный in vitro резервуар успешно трансплантирован человеку [10].
Однако исследователи в качестве источника клеток использовали собственные ткани МП, что невозможно в случаях замещения всех тканей мочевого пузыря рубцовыми, когда практически отсутствуют здоровый уротелий и мышечная стенка. Наши исследования направлены на поиск возможности применения клеточных технологий для помощи именно таким пациентам, имеющим малый МП, в том числе и туберкулезной этиологии [11].
Известно, что некоторые клетки организма не обладают выраженной иммуногенностью, и подходят для аллогенной трансплантации. Из всего многообразия клеточных источников хочется выделить группу мезенхимальных стволовых клеток (МСК). In vitro доказана способность МСК дифференцироваться в клетки, обладающие свойствами гладких миоцитов, уротелиальных и эндотелиальных клеток. Поэтому они являются весьма заманчивым кандидатом для реконструкции мочевого пузыря [12]. Мезенхимальные стволовые клетки обладают способностью воздействовать на иммунный ответ, снижая выраженность реакции на имплант [13].
За последний год опубликованы результаты системной терапии МСК при различных заболеваниях [14,15] и экспериментальных работ по реконструкции различных урологических структур. Мировой опыт применения аллогенных МСК для реконструкции МП на сегодняшний день представ-лен всего несколькими экспериментальными исследованиями [16-20].
Цель. Изучение возможности применения многокомпонентного трансплантата с использованием аллогенных мезенхимальных стволовых клеток красного костного мозга для замещения дефекта стенки МП в экспериментальных условиях.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на взрослом кролике-самце породы «шиншилла» (питомник «Рапполово» РАМН, Санкт-Петербург). МСК кролика выделены по стандартной методике после забора красного костного мозга из гребня подвздошной кости кролика (рис. 1) [21]. Клетки мечены железосодержащими наночастицами.
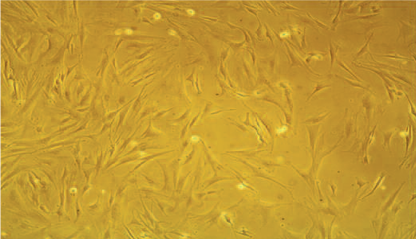
Рис. 1. Морфология мезенхимальных стволовых клеток ( х100)
Fig. 1. Morphology of mesenchymal stem cells (x100)
В качестве материала для приготовления скаффолда использован полимер на основе молочной кислоты – поли-L,L-лактид. Внешний вид матрицы представлен на рисунке 2а. Гидрофобный характер полилактида и отсутствие специфических сайтов связывания с рецепторами клеток существенно ограничивает использование его для культивирования и трансплантации клеток. Оказалось, что с этой проблемой можно справиться, заполнив матрицу гелем на основе коллагена I типа (рис. 2б).
После культивирования необходимого количества МСК приготовлен трансплантат на основе полилактидной матрицы, заселенной мечеными клетками в составе коллагенового геля, который трансплантирован in vivo после парциальной резекции МП кролика.
Анестезиологическое пособие включало: комбинированный препарат для анестезии тилетамина гидрохлорид/ золазепама гидрохлорид (золетил) в дозе 25 мг/кг массы тела внутривенно в краевую ушную вену; миорелаксант ксилазина гидрохлорид (рометар) в виде 2% раствора внутримышечно в объеме 1,0-1,5 мл. Под общей анестезией МП кролика выведен в рану через срединный лапаротомический разрез длиной 4 см. По передней стенке МП частично отсепарована паравезикальная клетчатка, выполнена резекция фрагмента стенки пузыря 2,0х2,0см (рис. 3а). Приготовленный многокомпонентный трансплантат фиксирован к стенке МП узловыми швами викрил 4-0 (рис. 3б), снаружи анастомоз укреплен отсепарованной около-пузырной клетчаткой (рис. 3в). Деривация мочи осуществлена цистостомическим дренажом (подключичный венозный катетер), проведенным под кожей на спину. Рана ушита послойно.
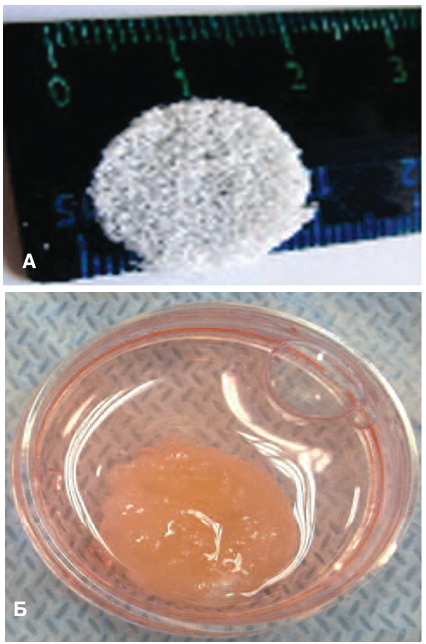
Рис. 2. Матрица на основе поли-L,L-лактида А – Внешний вид матрицы; Б – Матрица, заселенная клетками
Fig. 2. A matrix based on poly-L, L-lactide А – The view of the matrix; Б – Cell populated matrix
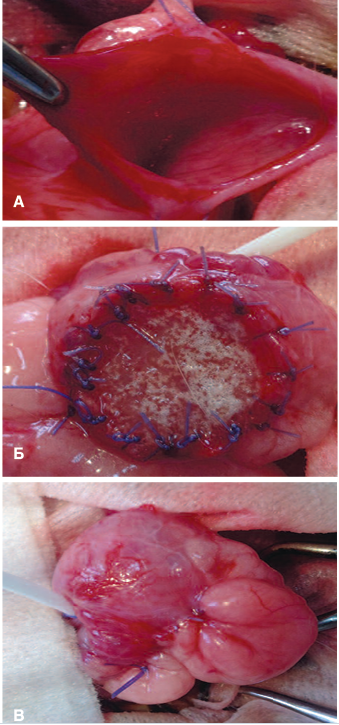
Рис. 3. Замещение дефекта мочевого пузыря А – Мочевой пузырь кролика после резекции фрагмента; Б – Закрытие дефекта заселенным клетками скаффолдом; В – Внешний вид мочевого пузыря
Fig.3. Bladder defect replacement А – Rabbit bladder after fragment resection; Б – Closure of the defect with a cell-infested scaffold; В – The view of the bladder
Период наблюдения составил 2,5 месяца, в течение которого еженедельно проводился мониторинг массы тела животного, также выполнялись клинический и биохимический анализы крови и общий анализ мочи, изучалось кислотно-основное состояние крови. В конце периода наблюдения выполнена магнитно-резонансная томография.
Животное выведено из эксперимента с использованием препаратов тилетамина гидрохлорид/золазепама гидрохлорид (золетил) и ксилазина гидрохлорид (рометар) в дозах троекратно превышающих терапевтическую.
Исследования проводили в соответствии с этическими принципами обращения с лабораторными животными «Eu-ropean Convention for the Protection of Vertebral Animals Used for Experimental and Other Scientific Purposes. CETS No. 123» и Правилами лабораторной практики (Приказ Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. № 708н «Об утверждении Правил лабораторной практики»).
РЕЗУЛЬТАТЫ
Животное перенесло операцию хорошо. Рана зажила первичным натяжением. Катетер удален на 14-е сутки. За период наблюдения в анализах крови и мочи не зафиксировано патологических сдвигов, также отмечался адекватный прирост массы тела кролика.
На серии магнитно-резонансных томограмм виден заполненный мочевой пузырь нормальной емкости (рис. 4).
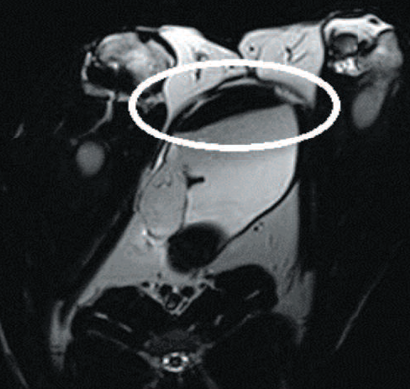
Рис. 4. Мочевой пузырь кролика при магнитно-резонансной томографии
Fig. 4. Magnetic resonance imaging of rabbit's bladder
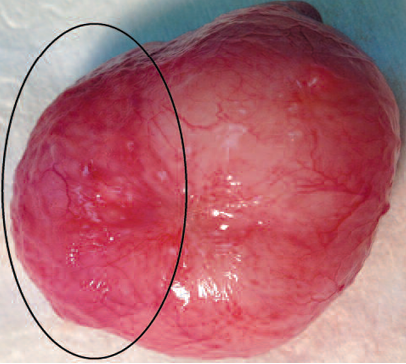
Рис. 5. Макроскопическое исследование. Внутренняя поверхность мочевого пузыря кролика
Fig. 5. Macroscopic examination. The inner surface of the rabbit bladder
В месте имплантации визуализируется наводящий артефакт от введенных в клетки железосодержащих меток.
При макроскопическом осмотре патологических изменений со стороны внутренних органов не выявлено: паренхиматозные органы визуально не изменены, спаечный процесс и патологический выпот в брюшной полости отсутствовали, внутрибрюшные лимфатические узлы визуально не увеличены.
Следует отметить также отсутствие явлений отторжения трансплантата и признаки васкуляризации пересаженного лоскута (рис. 5).
При конфокальной микроскопии криосрезов в месте имплантации определяются меченые клетки, принимающие участие в формировании структуры, сходной с уротелием (рис. 6).
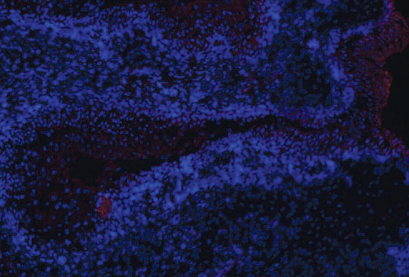
Рис. 6. Место имплантации при конфокальной микроскопии криосреза, х40
Fig.6. Place of implantation under confocal microscopy of cryosection, x40
ОБСУЖДЕНИЕ
Идея использования мезенхимальных стволовых клеток для формирования тканеинженерных конструкций рассматривается многими ведущими российскими и зарубежными исследователями. В результате проведенного нами экспериментального исследования разработан аллогенный тканеинженерный продукт, который может применяться для хирургического восстановления дефекта мочевого пузыря. Показана принципиальная возможность трансплантации искусственных тканеподобных субстанций аллогенной природы.
Полученные положительные результаты создают предпосылки для дальнейшей разработки и создания многокомпонентного трансплантата с использованием алло-генных клеток, что, возможно, будет способствовать улучшению результатов лечения патологических состояний, при которых получение аутологичного материала не представляется возможным.
ЗАКЛЮЧЕНИЕ
Проведенный эксперимент в очередной раз показывает необходимость дальнейших исследований в области реконструкции стенки МП. Однако вопрос возможности применения МСК в клинической практике пока остается открытым, уникальные свойства этих клеток до сих пор полностью не изучены и представляют собой огромный научный интерес. Полного понимания механизмов, отвечающих за их
защитные и регенеративные эффекты, пока не достигнуто. Полученные на сегодняшний день результаты хотя и являются обнадеживающими, но требуют более детального изучения.
ЛИТЕРАТУРА
- Зубань О.Н., Комяков Б.К. Хирургическая коррекция малого мочевого пузыря. СПб.: Стикс, 2011. 227 с. [Zuban O.N., Komyakov B.K. Surgical correction of the small bladder. St. Pe-tersburg: Styx, 2011.227 p. (In Russian)].
- Муравьев А.Н, Зубань О.Н. Роль суправезикального отведения мочи в комплексном лечении больных туберкулезом почек и мочеточников. Урология 2012;(6):16-20. [Muravyev A.N., Zuban O.N. Role of supravesicular urine diversion in the treatment of patients with renal and ure-thral tuberculosis. Urologiya = Urology 2012;(6):16-20. (In Russian)].
- Муравьев А.Н., Орлова Н.В., Блинова М.И., Юдинцева Н.М. Тканевая инженерия в урологии, новые возможности для реконструкции мочевого пузыря. Цитология 2015;57(1):14-18. [Muravjev A.N., Orlova N.V., Blinova M.I., Yudintseva N.M. Tissue engineering in urology, new approaches for urinary bladder reconstructio. Cytologiya Cytology 2015;57(1):14-18. (In Russian)].
- Семенов С.А., Муравьев А.Н. Влияние хронической задержки мочеиспускания на качество жизни больных туберкулезом мочевого пузыря, перенесших аугментационную илеоцистопластику. Туберкулез и социально значимые заболевания 2014;(3):13-18. [Semenov S.A, Mu-ravjev A.N. The influence of chronic urinary retention on the quality of life of patients with tuberculosis of the bladder undergoing augmentation ileal cystoplasty. Tuberkulez i sotsial'no znachimyye zabolevaniya = Tuberculosis and socially significant diseases 2014;(3):13-18]
- Gupta NP, Kumar A, Sharma S. Reconstructive bladder surgery in genitourinary tuberculosis.Indian J Urol 2008;24(3):382-387. doi: 10.4103/0970-1591.42622.
- Ho MH, Hou LT, Tu CY, Hsieh HJ, Lai JY, Chen WJ, et al. Promotion of cell affinity of porous PLLA scaffolds by immobilization of RGD peptides via plasma treatment. Macromol Biosci 2006;6(1):90-98. doi: 10.1002/mabi.200500130.
- Shao J, Chen C, Wang Y, Chen X, Du C. Early stage structural evolution of PLLA porous scaffolds in thermally induced phase separation process and the corresponding biodegradability and biolog-ical property. Polym Degrad Stab 2012;97(6):955–963. doi: 10.1016/j.polymdegradstab.2012.03.014.
- Pariente JL, Kim BS, Atala A. In vitro biocompatibility evaluation of naturally derived and synthetic biomaterials using normal human bladder smooth muscle cells. J Urol 2002. 167(4): 1867–1871.
- Oberpenning F, Meng J, Yoo JJ, Atala A. De novo reconstitution of a functional mammalian uri-nary bladder by tissue engineering. Nat. Biotechnol 1999;17(2):149-155. doi: 10.1038/6146.
- Yoo JJ, Olson J, Atala A, Kim B. Regenerative medicine strategies for treating neurogenic bladder.Int Neurourol J 2011;15(3):109–119. doi: 10.5213/inj.2011.15.3.109.
- Орлова Н.В., Муравьев А.Н., Виноградова Т.И., Блюм Н.М., Семенова Н.Ю., Юдинцева Н.М. и др. Экспериментальная реконструкция мочевого пузыря кролика с использованием аллогенных клеток различного тканевого происхождения. Медицинский Альянс 2016;(1): 50-52. [Orlova N.V., Murav'ev A.N., Vinogradova T.I., Blyum N.M., Semenova N.Yu., Yudintseva N.M., et al. Experimental reconstruction of rabbit bladder using allogeneic cells of different tissue origin.
Meditsinskiy Al'yans= Medical Alliance 2016;(1): 50-52. (In Russian)] - Da Silva ML, Chagastelles PC, Nardi NB. Mesenchymal stem cells reside in virtually all post natal organs and tissues. J Cell Sci 2006;119(Pt 11):2204 2213. doi: 10.1242/jcs.02932
- Yan SX, Deng XM, Wei W. A big step forward in the treatment of refractory systemic lupus erythematosus: allogenic mesenchymal stem cell transplantation. Acta Pharmacol Sin 2013;34(4): 453–454. doi: 10.1038/aps.2013.33.
- Du T, Zhu YJ. The Regulation of Inflammatory Mediators in Acute Kidney Injury via Exogenous Mesenchymal Stem Cells. Mediators Inflamm. 2014;2014:261697. doi: 10.1155/2014/2616972014.
- Liang J, Zhang H, Wang D, Feng X, Wang H, Hua B, et al. Allogeneic mesenchymal stem cell transplantation in seven patients with refractory inflammatory bowel disease.
Gut 2012;61(3):468-469. doi: 10.1136/gutjnl-2011-300083. - Coutu DL, Mahfouz W, Loutochin O. Galipeau J, Corcos J. Tissue engineering of rat bladder using marrow-derived mesenchymal stem cells and bladder acellular matrix. PLoS One 2014; 9(12): e111966. doi: 10.1371/journal.pone.0111966.
- Snow-Lisy DC, Diaz EC, Bury MI, Fuller NJ, Hannick JH, Ahmad N, et al. The role of genetically modified mesenchymal stem cells in urinary bladder regeneration. PLoS One 2015;10(9): e0138643. doi: 10.1371/journal.pone. 0138643.
- Yuan H, Zhuang Y, Xiong J, Zhi W, Liu L, Wei Q, et al. Human umbilical mesenchymal stem cells-seeded bladder acellular matrix grafts for reconstruction of bladder defects in a canine model.
PLoS One 2013;8(11):e80959. doi: 10.1371/journal.pone.0080959. - Yudintceva NM, Nashchekina YA, Blinova MI, Orlova NV, Muraviov AN, Vinogradova TI, et al. Experimental bladder regeneration using a poly-l-lactide/silk fibroin scaffold seeded with nanoparticle-labeled allogenic bone marrow stromal cells. Int J Nanomedicine 2016;(11):4521-4533. doi: 10.2147/IJN.S111656.
- Hou X, Shi C, Chen W, Chen B, Jia W, Guo Y, et al. Transplantation of human adipose-derived mesenchymal stem cells on a bladder acellular matrix for bladder regeneration in a canine model.
Biomed Mater 2016;11(3):031001. doi: 10.1088/1748-6041/11/3/031001. - Pittenger MF, Mbalaviele G, Black M, Mosca JD, Marshak DR. Mesenchymal Stem Cells. in Koller MR, Palsson BO, Masters JRW [eds.]. Human Cell Culture. Dordrecht: Kluwer Academic Publishers. 2001. P. 189-20.
Статья опубликована в журнале "Экспериментальная и клиническая урология" №4 2019, стр. 26-30









Комментарии