Неймарк А.И., Неймарк Б.А., Ноздрачев Н.А., Мельник М.А., Ковалева Ю.С.
Сведения об авторах:
- Неймарк А.И. – д.м.н., профессор., заведующий кафедрой урологии и андрологии с курсом ДПО Федерального государственного бюджетного образовательного учреждение высшего образования «Алтайский государственный медицинский университет» Министерства здравоохранения Российской Федерации; Барнаул, Россия; РИНЦ AuthorID 527832
- Неймарк Б.А. – д.м.н., профессор кафедры урологии и андрологии с курсом ДПО Федерального государственного бюджетного образовательного учреждения высшего образования «Алтайский государственный медицинский университет» Министерства здравоохранения Российской Федерации; Барнаул, Россия; РИНЦ AuthorID 737759
- Ноздрачев Н.А. – к.м.н., доцент кафедры урологии и андрологии с курсом ДПО Федерального государственного бюджетного образовательного учреждения высшего образования «Алтайский государственный медицинский университет» Министерства здравоохранения Российской Федерации; Барнаул, Россия; РИНЦ AuthorID 648075
- Мельник М.А. – к.м.н., ассистент кафедры урологии и андрологии с курсом ДПО Федерального государственного бюджетного образовательного учреждения высшего образования «Алтайский государственный медицинский университет» Министерства здравоохранения Российской Федерации; Барнаул, Россия
- Ковалева Ю.С. – д.м.н., доцент, заведующая кафедрой дерматовенерологии, косметологии и иммунологии АГМУ; Барнаул, Россия; РИНЦ AuthorID 181368
ВВЕДЕНИЕ
По данным международной статистики доброкачественная гиперплазия предстательной железы (ДГПЖ) наблюдается в среднем у 80% мужчин в возрасте от 60 лет и старше [1].
В настоящее время трансуретральная резекция (ТУР) предстательной железы (ПЖ) является основным методом хирургического лечения ДГПЖ [2-4]. При проведении ТУР ПЖ сохраняется риск развития послеоперационных тромбоэмболических, геморрагических и гнойно-воспалительных осложнений. Инфекционновоспалительные осложнения (ИВО) возникают обычно в течение нескольких недель после ТУР и могут проявляться в виде острого пиелонефрита (1,7-10%), уретрита и простатита (2,1%), эпидидимита и эпидидимоорхита (1,2-3,1%), цистита, парауретральных абсцессов (5-22%) и др. [5-9]. В патогенезе этих осложнений большое значение имеют инволютивные изменения верхних и нижних мочевых путей, иммунодефицит и персистирующая грамотрицательная инфекция [6-9]. Профилактике и лечению послеоперационных осложнений посвящено много исследований, методы профилактики постоянно обновляются и дорабатываются [10-14].
При профилактике ИВО после урологических вмешательств, в том числе трансуретральных операций на предстательной железе, необходимо придерживаться двух принципов [15]:
- первичная профилактика должна включать предотвращение продвижения инфекции из источника вне мочевых путей (инструмент, катетер, ирригационная жидкость, периуретральная флора);
- вторичная профилактика заключается в снижении риска инфицирования в пределах мочевых путей (очаги инфекции в ПЖ, «биофильмы» на камнях, катетерах).
Перед трансуретральными вмешательствами антибактериальная профилактика обязательна, даже при отсутствии бактериурии или данных за инфекционновоспалительный процесс в мочевых путях перед операцией. Инфицирование возможно как во время операции (из вскрывающихся инфицированных протоков ПЖ, нестерильного ирригационного раствора, инструментария, кожи пациента), так и после операции установка уретрального катетера. В условиях высокой резистентности микроорганизмов к применяемым антимикробным препаратам, особенно актуальным является соблюдение стратегии рационального применения антибиотиков для профилактики и лечения инфекционных осложнений при оперативных вмешательствах и манипуляциях с учетом фармакокинетических особенностей препарата, спектра возбудителей и чувствительности микроорганизмов к антибиотику [15]. Поэтому выбор препарата для данного исследования основывался не только на преимуществах фармакокинетики, но и на максимально расширенном спектре действия, включающем не только основных аэробных уропатогенов, но и анаэробных представителей возбудителей урологических инфекций.
Орцепол ВМ- комбинированный противомикробный и противопротозойный препарат, содержащий в своем составе орнидазол 500 мг и ципрофлоксацин 500 мг. Препарат соответствует всем требованиям, предъявляемым к антибиотику для профилактики инфекции, в том числе генерализованной, после вмешательств на органах мочеполовой системы, манипуляций на ПЖ, учитывая спектр возможных возбудителей. Ципрофлоксацин – производное фторхинолона II поколения, обладает высокой бактерицидной активностью в отношении более 90% патогенов, вызывающих инфекции урогенитального тракта, в том числе внутриклеточных микроорганизмов, имеет ряд преимуществ. Выводится преимущественно почками (более 80%) в неизмененном виде, поэтому концентрация препарата в паренхиме почек и в чашечно-лоханочной системе высокая, а гепатотоксичность минимальна. Орнидазол – средство с мощным противопротозойным, противомикробным и антианаэробным спектром активности и минимальной резистентностью возбудителей, обладает лучшими фармакокинетическими свойствами по сравнению с 5-нитроимидазолами первого поколения. Биодоступность препарата приближается к 100%.
Цель исследования: оценить эффективность и безопасность лекарственного препарата Орцепол ВМ производства компании «WORLD MEDICINE» (Турция), в пред- и послеоперационной профилактике инфекционно-воспалительных осложнений после ТУР ДГПЖ.
МАТЕРИАЛЫ И МЕТОДЫ
Нами проведен анализ течения послеоперационного периода 50 пациентов с ДГПЖ, которым была выполнена ТУР ПЖ.
Критерии включения:
– пациенты с ДГПЖ, требующие хирургического лечения;
– отсутствие противомикробной терапии в течение 30 дней.
Критерии исключения:
– хронический простатит в анамнезе;
– острые воспалительные заболевания мочевыделительной системы;
– повышенная чувствительность к компонентам препарата Орцепол ВМ в анамнезе;
– выраженные нарушения функции печени и/или почек, и/или других жизненно важных органов, сопровождающиеся декомпенсацией их функций.
Пациенты, включенные в исследование, были разделены на две группы, сопоставимые по возрасту, клиническим проявлениям и лабораторно-инструментальным показателям. Больным 1-ой (контрольной) группы (20 человек) интраоперационно вводился ципрофлоксацин 200,0 мг внутривенно. Больные 2-ой (основной) группы (30 человек) получали лекарственный препарат Орцепол ВМ по 1 таблетке 2 раза в сутки в течение 15 дней, прием препарата начинался за 5 дней до операции.
Всем пациентам проводились следующие исследования:
– трансректальное ультразвуковое исследование (ТРУЗИ) ПЖ;
– общий анализ крови, до операции, на 3 и 10 дни после оперативного вмешательства;
– биохимический анализ крови, проводился при поступлении и через 10 дней после операции;
– общий анализ мочи выполнялся при поступлении и через 10 дней после операции;
– УЗИ почек и изучение микроциркуляции почек методом лазерной допплеровской флоуметрии. Исследование выполнялось дважды – при поступлении и через 10 дней после операции;
– посев мочи на флору и чувствительность к антибиотикам перед операцией и через 10 дней после операции;
– посев резецированной ткани ПЖ в день операции;
– оценка клинической симптоматики (гипертермия, боль в области почек, слабость, тахикардия, тошнота и т.д.).
Пациенты основной и контрольной групп не отличались по характеру сопутствующей патологии. Все пациенты были компенсированы относительно сопутствующих заболеваний до оперативного вмешательства.
Оперативное вмешательство заканчивалось установкой уретрального катетера, который удалялся на 2 сутки после операции.
Безопасность и переносимость препарата оценивались путем регистрации всех побочных эффектов, связанных с приемом препарата Орцепол ВМ.
РЕЗУЛЬТАТЫ
Средний возраст пациентов 1 группы составил 69,5±6,7 лет, 2 группы – 70,5±6,5. Средний объем ПЖ по данным ТРУЗИ у пациентов 1 группы составил 62,5±13,6 см3, у пациентов 2 группы – 85,3 ±12,9 см3.
По данным проведенного динамического исследования клинического анализа крови у больных обеих групп до лечения явлений острого воспаления (лейкоцитоз, повышение СОЭ) не отмечалось. После операции у пациентов 1 группы отмечались воспалительные изменения периферической крови: повышение количества лейкоцитов и ускорение СОЭ. Во 2 группе пациентов достоверного изменения данных показателей не отмечено (табл. 1). В биохимическом анализе крови изменения носили минимальный, клинически не значимый, характер.
Таблица 1. Основные показатели периферической крови у больных ДГПЖ до операции и после ТУР ПЖ
Table 1. Main indicators of peripheral blood in patients with BPH вefore surgery and after TURP
| Показатели Indicators |
1 группа (n - 20) 1 group (n - 20) |
2 группа (n - 30) 2 group (n - 30) |
||
|---|---|---|---|---|
| До операции Before surgery |
После операции After surgery |
До операции Before surgery |
После операции After surgery |
|
| Лейкоциты, х109/л White blood cells, x109/L |
8,1±0,6 | 11,5±0,7** | 7,3±0,8 | 7,7±0,4* |
| СОЭ, мм/ч ESR, mm/h |
9±2,1 | 25±1,8** | 9±2,4 | 12±0,7* |
*р<0,05; **р>0,05
По данным микробиологического исследования мочи в первой группе пациентов до операции в 70% случаев (14 пациентов) моча была стерильна, а в 30% (6 пациентов) обнаружились различные уроштаммы. Во второй группе до операции у 56,7% (17 пациентов) получены стерильные посевы мочи, у 43,3% (13 пациентов) – инфицированные.
При анализе структуры микробного состава у больных 1 группы до операции монокультура составила 83,3%, микробные ассоциации 16,7%. Во 2 группе до лечения монокультура обнаружена у 69,3%, а микробные ассоциации у 30,7% больных. Микробный спектр мочи до и после ТУР ПЖ представлен в таблице 2.
Таблица 2. Микробный спектр мочи у больных ДГПЖ до операции и после ТУР ПЖ
Table 2. Microbial spectrum of urine in patients with BPH before surgery and after TURP
| Возбудитель Microbial pathogen |
1 группа (n - 20) 1 group (n - 20) |
|||
|---|---|---|---|---|
| 1 группа (n - 20) 1 group (n - 20) |
2 группа (Орцепол ВМ) (n - 30) 2 group (Orcepol BM) (n - 30) |
|||
| До операции Before surgery |
После операции After surgery |
До операции Before surgery |
После операции After surgery |
|
| Escherichia coli | 0 | 1 (5%) | 3 (10%) | 0 |
| Proteus | 0 | 3 (15%) | 1 (3,3%) | 0 |
| Pseudomonas aeruginosae | 1 (5%) | 2 (10%) | 0 | 0 |
| Staphylococcus epidermalis | 2 (10%) | 3 (15%) | 1 (3,3%) | 0 |
| Klebsiella | 2 (10%) | 3 (15%) | 1 (3,3%) | 0 |
| Enterococcus faecalis | 0 | 0 | 3 (10%) | 1 (3,3%) |
| Микробные ассоциации | 1 (5%) | 2 (10%) | 4 (13,3%) | 0 |
| Посев стерилен | 14 (70%) | 6 (30%) | 17 (56,7%) | 29 (96,7%) |
| Всего | 20 (100%) | 20 (100%) | 30 (100%) | 30 (100%) |
При анализе микробного состава мочи выявлено, что у пациентов 1 группы после операции достоверно возрос процент инфицированной мочи с (с 30% до 70%). Увеличился процент высеваемых до операции микроорганизмов (Pseudomonas aeruginosa, Staphylococcus epidermidis, Klebsiella pneumoniae ), а также появились не имеющиеся ранее (Escherichia coli, Proteus). Дополнительно обнаружена микробная ассоциация.
Следовательно, после выполнения ТУР с применением ципрофлоксацина для профилактики инфекционно-воспалительных осложнений, происходит выраженное инфицирование мочи, обусловленное, скорее всего, вскрытием инфицированных ацинусов аденоматозной ткани ПЖ, а также проникновением госпитальной инфекции.
При бактериологическом исследовании проб мочи у больных 2 группы после операции процент инфицированной мочи, снизился с 43,3% до 3,3%. (табл. 2).
Таким образом, профилактика инфекционно-воспалительных осложнений с применением препарата Орцепол ВМ позволила достоверно снизить процент инфицирования мочи за счет расширенного спектра действия препарата, охватывающего также анаэробную часть возбудителей.
По результатам бактериологического исследования резецированной ткани ПЖ в 1 группе стерильный посев был выявлен у 25% (5 пациентов), а во 2 группе – у 66,7% (20 пациентов) (табл. 3).
Таблица 3. Микробный спектр ткани предстательной железы у больных ДГПЖ
Table 3. Microbial spectrum of prostate tissue in patients with BPH
| Возбудитель Microbial pathogen |
1 группа (n - 20) 1 group (n - 20) |
2 группа (Орцепол ВМ) (n - 30) 2 group (Orcepol BM) (n - 30) |
|---|---|---|
| Escherichia coli | 4 (20%) | 1 (3,3%) |
| Klebsiella | 4 (20%) | 2 (6,6%) |
| Proteus | 1 (5%) | 0 |
| Pseudomonas aeruginosae | 1(5%) | 0 |
| Staphylococcus epidermalis | 1 (5%) | 0 |
| Enterococcus faecalis | 2 (10%) | 2 (6,6%) |
| Микробные ассоциации | 2 (10%) | 2 (6,6%) |
| Посев стерилен | 5 (25%) | 23 (76,7%) |
| Всего | 20 (100%) | 30 (100%) |
Данные результаты показывают, что предоперационная антибактериальная подготовка препаратом Орцепол ВМ снижает бактериологическую обсемененность ПЖ, что в свою очередь уменьшает риск инфицирования мочевыводящих путей во время оперативного лечения.
Эхографическая картина почек до и после операции у больных обеих групп практически не отличались и характеризовались диффузной акустической неоднородностью почек и деформацией чашечно-лоханочной системы у некоторых пациентов.
При исследовании микроциркуляции до операции в точках проекции почек, у пациентов обеих групп отклонений от физиологической нормы не выявлено: преобладал активный механизм регуляции микроциркуляции, индекс эффективности находился в пределах средних значений, снижения вазомоторной активности не было.
При исследовании состояния микроциркуляции почек после операции у больных 1 группы были выявлены значительные изменения базального кровотока, выражающиеся в снижении среднего потока крови, индекса эффективности микроциркуляции и повышении показателя шунтирования по сравнению с контрольными величинами, что свидетельствует о функциональном подавлении интенсивности перфузии и ухудшении микроциркуляции в почках (ишемия, застой). Данные нарушения сохранялись и на 10 сутки после операции (рис. 1, 2, 3). Это можно объяснить снижением активных вазомоторных механизмов регуляции микроциркуляции, увеличением застойных явлений, что располагает к воспалительным изменениям в почках и развитию восходящего пиелонефрита.
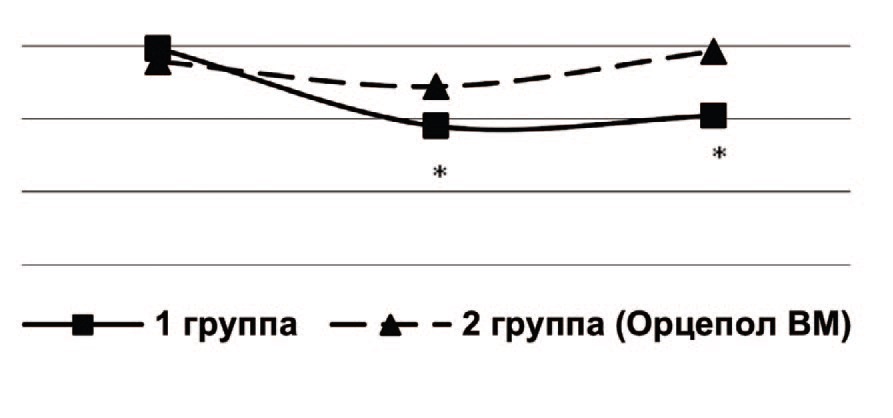
Рис. 1. Средний поток крови в почках при изучении микроциркуляции до операции, через 5 и 10 дней после ТУР ПЖ, пф. ед.
Примечание: *достоверное отличие с показателем до операции, р< 0,05
Fig. 1. Average blood flow in the kidneys during the study of microcirculation before surgery, after 5 and 10 days after TURP, pf. units
Note: *significant difference with the indicator before surgery p<0.05
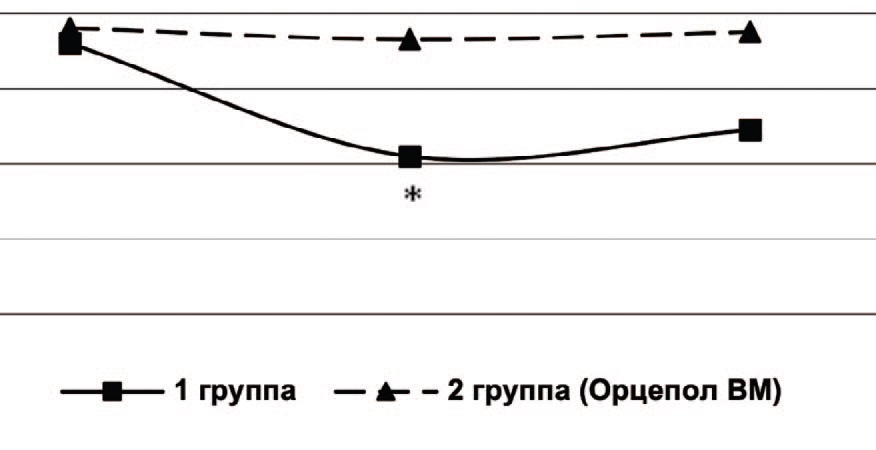
Рис. 2. Индекс эффективности микроциркуляции в почках до операции, через 5 и 10 дней после ТУР ПЖ, %.
Примечание: *достоверное отличие с показателем до лечения р< 0,05
Fig. 2. Microcirculation efficiency index in the kidneys before surgery, 5 and 10 days after TURP, %
Note: *significant difference with the index before treatment р<0.05
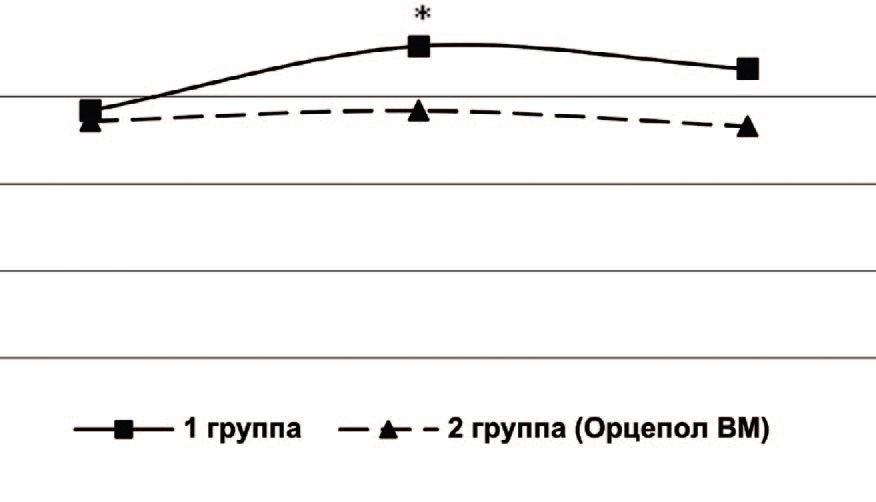
Рис. 3. Показатель шунтирования в почках до операции, через 5 и 10 дней после ТУР ПЖ, отн. ед.
Примечание: *достоверное отличие с показателем до лечения р< 0,05
Fig. 3. Preoperative kidney bypass rate, 5 and 10 days after TURP, rel. units
Note: *significant difference with the index before treatment р<0.05
У пациентов 2 группы после операции на фоне профилактики инфекционно-воспалительных осложнений с применением препарата Орцепол ВМ микроциркуляторные нарушения почек были незначительны, и на 10 сутки после операции полностью купировались (рис. 1, 2, 3).
Анализируя течение послеоперационного периода у больных 1 группы, в которой пациенты получали антибактериальный препарат однократно, интраоперационно, мы отметили инфекционно-воспалительные осложнения у 35% больных: два случая пиелонефрита, два случая орхоэпидидимита, у двух больных признаки цистита и у одного больного – явления послеоперационного уретрита. Данные осложнения сопровождались общими симптомами интоксикации (слабость, тахикардия, потливость). Пациентам потребовалась дополнительная противовоспалительная терапия. Средняя продолжительность послеоперационного периода больных 1 группы составила 11±1,3 дней. В среднем на каждого пациента 1 группы приходилось по 4,3±0,65 послеоперационных лихорадящих дней. Максимальное повышение температуры тела составило в среднем 38,2±0,12°. Таким образом, у больных после ТУР ПЖ со стандартной противомикробной профилактикой ципрофлоксацином 200,0 мг внутривенно. отмечен высокий процент инфекционно-воспалительных осложнений.
У больных, которым проводилась профилактика с применением препарата Орцепол ВМ, процент инфекционно-воспалительных осложнений в послеоперационном периоде составил 6,6%, что значительно ниже, чем в первой группе. Средняя продолжительность послеоперационного периода больных 2 группы составила 7,5±1,3 дней.
В группе, принимавшей лекарственный препарат Орцепол ВМ, аллергические реакции не выявлены. Диарею, тошноту отмечал 1 пациент (3,3%); головную боль – 1 пациент (3,3%).
При оценке отдаленных результатов через 6 месяцев наблюдалось возникновение стриктуры уретры у 2 (10%) пациентов в контрольной группы.
ОБСУЖДЕНИЕ
В ходе нашей работы продемонстрирована достаточно высокая инфицированной ткани ПЖ и отсутствие диагноза хронический простатит не исключает наличие патогенной микрофлоры в ткане железы. Препарат Орцепол ВМ эффективно профилактирует распространение патогенной микрофлоры из ПЖ в процессе оперативного лечения, позволяет избежать нарушения микроциркуляции почек, тем самым снижая количество инфекционно-воспалительных осложнений при проведении ТУР ПЖ. Эффективность препарата подтверждается тем, что в основной группе назначение дополнительной антибактериальной терапии потребовалось 6,6% пациентов, а в контрольной – 35%. При отсутствии агрессивной микрофлоры в посевах у пациентов зачастую достаточно таблетированных форм антибактериальных препаратов. Применение препарата Орцепол ВМ сокращает время пребывания больного в стационаре, снижает риск возникновения стриктур уретры в отдаленном послеоперационном периоде.
ЗАКЛЮЧЕНИЕ
Препарат Орцепол ВМ эффективен в профилактике инфекционно-воспалительных осложнений при проведении ТУР у больных с ДГПЖ и может быть рекомендован в качестве монотерапии.
ЛИТЕРАТУРА
1. Sarma AV, Jacobson DJ, McGree ME, Roberts RO, Lieber MM, Jacobsen SJ. A population based study of incidence and treatment of benign prostatic hyperplasia among residents of Olmsted County, Minnesota: 1987 to 1997; J Urol 2005;173(6):2048-2053.
2. Мустафаев А.Т., Кызласов П.С., Дианов М.П., Мартов А.Г., Ергаков Д.В., Севрюков Ф.А. Хирургическое лечение доброкачественной гиперплазии предстательной железы: прошлое и настоящее. Урологические ведомости 2019;9(1):47-56. [Mustafaev Ali T., Kyzlasov Pavel S., Dianov Maksim P., Martov Aleksej G., Ergakov Dmitrij V., Sevryukov Fedor A. Surgical treatment of benign prostatic hyperplasia: the past and the present. Urologicheskie vedomosti = Urology reports 2019;9(1):47-56. (In Russian)].
3. Alschibaja M, May F, Treiber U, Paul R, Hartung R. Transurethral resection for benign prostatic hyperplasia current developments. Urologe A 2005;44(5):499–504. https://doi.org/10.1007/s00120- 005-0802-z.
4. Minardi D, Garofalo F, Yehia M, Cristalli AF, Giammarco L, Galosi AB, Muzzonigro G. Pressure-flow studies in men with benign prostatic hypertrophy before and after treatment with transurethral needle ablation. Urol Int 2001;66(2):89-93. https://doi.org/10.1159/000056577.
5. Лопаткин Н.А. Осложнения ТУР предстательной железы и аденомэктомии. В кн. Доброкачественная гиперплазия предстательной железы [Под ред. Лопаткина Н.А.] Москва 1997; 163-167 с. [Lopatkin N.A. Complications of TUR of the prostate and adenomectomy. In book. Benign prostatic hyperplasia [Edit. Lopatkin N.A.] Moscow 1997; 163-167 р. (In Russian)]
6. Boyle P, Napalkov P. Epidemiology of benign prostatic hyperplasia: current perspectives. Eur Urol 1996;29(1):7-11.
7. Ferretti S, Azzolini N, Barbieri A, Frattini A, Cortellini P. Randomized comparison of loops for transurethral resection of the prostate; preliminary results. Endourol 2004;18(9):897-900. https://doi.org/10.1089/end.2004.18.897.
8. Souverein PC, Erkens JA, de la Rosette JJ, Leufkens HG, Herings RM. Drug treatment of BPH and hospital admission for BPH-related surgery. Eur Urol 2003(43):528-534. https://doi.org/10.1016/s0302-2838(03)00089-7.
9. Wendt-Nordahl G, Häcker A, Fastenmeier K, Knoll T, Reich O, Alken P, Michel MS. New bipolar resection device for transurethral resection of the prostate: first ex-vivo and in-vivo evaluation. Endourol 2005;19(10):1203-9. https://doi.org/10.1089/end.2005.19.1203.
10. Сорокин Д.А., Семенычев Д.В., Володин М.А. Лечение и профилактика осложнений трансуретральных эндоскопических операций по поводу доброкачественной гиперплазии простаты. Int J Med Psychol 2019;2(4):118-125. [Sorokin D.A., Semenychev D.V., Volodin M.A. Treatment and prevention of complications in transurethral endoscopic surgery for benign prostatic hyperplasia. Int J Med Psychol 2019;2(4):118-125. (In Riussian)].
11. Спивак Л.Г., Платонова Д.В. Эффективность и безопасность применения препарата Витапрост® Плюс у пациентов с хроническим бактериальным простатитом, а также у пациентов с доброкачественной гиперплазией предстательной железы до и после трансуретральной резекции для профилактики осложнений. Эффективная фармакотерапия 2017(24):16-21. [Spivak L.G., Platonova D.V. The efficacy and safety of Vitaprost® plus drug application in patients with chronic bacterial prostatitis and in patients with benign prostatic hyperplasia before and after transurethral resection in terms of prevention of complications. Effektivnaya farmakoterapiya = Effective pharmacotherapy 2017(24):16-21. (In Russian).
12. Перепанова Т.С. Федеральные клинические рекомендации. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Терапевтический архив 2016;88(4):100-104. [Perepanova TS. The Federal Clinical Guidelines for Antimicrobial Therapy and Prevention of Infections of the Kidney, Urinary Tract, and Male Genitals. Terapevticheskii Arkhiv = Terapevticheskij arhiv 2016;88(4):100-104. (In Russian)]. https://doi.org/10.17116/terarkh2016884100-104.
13. Bonkat G, Bartoletti R, Bruy re F, Cai T, Geerlings SE, K ves B, Schubert S, et al. EAU Guidelines on Neuro-urology. In: EAU Guidelines, edition presented at the annual EAU Congress Amsterdam 2022. ISBN 978-94-92671-16-5.
14. Naber KG, Schaeffer AJ, Heyns CF, Matsumoto T, Shoskes DA. Urogenital Infections. International Consultation on Urogenital Infections, Stockholm, Sweden, March 2009, Ed. 2010, EAU.
15. Перепанова Т.С., Мартов А.Г., Хазан П.Л. Антимикробная профилактика инфекционновоспалительных осложнений после урологических вмешательств. Эффективная фармакотерапия 2007(17):6-10. [Perepanova T.S., Martov A.G., Khazan P.L. Antimicrobial prevention of infectious and inflammatory complications after urological interventions. Effektivnaya farmakoterapiya = Effective pharmacotherapy 2007(17):6-10. (In Russian)].








Комментарии